脑膜瘤是中枢神经系统最常见的原发性肿瘤,占比达到40.0%[1]。手术是脑膜瘤患者的主要治疗方案[2]。部分患者术后短期预后较差,约有7%![]() 14%的脑膜瘤患者在术后1年内死亡[3],高达5%左右的患者术后30 d内死亡[4]。脑膜瘤患者的短期不良预后是威胁该群体生存的重要因素。而目前针对脑膜瘤患者术后短期预后的研究较少,因此急需良好的预后预测模型来指导脑膜瘤治疗的临床决策。目前的研究多使用传统线性回归方法来构建临床预测模型,但是线性回归模型过于刚性,不易揭示变量之间的非线性关系,且难以处理高维数据和非结构性数据[5]。而临床数据具有维度高、变量之间作用复杂的特点,且存在许多非结构化的数据,因此使用线性回归模型驱动临床大数据构建预测模型具有很大的困难。而机器学习能够很好地处理高维数据,应对非线性关系和复杂的相互作用,更适合临床大数据的分析[6-7]。
14%的脑膜瘤患者在术后1年内死亡[3],高达5%左右的患者术后30 d内死亡[4]。脑膜瘤患者的短期不良预后是威胁该群体生存的重要因素。而目前针对脑膜瘤患者术后短期预后的研究较少,因此急需良好的预后预测模型来指导脑膜瘤治疗的临床决策。目前的研究多使用传统线性回归方法来构建临床预测模型,但是线性回归模型过于刚性,不易揭示变量之间的非线性关系,且难以处理高维数据和非结构性数据[5]。而临床数据具有维度高、变量之间作用复杂的特点,且存在许多非结构化的数据,因此使用线性回归模型驱动临床大数据构建预测模型具有很大的困难。而机器学习能够很好地处理高维数据,应对非线性关系和复杂的相互作用,更适合临床大数据的分析[6-7]。
在本研究从电子病历系统中提取脑膜瘤患者的大规模的临床数据,使用机器学习的方法处理术前的真实世界的特征,构建了可解释的机器学习模型来预测脑膜瘤患者的术后短期预后,以探索影响短期不良预后的临床变量,对脑膜瘤患者的临床决策具有参考价值。
1 资料与方法
1.1 研究对象与纳入的临床数据
收集于2011年9月—2022年3月在同济大学附属第十人民医院神经外科治疗的颅内脑膜瘤患者的病历资料。纳入标准: (1) 病理确诊为脑膜瘤;(2) 进行了手术切除治疗;(3) 年龄>18岁。排除标准: (1) 其他恶性肿瘤病史;(2) 需要研究的临床数据缺失。
本次研究纳入的临床数据包括患者的短期预后数据,即出院时的格拉斯哥预后评分(Glasgow outcome scale, GOS),将4![]() 5级定义为预后良好,1
5级定义为预后良好,1![]() 3级定义为预后较差。结局变量即为基于GOS评分的预后良好和预后较差这个二分类变量。其他的临床数据则作为特征来预测患者出院时的预后情况,这些特征包括人口学特征、肿瘤学特征、入院时的血压、血常规、肝功能、肾功能、电解质和凝血功能,共计纳入42种临床特征。在这42种临床特征中,除肿瘤分级外,其余41种均为术前容易获得的临床特征。脑膜瘤的分级被认为是影响患者长期预后的最重要因素之一[2-3],因而被纳入模型构建的研究流程中。此外,考虑到2016年世界卫生组织分类指南对脑膜瘤的分级提出了新的意见[8],因此如果患者的病理报告显示Ⅰ级脑膜瘤且存在脑浸润,纳入本研究时会被记录为Ⅱ级脑膜瘤。
3级定义为预后较差。结局变量即为基于GOS评分的预后良好和预后较差这个二分类变量。其他的临床数据则作为特征来预测患者出院时的预后情况,这些特征包括人口学特征、肿瘤学特征、入院时的血压、血常规、肝功能、肾功能、电解质和凝血功能,共计纳入42种临床特征。在这42种临床特征中,除肿瘤分级外,其余41种均为术前容易获得的临床特征。脑膜瘤的分级被认为是影响患者长期预后的最重要因素之一[2-3],因而被纳入模型构建的研究流程中。此外,考虑到2016年世界卫生组织分类指南对脑膜瘤的分级提出了新的意见[8],因此如果患者的病理报告显示Ⅰ级脑膜瘤且存在脑浸润,纳入本研究时会被记录为Ⅱ级脑膜瘤。
1.2 数据预处理和特征筛选
离散型特征使用独热编码进行预处理,以方便后续的模型构建。然后使用最小绝对值收敛和选择算子算法(least absolute shrinkage and selection operator, LASSO)进行特征筛选,当Binomial Deviance最小时,选择对应惩罚系数(λ)下的系数非0的特征纳入机器学习模型的构建。
1.3 机器学习模型构建
将患者随机按照7∶3的比例分为训练集和验证集,其中训练集用于模型的训练,而验证集则用于模型的评估和解释。本次研究使用了5种机器学习的方法进行模型构建,包括支持向量机(support vector machines, SVM)、随机森林(random forest, RF)、梯度提升(gradient boosting, GB)、自适应增强(adaptive boosting, AdaBoost)和多层感知器(multilayer per-ceptron, MLP)。这5种机器学习的方法各具优缺点。SVM可以很好地处理复杂的分类问题,针对高维数据具有优势,但是容易受到噪声数据的影响[9];RF在分类任务上表现良好,不容易出现过拟合,但是不适合具有稀疏特征的数据[10];GB在同时处理异质性特征时具有优势,但是容易出现过拟合[11];AdaBoost不容易出现过拟合且预测的精度较高,但是对于异常值敏感[12];MLP适用于复杂的高维数据处理,但是需要训练大量的数据才能取得很好的预测效果,且容易出现过拟合[13]。使用训练集对这5种机器学习的模型进行训练后,再使用验证集对模型的准确率、精确率、灵敏度、特异度、误报率和漏报率等进行评估。受试者工作特征(receiver operating characteristic, ROC)曲线和混淆矩阵也被绘制。使用Shapley Additive Explanations(SHAP)算法对模型进行解释[14]。
1.4 统计学处理
本研究的数据分析和模型构建基于R软件(4.2.0)和Python软件(3.9)。正态分布的连续性变量用均值±标准差![]() 表示,分类变量用n(%)表示;连续性变量用t检验或Mann-Whitney检验进行比较,分类变量用χ2检验或Fisher精确概率检验进行比较。P<0.05为差异有统计学意义。
表示,分类变量用n(%)表示;连续性变量用t检验或Mann-Whitney检验进行比较,分类变量用χ2检验或Fisher精确概率检验进行比较。P<0.05为差异有统计学意义。
2 结 果
2.1 纳入的患者和特征筛选
本研究共纳入424例脑膜瘤患者。人口和肿瘤学特征如表1所示。患者的平均年龄为(57.6±11.6)岁,女性患者292例(68.9%),109例患者既往具有高血压病史(25.7%)。91%患者为Ⅰ级脑膜瘤,Ⅱ级脑膜瘤为8.5%,而Ⅲ级脑膜瘤仅有2例。肿瘤的平均直径为(4.2±2.1) cm。脑膜瘤位于非颅底有265例(62.5%),而37.5%的脑膜瘤位于颅底。患者的其他临床特征包括血常规、肝功能、肾功能、电解质和凝血功能。患者的42个临床特征以热图的形式展示出来(图1A)。患者的短期预后大部分较好,90.1%的患者出院时GOS评分>3级,9.9%的患者短期预后较差,出院时GOS评分≤3级。

图1 临床特征的纳入及筛选
Fig.1 Inclusion and selection of clinical features
A: 利用热图展示了纳入的42个临床特征在所有患者中的分布情况;B: LASSO算法对临床特征进行筛选时得到的10折交叉验证图;C: LASSO算法对临床特征进行筛选时得到的路径图
表1 患者的一般资料
Tab.1 The characteristics of enrolled patients![]()

参数总体(n=424)GOS≤3(n=42)GOS>3(n=382)P年龄/岁57.6±11.660.8±12.157.2±11.5 0.053性别0.001 女292(68.9%)19(45.2%)273(71.5%) 男132(31.1%)23(54.8%)109(28.5%)既往史 高血压109(25.7%)13(31.0%)96(25.1%)0.526 糖尿病30(7.1%)4(9.5%)26(6.8%)0.738 高血脂12(2.8%)3(7.1%)9(2.4%)0.199肿瘤分级<0.001 Ⅰ386(91.0%)30(71.4%)356(93.2%) Ⅱ36(8.5%)12(28.6%)24(6.3%) Ⅲ2(0.5%)0(0.0%)2(0.5%)肿瘤最大径/cm4.2±2.14.8±1.4 4.1±2.20.048肿瘤位置0.111 颅底159(37.5%)11(26.2%)148(38.7%) 非颅底265(62.5%)31(73.8%)234(61.3%)原发型401(94.6%)33(78.6%)368(96.3%)<0.001入院血压 收缩压/mmHg134±20129±19135±200.064 舒张压/mmHg80±1176±880±120.020血常规指标 C反应蛋白/(mg·L-1)3.8±7.13.0±3.23.9±7.40.446 红细胞比积(%)38.9±3.840.2±4.938.8±3.60.023 中性粒细胞数(×109)/(个·L-1)3.77±1.684.02±2.303.74±1.600.297 淋巴细胞数(×109)/(个·L-1)1.82±0.571.79±0.721.83±0.560.717 血小板平均体积/fL10.6±1.210.1±1.010.7±1.30.010 血小板分布宽度(%)14.9±3.114.4±2.314.9±3.20.354肝功能指标 白蛋白/(g·L-1)39.4±4.338.1±3.939.6±4.30.033 丙氨酸氨基转移酶/(U·L-1)23.4±15.320.9±13.123.7±15.50.258肾功能指标 血尿素/(mmol·L-1)5.2±1.95.9±1.45.2±1.90.020 血肌酐/(μmol·L-1)61.3±15.673.6±23.959.9±13.9<0.001 血尿酸/(μmol·L-1)289±86346±107283±81<0.001电解质指标 钾离子/(mmol·L-1)3.81±0.363.90±0.423.80±0.350.075 氯离子/(mmol·L-1)105±4104±4105±30.044 钙离子/(mmol·L-1)2.20±0.212.16±0.212.20±0.210.214凝血指标 血浆凝血酶原时间/s11.2±1.411.0±1.011.2±1.40.478 活化部分凝血活酶时间/s26.5±3.426.2±3.626.5±3.40.576
1 mmHg=0.133 kPa
使用LASSO法对42个临床特征进行筛选,当Binomial Deviance最小时(图1B),取对应λ值下系数非零的临床特征(图1C),包括患者的基础疾病数量、肿瘤学特征(最大径、位置、分级、原发型)、血压(收缩压和舒张压)、血常规指标(C反应蛋白、红细胞比积、中性粒细胞数、淋巴细胞数、血小板平均体积、血小板分布宽度)、肝功能指标(白蛋白、丙氨酸氨基转移酶)、肾功能指标(血尿素、血肌酐、血尿酸)、电解质指标(钾离子、氯离子、钙离子)、凝血指标(血浆凝血酶原时间、活化部分凝血活酶时间),共计23种特征。表1包含了预后良好和预后较差的患者在这些特征上的一般分布情况,部分临床特征的分布在两个人群中存在统计学上的差异。预后较差的患者男性的比例更高,肿瘤级别更高,肿瘤的最大径比较大,复发型的比例较高。此外,在预后较差的患者中,舒张压较低,红细胞比积较高,血小板平均体积较低,白蛋白较低,血尿素、血肌酐和血尿酸均比较高,氯离子浓度比较低。
2.2 机器学习模型的训练
在训练集上,通过LASSO筛选出的23个临床特征被用于机器学习模型的训练。表2包含了这些特征在训练集和验证集患者中的分布情况。由于是随机分配,因此在训练集和验证集之间的大部分特征没有出现统计学上的差别。使用训练集分别训练了SVM、RF、GB、AdaBoost和MLP模型。
表2 训练集和验证集的一般资料
Tab.2 Characteristics of the training and validation sets![]()

参数训练集(n=296)验证集(n=128)P年龄/岁57.4±11.158±12.50.610性别0.882 女205(69.3%)87(68.0%) 男91(30.7%)41(32.0%)既往史 高血压75(25.3%)34(26.6%)0.886 糖尿病17(5.7%)13(10.2%)0.155 高血脂9(3.0%)3(2.3%)0.938肿瘤分级0.403 Ⅰ273(92.2%)113(88.3%) Ⅱ22(7.4%)14(10.9%) Ⅲ1(0.3%)1(0.8%)肿瘤最大径/cm4.2±2.14.1±2.10.727肿瘤位置0.190 颅底105(35.5%)54(42.2%) 非颅底191(64.5%)74(57.8%)原发型277(93.6%)124(96.9%)0.254出院GOS评分0.949 >3266(89.9%)116(90.6%) ≤330(10.1%)12(9.4%)入院血压 收缩压/mmHg134±20134±200.747 舒张压/mmHg80±1179±120.256血常规指标 C反应蛋白/(mg·L-1)3.4±6.14.7±8.80.074 红细胞比积(%)38.9±3.639.0±4.10.951 中性粒细胞数(×109)/(个·L-1)3.65±1.634.03±1.760.036 淋巴细胞数(×109)/(个·L-1)1.84±0.571.78±0.590.347 血小板平均体积/fL10.6±1.210.6±1.30.776 血小板分布宽度(%)15.0±3.314.6±2.50.197肝功能指标 白蛋白/(g·L-1)39.4±4.039.5±4.90.813 谷丙转氨酶/(U·L-1)23.2±15.223.8±15.50.725肾功能指标 血尿素/(mmol·L-1)5.2±1.65.2±2.50.997 血肌酐/(μmol·L-1)60.7±14.862.5±17.50.298 血尿酸/(μmol·L-1)289±83292±930.742电解质指标 钾离子/(mmol·L-1)3.81±0.353.81±0.390.906 氯离子/(mmol·L-1)105±3105±40.454 钙离子/(mmol·L-1)2.19±0.222.22±0.200.165凝血指标 血浆凝血酶原时间/s11.1±0.811.2±2.20.423 活化部分凝血活酶时间/s26.5±3.326.6±3.70.805
1 mmHg=0.133 kPa
2.3 机器学习模型的评估
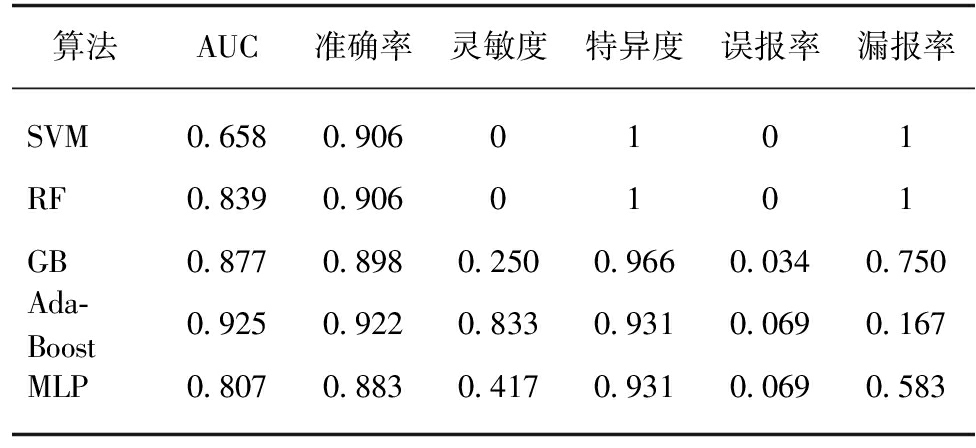
用验证集评估模型的预测能力。5种模型的ROC曲线和混淆矩阵分别在图2A和图2B展示。表3汇总了5种模型的预测能力,SVM的曲线下面积(area under the curve, AUC)是0.658,RF的AUC是0.839,GB的AUC是0.877,AdaBoost的是0.925,MLP的是0.807。可见AdaBoost模型的AUC值最大。在准确率上面,SVM和RF均是0.906,GB是0.898,AdaBoost是0.922,MLP是0.883。AdaBoost模型的准确率是最高的。此外,AdaBoost模型的灵敏度也是最高的,且漏报率最低。综合来看,Ada-Boost的模型的预测能力最强。

图2 SVM、RF、GB、AdaBoost和MLP算法的性能评估
Fig.2 Performance evaluation of SVM, RF, GB, AdaBoost, and MLP algorithms
A: ROC曲线;B: 混淆矩阵
表3 机器学习模型的鉴别能力比较
Tab.3 Comparison of the predictive ability of machine learning models
算法AUC准确率灵敏度特异度误报率漏报率SVM0.6580.9060101RF0.8390.9060101GB0.8770.8980.2500.9660.0340.750Ada-Boost0.9250.9220.8330.9310.0690.167MLP0.8070.8830.4170.9310.0690.583
2.4 AdaBoost的模型解释
针对在5个模型中表现最好的AdaBoost模型,我们使SHAP算法在验证集中对该模型进行模型解释。在AdaBoost模型中23种特征的SHAP值被提取出来(图3A),并且评估了每个特征下各个样本的SHAP值对两种预测结局的贡献大小,展示了贡献程度最大的12个特征(图3B)。从图3B可知,在AdaBoost模型中,脑膜瘤的最大径对于短期预后预测的贡献最大。入院舒张压、术前钙离子浓度、术前血尿素、术前血肌酐、术前平均血小板体积、术前氯离子浓度、术前尿酸、术前红细胞压积、术前中性粒细胞数、术前淋巴细胞数和术前钾离子浓度对于模型预测也有较大的贡献。

图3 特征的SHAP值分布
Fig.3 Distribution of SHAP values for features
A: 利用SHAP算法和验证集对AdaBoost的模型进行解释,23个特征的SHAP值被提取出来且以热图的形式展示;B: 每一个特征下各个样本的SHAP值则提取后,贡献最大的12个特征以提琴图展示
3 讨 论
脑膜瘤是最常见的颅内原发性肿瘤,手术是最主要的治疗手段,但是部分患者术后的短期预后不佳。目前少有研究针对脑膜瘤患者术后短期预后构建临床预测模型。本研究则通过术前的临床大数据构建机器学习模型来预测脑膜瘤患者术后短期预后情况,发现基于AdaBoost算法的模型预测能力最佳,能很好地对患者的预后进行预测。此外,本研究还使用了SHAP算法对该模型进行了解释,提示肿瘤尺寸和患者术前的一般状态对术后短期预后的影响较大。
针对脑膜瘤患者的预后,大多数研究集中于探索影响患者长期预后的因素[4]。确诊时患者的年龄、性别、肿瘤位置、肿瘤尺寸、分级、是否为复发型等对脑膜瘤患者的长期预后产生显著的影响[15-18]。通常来说,高龄患者、男性患者、肿瘤尺寸较大的脑膜瘤、高级别脑膜瘤和复发型脑膜瘤的长期预后一般较差。在本研究中,我们也发现这些指标在短期预后不佳和良好的人群中也存在统计学上的差异。短期预后较差的患者中男性比例较高(P=0.001)、肿瘤的最大径较高(P=0.048)、高级别脑膜瘤的比例较高(P<0.001)、复发型肿瘤的比例较高(P<0.001),平均年龄稍高(P=0.053)。可见,这些影响脑膜瘤患者长期预后的临床因素,在术后短期预后不良患者中也具有一致的分布特点。
本研究将脑膜瘤根据其发病位置分为颅底脑膜瘤和非颅底脑膜瘤。然而,在短期预后较差和较好患者之间,肿瘤位置的分布没有显示出统计学差异(P=0.111)。与此相符,Meling等[19]的研究也未观察到颅底和非颅底脑膜瘤在短期预后上的差异。但是在随访中,他们发现颅底脑膜瘤患者的长期预后相对较差。另外,一些研究者将脑膜瘤分为小脑幕上和小脑幕下两大类。幕上脑膜瘤的发病率远高于幕下脑膜瘤,而后者则因为肿瘤靠近脑干和小脑等重要的血管神经结构,手术难度较大[20-21]。另外,临近静脉窦的脑膜瘤切除术也具有挑战性,因为手术操作可能导致脑静脉窦的引流不连续,进而引发静脉充血,导致严重的神经功能障碍[22-23]。因此,脑膜瘤的位置及其与重要静脉结构的邻近关系值得进一步深入探索。
此外,也有少部分研究针对脑膜瘤患者的术后短期预后分析危险因素,这些研究发现影响短期预后的临床变量主要是年龄、性别和肿瘤尺寸等。例如,Lemée等[4]发现年龄是脑膜瘤术后30 d脑血肿和死亡的危险因素,Ekaireb等[24]的研究则显示性别与脑膜瘤围手术期的并发症存在关系,男性患者术后脑膜瘤出现并发症的概率更大。Zhang等[25]的数据则显示高龄、大肿瘤尺寸和复发型的脑膜瘤患者的短期生存情况较差。
本研究除了纳入这些变量外,还发现其他没有被探索过的术前变量也提示与脑膜瘤患者较差的术后短期预后相关,包括入院舒张压(P=0.020)、血常规指标中的红细胞比积(P=0.023)和血小板平均体积(P=0.010)、肝功能指标中的白蛋白(P=0.033)、肾功能指标中的血尿素(P=0.020)、血肌酐(P<0.001)和血尿酸(P<0.001)、电解质指标中的氯离子(P=0.044)。这些临床变量已经被发现在其他疾病的术后短期预后中具有一定的预测作用。血压管理是围手术期工作中重要的组成部分[26]。Sanders等[27]的研究表明术前舒张压与术后死亡率存在非线性的关系,术前舒张压80 mmHg(1 mmHg=0.133 kPa)对于术后短期生存是最佳的,低于或者高于80 mmHg都会导致术后死亡率升高。在本次研究中,预后较好人群的入院舒张压平均值在80 mmHg而不良预后人群的舒张压平均值在76 mmHg。血常规指标对外科患者短期预后的预测作用也在多篇文章中报道[28]。Easterday等[29]报道了高红细胞比积是乙状结肠扭转切除术术后再次手术的危险因素,Kaya等[30]发现平均血小板体积与冠状动脉旁路移植术和大隐静脉移植术的术后死亡率存在相关性。而低白蛋白水平则被诸多文献报道与多种疾病术后围手术期的不良预后存在相关性,比如结直肠癌术后[31]、腰椎椎体间融合术术后[32]和胫骨骨折术后[33]等,而本研究中预后不良组患者的白蛋白水平显著低于预后良好组。此外,本研究中预后不良组患者的肾功能相关指标显著劣于预后良好组,包括血尿素、血肌酐和血尿酸。Vlisides等[34]报道了在非心血管手术的患者中,较低的肾功能水平与围手术期的术后卒中发生存在相关性。Shi等[35]发现术后血清尿酸升高与冠状动脉搭桥术后的主要不良事件发生有关。术前电解质也与术后患者的短期预后存在相关性。Wahr等[36]报道心脏手术的预后与钾离子存在相关性,Bi等[37]则发现钙离子在心血管手术后的重症监护室的患者中具有预后价值,Li等[38]报道了术前血清钙水平与老年髋部骨折患者术后死亡率存在非线性关系,徐凌霄等[39]发现血清钙在重症股骨颈骨折患者的院内死亡具有预测价值。
以往的研究多使用传统的统计学方法,能同时探索的临床特征有限。本研究发挥了机器学习的优点,在使用LASSO法筛选变量后,纳入了较多的临床特征,构建了基于高维临床特征的脑膜瘤术后预测模型。在构建的机器学习模型中,AdaBoost模型在验证集中的表现最好。尽管机器学习构建的预测模型具有“黑箱”性质,但使用了SHAP算法对模型进行解释,计算了纳入特征对于模型决策的贡献值,建立一个可解释的AdaBoost模型。SHAP算法表明在我们纳入的临床特征中,肿瘤学指标、入院前血压、电解质指标、肾功能指标和血常规指标对术后脑膜瘤预后的决策均具有贡献度,其中脑膜瘤最大径、入院时血压、术前钙离子浓度、术前尿素水平和术前肌酐水平对模型决策的贡献度较大。这些信息提示,对较大尺寸脑膜瘤的临床决策需要谨慎,也要注意做好患者术前的血压和电解质管理,以及肾功能的维护。
本研究仍然有几个不足之处。首先,本研究是回顾性的研究,没有使用前瞻性的数据来验证模型。其次,本研究纳入的患者数量较少,在未来需要纳入更多的人群来矫正模型,以提高模型的预测性能。最后就是本研究的人群是基于三甲综合医院的单中心的研究,没有使用其他中心的病例,因而可能存在潜在的偏倚,构建的预测模型在其他中心的人群应用上存在风险。
总而言之,本研究通过真实世界来源的高维度临床特征,使用AdaBoost算法构建了一个表现良好的机器学习模型,用于脑瘤患者术后短期不良结局的预测。本研究也使用了SHAP算法对模型进行解释,发现肿瘤学指标、入院前血压、电解质指标、肾功能指标和血常规指标对术后短期预后的决策均具有一定的贡献度。在后续的研究中,需要扩大样本量,纳入其他中心的病例数据,以增强模型的稳定性。
[1] OSTROM Q T, PRICE M, NEFF C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2015-2019[J]. Neuro Oncol, 2022,24(Suppl 5): v1-v95.
[2] GOLDBRUNNER R, STAVRINOU P, JENKINSON M D, et al. EANO guideline on the diagnosis and management of meningiomas[J]. Neuro Oncol, 2021,23(11): 1821-1834.
[3] CHOUDHURY A, MAGILL S T, EATON C D, et al. Meningioma DNA methylation groups identify biological drivers and therapeutic vulnerabilities[J]. Nat Genet, 2022,54(5): 649-659.
[4] LEMÉE J M, CORNIOLA M V, BROI M D, et al. Early postoperative complications in meningioma: predictive factors and impact on outcome[J]. World Neurosurg, 2019,128: e851-e858.
[5] OBERMEYER Z, EMANUEL E J. Predicting the future-big data, machine learning, and clinical medicine[J]. N Engl J Med, 2016,375(13): 1216-1219.
[6] JORDAN M I, MITCHELL T M. Machine learning: trends, perspectives, and prospects[J]. Science, 2015,349(6245): 255-260.
[7] RAJKOMAR A, OREN E, CHEN K, et al. Scalable and accurate deep learning with electronic health records[J]. NPJ Digit Med, 2018,1: 18.
[8] LOUIS D N, PERRY A, REIFENBERGER G, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary[J]. Acta Neuropathol, 2016,131(6): 803-820.
[9] CORTES C, VAPNIK V. Support-vector networks[J]. Mach Learn, 1995,20(3): 273-297.
[10] BREIMAN L. Random forests[J]. Mach Learn, 2001,45(1): 5-32.
[11] FRIEDMAN J H. Greedy function approximation: a gradient boosting machine[J]. Ann Statist, 2001,29(5): 1189-232.
[12] FREUND Y, SCHAPIRE R E. A decision-theoretic generalization of on-line learning and an application to boosting[C]∥Proceedings of the Second European Conference on Computational Learning Theory. ACM, 1995: 23-37.
[13] RUCK D W, ROGERS S K, KABRISKY M, et al. The multilayer perceptron as an approximation to a Bayes optimal discriminant function[J]. IEEE Trans Neural Netw, 1990,1(4): 296-298.
[14] LUNDBERG S M, LEE S I. A unified approach to interpreting model predictions[C]∥Proceedings of the 31st International Conference on Neural Information Processing Systems. December 4-9, 2017, Long Beach, California, USA. ACM, 2017: 4768-4777.
[15] OSTROM Q T, PATIL N, CIOFFI G, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2013-2017[J]. Neuro Oncol, 2020,22(12 Suppl 2): iv1-iv96.
[16] RYDZEWSKI N R, LESNIAK M S, CHANDLER J P, et al. Gross total resection and adjuvant radiotherapy most significant predictors of improved survival in patients with atypical meningioma[J]. Cancer, 2018,124(4): 734-742.
[17] MCCARTHY B J, DAVIS F G, FREELS S, et al. Factors associated with survival in patients with meningioma[J]. J Neurosurg, 1998,88(5): 831-839.
[18] LEMÉE J M, JOSWIG H, BROI M D, et al. WHO grade I meningiomas: classification-tree for prognostic factors of survival[J]. Neurosurg Rev, 2020,43(2): 749-758.
[19] MELING T R, BROI M D, SCHEIE D, et al. Meningiomas: skull base versus non-skull base[J]. Neurosurg Rev, 2019,42(1): 163-173.
[20] ANDRÉS SANZ J A, MARRONE S, CACCIOTTI G, et al. Safeness and efficacy of 2 μm handheld thulium laser during microsurgical resection of supratentorial and infratentorial meningiomas: experience of a single center[J]. Front Surg, 2022,9: 1021019.
[21] JUNG M H, MOON K S, LEE K H, et al. Surgical experience of infratentorial meningiomas: clinical series at a single institution during the 20-year period[J]. J Korean Neurosurg Soc, 2014,55(6): 321-330.
[22] CORNIOLA M V, ROCHE P H, BRUNEAU M, et al. Management of cavernous sinus meningiomas: consensus statement on behalf of the EANS skull base section[J]. Brain Spine, 2022,2: 100864.
[23] SCHMUTZER M, SKRAP B, THORSTEINSDOTTIR J, et al. Meningioma involving the superior sagittal sinus: long-term outcome after robotic radiosurgery in primary and recurrent situation[J]. Front Oncol, 2023,13: 1206059.
[24] EKAIREB R I, EDWARDS C S, ALI M S, et al. Meningioma surgical outcomes and complications in patients aged 75 years and older[J]. J Clin Neurosci, 2021,88: 88-94.
[25] ZHANG G J, LIU X Y, YOU C. Clinical factors and outcomes of atypical meningioma: a population-based study[J]. Front Oncol, 2021,11: 676683.
[26] 薛小云,徐成,韩小莉,等.不同剂量瑞马唑仑用于老年患者喉罩全麻诱导时对血流动力学参数影响的双盲随机对照研究[J].同济大学学报(医学版),2023,44(4): 574-579.
[27] SANDERS R D, HUGHES F, SHAW A, et al. Perioperative Quality Initiative consensus statement on preoperative blood pressure, risk and outcomes for elective surgery[J]. Br J Anaesth, 2019,122(5): 552-562.
[28] 陈忠容,秦家骏,沈照立,等.高血压脑出血预后不良风险预测模型的构建与验证[J].同济大学学报(医学版),2022,43(2): 181-187.
[29] EASTERDAY A, AURIT S, DRIESSEN R, et al. Perioperative outcomes and predictors of mortality after surgery for sigmoid Volvulus[J]. J Surg Res, 2020,245: 119-126.
[30] KAYA U, KOZA Y. Predictive value of mean platelet volume in saphenous vein graft disease[J]. Braz J Cardiovasc Surg, 2018,33(4): 317-322.
[31] GUPTA A, GUPTA E, HILSDEN R, et al. Preoperative malnutrition in patients with colorectal cancer[J]. Can J Surg, 2021,64(6): E621-E629.
[32] LIU B, PAN J P, ZONG H, et al. The risk factors and predictive nomogram of human albumin infusion during the perioperative period of posterior lumbar interbody fusion: a study based on 2015-2020 data from a local hospital[J]. J Orthop Surg Res, 2021,16(1): 654.
[33] GROZNIK M, CIMERMAN M, LUSA L, et al. Increased perioperative C-reactive protein and decreased postoperative albumin is associated with acute posttraumatic osteomyelitis in patients with high-energy tibial fractures[J]. Injury, 2019,50(4): 827-833.
[34] VLISIDES P, MASHOUR G A. Perioperative stroke[J]. Can J Anaesth, 2016,63(2): 193-204.
[35] SHI Y, ZHANG X Q, DU J, et al. Elevated postoperative serum uric acid is associated with major adverse events following coronary artery bypass grafting[J]. J Card Surg, 2020,35(10): 2559-2566.
[36] WAHR J A, PARKS R, BOISVERT D, et al. Preoperative serum potassium levels and perioperative outcomes in cardiac surgery patients. Multicenter Study of Perioperative Ischemia Research Group[J]. JAMA, 1999,281(23): 2203-2210.
[37] BI S W, LIU R Q, LI J Y, et al. The prognostic value of calcium in post-cardiovascular surgery patients in the intensive care unit[J]. Front Cardiovasc Med, 2021,8: 733528.
[38] LI D Y, ZHANG K, WANG H, et al. Preoperative serum calcium level predicts postoperative mortality in older adult patients with hip fracture: a prospective cohort study of 2333 patients[J]. J Am Med Dir Assoc, 2024,25(4): 655-660.
[39] 徐凌霄,刘俊,韩春霞,等.基于机器学习的重症股骨颈骨折患者死亡风险预测模型构建和验证[J].同济大学学报(医学版),2022,43(6): 812-818.