甲状腺激素是人体调节葡萄糖和蛋白质的重要体液因子[1-3],糖耐量代谢(包括葡萄糖)、胰岛素抵抗和胰岛素分泌受损在甲状腺机能亢进中都有观察到[4-6]。目前已知导致糖耐量异常的因素包括代谢率异常、内源性糖异生和葡萄糖吸收,这些因素都受甲状腺激素的影响。而糖尿病是一种对人体健康危害极大的慢性代谢性疾病,可累及眼、肾脏、神经、心脑血管及下肢血管等多个重要脏器。甲状腺功能亢进症(以下简称甲亢)可加速糖尿病的进程,促进某些并发症的发生及发展[7]。随着近年来人们对甲状腺疾病及糖尿病等慢性病的关注,糖尿病合并甲状腺疾病逐渐受到关注。据报道,甲亢的患者有44%![]() 65%存在着糖耐量异常[8]。也有研究证实甲状腺机能亢进在得到控制后,糖耐量异常会改善,逐渐恢复至正常血糖水平[2]。
65%存在着糖耐量异常[8]。也有研究证实甲状腺机能亢进在得到控制后,糖耐量异常会改善,逐渐恢复至正常血糖水平[2]。
本研究利用动态血糖监测技术全面评估甲亢患者有效治疗前后的全天动态血糖谱变化、幅度、频率、时间以及原因等,同时探讨甲亢患者发生糖代谢异常的发病机理。
1 资料与方法
1.1 一般资料
选取2021年9月—2023年1月江苏省南通市海门区人民医院内分泌科的Graves甲亢患者,其中男12例,女18例,平均年龄(35.14±9.96)岁,平均BMI为(21.20±3.02)kg/m2。Graves患者诊断按照2011年美国临床内分泌学家协会和美国甲状腺协会制定的诊断标准[9],入组后给予抗甲状腺药物治疗。入组标准: (1) 符合Graves甲亢诊断标准;(2) 3个月内未接受过抗甲状腺药物治疗。排除标准: (1) 非甲亢诱导型甲状腺毒症;(2) 存在创伤、手术、感染等应激情况;(3) 已确诊的糖代谢异常、肝肾功能异常及其他影响糖代谢相关疾病史。本研究获得江苏省南通市海门区人民医院伦理委员会批准(审查编号: 2021-KY03),且所有对象入组时均签署了知情同意书。
1.2 检验方法
所有患者甲亢治疗前及甲状腺功能恢复正常状态4周后完善促甲状腺激素(thyroid stimulating hormone, TSH)、游离三碘甲状腺原氨酸(three free iodine thyroid original amino acid, FT3)、游离甲状腺素(free thyroxine, FT4),葡萄糖耐量试验(oral glucose tolerance test, OGTT)及胰岛素释放试验。检测治疗前后空腹葡萄糖(fasting glucose, FBG)、餐后1 h葡萄糖(1-hour postprandial blood glucose, P1BG)、餐后2 h葡萄糖(2-hour postprandial blood glucose, P2BG)、空腹胰岛素(fasting insulin, FINS)、餐后1 h胰岛素(1-hour postprandial insulin, 1hINS)、餐后2 h胰岛素(2-hour postprandial insulin, 2hINS)、生长激素(growh hormone, GH)、皮质醇(cortisol, Cor)等指标。治疗前后使用辅理善瞬感医院用动态葡萄糖监测系统行动态血糖监测(continuous glucose monitoring, CGM)。
1.3 评估参数
按HOMA模型等研究公式计算相关胰岛素指数[10-11]: (1) 胰岛素抵抗的稳态模型评估(HOMA-IR)=(FBG×FINS)/22.5;(2) β细胞功能的稳态模型评估(HOMA-β)=20×FINS/(FBG-3.5)。
动态血糖参数(使用雅培康为动态血糖处理软件): 统一截取次日6点至第8日6点共7 d的血糖谱。血糖变异系数(variable coefficient, CV): 血糖24 h变异性。血糖标准差(standard deviation of blood glucose, SDBG): CGM期间血糖测定的标准差;日间平均血糖波动幅度(24 hours mean amplitude of glycemic excursions, MAGE): 研究对象24 h波动幅度大于1个SDBG的,根据第1个有效波动方向统计,取所有血糖波动幅度的平均值为MAGE;日间血糖平均绝对差(mean absolute daily difference, MODD): 根据动态血糖2个24 h监测期间的血糖测定值,相匹配测定值间的平均绝对差;血糖最大波动幅度(largest amplitude of glycemic excursions, LAGE): 动态血糖监测时血糖最大和最小差值;三餐后血糖波动: 餐后血糖峰值,CGM期间餐后3 h内时间-血糖曲线对应面积的均值,即餐后血糖曲线下面积(area under curve for postprandial glucose, AUCPBG)。
1.4 统计学处理
本研究所有符合正态分布的计量数据以均值±标准差![]() 表示,甲亢患者治疗前后两组间比较采用配对样本t检验进行统计分析,治疗前甲亢患者按性别分组并采用独立样本t检验,P<0.05为差异具有统计学意义。
表示,甲亢患者治疗前后两组间比较采用配对样本t检验进行统计分析,治疗前甲亢患者按性别分组并采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 治疗前后甲亢患者血糖及胰岛功能
治疗后甲亢患者甲状腺功能三项(TSH、FT3、FT4)、葡萄糖、胰岛素、HOMA-IR、HOMA-β等指标见表1。治疗后P1BG、1hINS、餐后1 hC-肽(1-hour postprandial C-peptide, 1 hC-p)、餐后2 hC-肽(2-hour postprandial C-peptide, 2 hC-p)及HOMA-IR较治疗前明显下降(P<0.05)。
表1 甲亢治疗前后OGTT相关指标比较
Tab.1 Comparison of OGTT indexes before and after treatment in patients with hyperthyroidism![]()

指标治疗前治疗后PTSH/(μIU·L-1)0.01±0.001.58±0.930.000FT3/(pmol·L-1)27.06±12.085.23±0.950.000FT4/(pmol·L-1)59.34±21.0416.45±3.850.000TRAb11.98±7.705.01±1.400.001HbA1c(%)5.21±0.485.22±0.360.672FBG/(mmol·L-1)4.64±0.634.81±0.630.383P1BG/(mmol·L-1)10.10±2.158.53±1.810.014P2BG/(mmol·L-1)6.77±1.746.45±1.360.522FINS/(mIU·mL-1)11.18±3.1310.13±3.410.4871hINS/(mIU·mL-1)104.12±19.0886.60±17.050.0242hINS/(mIU·mL-1)71.58±18.2156.06±15.760.245C-p/(pmol·mL-1)0.88±0.320.50±0.190.1291hC-p/(pmol·mL-1)3.96±1.593.36±1.510.0272hC-p/(pmol·mL-1)2.95±0.842.41±0.960.047HOMA-IR2.29±1.062.14±0.920.043HOMA-β(%)196.14±147.43154.65±121.680.564
2.2 甲亢治疗前后动态血糖参数比较
随着甲状腺激素的下降,治疗后餐后血糖峰值、LAGE、AUCPBG、MAGE、MODD、SDBG较治疗前明显下降(P<0.05),见表2。
表2 甲亢治疗前后动态血糖参数的变化
Tab.2 Changes of CGM before and after treatment in patients with hyperthyroidism![]()

指标治疗前治疗后P餐后血糖峰值/(mmol·L-1)8.04±1.017.14±1.100.008LAGE/(mmol·L-1)5.26±0.794.33±0.440.002AUCPBG/(mmol·L-1·m-1)52.18±5.7045.72±5.340.001CV(%)22.85±4.4720.99±3.640.146MAGE/(mmol·L-1)2.44±0.472.22±0.340.043MODD/(mmol·L-1)0.34±0.160.29±0.130.024SDBG/(mmol·L-1)1.31±0.251.17±0.200.038
2.3 甲亢治疗前按性别分组的血糖谱的比较
甲亢患者治疗前,按照性别分为女性患者组、男性患者组。女性患者组LAGE、MAGE、MODD、SDBG明显低于男性患者组,且差异有统计学意义(P<0.05),详见表3。
表3 按性别分组甲亢治疗前血糖谱的变化
Tab.3 Comparison of blood glucose spectrum between male and female patients with hyperthyroidism![]()

指标女性组男性组P年龄/岁33.33±13.7636.82±6.020.767BMI/(kg·m-2)21.12±3.1221.41±2.980.469FT3/(pmol·L-1)25.65±11.4328.33±13.110.640FT4/(pmol·L-1)58.64±16.7660.12±26.250.893HbA1c(%)5.34±0.525.18±0.420.562FBG/(mmol·L-1)4.67±0.674.61±0.630.060FINS/(mIU·mL-1)11.99±3.9410.44±6.120.493HOMA-IR2.51±0.942.09±1.160.374餐后血糖峰值/(mmol·L-1)7.74±0.858.32±1.110.191LGAE/(mmol·L-1)5.05±0.625.47±0.930.008AUCPBG(mmol·L-1·m-1)51.27±5.1553.01±6.290.495CV(%)21.09±2.7424.46±5.210.079MAGE/(mmol·L-1)2.25±0.342.61±0.510.041MODD/(mmol·L-1)0.25±0.890.42±0.170.012SDBG/(mmol·L-1)1.20±0.191.43±0.260.035
2.4 甲亢治疗前后胰岛素拮抗激素变化
在本研究中显示,甲亢治疗后GH、Cor与治疗前相比有下降趋势,但无明显统计学意义,详见表4。
表4 甲亢治疗前后胰岛素拮抗激素的比较
Tab.4 Comparison of insulin antagonistic hormones before and after treatment in patients with hyperthyroidism![]()
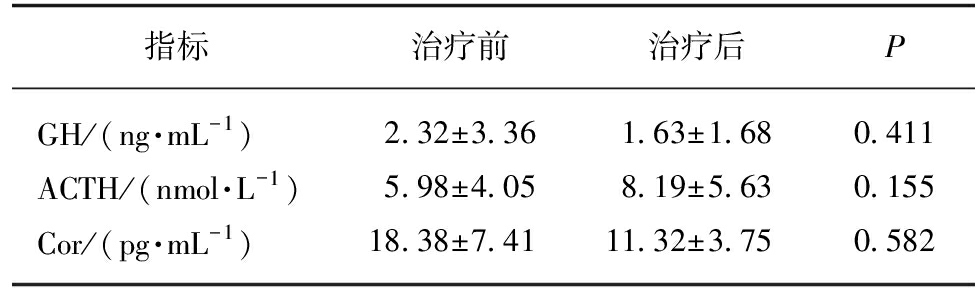
指标治疗前治疗后PGH/(ng·mL-1)2.32±3.361.63±1.680.411ACTH/(nmol·L-1)5.98±4.058.19±5.630.155Cor/(pg·mL-1)18.38±7.4111.32±3.750.582
3 讨 论
本研究中显示,甲亢患者的血糖谱有所改变,治疗前甲亢患者的空腹血糖偏低,但餐后血糖升高迅速,餐后1 h血糖达高峰。与治疗后相比,LAGE、MAGE、MODD、SDBG、AUCPBG等升高明显,提示甲亢治疗前血糖波动幅度较大。同时,本研究观察到未经治疗的甲亢患者表现出空腹葡萄糖和胰岛素、C-肽水平较高,甲亢患者的餐后血糖水平,尤其是餐后1 h血糖明显偏高,提示可能出现了胰岛素抵抗[12]。但有研究认为甲亢患者餐后1 h血糖升高可能与葡萄糖在小肠的吸收增加相关[13]。甲亢所致餐后血糖升高原因有待进一步研究证实。有研究也证实了甲亢时患者胰腺β细胞的分泌功能是超生理性的[14]。
甲亢患者的血糖变异性的升高、胰岛素抵抗及胰岛素超生理性分泌可归因于甲状腺激素水平升高导致胰岛素拮抗激素分泌增加(如GH、胰高糖素等)、肾上腺皮质功能紊乱等。甲状腺激素可提高GH基因表达率、基础GH分泌和GH对生长激素释放激素的反应[15],此外甲状腺激素和TSH可影响GH对血糖及胰岛素的生物学效应[16]。国内外研究[17-18]显示随着甲状腺激素水平的升高,Cor的代谢增快,甲亢患者Cor、ACTH水平与FT3、FT4水平呈负相关。甲亢患者治疗前空腹血糖低于治疗后,其机制可能与Cor降低相关。本研究中检测治疗前后生长激素、皮质醇等指标差异未见统计学意义,可能与样本量少、门诊进行检测干扰因素过多有关。
随着FT3、FT4的下降,餐后血糖升高幅度有所下降,考虑甲亢治疗稳定后患者高胰岛素血症及胰岛素抵抗有所缓解。本研究结果发现甲亢治疗前后MAGE和SDBG均在正常范围内(正常参考范围MAGE<3.9 mmol/L,SDBG<1.4 mmol/L),但治疗后LAGE、MAGE、SDBG、MODD可以得到进一步改善,这与既往的一些文献报道相一致[19]。Hu等[20]研究证明在甲状腺功能正常4周后胰岛素敏感性明显提高。提示甲状腺激素导致的胰岛素抵抗可能是可逆的[21-22]。
本研究中观察到女性甲亢患者的血糖变异性明显小于男性患者,可能与雌激素对胰高血糖素分泌的抑制作用相关[23]。在实验模型中[24],也显示雌激素可能对维持雌性大鼠的胰岛素敏感性具有保护作用。但Zaniqueli等[25]研究认为,女性体脂含量高于男性,因此在女性中,更易出现空腹血糖、胰岛素和HOMA-IR增加。在本研究中,女性患者胰岛素和HOMA-IR差异未见统计学意义,但均明显升高,这与上述研究结论基本一致。
综上所述,由于甲亢通常与胰岛素抵抗和糖代谢异常相关,甲亢患者的血糖波动较大,以餐后血糖升高为主,并发生胰岛素抵抗,且男性甲亢患者血糖波动更为显著。甲亢患者在经治疗后胰岛素抵抗程度、餐后血糖和血糖变异性等随着甲状腺功能的恢复而改善。
[1] MULLUR R, LIU Y Y, BRENT G A. Thyroid hormone regulation of metabolism[J]. Physiol Rev, 2014,94(2): 355-382.
[2] TAYLOR P N, ALBRECHT D, SCHOLZ A, et al. Global epidemiology of hyperthyroidism and hypothyroidism[J]. Nat Rev Endocrinol, 2018,14(5): 301-316.
[3] HALL J E. Textbook of Medical Physiology: 13th ed [M]. Philadelphia: Elsevier, 2015.
[4] KARBALAEI N, NOORAFSHAN A, HOSHMANDI E. Impaired glucose-stimulated insulin secretion and reduced β-cell mass in pancreatic islets of hyperthyroid rats[J]. Exp Physiol, 2016,101(8): 1114-1127.
[5] WARD R J, HEALD A H, OGUNMEKAN S, et al. Should we be screening for thyroid dysfunction in patients with type 2 diabetes mellitus?[J]. Br J Gen Pract, 2018,68(667): 94-95.
[6] MENG L H, HUANG Y, ZHOU J, et al. Use of first-phase insulin secretion in early diagnosis of thyroid diabetes and type 2 diabetes mellitus[J]. Chin Med J, 2017,130(7): 798-804.
[7] KIM S Y. Diabetes and hyperthyroidism: is there a causal link?[J]. Endocrinol Metab, 2021,36(6): 1175-1177.
[8] ROA DUE AS O H, VAN DER BURGH A C, ITTERMANN T, et al. Thyroid function and the risk of prediabetes and type 2 diabetes[J]. J Clin Endocrinol Metab, 2022,107(6): 1789-1798.
AS O H, VAN DER BURGH A C, ITTERMANN T, et al. Thyroid function and the risk of prediabetes and type 2 diabetes[J]. J Clin Endocrinol Metab, 2022,107(6): 1789-1798.
[9] BAHN R S, BURCH H B, COOPER D S, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists[J]. Endocr Pract, 2011,17(3): 456-520.
[10] HAFFNER S M, KENNEDY E, GONZALEZ C, et al. A prospective analysis of the HOMA model. The Mexico City Diabetes Study[J]. Diabetes Care, 1996,19(10): 1138-1141.
[11] 李光伟,潘孝仁,STEPHENLILLIOJA,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10): 656-660.
[12] KIM S R, TULL E S, TALBOTT E O, et al. A hypothesis of synergism: the interrelationship of T3 and insulin to disturbances in metabolic homeostasis[J]. Med Hypotheses, 2002,59(6): 660-666.
[13] ALQAHTANI H A, ALMAGSOODI A A, ALSHAMRANI N D, et al. Common electrolyte and metabolic abnormalities among thyroid patients[J]. Cureus, 2021,13(5): e15338.
[14] AL-SHOUMER K A S, VASANTHY B A, AL-ZAID M M. Effects of treatment of hyperthyroidism on glucose homeostasis, insulin secretion, and markers of bone turnover[J]. Endocr Pract, 2006,12(2): 121-130.
[15] VALCAVI R, DIEGUEZ C, ZINI M, et al. Influence of hyperthyroidism on growth hormone secretion[J]. Clin Endocrinol, 1993,38(5): 515-522.
[16] SMITH T J. Insulin-like growth factor pathway and the thyroid[J]. Front Endocrinol, 2021,12: 653627.
[17] 陈红,李阳,何旭梅,等.甲状腺功能亢进症患者血皮质醇、促肾上腺皮质激素含量水平与疾病程度相关性研究[J].陕西医学杂志,2020,49(9): 1168-1171.
[18] AGBAHT K, GULLU S. Adrenocortical reserves in hyperthyroidism[J]. Endocrine, 2014,45(1): 136-143.
[19] TORIMOTO K, OKADA Y, ARAO T, et al. Glucose variability before and after treatment of a patient with Graves’ disease complicated by diabetes mellitus: assessment by continuous glucose monitoring[J]. Endocr J, 2014,61(4): 321-328.
[20] HU Y, GAO G, YAN R N, et al. Glucose metabolism before and after radioiodine therapy of a patient with Graves’ disease: assessment by continuous glucose monitoring[J]. Biomed Rep, 2017,7(2): 183-187.
[21] PERUMAL N L, SELVI J, SRIDHARAN K, et al. Insulin sensitivity and beta-cell function in Graves’ disease and their changes with the carbimazole-induced euthyroid state[J]. Eur Thyroid J, 2019,8(2): 59-63.
[22![]() ERDOGAN M F, EMRAL R, et al. Circulating glucagon to ghrelin ratio as a determinant of insulin resistance in hyperthyroidism[J]. Endocrine, 2014,45(1): 106-113.
ERDOGAN M F, EMRAL R, et al. Circulating glucagon to ghrelin ratio as a determinant of insulin resistance in hyperthyroidism[J]. Endocrine, 2014,45(1): 106-113.
[23] ALDHOON-HAINEROV I, ZAMRAZILOV
I, ZAMRAZILOV H, HILL M, et al. Insulin sensitivity and its relation to hormones in adolescent boys and girls[J]. Metabolism, 2017,67: 90-98.
H, HILL M, et al. Insulin sensitivity and its relation to hormones in adolescent boys and girls[J]. Metabolism, 2017,67: 90-98.
[24] D AZ A, L
AZ A, L PEZ-GRUESO R, GAMBINI J, et al. Sex differences in age-associated type 2 diabetes in rats-role of estrogens and oxidative stress[J]. Oxid Med Cell Longev, 2019,2019: 6734836.
PEZ-GRUESO R, GAMBINI J, et al. Sex differences in age-associated type 2 diabetes in rats-role of estrogens and oxidative stress[J]. Oxid Med Cell Longev, 2019,2019: 6734836.
[25] ZANIQUELI D, ALVIM R O, GRIEP R H, et al. Insulin resistance may be misdiagnosed by HOMA-IR in adults with greater fat-free mass: the ELSA-Brasil Study[J]. Acta Diabetol, 2021,58(1): 73-80.