腺癌作为肺癌最主要的组织学分类,以其分子病理多样性和生长速率多变而著称[1-5]。在肺腺癌中,常见的驱动基因包括EGFR、KRAS、ALK、BRAF和ROS1[6]。当基因发生突变时,相应的信号通路被激活,触发细胞内的级联信号,影响细胞增殖、血管生成和细胞凋亡,从而促进肿瘤的发生或肿瘤的进展[7-10]。
有几项研究比较了EGFR突变腺癌与未突变腺癌的体积倍增时间(volume doubling time, VDT),但由于测量方法和纳入标准的差异,结论存在矛盾[11-13]。此外,在肿瘤生长的过程中,影像上不仅表现为直径或体积会增加,而且内部实性成分也在同步增加[14-15]。本研究旨在比较有无驱动基因突变的原发性侵袭性肺腺癌中VDT和质量倍增时间(mass doubling time, MDT)的差异。
1 资料与方法
1.1 一般资料
选取2019年1月—2020年12月期间在同济大学附属上海市肺科医院行手术切除且术前至少2次胸部非增强CT检查的患者作为研究对象。纳入标准: (1) 经组织学证实的浸润性肺腺癌;(2) 切除前至少做2次胸部CT检查。排除标准: (1) 术后未进行基因检测;(2) 新辅助治疗患者;(3) 术前可用的非增强CT少于2次;(4) 术前2次非增强CT间隔<90 d;(5) 图像质量差;(6) 与周围正常组织难以区分;(7) 病理证实为复发或转移性腺癌。
1.2 结节分割及VDT和MDT的计算
一位胸部放射科医师(3年胸部CT经验)在肺窗(窗位,-450 HU;窗宽,1 200 HU)背景下独立绘制了每位患者2次胸部CT的病灶轮廓。勾画完成后由一位具有30年以上胸部CT经验的资深放射科医生验证和纠正。
结节分割完成后,通过商业软件自动计算病灶在首次和末次CT上的体积、质量。然后通过如下公式计算病灶的VDT和MDT: 倍增时间(doubling time, DT)=(log102×ΔT) /(log10Xi/Xf),其中DT为VDT或MDT,ΔT(单位: d)为两次胸部CT检查的间隔时间,Xi和Xf分别为初始体积/质量和最终体积/质量[单位: 立方毫米(mm3)或亨氏单位-立方毫米(HU-mm3)]。
1.3 CT扫描参数
所有CT图像均来自放射科扫描仪(飞利浦40排扫描仪或西门子64排扫描仪)。详细成像参数如下: 飞利浦40排扫描仪: 管电流150![]() 200 mAs,管电压120 kV,准直宽度40 mm×1.0 mm,旋转时间0.75 s,螺距1.2,扫描野350 mm,矩阵512×512。西门子64排扫描仪: 管电压120 kV,管电流200 mAs,准直宽度64 mm×0.6 mm,旋转时间0.9 s,螺距1.0,扫描野350 mm,矩阵512×512。所有胸部CT检查均在不注射造影剂的情况下进行。本中心所有CT扫描仪每周进行维护和校准,并扫描一个标准水模作为质量控制,以避免CT值偏移对病变诊断的影响。
200 mAs,管电压120 kV,准直宽度40 mm×1.0 mm,旋转时间0.75 s,螺距1.2,扫描野350 mm,矩阵512×512。西门子64排扫描仪: 管电压120 kV,管电流200 mAs,准直宽度64 mm×0.6 mm,旋转时间0.9 s,螺距1.0,扫描野350 mm,矩阵512×512。所有胸部CT检查均在不注射造影剂的情况下进行。本中心所有CT扫描仪每周进行维护和校准,并扫描一个标准水模作为质量控制,以避免CT值偏移对病变诊断的影响。
1.4 驱动基因突变检测
从手术切除的福尔马林固定石蜡包埋的肺腺癌样本中获得用于突变检测的DNA或RNA。提取的RNA首先反转录为cDNA,用于后续的检测程序。使用基于突变特异性扩增系统(amplification refractory mutation system, ARMS)技术的商业试剂盒检测EGFR、KRAS、BRAF、ALK和ROS1的突变。以上实验均按试剂盒提供的操作说明书进行。上述基因突变的归为突变组,其余为野生组。
1.5 测量变异性分析
在完成病灶分割1个月后,随机选择的30个结节(15个来自初始CT扫描,15个来自最终CT扫描),由同一观察者根据相同的标准再次进行人工分割,两次分割结果进行测量变异性测试。采用Bland-Altman分析计算观察者内测量变异性的95%置信区间(confidence interval, CI)。
1.6 体积或质量增长结节
基于初始体积(或质量)和术前体积(或质量),计算每个病灶在随访期间的相对体积和质量变化,并以百分比表示。参考以往的研究成果,本研究将相对体积(或质量)变化超过观察者测量变异性检验95%CI上限的结节定义为体积或质量生长结节[16]。
1.7 统计学处理
本研究的所有统计分析均使用SPSS 20.0和MedCalc(version 14.8.1)进行。正态分布的数据以均值±标准差![]() 表示,由于肿瘤的VDT和MDT不满足正态分布,所以用中位数和四分位数[M(P25,P75)]来描述。本研究中的计数资料以n(%)表示。采用Mann-Whitney U检验比较两组间VDT或MDT的统计学差异。采用Kruskal-Wallis检验多组间VDT或MDT的统计学意义。所有检验均为双侧检验,P<0.05为差异有统计学意义。
表示,由于肿瘤的VDT和MDT不满足正态分布,所以用中位数和四分位数[M(P25,P75)]来描述。本研究中的计数资料以n(%)表示。采用Mann-Whitney U检验比较两组间VDT或MDT的统计学差异。采用Kruskal-Wallis检验多组间VDT或MDT的统计学意义。所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 人口学及临床特征
2019年1月—2020年12月期间,共有4 054例成人患者在同济大学附属上海市肺科医院术前进行了至少2次胸部CT并最终进行了手术切除。根据前文排除标准,3 775例患者被排除,最后共有279例患者[平均年龄(62.15±8.90)岁]纳入了本次研究。其中99名男性和180名女性患者,共287个结节(其中8例患者有2个病变符合纳入标准),见表1。
表1 287例腺癌患者的基线特征
Tab.1 Baseline characteristics of 287 patients with adenocarcinoma ![]()

特征总数(n=287)驱动基因阳性组(n=72)驱动基因阴性组(n=215)P年龄/岁62.2±8.962.2±8.762.0±9.60.84性别0.65 女性185(64.5%)137(47.7%)24(16.7%) 男性102(35.5%)78(27.2%)24(8.4%)中位初始体积/mm3765(354,2012)783(388,2215)690(264,2358)0.15中位初始质量/(HU·mm-3)346(141,826)379(161,1006)268(101,1415)0.24中位术前体积/mm31358(708,2787)1282(703,2891)1414(718,2561)0.94中位术前质量/(HU·mm-3)601(319,1441)601(316,1441)569(349,1531)0.93中位随访间隔/d359(158,1004)346(150,937)429(163,1125)0.27中位体积倍增时间/d734(368,1389)767(375,1416)593(359,1187)0.45中位质量倍增时间/d703(411,1356)824(440,1452)537(351,1152)<0.01中位相对体积变化35.1%(11.3%,128.2%)33.4%(11.2%,101.5%)52.5%(15.5%,332.5%)0.06中位相对质量变化33.0%(11.3%,161.6%)31.9(9.8%,142.0%)63.73%(18.4%,375.8%)0.02病变类型0.07 纯磨玻璃结节100(34.8%)20(7.0%)80(27.9%) 混杂密度结节126(43.9%)30(10.5%)96(33.4%) 纯实性结节61(21.3%)22(7.7%)39(13.6%)驱动基因状态/ 阴性72(25.1%)072(25.1%) EGFR阳性193(67.3%)193(67.3%)0 BRAF阳性2(0.7%)2(0.7%)0 KRAS阳性10(3.5%)10(3.5%)0 ALK阳性4(1.4%)4(1.4%)0 ROS1阳性6(2.1%)6(2.1%)0EGFR突变位点/ Exon1810(5.2%)10(5.2%)0 Exon1966(34.2%)66(34.2%)0 Exon203(1.6%)3(1.6%)0 Exon21110(57.0%)110(57.0%)0 双突变4(2.1%)4(2.1%)0主要的组织学亚型0.19 贴壁型29(10.1%)21(7.3%)8(2.8%) 腺泡型217(75.6%)168(58.5%)49(17.1%) 乳头型23(8.0%)16(5.6%)7(2.4%) 实性型、微乳头型或复杂腺体型18(6.3%)10(3.5%)8(2.8%)
中位随访时间为359(158,1 004) d。所有肿瘤的中位相对体积变化为35.1%(11.3%,128.2%)。所有肿瘤的中位相对质量变化为33.0%(11.3%,161.6%)。
基因突变发生率为74.9%(215/287)。144例(50.2%)病变未检测BRAF和KRAS基因。在287例患者病灶中,EGFR突变阳性率为67.3%(193例),BRAF突变阳性率为1.4%(2例),KRAS突变阳性率为7.0%(10例),ALK突变阳性率为1.39%(4例),ROS1融合突变阳性率为2.1%(6例)。
腺泡型是最常见的组织学亚型[75.6%(217/287)],最常见的影像学表现为部分实性结节[43.9%(126/287)]。EGFR阳性是最常见的突变[67.3%(193/287)],外显子21是EGFR突变腺癌中最常见的突变位点[57.0%(110/193)]。
2.2 观察者内部体积和质量测量变异性
Bland-Altman分析(图1)显示,本研究的观察者体积测量变异性为-11.82%![]() 9.56%(平均值为-1.13%),质量测量的变异性为-8.30%
9.56%(平均值为-1.13%),质量测量的变异性为-8.30%![]() 8.78%(平均值为0.24%)。体积和质量测量无显著差异(体积,P=0.266 3;质量,P=0.767 2),表明观察者分割的一致性较好。
8.78%(平均值为0.24%)。体积和质量测量无显著差异(体积,P=0.266 3;质量,P=0.767 2),表明观察者分割的一致性较好。
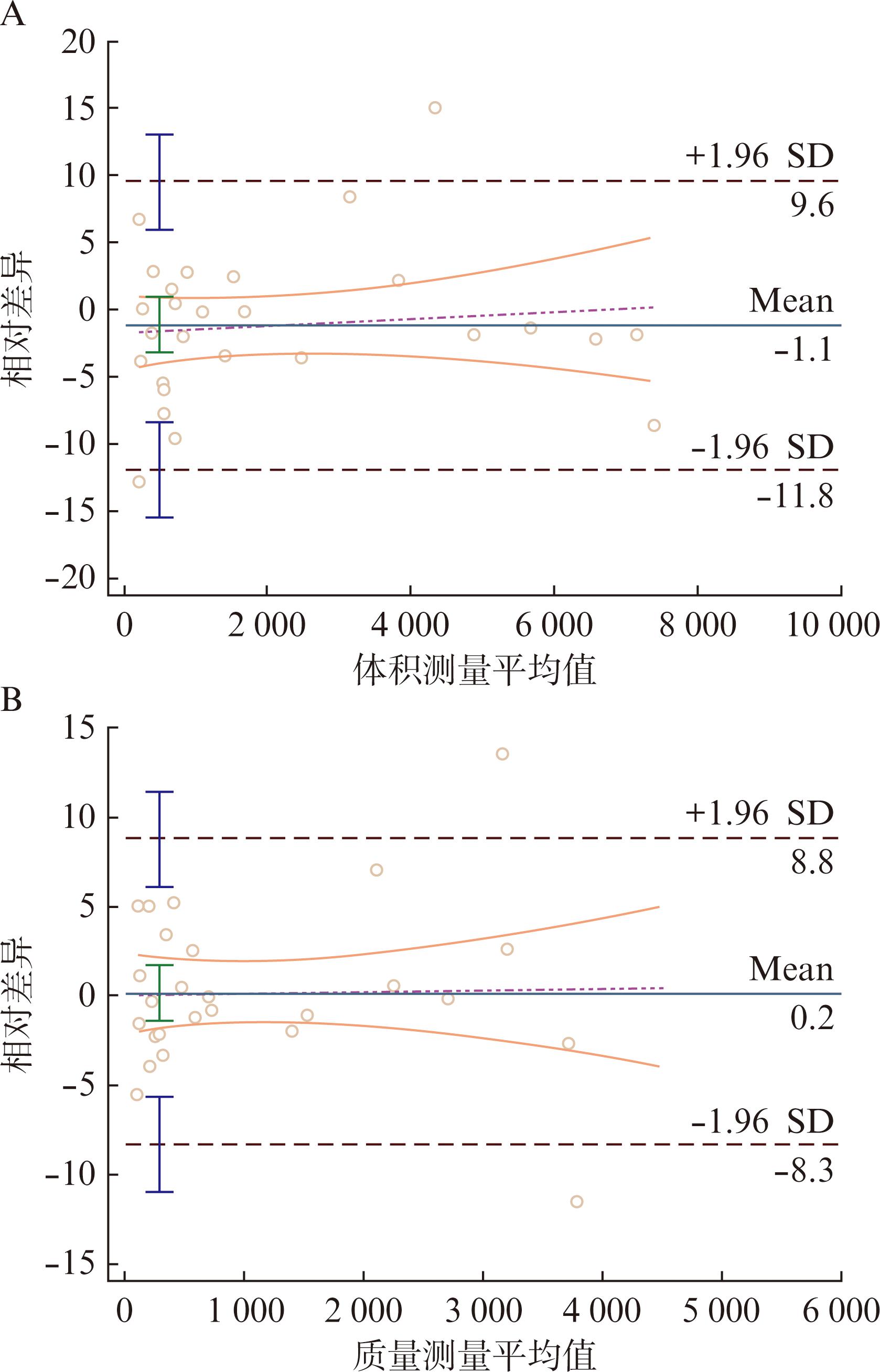
图1 观察者内测量变异性的Bland-Altman图
Fig.1 Bland-Altman plot of intra-observer measurement variability
A: 对于体积测量,观察者内变异性为-11.82%![]() 9.56%(平均值为-1.13%);B: 对于质量测量,观察者内变异性为-8.30%
9.56%(平均值为-1.13%);B: 对于质量测量,观察者内变异性为-8.30%![]() 8.78%(平均值为0.24%)
8.78%(平均值为0.24%)
根据变异性检验的结果,将初始和术前CT相对体积(或质量)变化超过9.56%(或8.78%)的结节定义为体积(或质量)增长的结节。
2.3 有无基因突变的VDT和MDT
基因突变组的中位VDT为767 d,基因野生组的中位VDT为593 d,基因突变组的中位MDT为824 d,基因野生组的中位MDT为537 d。在所有287例肿瘤中,突变组的VDT和MDT均大于野生组,但VDT差异无统计学意义(VDT,P=0.447;MDT,P=0.004),见表2。
表2 不同基因状态的VDT与MDT
Tab.2 VDTs and MDTs according to Gene Mutation Status [M(P25,P75)]
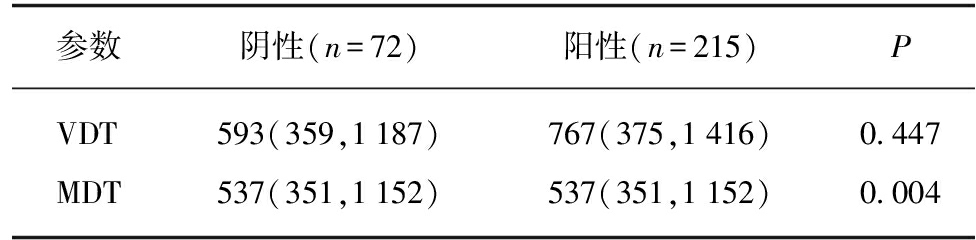
参数阴性(n=72)阳性(n=215)PVDT593(359,1187)767(375,1416)0.447MDT537(351,1152)537(351,1152)0.004
VDT: 体积倍增时间;MDT: 质量倍增时间
2.4 不同突变类别的VDT与MDT
EGFR阳性组的中位VDT为758 d,EGFR阴性组的中位VDT为593 d。关于EGFR的MDT,突变组和野生型组的中位MDT分别为824 d和537 d。虽然EGFR阳性组的VDT和MDT值均高于EGFR阴性组,但只有MDT存在显著差异(P=0.004;VDT,P=0.382),见表3。然而,在有无BRAF、KRAS、ALK或ROS1突变的结节之间,VDT和MDT没有显著差异(表3)。此外,在215例基因突变肿瘤中,Kruskal-Wallis检验显示5种常见腺癌驱动基因的差异不具有统计学意义(VDT,P=0.275;MDT,P=0.882)。
表3 不同突变类别的VDT与MDT
Tab.3 VDTs and MDTs according to driver gene category [M(P25,P75)]
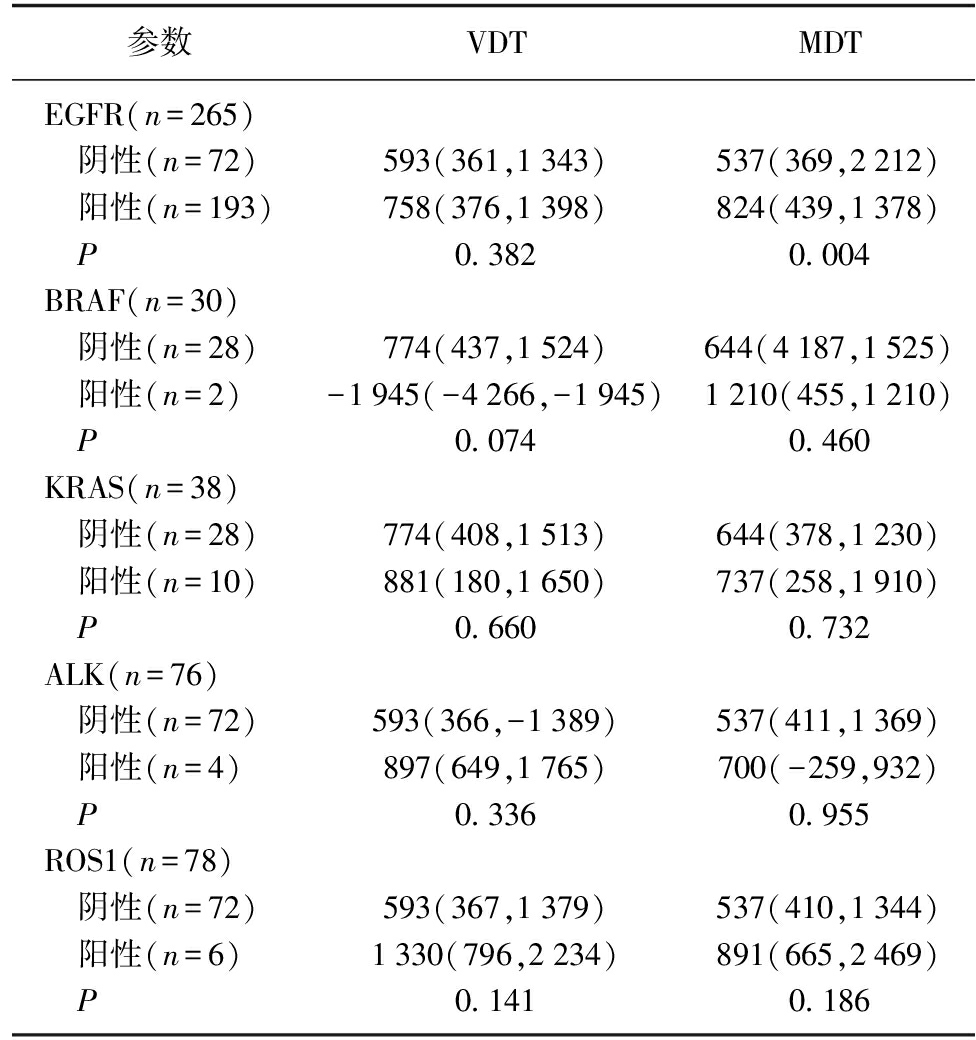
参数VDTMDTEGFR(n=265) 阴性(n=72)593(361,1343)537(369,2212) 阳性(n=193)758(376,1398)824(439,1378) P0.3820.004BRAF(n=30) 阴性(n=28)774(437,1524)644(4187,1525) 阳性(n=2)-1945(-4266,-1945)1210(455,1210) P0.0740.460KRAS(n=38) 阴性(n=28)774(408,1513)644(378,1230) 阳性(n=10)881(180,1650)737(258,1910) P0.6600.732ALK(n=76) 阴性(n=72)593(366,-1389)537(411,1369) 阳性(n=4)897(649,1765)700(-259,932) P0.3360.955ROS1(n=78) 阴性(n=72)593(367,1379)537(410,1344) 阳性(n=6)1330(796,2234)891(665,2469) P0.1410.186
VDT: 体积倍增时间;MDT: 质量倍增时间
2.5 EGFR不同突变位点肺腺癌的VDT与MDT
193例EGFR阳性腺癌中,18、19、20、21号外显子突变位点的频率分别为10(5.2%)、66(34.2%)、3(1.6%)和110(57.0%)。此外,有4例EGFR阳性腺癌具有两个突变位点(分别是外显子18和外显子21;外显子19和21;外显子19和外显子20;外显子20和外显子21),并在随后的Kruskal-Wallis检验中被排除。外显子18、外显子19、外显子20和外显子21突变的中位VDT和MDT分别为556、696、472、798 d和642、891、402、828 d。此外,94例(32.8%)EGFR野生型腺癌的中位VDT和MDT分别为601 d和622 d。Kruskal-Wallis检验显示,EGFR野生组、外显子18、19、20、21突变组间的VDT和MDT差异均无统计学意义(VDT,P=0.875;MDT,P=0.111),见表4。同样地,Kruskal-Wallis检验显示外显子18、19、20、21突变组间差异无统计学意义(VDT,P=0.111;MDT,P=0.763)。
表4 EGFR不同突变位点的VDT与MDT
Tab.4 VDTs and MDTs according to mutation site of EGFR [M(P25,P75)]

参数野生型(n=94)Exon 18(n=10)Exon 19(n=66)Exon 20(n=3)Exon 21(n=110)PVDT601(357,758)556(415,768)696(486,928)472(452,1941)798(586,924)0.875MDT622(422,825)642(426,824)891(728,1105)402(289,688)828(678,1358)0.111
VDT: 体积倍增时间;MDT: 质量倍增时间
2.6 增长结节的VDT和MDT
根据上述变异性检验结果,本研究共有223例(77.70%)结节在随访期间相对体积变化超过9.56%。在这223个体积增长结节中,中位VDT为691(105,6 721) d。Mann-Whitney U检验显示两组体积增长结节的VDT和MDT差异有统计学意义(突变组 vs 野生组,VDT,759 vs 592,P=0.048;MDT,749 d vs 499 d,P<0.001),见表5。
表5 增长型结节VDT与MDT
Tab.5 VDTs and MDTs in growing nodules [M(P25,P75)]
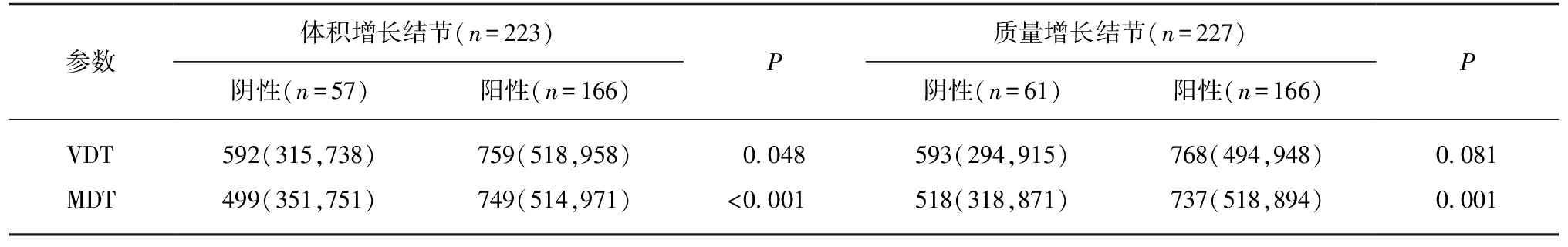
参数体积增长结节(n=223)阴性(n=57)阳性(n=166)P质量增长结节(n=227)阴性(n=61)阳性(n=166)PVDT592(315,738)759(518,958)0.048593(294,915)768(494,948)0.081MDT499(351,751)749(514,971)<0.001518(318,871)737(518,894)0.001
VDT: 体积倍增时间;MDT: 质量倍增时间
287例腺癌中有227例(79.09%)质量在随访期间显著增长。在227个质量增长结节中,中位MDT为660(96,4 311) d。Mann-Whitney U检验显示基因突变组和野生组的MDT有显著差异(737 d vs 518 d,P=0.001),见表5。
3 讨 论
对于肺腺癌的VDT,本研究中所有腺癌的中位值为751 d,其中EGFR野生腺癌的中位值为699 d,比以往的研究稍长[11-13]。在Nakamura、Zhang和Park的研究中,腺癌的VDT中位数分别为305、200和529 d,EGFR阴性病例的VDT中位数分别为139、207和339 d。笔者认为这些差异可能与纳入标准有关: 在他们的研究中,2次CT扫描之间的最短间隔分别为14、25、31 d,而本次研究只涉及随访间隔为90 d或更长时间的患者。
在本研究中,EGFR阳性腺癌和EGFR阴性腺癌的VDT没有明显差异,与之前的报道不一致[12-13]。在Nakamura等[12]的研究中,EGFR阴性组有22例(33%)肺鳞癌,EGFR阳性组有33例(94%)腺癌和1例(3%)鳞癌。Park等[13]的研究中,纳入对象为2次CT扫描中直径变化大于2 mm的肺腺癌。同样地,本研究中定义为体积增长结节中也观察到了类似的结果(表5)。
为了研究不同驱动基因对腺癌VDT和MDT的影响,分别在EGFR、KRAS、ROS1、ALK和BRAF组中进行Mann-Whitney U检验。虽然5组间两项肿瘤生长指标的数值存在差异,但除EGFR组外,未观察到差异有统计学意义(表3),这可能与本次研究纳入的样本数量较少有关。因此,未来需要更大规模的样本研究来揭示VDT或MDT与腺癌少见驱动基因之间的潜在相关性。
为了进一步探究EGFR不同突变位点与EGFR野生型肺腺癌在生长速率上有无差异,对它们的VDT和MDT进一步进行了亚组分析发现差异不具有统计学意义,与之前的报道一致[11-12]。
由于肿瘤的生物学行为受驱动基因及相关信号通路的调控,晚期腺癌患者的基因状态具有重要意义,也可能部分影响驱动基因突变患者的预后。基因状态(尤其是EGFR)在之前发表的几篇报道中已经证实了手术后生存不良与EGFR激活之间的负相关[16-17]。因此,本研究结果表明,EGFR突变组与较长的MDT相关,这可能解释了EGFR阳性患者的预后优于EGFR野生型患者。
虽然VDT在本研究的大部分统计检验中都没有统计学意义,但MDT在几项比较中表现出统计学意义,分析可能有以下几点原因。
首先,MDT是结合了直径和CT值变化的指标,相对于只考虑体积变化的VDT,MDT可能更为敏感,因为它同时考虑了CT值变化,这可能使得能够捕捉到那些体积变化不明显但质量变化较大的病灶[18-19]。因此,MDT的差异可能更易被检测出来。其次,肿瘤的体积变化和质量变化可能受到不同的生物学机制影响。驱动基因阳性的肿瘤可能在密度增加方面表现得更为明显,而在体积方面的变化较小。这可能与驱动基因突变导致的细胞增殖、凋亡和血管生成等生物学过程有关,从而影响了肿瘤的质量[8-9]。最后,肿瘤生长的不同阶段可能对其生物学行为和患者的预后产生不同的影响。在早期生长阶段,肿瘤可能更注重细胞增殖,而在后期可能更倾向于形成实性成分[20-21]。因此,MDT作为综合指标可能更能反映肿瘤在不同生长阶段的特点,从而显示出在两组之间的差异。
总之,VDT和MDT作为肿瘤生长的指标在不同方面具有不同的敏感性和生物学意义。MDT更能综合考虑肿瘤的生物学特性和内部结构变化,因此当存在驱动基因突变时,MDT可能更易显示出统计学差异。这也强调了在研究肿瘤生长特性时,综合多个指标来评估可能更为准确和全面。
本研究也存在一些局限性。(1) 本研究纳入的病例数量相对较少,可能存在不可避免的选择偏差,考虑为结节倍增时间研究的固有局限性。(2) BRAF、KRAS、ALK或ROS1突变患者入组的比例很小。由于较低的发生率和严格的纳排标准,无法纳入足够数量的患者,未来需要更大规模的研究来调查罕见突变与未来腺癌加倍时间之间的潜在联系。(3) 用于计算肿瘤体积和质量掩膜是由一个放射科医生手动分割的,这可能不可避免地受到来自观察者的主观性的影响。然而,本研究使用了Bland-Altman分析作为观察者内变异性检验以评估观察者内人工分割差异,结果显示出良好的一致性。
综上所述,驱动基因突变的原发性浸润性腺癌比野生型具有更长的倍增时间。特别是EGFR阳性的浸润性腺癌的MDT明显长于EGFR阴性的浸润性腺癌。
[1] TRAVIS W D, BRAMBILLA E, NOGUCHI M, et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society: international multidisciplinary classification of lung adenocarcinoma: executive summary[J]. Proc Am Thorac Soc, 2011,8(5): 381-385.
[2] LINDELL R M, HARTMAN T E, SWENSEN S J, et al. Five-year lung cancer screening experience: CT appearance, growth rate, location, and histologic features of 61 lung cancers[J]. Radiology, 2007,242(2): 555-562.
[3] HONDA O, JOHKOH T, SEKIGUCHI J, et al. Doubling time of lung cancer determined using three-dimensional volumetric software: comparison of squamous cell carcinoma and adenocarcinoma[J]. Lung Cancer, 2009,66(2): 211-217.
[4] MACKINTOSH J A, MARSHALL H M, YANG I A, et al. A retrospective study of volume doubling time in surgically resected non-small cell lung cancer[J]. Respirology, 2014,19(5): 755-762.
[5] 万志杰,王航,杜志鹏,等.基于TCGA数据库的肺癌和结直肠癌放疗后差异基因筛选、功能及通路研究[J].同济大学学报(医学版),2022,43(4): 467-473.
[6] LEVY M A, LOVLY C M, PAO W. Translating genomic information into clinical medicine: lung cancer as a paradigm[J]. Genome Res, 2012,22(11): 2101-2108.
[7] BROMBERG J. Stat proteins and oncogenesis[J]. J Clin Invest, 2002,109(9): 1139-1142.
[8] SCALTRITI M, BASELGA J. The epidermal growth factor receptor pathway: a model for targeted therapy[J]. Clin Cancer Res, 2006,12(18): 5268-5272.
[9] WOODBURN J R. The epidermal growth factor receptor and its inhibition in cancer therapy[J]. Pharmacol Ther, 1999,82(2-3): 241-250.
[10] 顾金香,李凯锐,吴家涛,等.Fbxl10通过PI3K途径促进肺癌细胞增殖和侵袭[J].同济大学学报(医学版),2022,43(3): 310-315.
[11] ZHANG R, CHEN B J, ZHOU Y Z, et al. Volume doubling time of lung adenocarcinomas considering epidermal growth factor receptor mutation status of exon 19 and 21: three-dimensional volumetric evaluation[J]. J Thorac Dis, 2017,9(11): 4387-4397.
[12] NAKAMURA R, INAGE Y, TOBITA R, et al. Epidermal growth factor receptor mutations: effect on volume doubling time of non-small-cell lung cancer patients[J].J Thorac Oncol, 2014,9(9): 1340-1344.
[13] PARK S, LEE S M, KIM S, et al. Volume doubling times of lung adenocarcinomas: correlation with predominant histologic subtypes and prognosis[J]. Radiology, 2020,295(3): 703-712.
[14] LEE H W, JIN K N, LEE J K, et al. Long-term follow-up of ground-glass nodules after 5 years of stability[J].J Thorac Oncol, 2019,14(8): 1370-1377.
[15] 赵方超,王增颖,林韬.肿瘤倍增时间在非小细胞肺癌患者预后评价中的作用[J].中国现代医学杂志,2020,30(15): 75-78.
[16] ISAKA T, NAKAYAMA H, ITO H, et al. Impact of the epidermal growth factor receptor mutation status on the prognosis of recurrent adenocarcinoma of the lung after curative surgery[J]. BMC Cancer, 2018,18(1): 959.
[17] BALASUBRAMANIAN S K, SHARMA M, VENUR V A, et al. Impact of EGFR mutation and ALK rearrangement on the outcomes of non-small cell lung cancer patients with brain metastasis[J]. Neuro Oncol, 2020,22(2): 267-277.
[18] DE HOOP B, GIETEMA H, VAN DE VORST S, et al. Pulmonary ground-glass nodules: increase in mass as an early indicator of growth[J]. Radiology, 2010,255(1): 199-206.
[19] HONG J H, PARK S, KIM H, et al. Volume and mass doubling time of lung adenocarcinoma according to WHO histologic classification[J]. Korean J Radiol, 2021,22(3): 464-475.
[20] CASTELLANOS E, FELD E, HORN L. Driven by mutations: the predictive value of mutation subtype in EGFR-mutated non-small cell lung cancer[J]. J Thorac Oncol, 2017,12(4): 612-623.
[21] SHIN D Y, NA I I, KIM C H, et al. EGFR mutation and brain metastasis in pulmonary adenocarcinomas. [J]. J Thorac Oncol, 2014,9(2): 195-199.