糖尿病(diabetes mellitus, DM)是临床常见的慢性系统性疾病,2015年全球糖尿病患者数量约为4.15亿人[1],全球范围内糖尿病的患病率高达8.5%[2],预计到2040年,全球糖尿病患者将达到6.42亿人,每10名成人中有1例糖尿病患者。糖尿病性视网膜病变(diabetic retinopathy, DR)是糖尿病的最常见并发症之一,约1/3糖尿病患者会并发DR,DR是全球处于工作年龄的成年人视力下降的首要原因[3]。随着我国国民经济快速增长,糖尿病患者病程延长、人们生活方式的改变,DM和DR的患病率逐年增加,致盲率也逐年升高。《中国2型糖尿病防治指南(2020版)》指出,我国糖尿病患者的患病率上升至11.2%,总数居世界第一[4]。对DR患者的及早诊断和治疗已成为当务之急。眼底荧光素血管造影(fundus fluorescein angiography, FFA)是目前公认的DR诊断的金标准,但由于其有创性,检查时间长、部分患者出现过敏反应等情况,导致许多患者无法进行此项检查。光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)作为一种新的诊疗手段,具有无创、高效、高分辨率、可持续追踪等优点,在DR的筛查和诊断方面具有重要的应用价值。本研究通过对不同分期的DR患者血流密度进行分析,探讨基于OCTA检查,不同分期DR患者视网膜血流密度的特点。
1 资料与方法
1.1 一般资料
本研究选取2017年1月—2020年12月于同济大学附属杨浦医院就诊并进行眼底荧光造影的DM患者98例(98眼),根据眼底照相及造影情况分为非增殖性糖尿病视网膜病变(non-proliferative DR, NPDR)组和增殖性糖尿病视网膜病变(proliferative-DR, PDR)组,其中NPDR组73例(73眼),PDR组25例(25眼)。另选取年龄、性别相匹配的无眼底疾病者22例(39眼)为对照组,基础信息见表1。
表1 健康人和糖尿病患者基础信息
Tab.1 Basic information for healthy subjects and diabetic patients
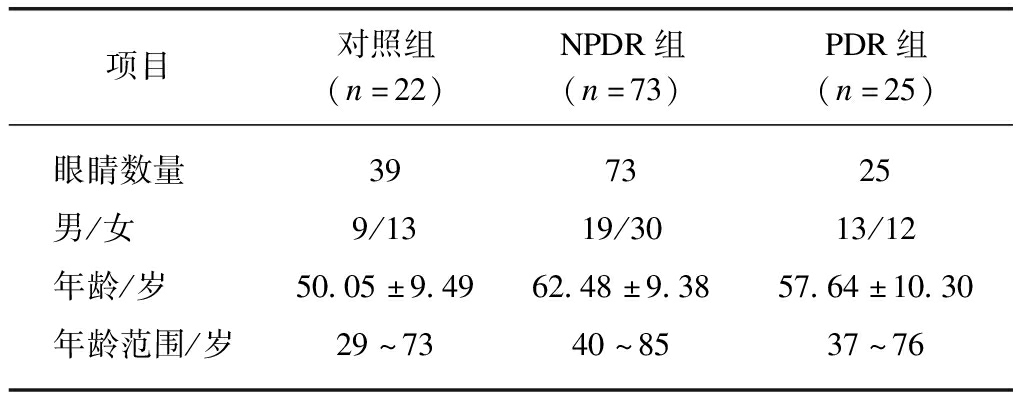
项目对照组(n=22)NPDR组(n=73)PDR组(n=25)眼睛数量397325男/女9/1319/3013/12年龄/岁50.05±9.4962.48±9.3857.64±10.30年龄范围/岁29~7340~8537~76
1.2 纳入标准和排除标准
纳入标准:(1)DM患者能较好地配合所需检查;(2)糖尿病患者均于1周内接受FFA和OCTA检查;(3)所有OCTA检查图片需满足成像质量≥5;(4)单眼图片质量合格者选取合格眼,双眼质量合格者根据患者FFA检查选取较严重的单眼,双眼相似者选择右眼。排除标准:(1)眼部手术史和外伤史;(2)黄斑水肿、萄膜炎症、视网膜静脉阻塞、老年黄斑变性、青光眼、高度近视等眼部其他疾病;(3)其他全身疾病:包括肾功能不全,高血压、冠心病等可能致眼部血管变化的疾病;(4)屈光间质浑浊致图片质量不合格者。本研究在患者和家属知情同意后进行,并经医院伦理委员会批准(编号:LL-2021-LW-007)。
1.3 方法
1.3.1 FFA及OCTA检查 常规对已进行FFA的患者行OCTA检查,运用Avanti RTVue XR(美国Optovue公司)OCTA机器中的Angio Vue Retina 6 mm×6 mm扫描模式对患者进行黄斑扫描,所有FFA和OCTA检查各由同1名操作熟练的眼科医师和技师完成,所有影像资料结果送由同1名眼底病医师进行阅片,以保证OCTA检查和读片的一致性。诊断标准参照《我国糖尿病视网膜病变临床诊疗指南(2014年)》中DR诊断标准,根据FFA检查结果诊断为NPDR和PDR。
1.3.2 观察指标 根据设备自带软件将黄斑区分同心圆,直径分别为1、3、6 mm,其中1 mm同心圆定义为黄斑中心凹区域,1~3 mm处定义为旁中心凹,3~6 mm为近中心凹,见图1。(1)给出的数据中读取深层及浅层的各分区血流密度,包括全图区视网膜平均血流密度(whole vessel density, WVD)、近中心凹血流密度(perifoveal vessel density, perifoveal VD/6 mm×6 mm)、旁中心凹血流密度(parafoveal vessel density, parafoveal VD/3 mm×3 mm)、中心凹血流密度(foveal vessel density, foveal VD/1 mm×1 mm)。(2)记录以上各区域平均视网膜厚度。(3)记录黄斑区数据。黄斑无血管区(foveal avascular zone, FAZ):基于全层视网膜进行测量(内界膜-外丛状层),自动识别黄斑无血管区的面积,FD-300:围绕FAZ区域300 mm宽度内中心凹血流密度。(4)分别记录深、浅层视网膜的各同心圆中的上、下、鼻、颞四方位血流密度;其中浅层视网膜为内界膜-内丛状层上10 μm;深层视网膜为内丛状层上10 μm-外丛状层下10 μm。
1.4 统计学处理
采用SPSS 22.0软件对数据进行统计学分析,对计量资料进行正态性检验,3组数据均符合正态分布。对数据进行方差齐性检验,方差齐性的数据,采用方差分析进行检验组间差异,方差不齐的数据,采用韦尔奇检验组间差异;再对3组数据进行多重比较。P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者浅层视网膜血流图比较
如下正常、NPDR、PDR患者的浅层视网膜血流图,可见随着DR患者的疾病程度加重,OCTA显示视网膜深、浅层的血流密度均有所下降,见图1。
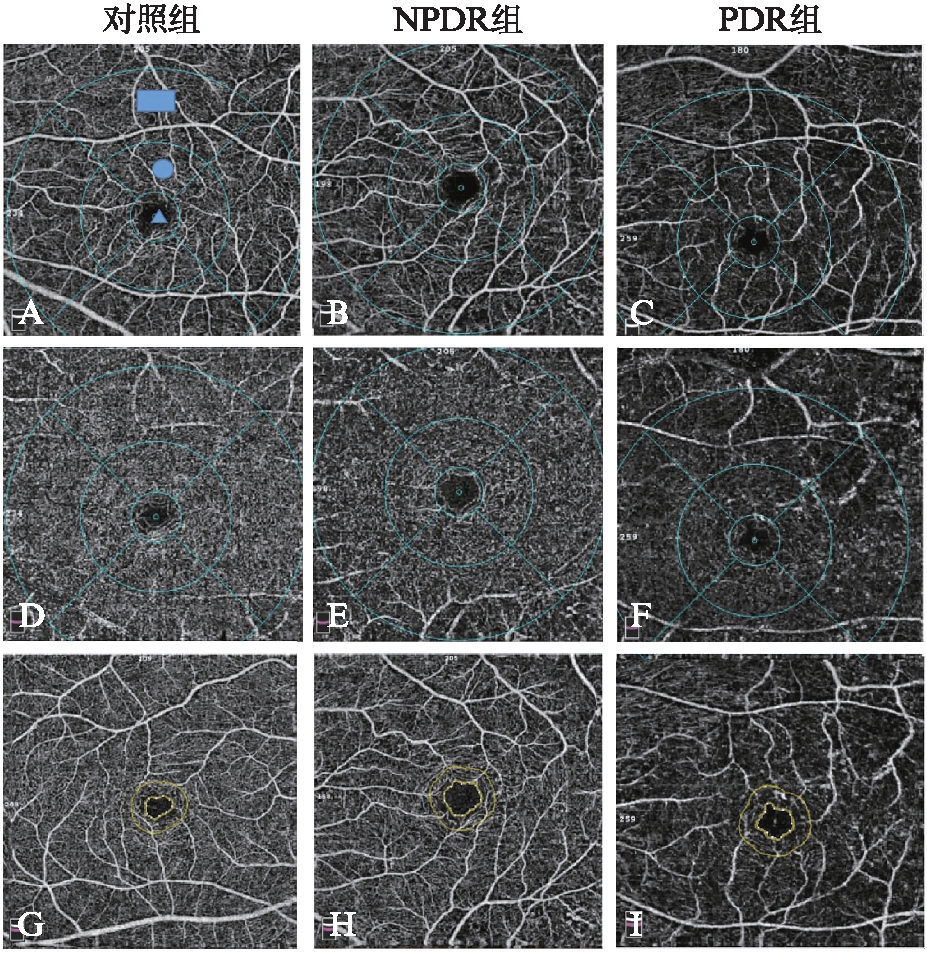
图1 3组患者浅层视网膜血流图
Fig.1 Superficial retinal vascular density in three groups
ABC分别为浅层视网膜血流图,矩形所示同心圆为3~6 mm直径,圆形所示为1~3 mm,三角形为1 mm血流;DEF分别为深层视网膜血流图;GHI所示内侧圆内为系统自动识别的黄斑中心凹无血管区,两个同心圆之间的区域即为FD-300:围绕无血管区域300 mm范围血流
2.2 各组浅层视网膜血流密度比较
3组视网膜浅层血流密度组间比较差异均有统计学意义,见表2。多重比较可见,正常组与PDR和NPDR组在全视网膜平均血流密度、近中心凹血流密度、旁中心凹血流密度相比差异均有统计学意义(P<0.05);正常组与NPDR的中心凹血流密度差异有统计学意义(P<0.05),而PDR与正常组和NPDR组的中心凹血流密度的差异无统计学意义,见表3。
表2 不同分组视网膜血流密度及视网膜厚度
Tab.2 Retinal vascular density and thickness in three groups![]()
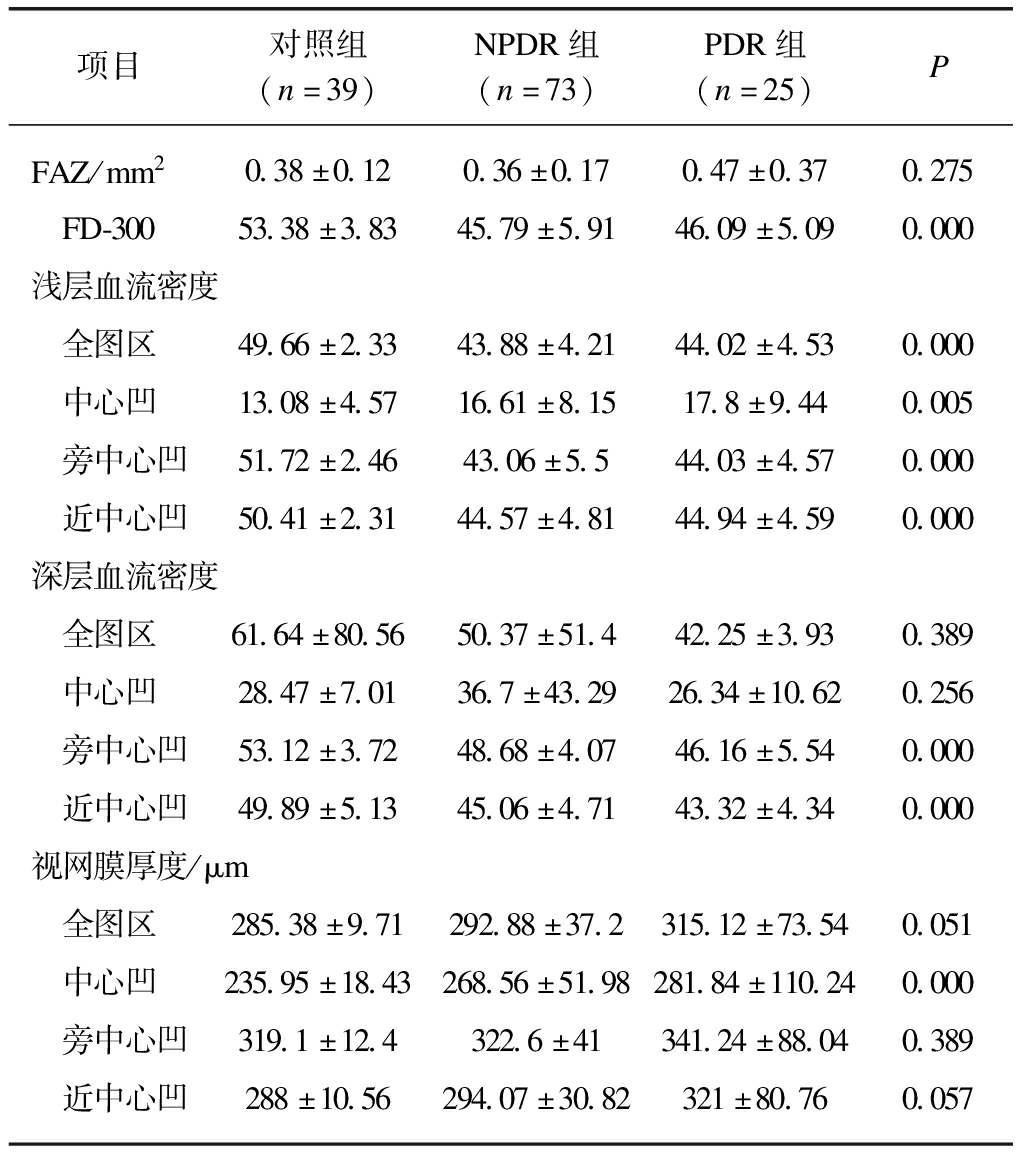
项目对照组(n=39)NPDR组(n=73)PDR组(n=25)PFAZ/mm20.38±0.120.36±0.170.47±0.370.275 FD-30053.38±3.8345.79±5.9146.09±5.090.000浅层血流密度 全图区49.66±2.3343.88±4.2144.02±4.530.000 中心凹13.08±4.5716.61±8.1517.8±9.440.005 旁中心凹51.72±2.4643.06±5.544.03±4.570.000 近中心凹50.41±2.3144.57±4.8144.94±4.590.000深层血流密度 全图区61.64±80.5650.37±51.442.25±3.930.389 中心凹28.47±7.0136.7±43.2926.34±10.620.256 旁中心凹53.12±3.7248.68±4.0746.16±5.540.000 近中心凹49.89±5.1345.06±4.7143.32±4.340.000视网膜厚度/μm 全图区285.38±9.71292.88±37.2315.12±73.540.051 中心凹235.95±18.43268.56±51.98281.84±110.240.000 旁中心凹319.1±12.4322.6±41341.24±88.040.389 近中心凹288±10.56294.07±30.82321±80.760.057
2.3 各组深层视网膜血流密度比较
3组视网膜深层血流密度组间比较部分数据(近中心凹血流密度,旁中心凹血流密度)差异有统计学意义(P<0.05),见表2。多重比较可见其中正常组与PDR和NPDR组相比在近中心凹血流密度、旁中心凹血流密度差异有统计学意义(P<0.05),PDR和NPDR组相比在近中心凹血流密度差异有统计学意义(P<0.05),其余各组数组相比较差异无统计学意义(P<0.05),见表3。
表3 三组之间多重比较统计学结果
Tab.3 Multiple comparison results among three groups (P)
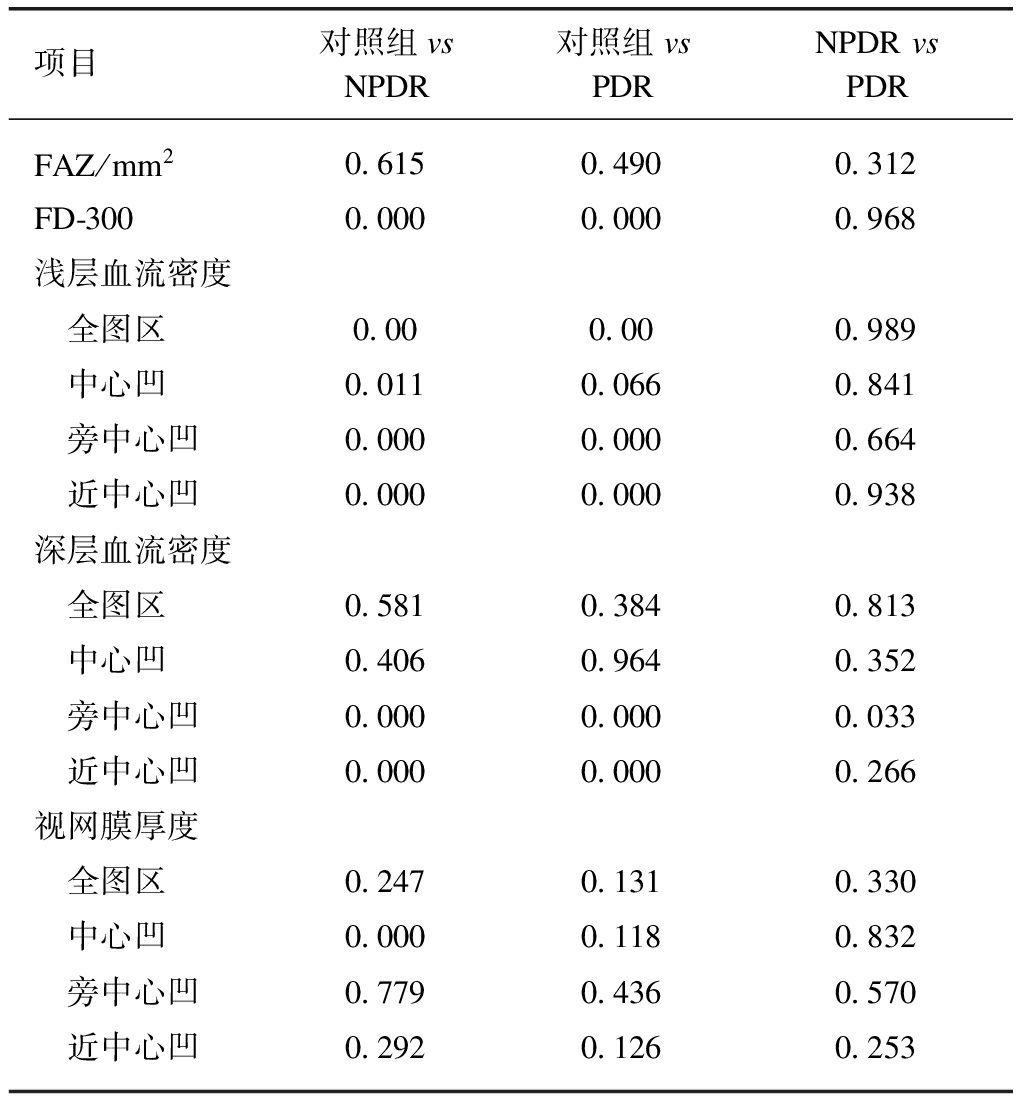
项目对照组vsNPDR对照组vsPDRNPDRvsPDRFAZ/mm20.6150.4900.312FD-3000.0000.0000.968浅层血流密度 全图区0.000.000.989 中心凹0.0110.0660.841 旁中心凹0.0000.0000.664 近中心凹0.0000.0000.938深层血流密度 全图区0.5810.3840.813 中心凹0.4060.9640.352 旁中心凹0.0000.0000.033 近中心凹0.0000.0000.266视网膜厚度 全图区0.2470.1310.330 中心凹0.0000.1180.832 旁中心凹0.7790.4360.570 近中心凹0.2920.1260.253
2.4 各组FAZ和FD-300比较
FAZ组间以及多重比较差异均无统计学意义。FD-300在正常组与PDR和NPDR组相比差异有显著统计学意义(P<0.05);而PDR和NPDR组相比差异无统计学意义,见表3。
2.5 各组视网膜厚度比较
除正常组与NPDR组相比黄斑中心凹厚度差异有统计学意义(P<0.05),其余各组相比差异均无统计学意义,见表2、3。
2.6 各组深、浅层各分区视网膜血流比较
进一步对深、浅层各个扇形区域进行分析比较,浅层视网膜中四方位(上、下、鼻、颞)与同心圆分区结果一致,均显示正常组与NPDR及PDR组差异显著(除黄斑区),PDR与NPDR血流密度无显著差异。深层各组四方位(上、下、鼻、颞)血流密度分析如下:全图区血流密度、中心凹血流密度、以及近中心凹上、鼻侧分区在各组间差异无统计学意义;旁中心凹四方位以及近中心凹的下、颞侧血流密度在正常组与NPDR及PDR组之间差异有统计学意义(P<0.05),PDR与NPDR两组之间相比,旁中心凹以及旁中心凹颞侧区域血流密度有差异有统计学意义(P<0.05),其余部位血流密度两组之间差异无统计学意义,这个结果与浅层血流不同,见表4、5。
表4 浅层视网膜各个分区血流密度统计学比较
Tab.4 Statistical results of vascular density in each division of superficial retina (P)
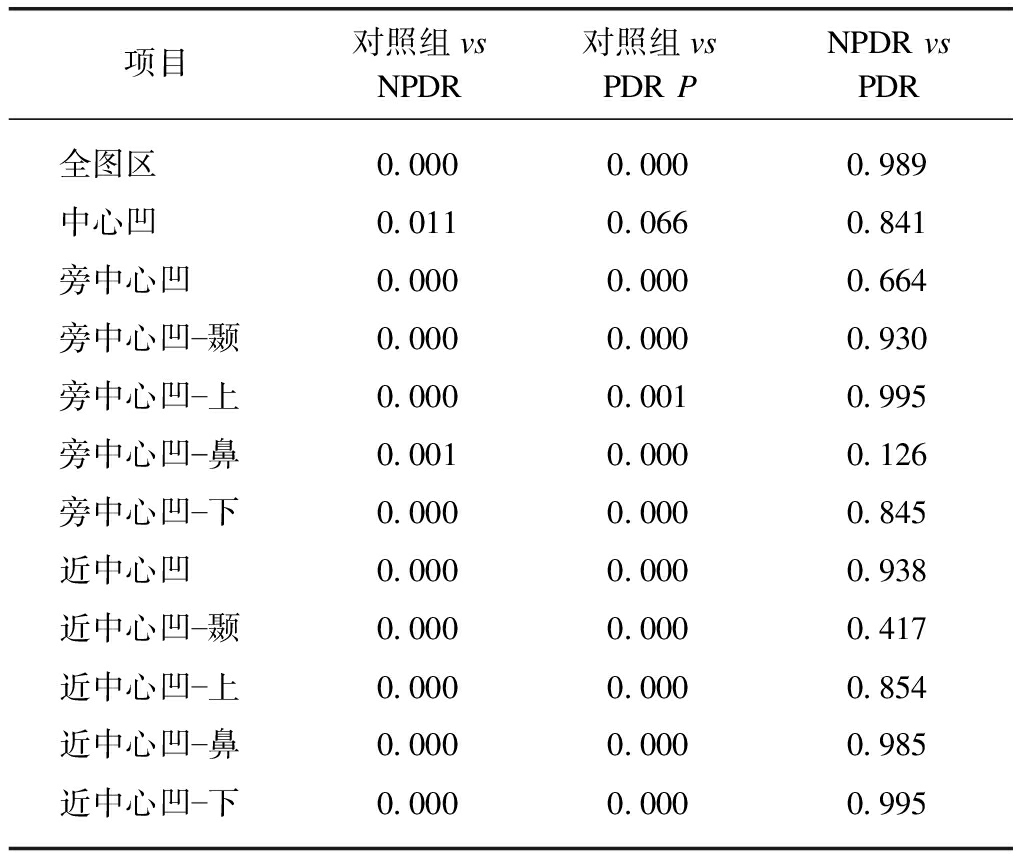
项目对照组vsNPDR对照组vsPDRPNPDRvsPDR全图区0.0000.0000.989中心凹0.0110.0660.841旁中心凹0.0000.0000.664旁中心凹颞0.0000.0000.930旁中心凹上0.0000.0010.995旁中心凹鼻0.0010.0000.126旁中心凹下0.0000.0000.845近中心凹0.0000.0000.938近中心凹颞0.0000.0000.417近中心凹上0.0000.0000.854近中心凹鼻0.0000.0000.985近中心凹下0.0000.0000.995
表5 深层视网膜各个分区血流密度统计学比较
Tab.5 Statistical results of vascular density in each division of deep retina (P)
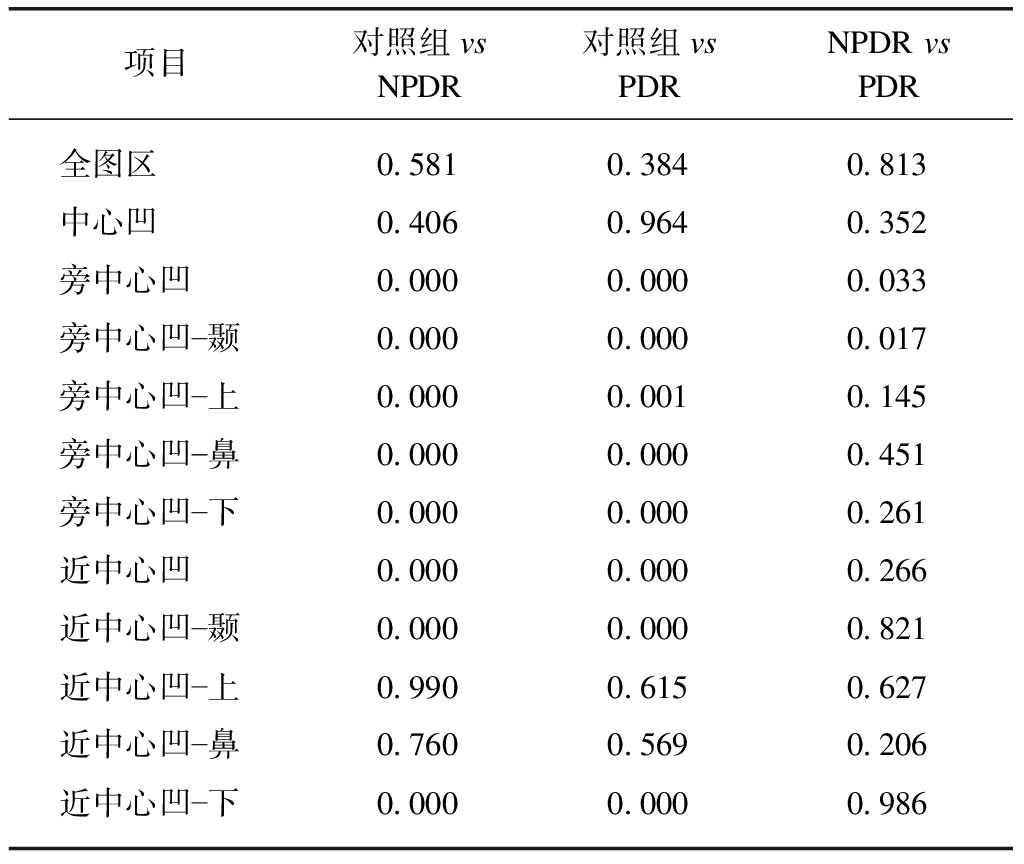
项目对照组vsNPDR对照组vsPDRNPDRvsPDR全图区0.5810.3840.813中心凹0.4060.9640.352旁中心凹0.0000.0000.033旁中心凹颞0.0000.0000.017旁中心凹上0.0000.0010.145旁中心凹鼻0.0000.0000.451旁中心凹下0.0000.0000.261近中心凹0.0000.0000.266近中心凹颞0.0000.0000.821近中心凹上0.9900.6150.627近中心凹鼻0.7600.5690.206近中心凹下0.0000.0000.986
3 讨 论
糖尿病视网膜病变是糖尿病的常见并发症,以视网膜微血管损害为特征的慢性进行性视力损害的眼病,病程较长的糖尿病患者几乎都会出现不同程度的视网膜微血管病变,尤其是糖尿病性黄斑水肿,严重影响视力,年轻患者更甚,发病迅速,治疗后复发率较高。OCTA作为一种全新的诊疗技术,利用去相干血管成像技术和血管分层重建使得视网膜和脉络膜的毛细血管可视化,并使用新颖的算法生成高分辨率的图像。相比与FFA,它具有无创、免散瞳、无时间窗限制、量化分析各层血管血流等优点,在国内外被广泛应用于眼科。一些研究表明[5-7],视网膜血流密度与空腹血糖、餐后血糖、糖化血红蛋白(HbA1c)等全身指标呈负相关;OCTA不仅可以检测出患视网膜病变风险更高的糖尿病眼,甚至可以在系统诊断之前筛查出DM,具有良好的预测作用。据文献报道,OCTA检测发现糖尿病眼在视网膜病变发生之前,黄斑部就存在视网膜微循环障碍[8]。
本研究发现,浅层视网膜血流分析,PDR/NPDR组与正常组相比,浅层不同范围内血流密度,以及深层近中心凹、旁中心凹血流密度、以及FD-300,差异均有统计学意义(P=0.00);而PDR与NPDR组相比差异不明显,从而提示了在糖尿病患者发生视网膜病变后视网膜浅层血流密度即开始出现明显下降,随着病情的进展,在未发生明显糖尿病性黄斑水肿(diabetic macular edema, DME)之前,视网膜浅层的血流密度下降反而不明显。在深层血流密度分析中,正常组分别与PDR/NPDR组相比较,旁中心凹和近中心凹血流密度差异显著,而PDR和NPDR相比较,旁中心凹尤其是旁中心凹颞侧血流密度有显著差异,而近中心凹和黄斑中心凹无显著差异,即随着DR严重程度的增加,深部的血流密度下降趋势更为明显,而且整个旁中心凹(尤其以颞侧为甚)的血流密度下降更明显。这与既往的一些的研究结果相似[9-11],在视力低于正常水平的糖尿病患者中,深部毛细血管丛的血管密度降低较浅层血流下降更明显。对于出现这种分化的原因,有研究[12]发现,在DR患者的视网膜血管中,深部微动脉瘤的数量明显多于浅部毛细血管丛。表明微动脉瘤主要起源于深部毛细血管丛,提示视网膜深层的血流可能受糖尿病进程的影响更大。在解剖结构上,浅层视网膜血流主要反映内界膜-内丛状层上10 μm;深层视网膜血流反映内丛状层上10 μm-外丛状层下10 μm 的血流状态,外丛状层为疏松的网状结构,是视锥、视杆细胞的终极球与双极细胞树突及水平细胞相连的突触部分,推测疏松结构中的微循环血流可能会有更明显的变化,颞侧的神经纤维束相对于黄斑与视盘之间的纤维束更为疏松分散,这也可能是旁中心凹深层的颞侧血流密度差异更显著的原因。而在缺血环境中,深部毛细血管丛可能对光感受器代谢有更大的影响,在血液回流中的作用更显著[13-15]。所以深层血流密度尤其是旁中心凹的血流密度更能体现糖网病的严重程度,在视网膜的血液回流和代谢中起到更为重要的作用。
糖尿病眼的FAZ因血管完整性丧失而增大[16],在糖尿病患者中,FAZ的形状因毛细血管丛的间隙、孔洞或缺口而不对称,其最大直径既不是水平的也不是垂直的。既往对FAZ的研究中发现其结果差异性较大,一些研究表明[17-19],与正常眼相比,FAZ破坏的分级与DR严重程度和视功能相关;但即使在正常个体中,FAZ区域也有很大的不同[20],与患者的年龄、中心凹和旁中心凹的厚度有关[21],这限制了其在DR病情中的评估作用;此外,视网膜深层的FAZ边界不太清晰,这使得测量更不稳定,可变性更强[9]。但在本研究中,3组患者随着DR的进展,FAZ的大小没有变化,可能一方面由于本研究在分析数据时剔除了DME患者的FAZ数据,另一方面,由于FAZ的测量存在一定的不稳定性,致使FAZ与糖网病的严重程度不具有一定的相关性。而FD-300作为围绕FAZ区域300 mm宽度内中心凹血流密度,可能对DR患者的视功能具有更为重大的意义,也可作为追踪DR患者眼底视网膜血流密度的一项重要指标,DR患者的FD-300较正常患者明显降低,在OCTA机器中,可设置多次检测结果的对比,更利于患者的管理和治疗对比。
在视网膜厚度对比中,仅正常组较NPDR组黄斑中心凹厚度差异有统计学意义(P=0.00),较NPDR组厚度更薄,而其余范围内视网膜厚度各组之间均无显著差异,这可能与本研究提前剔除DME患者相关。鉴于黄斑水肿这一特殊病理过程将导致视网膜增厚,不同时期的视网膜的厚度差异可能各不相同,与患者的血糖稳定性,是否进行药物治疗等均有关系,难以进行单一分析,分析结果可能不具有一致性。
综上,本研究认为通过OCTA检查发现糖尿病视网膜病变患者浅层血流密度及FD-300下降明显,且在NPDR时期已经出现明显的血流密度下降,PDR和NPDR之间血流密度差异不明显;糖尿病视网膜病变患者深层血流密度下降明显,且近中心凹及旁中心凹,尤其是旁中心凹血流密度更能反应DR患者的疾病严重程度。在OCT上未出现黄斑水肿之前,正常组与PDR/NPDR组,以及PDR和NPDR组之间各部位的视网膜水肿差异并不明显。
[1] International Diabetes Federation.IDF Diabetes Atlas.7th Edition.Brussels[EB/OL][2021-06-15].https:∥diabetesatlas.org/atlas/seventh-edition/
[2] World Health Organization.Global Report on Diabetes[EB/OL].[2021-06-20].https:∥www.who.int/publications/i/item/9789241565257
[3] YANG W, LU J, WENG J, et al.Prevalence of diabetes among men and women in China[J].N Engl J Med, 2010,362(12):1090-1101.
[4] LI Y Z, TENG D, SHI X G, et al.Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association:national cross sectional study[J].BMJ, 2020,369:m997.
[5] BHANUSHALI D, ANEGONDI N, GADDE S G, et al.Linking retinal microvasculature features with severity of diabetic retinopathy using optical coherence tomography angiography[J].Invest Ophthalmol Vis Sci, 2016,57(9):OCT519-OCT525.
[6] KIM A Y, CHU Z, SHAHIDZADEH A, et al.Quantifying microvascular density and morphology in diabetic retinopathy using spectral-domain optical coherence tomography angiography[J].Invest Ophthalmol Vis Sci, 2016,57(9):OCT362-OCT370.
[7] FALAVARJANI K G, KHADAMY J, AMIRKOURJANI F, et al.Macular thickness measurement in clinically significant macular edema before and after meal[J].J Curr Ophthalmol, 2015,27(3-4):125-128.
[8] TAKASE N, NOZAKI M, KATO A, et al.Enlargement of foveal avascular zone in diabetic eyes evaluated by en face optical coherence tomography angiography[J].Retina, 2015,35(11):2377-2383.
[9] SUN Z H, TANG F Y, WONG R, et al.OCT angiography metrics predict progression of diabetic retinopathy and development of diabetic macular edema:a prospective study[J].Ophthalmology, 2019,126(12):1675-1684.
[10] Mastropasqua R, Toto L, Mastropasqua A, et al.Foveal avascular zone area and parafoveal vessel density measurements in different stages of diabetic retinopathy by optical coherence tomography angiography[J].Int J Ophthalmol, 2017,10(10): 1545-1551.
[11] DUPAS B, MINVIELLE W, BONNIN S, et al.Association between vessel density and visual acuity in patients with diabetic retinopathy and poorly controlled type 1 diabetes[J].JAMA Ophthalmol, 2018,136(7):721-728.
[12] COUTURIER A, MANÉ V, BONNIN S, et al.Capillary plexus anomalies in diabetic retinopathy on optical coherence tomography angiography[J].Retina, 2015,35(11):2384-2391.
[13] SAMARA W A, SHAHLAEE A, ADAM M K, et al.Quantification of diabetic macular ischemia using optical coherence tomography angiography and its relationship with visual acuity[J].Ophthalmology, 2017,124(2):235-244.
[14] SCARINCI F, NESPER P L, FAWZI A A.Deep retinal capillary nonperfusion is associated with photoreceptor disruption in diabetic macular ischemia[J].Am J Ophthalmol, 2016,168:129-138.
[15] NESPER P L, SCARINCI F, FAWZI A A.Adaptive optics reveals photoreceptor abnormalities in diabetic macular ischemia[J].PLoS One, 2017,12(1):e0169926.
[16] FREIBERG F J, PFAU M, WONS J, et al.Optical coherence tomography angiography of the foveal avascular zone in diabetic retinopathy[J].Albrecht Von Graefes Arch Fur Klinische Und Exp Ophthalmol, 2016,254(6):1051-1058.
[17] LEE H, LEE M, CHUNG H, et al.Quantification of retinal vessel tortuosity in diabetic retinopathy using optical coherence tomography angiography[J].Retina, 2018,38(5):976-985.
[18] GOZLAN J, INGRAND P, LICHTWITZ O, et al.Retinal microvascular alterations related to diabetes assessed by optical coherence tomography angiography:a cross-sectional analysis[J].Medicine(Baltimore), 2017,96(15):e6427.
[19] TANG F Y, NG D S, LAM A, et al.Determinants of quantitative optical coherence tomography angiography metrics in patients with diabetes[J].Sci Rep, 2017,7(1):2575.
[20] SHAHLAEE A, PEFKIANAKI M, HSU J, et al.Measurement of foveal avascular zone dimensions and its reliability in healthy eyes using optical coherence tomography angiography[J].Am J Ophthalmol, 2016,161:50-55.e51.
[21] FALAVARJANI K G, SHENAZANDI H, NASERI D, et al.Foveal avascular zone and vessel density in healthy subjects:an optical coherence tomography angiography study[J].J Ophthalmic Vis Res, 2018,13(3):260-265.