谷氨酰胺(glutamine,Gln)是人体非必需氨基酸之一,对机体具有重要的生理功能,包括在蛋白质合成、维持酸碱平衡等生化过程中的重要作用。丙氨酰-谷氨酰胺(L-alanyl-L-glutamine,Ala-Gln)双肽注射液作为氨基酸类营养制剂,具有生物利用度较高、水溶性好的特点,临床上适用于处于分解代谢和高代谢状况的患者,比如存在肠道功能不全、严重代谢疾病、免疫缺乏综合征等。目前有动物实验及分子生物学等诸多证据表明Ala-Gln双肽制剂对于体质量下降和肌肉过量消耗的疾病机体康复有效[1]。相关研究显示Gln对机体有免疫增强作用,并有助于改善机体负氮平衡[2]。同时也有临床研究认为Gln有助于改善营养状况、维持外科重症患者肠道黏膜屏障功能及临床结局[3]。但目前仍缺乏针对Gln大样本的临床研究,尤其国内的相关研究较少,其临床应用的细胞分子机制也尚不完全明确。本研究拟评价Gln强化肠外营养在ICU患者中的应用效果,观察其对患者营养代谢、免疫功能、肠黏膜屏障功能及临床结局的影响,为临床合理规范应用Gln提供更多的依据。
1 资料与方法
1.1 一般资料
对2018年6月—2019年12月在同济大学附属第十人民医院ICU病房实施肠外营养的60例患者作为研究对象,随机分为实验组和对照组,脱落6例,实际完成研究54例,其中实验组28例,给予Ala-Gln双肽注射液强化肠外营养,对照组26例仅给予常规肠外营养。纳入标准:年龄18~80岁,性别不限;符合ICU病房收治标准,急性生理学及慢性健康状况评分系统Ⅱ(Acute Physiology and Chronic Health Evaluation Scoring System Ⅱ, APACHEⅡ)评分≥8分;预计实施肠外营养>7 d;符合肠外营养给予指征(NRS 2002评分≥3分,预期3 d内无法接受正常饮食且存在肠内营养禁忌证或不耐受肠内营养者)。纳入患者均签署知情同意书。排除标准:APACHEⅡ≥20分;肠内给予Gln或肠内肠外同时给予Gln;预计实施肠外营养≤7 d;生命体征未稳定的重症患者;正在使用免疫制剂或激素者;肝肾功能严重受损者;存在精神障碍者。
1.2 治疗方案
两组患者均给予肠外营养,提供热量为95.50~125.50 kJ/(kg·d),其配方含8.5%复方氨基酸注射液(制剂名称乐凡命,华瑞制药有限公司;规格:250 mL),提供氮量0.12~0.15 g/(kg·d);含有20%中长链脂肪乳注射液(制剂名称卡路,广州百特侨光医疗有限公司,规格:250 mL);糖脂能量比为2∶1,热氮比为(100~130)∶1。水与电解质、维生素、微量元素均按出入平衡原则供给,一起配制成全合一营养混合液(TNA),通过输液泵经深静脉导管16~18 h匀速输入。实验组在肠外营养的基础上额外给予(Ala-Gln)双肽注射液,根据指南和专家推荐意见[4-5],Gln的补充剂量按0.2~0.4 g/(kg·d)(二肽:0.3~0.6 g/kg·d),并算入患者的总氮摄入量,两组含氮摄入量差异无统计学意义。
1.3 观察指标
1.3.1 营养状况、炎性与免疫指标 入院第1天及第10天,分别抽取两组空腹外周静脉血,同时采用全自动生化分析仪对前白蛋白(pre-albumin, PA)、转铁蛋白(transferrin, TRF)、白蛋白(albumin, ALB)水平以及血清C反应蛋白(C-reactive protein, CRP)水平进行测定。采用流式细胞仪检测T淋巴细胞亚群指标,包括CD4+及CD8+。
1.3.2 肠黏膜屏障指标 二胺氧化酶、D-乳酸及内毒素可以反映肠道黏膜屏障损伤水平,可作为检测肠道屏障功能的指标[6]。采用北京中生金域诊断技术有限公司提供的二胺氧化酶/乳酸/细菌内毒素联检试剂盒(酶法)及JY-DLT肠道屏障功能生化指标分析系统检测两组患者实验前后血清二胺氧化酶、D-乳酸及细菌内毒素。正常值范围:二胺氧化酶≤10 U/L、D-乳酸≤15 mg/L、内毒素≤20 U/L。
1.3.3 临床结局指标 比较实验组和对照组在ICU住院期间的感染发生率、呼吸机辅助时间、病死率、住院天数。
1.4 统计学处理
采用SPSS 20.0软件进行数据统计分析,计量资料以![]() 表示,组间比较采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
表示,组间比较采用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
比较实验组与对照组入院时基本资料、体质量指数、病种、APACHE Ⅱ评分、PN时间、肝肾功能、随机血糖水平,两组之间差异无统计学意义(P>0.05),具有可比性,见表1。
表1 患者一般资料对比
Tab.1 Comparison of general information between two groups of patients
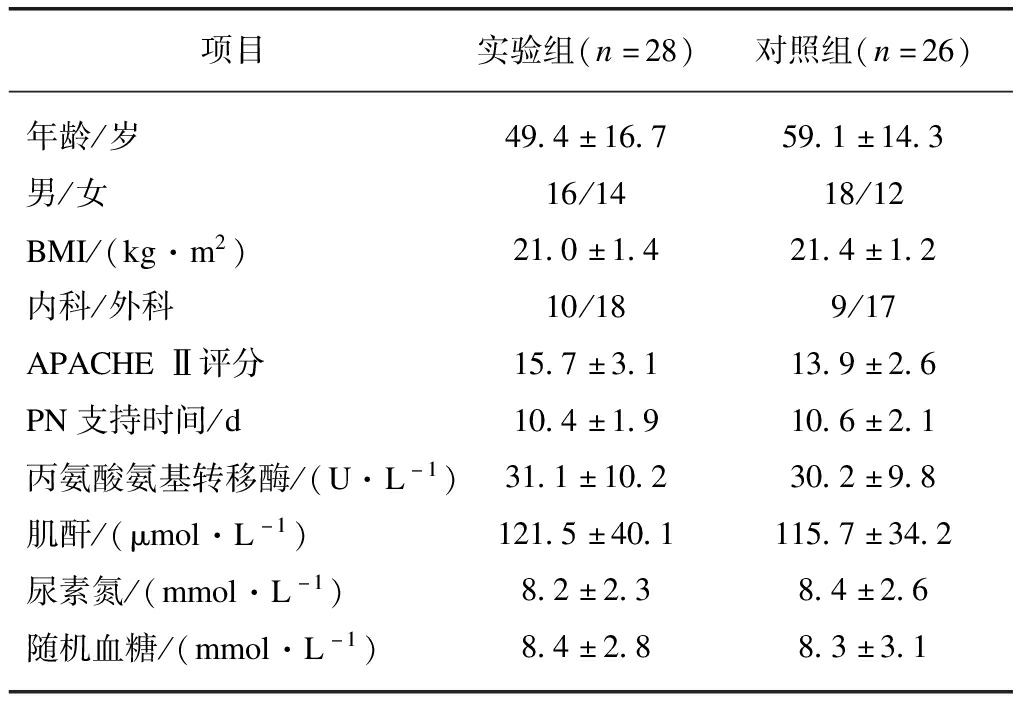
项目实验组(n=28)对照组(n=26)年龄/岁49.4±16.759.1±14.3男/女16/1418/12BMI/(kg·m2)21.0±1.421.4±1.2内科/外科10/189/17APACHEⅡ评分15.7±3.113.9±2.6PN支持时间/d10.4±1.910.6±2.1丙氨酸氨基转移酶/(U·L-1)31.1±10.230.2±9.8肌酐/(μmol·L-1)121.5±40.1115.7±34.2尿素氮/(mmol·L-1)8.2±2.38.4±2.6随机血糖/(mmol·L-1)8.4±2.88.3±3.1
2.2 两组营养状况、炎性与免疫水平比较
入院第10天:实验组前白蛋白、转铁蛋白、血清白蛋白水平显著高于对照组,差异有统计学意义(P<0.05);实验组血清C反应蛋白水平明显低于对照组,差异有统计学意义(P<0.05);实验组CD4+、CD8+水平明显高于对照组,差异具有统计学意义(P<0.05);与入院第1天比较,实验组前白蛋白、转铁蛋白、血清白蛋白水平显著提高,差异有统计学意义(P<0.05);血清C反应蛋白水平显著下降(P<0.05),见表2。
表2 两组营养状况、炎性与免疫水平比较
Tab.2 Comparison of nutrition status, inflammatory and immune indicators between two groups of patients

观察指标实验组(n=28)对照组(n=26)第1天第10天第1天第10天前白蛋白/(mg·L-1)134.6±23.1175.3±31.7∗#139.6±28.8150.6±18.4#转铁蛋白/(g·L-1)1.3±0.41.9±0.3∗#1.3±0.41.5±0.5#白蛋白/(g·L-1)31.9±3.133.1±1.2∗#31.2±3.231.9±3.2C反应蛋白/(mg·L-1)90.5±30.240.6±21.9∗#88.9±26.780.5±28.1CD4+(%)26.72±2.0833.90±2.19∗#26.30±4.5028.51±5.63CD8+(%)24.90±2.1029.31±4.62∗#23.69±3.1425.11±2.17
与对照组相比,*P<0.05;与第1天相比,#P<0.05
2.3 两组患者肠黏膜屏障功能比较
实验组入院第10天二胺氧化酶、D-乳酸、细菌内毒素水平显著低于对照组,差异有统计学意义(P<0.05);与入院第1天比较,实验组二胺氧化酶、D-乳酸、细菌内毒素水平显著降低,差异有统计学意义(P<0.05),见表3。
表3 两组肠黏膜屏障功能比较
Tab.3 Comparison of intestinal mucosal barrier function between two groups of patients

观察指标实验组(n=28)对照组(n=26)第1天第10天第1天第10天二胺氧化酶/(U·L-1)15.0±6.9011.33±5.7∗#14.68±4.8619.6±10.4#D-乳酸/(mg·L-1)26.7±14.7721.16±5.31∗#27.57±15.5030.15±11.33#细菌内毒素/(U·L-1)20.26±13.5819.15±6.27∗#19.74±11.4731.9±3.2#
与对照组相比,*P<0.05;与第1天相比,#P<0.05
2.4 临床结局指标
观察两组住院期间的感染发生率、呼吸机辅助时间、病死率、住院天数。实验组感染发生率明显低于对照组,差异有统计学意义(P<0.05);实验组呼吸机辅助时间、病死率、住院天数与对照组相比降低,但无统计学意义(P>0.05)。具体见表4。
表4 两组临床结局指标比较
Tab.4 Comparison of clinical outcomes between two groups of patients

组别n呼吸机辅助时间/d感染发生率(%)病死率(%)住院天数/d实验组286.3±2.110.7(3/28)∗7.1(2/28)14.8±3.2对照组267.1±3.234.6(9/26) 11.5(3/26)16.4±5.1
与对照组相比,*P<0.05
3 讨 论
机体在遭受严重打击后所产生的全身性炎症反应和免疫抑制是导致机体器官出现进一步损伤的基础,这方面的相关研究是目前重症医学研究的热点之一。肠内营养因为具有减少肠道菌群移位,降低感染发生率以及遵循生理途径、降低住院费用等诸多优点,被认为是ICU推荐首选的营养给予途径。但很多ICU病房的患者由于出现胃肠功能紊乱、减弱及障碍、机体消耗严重等原因仍然需要接受肠外营养支持。
免疫营养素发挥的炎症调理与免疫功能改善的作用一直受到医学界关注。免疫营养素不仅可以增强免疫应答功能,维持正常免疫反应,还能通过调控细胞因子产生和释放来缓解炎性反应,进而保护机体肠黏膜屏障功能,所以其在临床综合治疗中的作用也越来越受到重视。Gln作为具有代表性的免疫营养素之一,属于非必需游离氨基酸,人体内含量丰富。另外,它还可以在一定程度上预防和纠正机体的营养代谢异常状况。本研究显示,实验组在肠外营养基础上强化使用Ala-Gln双肽治疗10 d后,前白蛋白、转铁蛋白、血清白蛋白水平明显提升,并且高于对照组,提示使用该种方案可以帮助纠正ICU患者营养不良,这可能与增加危重症患者的支链氨基酸含量,改善蛋白质代谢,促进蛋白储备,提高血浆蛋白水平有关。机体在高分解代谢情况下,肌肉与血液中的Gln会减少;研究表明,大约25%~35%的ICU患者存在Gln水平浓度降低[1]。补充Gln可以明显增加危重患者的淋巴细胞总数、T淋巴细胞及循环中CD4+/CD8+的比率,从而改善机体免疫功能[2]。有临床研究认为,危重病患者中加用Gln制剂进行肠外营养支持能够降低患者感染的发生率,缩短ICU患者住院时间,但并不能降低在ICU住院的死亡率[7],这与本研究的结果基本一致。一项在美国研究中心进行的安全性和有效性研究认为,ICU患者外科术后加用Gln进行肠外营养治疗的方案是安全可靠的,不会导致患者发生肝肾损害,但不能有效地改善机体预后[8]。本研究结果显示,实验组的临床免疫指标CD4+、CD8+结果改善优于对照组,这与张万红等[9]的研究结果一致,说明Gln可以有效提高机体免疫力。另有研究也证实临床使用Gln双肽后,可以提高机体应激状态下的免疫功能[10]。本研究结果提示ICU患者加用Gln进行肠外营养治疗后,炎症指标CRP在第10天时与对照组相比明显降低,说明Gln有助于降低危重症患者的炎症反应,帮助提高机体的细胞免疫水平,研究结果与国外相关研究相一致[11]。
营养支持治疗有利用肠功能恢复、避免肠黏膜萎缩、维持肠道菌群平衡及肠黏膜屏障功能[12]。近年来,国内外学者们越来越关注Gln对肠道屏障功能的保护作用。Gln是人体含量最丰富的游离氨基酸,不仅是蛋白质合成的前提物质,而且还是核酸、嘌呤、嘧啶等物质合成的前提和氮源的提供者。它作为小肠黏膜上皮细胞的主要能源物质,给肠黏膜细胞提供较好呼吸燃料,也是所有快速增殖细胞特别是免疫细胞的能源物质[13]。本研究结果显示,实验组在第10天的肠黏膜屏障功能优于对照组,同时也较第1天的水平有所改善。
综上所述,给予Gln强化的肠外营养支持,可以帮助提高ICU患者的机体免疫功能、减轻机体炎性反应、降低感染并发症改善肠黏膜屏障功能、以及纠正机体细胞异常代谢,从而改善营养状况。对住院天数、病死率等临床结局方面的影响虽呈现下降趋势但并不显著。作为免疫营养素的Gln应用于危重症患者时,应慎重考虑临床用药指征、适宜对象和用药剂量,以及根据患者的个体差异制定个体化用药方案,将有助于发挥Gln的药理作用。
[1] BROOKS J R, OKETCH-RABAH H, LOW DOG T, et al.Safety and performance benefits of arginine supplements for military personnel:a systematic review[J].Nutr Rev, 2016,74(11):708-721.
[2] FAN J, WU J, WU L D, et al.Effect of parenteral glutamine supplementation combined with enteral nutrition on Hsp90 expression and lymphoid organ apoptosis in severely burned rats[J].Burns, 2016,42(7):1494-1506.
[3] 焦艳.丙氨酰谷氨酰胺对胃癌术后化疗患者腹泻的影响[J].安徽医药,2015,19(1):164-165.
[4] 薛长勇,江华,陈伟,等.谷氨酰胺在危重症患者中临床应用的专家推荐意见(节录)[J].营养学报,2016,38(5):421-426.
[5] SINGER P, BERGER M M, VAN DEN BERGHE G, et al.ESPEN Guidelines on parenteral nutrition:intensive care[J].Clin Nutr, 2009,28(4):387-400.
[6] 明亮,刘瑞涵,王欣,等.急性重症胰腺炎患者血清二胺氧化酶的变化及与患者CTSI评分、胃肠道功能变化的关系[J].国际检验医学杂志, 2017,38(14):1918-1920.
[7] WISCHMEYER P E, DHALIWAL R, MCCALL M, et al.Parenteral glutamine supplementation in critical illness:a systematic review[J].Crit Care, 2014,18(2):R76.
[8] ZIEGLER T R, MAY A K, HEBBAR G, et al.Efficacy and safety of glutamine-supplemented parenteral nutrition in surgical ICU patients:an American multicenter randomized controlled trial[J].Ann Surg, 2016,263(4):646-655.
[9] 张万红,苏长春.国内谷氨酰胺强化的肠外营养对胃癌患者免疫功能影响的meta分析[J].中华普通外科学文献(电子版),2011,5(4):343-346.
[10] NIENABER A, DOLMAN R C, VAN GRAAN A E, et al.Prevalence of glutamine deficiency in ICU patients:a cross-sectional analytical study[J].Nutr J, 2016,15(1):73.
[11] ABE T, HOSOI T, KAWAI R, et al.Perioperative enteral supplementation with glutamine, fiber, and oligosaccharide reduces early postoperative surgical stress following esophagectomy for esophageal cancer[J].Esophagus, 2019,16(1):63-70.
[12] 王若晨,韩婷,李伟.益生菌联合肠内营养制剂对炎症性肠病的疗效观察[J].同济大学学报(医学版),2018,39(4):107-113.
[13] 杨洋,赵勇.丙氨酰谷氨酰胺及双歧杆菌三联活菌胶囊在结直肠癌术后辅助化疗中对肠道屏障功能的影响[J].中国现代医学杂志,2020,30(15):79-84.