垂体腺瘤(pituitary adenomas, PAs)约占颅内肿瘤的10%[1]。大多数PAs是无创的,其生长缓慢,停留在蝶鞍内和/或取代周围组织。然而,高达25%~55%的PAs可能表现为浸润性特征(Knosp Ⅲb和Ⅳ),即侵袭海绵窦和蝶窦以及局灶性或广泛的骨侵蚀;这类肿瘤被认为是侵袭性的PAs[2]。侵袭性PAs的增殖率明显高于非浸润性PAs,预后较差,易复发。与非侵袭性腺瘤患者相比,侵袭性腺瘤患者术后6年生存率明显较低[2]。因此,探讨PA侵袭的机制对提高其诊断和治疗是必要的。
目前有临床研究表明,肥胖或过重是垂体瘤发生发展的危险因素,并且会降低临床治疗效果,导致不良预后的发生[3-5]。然而,其潜在的分子机制尚未阐明。近年来,解析肥胖与肿瘤发展和诊疗的关系已成了肿瘤研究的热门话题。有文献表明,肥胖可以重塑肿瘤微环境代谢减少抗肿瘤免疫细胞(CD8+ T细胞),促进促肿瘤细胞(M2巨噬细胞)的浸润从而加速肿瘤生长[6]。其中肿瘤相关巨噬细胞(tumor associated macrophages, TAMs)参与了体内平衡功能,促进恶性肿瘤的启动和进展[7-8]。多项研究表明,在各类PAs中均有发现巨噬细胞浸润[9-11]。此外,肥胖可以介导炎症细胞分泌趋化因子CCL17进而加重哮喘症状[12]。有研究表明,表达CCL17的CD163+ M2型的巨噬细胞可以促进非吸烟肺腺癌患者的肿瘤转移[13]。但其在垂体瘤微环境下的表达情况,及其对垂体瘤的进展却鲜有报道。本研究检测CCL17蛋白在垂体腺瘤微环境中的表达,并结合临床病例标本,探讨CCL17表达对肿瘤患者临床病理特征及肿瘤复发的关系,为垂体瘤诊断治疗和预防复发提供一定的理论基础及实验依据,以期寻找新的潜在垂体腺瘤诊断及判断预后的分子标志物。
1 资料与方法
1.1 一般资料
选取2017年1月—2020年12月上海交通大学附属第一医院神经外科接受内镜经鼻蝶窦垂体腺瘤切除术并且经临床症状、体征、影像、激素及病理证实为垂体腺瘤患者的肿瘤标本64例,其中侵袭性腺瘤32例,非侵袭性腺瘤32例。病例入选标准:(1)行内镜经鼻蝶窦垂体腺瘤切除术;(2)术前具有垂体腺瘤相关内分泌激素水平测定、CT和MRI检查结果等;(3)术后病理及免疫组织化学检查结果证实为垂体腺瘤;(4)之前未接受激素、药物、放疗和手术等治疗。术中见肿瘤累及鞍底硬膜及骨质或侵犯海绵窦或鞍上者为侵袭性垂体腺瘤;术中未见肿瘤侵犯鞍底、海绵窦或鞍上者诊断为非侵袭性垂体腺瘤。所有标本收集前均已获得患者知情同意,并且获得上海交通大学附属第一人民医院伦理委员会批准(编号:2021SQ120)。
1.2 仪器与试剂
兔抗鼠CCL17多克隆抗体、兔抗鼠CD68多克隆抗体购自武汉爱博泰克生物科技有限公司。二氨基联苯胺(diamino-benzidine, DAB)试剂盒购自北京中杉金桥生物技术有限公司。cDNA反转录试剂盒、RNA提取试剂盒和实时荧光定量试剂盒购自天根生化科技(北京)有限公司。CCK-8溶液购自武汉博士德生物工程有限公司。
1.3 方法
1.3.1 免疫组织化学染色 将人垂体瘤标本行蜡块包埋后进行连续切片处理,厚度为8 μm,60 ℃烤片1 h。随后用二甲苯和梯度乙醇进行脱蜡,95 ℃下用柠檬酸钠缓冲液进行抗原修复。置于0.3%的过氧化氢中,室温孵育10 min,羊血清封闭30 min,加入一抗(兔抗鼠CD68多克隆抗体1∶400稀释),4 ℃下过夜孵育。PBS缓冲液冲洗3次,加入生物素标记的羊抗兔IgG(1∶200稀释)室温孵育1 h,冲洗3次后DAB显色。梯度脱水后封片处理,在光学显微镜下拍照。染色强度由Image J软件分析。
1.3.2 免疫荧光检测 将人垂体瘤标本行蜡块包埋后进行连续切片处理,厚度为8 μm,60 ℃烤片1 h。随后用二甲苯和梯度乙醇进行脱蜡。经过封闭、孵育CCL17(1∶100)一抗,24 h避光孵育及DAPI复染细胞核。在正置荧光显微镜下拍照保存。细胞表达阳性比例由Image J软件分析。
1.3.3 RT-qPCR 将患者垂体瘤组织剪取黄豆大小,收集置于1.5 mL无酶EP管中,加入500 μL TRIzol和100 μL氯仿。振荡混匀并室温静置,离心半径8.66 cm,12 000 r/min,离心15 min。移出上清液至新的EP管中,加入等体积异丙醇,上下颠倒静置5 min 后,离心半径8.66 cm,10 000 r/min,离心10 min。去除上层液体,75%乙醇清洗,离心弃液后晾干,加水溶解。按cDNA反转录试剂盒操作说明进行反转录。以β-actin作为内参,根据FastStart Unicersal SYBR Green Master操作说明进行PCR反应。通过检测样本CT值进行统计,采用2-△△CT法计算出目的基因mRNA的相对表达量。引物序列如下。CD68上游引物:5′-TAGCTGGACTTTGGG-TGAGG-3′;CD68下游引物:5′-CCAGTGCTCTCT-GCCAGTA-3′;CCL17上游引物:5′-TCTGCCCGC-TCAAACA-GTTG-3′;CCL17下游引物:5′-TTTG-TGGTCGAAGGAGTCGG-3′;ACTB上游引物:5′-CTCACCATGGATGATGATATCGC-3′;ACTB下游引物:5′-CCACATAGGAATCCTTCTGACC-3′。
1.3.4 细胞活性试验 将正常GH3细胞预先培养于96孔板中,每孔2 500个细胞,在培养液中分别加入PBS和100 ng/mL的CCL17重组蛋白,分别培养0、24、48和72 h。每孔加入10 μL CCK-8溶液,于37 ℃培养箱中培养3 h,酶标仪设置波长450 nm 测定吸光度(A450),并依据吸光度绘制细胞生长曲线。
1.3.5 细胞划痕实验 将正常GH3细胞预先接种于6孔板中,待细胞融合度达100%时,用无菌10 μL枪头垂直划出均匀的3个间隔,随后用PBS清洗3次,以去除脱落细胞。在培养液中分别加入PBS和100 ng/mL的CCL17重组蛋白,在0、24和48 h时分别在相同位置进行拍照,比较两组划痕愈合速度。
1.4 统计学处理
采用Graph Pad Prism 8.0软件进行数据处理和统计学分析,计数资料比较采用χ2检验,计量资料以![]() 表示,并采用Student t检验统计分析,CCL17表达和肿瘤大小相关性采用Pearson相关性分析,P<0.05为差异有统计学意义。
表示,并采用Student t检验统计分析,CCL17表达和肿瘤大小相关性采用Pearson相关性分析,P<0.05为差异有统计学意义。
2 结 果
2.1 侵袭性垂体瘤中巨噬细胞浸润增加
结合患者临床信息分析,本研究发现侵袭性垂体瘤患者体质量指数(body mass index,BMI)显著高于非侵袭性垂体瘤患者[(29.891±5.461)vs(25.444±4.784)kg/m2],差异有统计学意义(P<0.01),见图1A。免疫组织化学结果显示,与非侵袭性垂体瘤相比,侵袭性垂体瘤巨噬细胞的浸润显著增多,见图1B;而且巨噬细胞标志物CD68在侵袭性垂体瘤患者中的表达水平(0.023±0.019)显著高于非侵袭性垂体瘤患者(0.034±0.024),差异有统计学意义(P<0.05),见图1C。
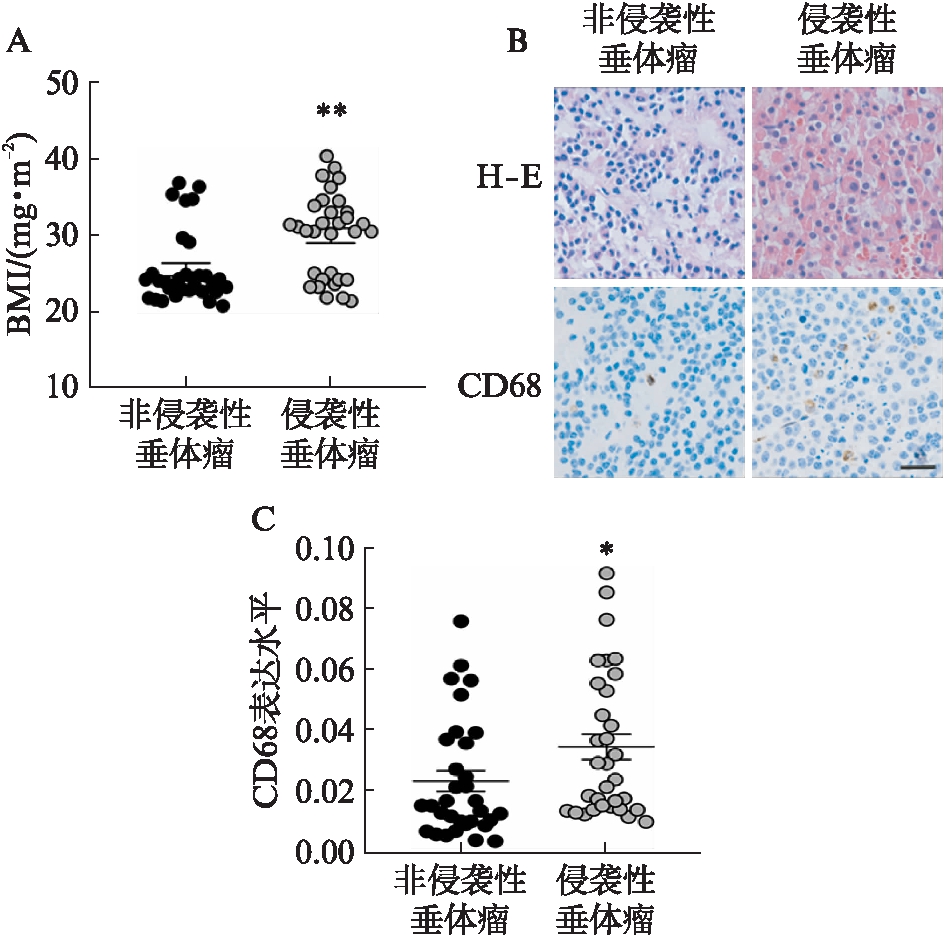
图1 非侵袭性垂体瘤和侵袭性垂体瘤组织中巨噬细胞浸润情况
Fig.1 Infiltration of macrophages in non-invasive and invasive pituitary adenoma tissues
A:侵袭和非侵袭性垂体瘤患者BMI比较;B:免疫组化结果(×200);C:CD68在侵袭和非侵袭性垂体瘤中的表达
2.2 侵袭性垂体瘤中CCL17表达升高
在64例垂体腺瘤组织中,侵袭性垂体瘤组织中CCL17的表达显著高于非侵袭性垂体瘤(0.002±0.004 vs 0.009±0.009,P<0.05),见图2A、B。而且CCL17的表达与巨噬细胞的浸润(r=0.307 6,P<0.05)、肿瘤大小(r=0.356 7,P<0.05)呈显著的正相关性,见图2C、D。
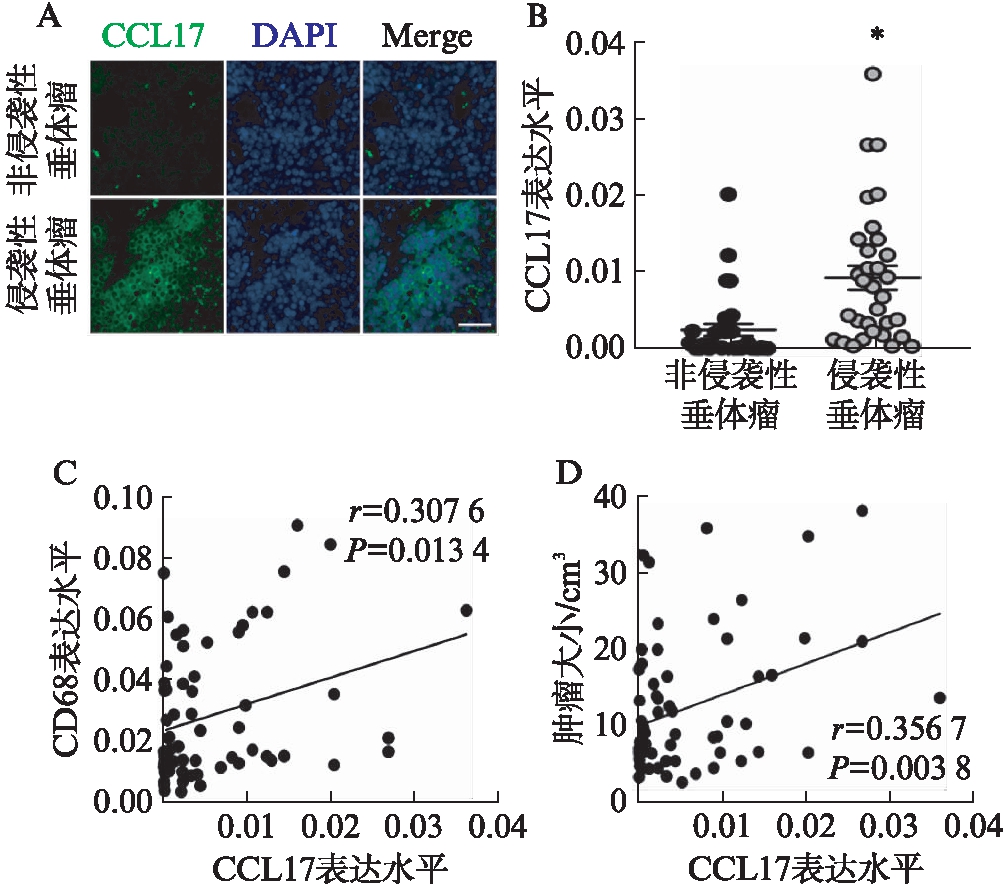
图2 侵袭性垂体瘤中CCL17的表达及其与肿瘤大小的关系
Fig.2 Correlation between CCL17 expression level and pituitary tumor aggressiveness and size
A:CCL17在侵袭性和非侵袭性垂体瘤中蛋白水平的表达;B:CCL17在侵袭性和非侵袭性垂体瘤中mRNA水平的表达;C:CCL17表达与巨噬细胞标志物CD68表达的相关性;D:CCL17表达与肿瘤大小的相关性
2.3 CCL17促进垂体腺瘤细胞增殖和迁移
在CCL17重组蛋白作用下,垂体腺瘤细胞在48和72 h显著增加(图3A),且差异均有统计学意义(t分别为3.14,3.53,均P<0.05)。同样在CCL17重组蛋白作用下,垂体腺瘤细胞72 h迁移能力更强(t=12.13,P<0.05),见图3B。
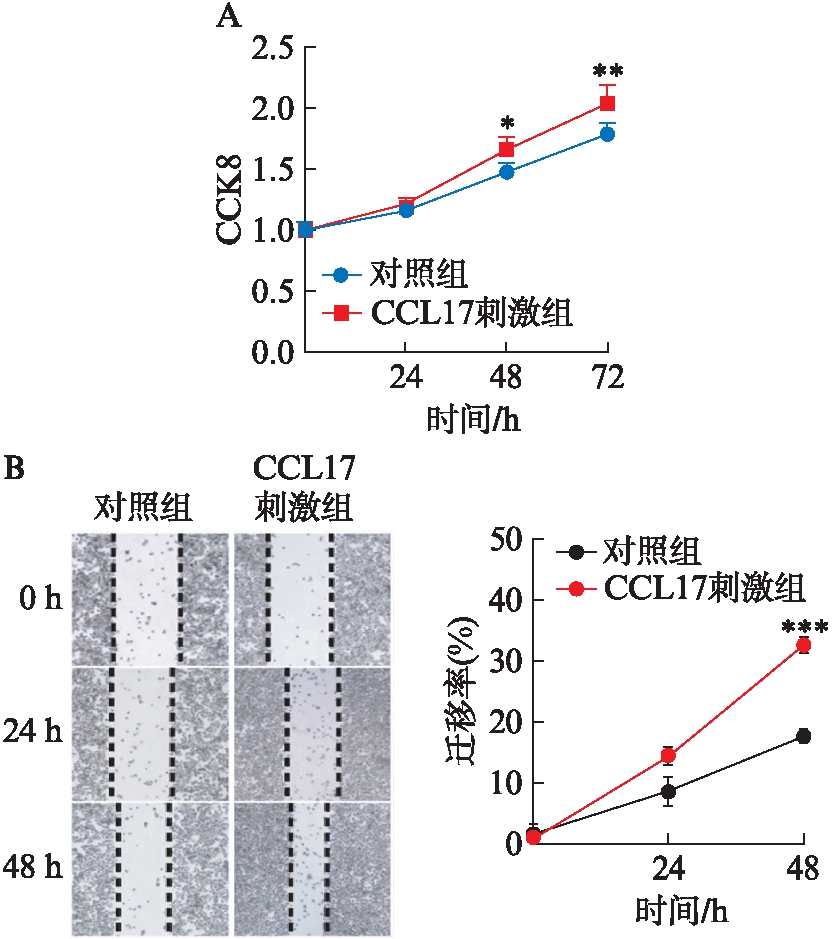
图3 CCL17对垂体瘤细胞增殖和迁移能力的影响
Fig.3 Effects of CCL17 on proliferation and migration of pituitary tumor cells
A:CCK8增殖试验;B:细胞迁移试验
2.4 CCL17与垂体瘤临床病理特征的相关性
依据CCL17在64例垂体瘤组织中的中位表达水平,将患者分为高表达组和低表达组。CCL17表达与垂体腺瘤患者的BMI、巨噬细胞浸润、肿瘤大小、肿瘤侵袭性及病后复发有关(P<0.05)。高表达CCL17的患者呈现更大的垂体腺瘤(P=0.023),更强的侵袭性(P=0.024),术后复发的易感程度也越高(P=0.031)。垂体腺瘤中CCL17的表达与患者年龄、性别无关(P>0.05),但与患者的BMI呈正相关(P=0.003),见表1。
表1 CCL17表达与垂体瘤临床病理因素的关系
Tab.1 Relations of CCL17 expression with clinicopathologic variables of pituitary adenoma
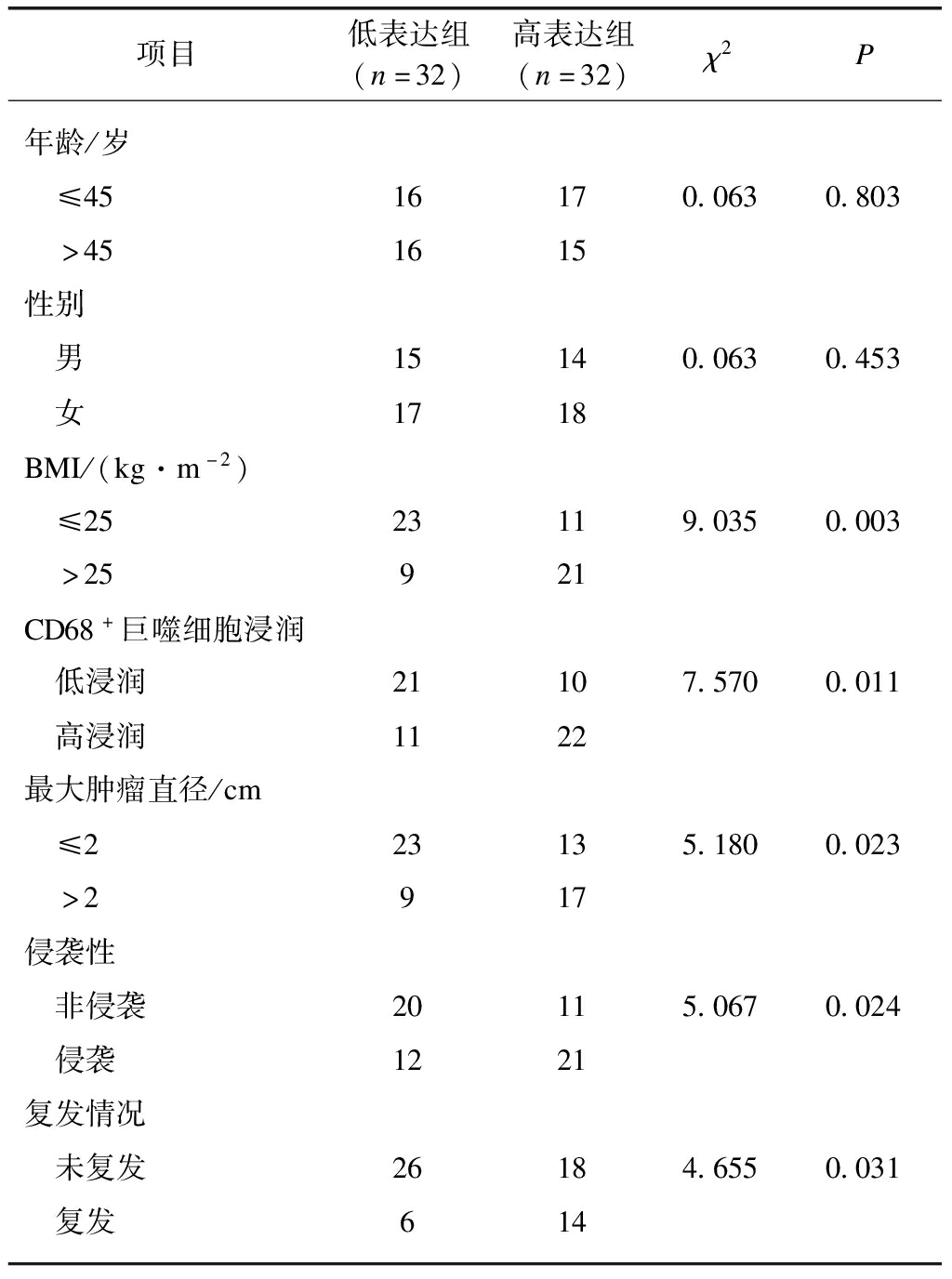
项目低表达组(n=32)高表达组(n=32)χ2P年龄/岁 ≤4516170.0630.803 >451615性别 男15140.0630.453 女1718BMI/(kg·m-2) ≤2523119.0350.003 >25921CD68+巨噬细胞浸润 低浸润21107.5700.011 高浸润1122最大肿瘤直径/cm ≤223135.1800.023 >2917侵袭性 非侵袭20115.0670.024 侵袭1221复发情况 未复发26184.6550.031 复发614
3 讨 论
肥胖目前是至少13种癌症的风险因素,此外也是垂体瘤等良性肿瘤发生发展的危险因素。因此,阐明肥胖增加肿瘤负担的机制是至关重要的。肥胖引起机体代谢的系统性扰动,导致血脂异常、高胆固醇血症、胰岛素抵抗、激素水平改变和炎症的基线变化[14-15]。以往关于肥胖和癌症的研究主要集中在肿瘤内在效应或内分泌-肿瘤细胞调节轴上,但肥胖诱导的系统代谢变化如何影响局部肿瘤微环境(tumor microenvironment, TME)中的免疫细胞却鲜有报道。Ringel等[6]的研究证实肥胖可以重塑TME代谢减少抗肿瘤免疫细胞,促进促肿瘤细胞浸润从而加速肿瘤生长。这为深入研究肿瘤发展和垂体瘤机制探究提供了新的思路。
肿瘤的恶性程度和TME进展与密切相关[16]。TAMs是组织内稳态和TME的关键调节因子。TAMs可通过促进肿瘤细胞增殖、EMT、侵袭和抑制杀瘤免疫细胞来促进肿瘤侵袭[7,17-18]。原发肿瘤中的TAMs促进肿瘤的侵袭转移,被认为是联合治疗肿瘤的一个有吸引力的靶点[7-8,19]。20世纪90年代,由于发现肿瘤附近存在少量巨噬细胞以及CD8+和CD4+淋巴细胞,Rossi等[9]首次报道了PAs组织中免疫细胞浸润。近期研究发现,CD68+巨噬细胞浸润与PA的侵袭相关,通过己烯雌酚(diethyl-stilbestrol, DES)诱导的泌乳素大鼠模型M2型巨噬细胞数量显著增加[10]。然而,TAMs在PAs中的具体功能尚未被阐明。本研究发现巨噬细胞浸润PAs并主导免疫细胞群,这与以往的研究结果相似[9-10]。
以往的文献研究倾向于从基因功能和肿瘤本身来阐明PAs的肿瘤侵袭机制[20]。肿瘤细胞与间质细胞的相互调控决定了TME的状态,而TME进一步决定肿瘤的预后。这可能是影响肿瘤侵袭的一种新的研究角度。本项研究说明了侵袭性的PAs会浸润更多的TAMs,这些TAMs会进一步分泌CCL17,可以在体内和体外促进肿瘤增殖和侵袭能力。针对临床资料的分析显示,在PA患者中,CCL17的表达与肿瘤侵袭程度呈正相关性。
巨噬细胞在免疫应答过程中分泌各种因子和其他免疫介质,并作为细胞内通信的手段[21]。巨噬细胞可以释放抗炎细胞因子(如IL-10和TGFB1)和趋化因子(如CCL17、CCL18和CCL22),抑制树突状细胞成熟,限制抗原呈递,促进免疫抑制Treg细胞的招募[22-23]。Zhou等[24]报道M2巨噬细胞分泌的趋化因子CCL18通过PI3K/Akt通路促进胆囊癌细胞的迁移和侵袭。Wang等[25]证实高水平的miR-100维持了TAMs的M2样表型,并通过增强IL-1α分泌促进肿瘤转移。此外,肿瘤内高水平的CCL17表达与HCC患者侵袭性的临床病理特征和较差的总生存率显著相关[26]最近,有报道称CCL17/C-C趋化因子受体4(CCR4)轴可诱导肝细胞癌细胞的迁移[27],并通过Akt信号增强乳腺癌上皮-间充质转化(epithelial to mesenchymal transition, EMT)[28]。CCL17及其受体CCR4已被证明对体内平衡和炎症反应有显著影响[29]。此外,肥胖可以介导炎症细胞分泌趋化因子CCL17进而加重哮喘症状[12]。本实验中CCL17蛋白能促进垂体腺瘤细胞增殖及迁移;有侵袭性垂体腺瘤的患者,CCL17蛋白表达也上调,并且高表达CCL17的患者呈现更大的垂体瘤肿瘤,更强的侵袭性,术后复发的易感程度也越高,并且和患者的BMI呈正相关性。这可能作为垂体腺瘤的一个潜在预测因子及治疗靶点,也可能是肥胖介导的趋化因子,为后期连接肥胖代谢与垂体瘤研究提供新的研究方向和治疗思路。
本研究中临床肿瘤样本较少,不同类型的垂体瘤也需要进行具体的分析,是否还有其他因子参与肿瘤微环境的调控,均需更深入的研究。综上所述,肥胖介导的CCL17在人侵袭性垂体瘤组织中呈现高表达,并且与垂体瘤肿瘤生长侵袭与肿瘤复发有密切关系。本研究可能为将来垂体瘤靶向治疗提供新的预测指标和治疗靶点,以期待改善患者的复发情况。
[1] MOLITCH M E.Diagnosis and treatment of pituitary adenomas:a review[J].JAMA, 2017,317(5):516-524.
[2] DI IEVA A, ROTONDO F, SYRO L V, et al.Aggressive pituitary adenomas:diagnosis and emerging treatments[J].Nat Rev Endocrinol, 2014,10(7):423-435.
[3] SETHI A, DIDI M, DHARMARAJ P, et al.Obesity is common at diagnosis of childhood pituitary adenoma and may persist following successful treatment[J].Clin Endocrinol(Oxf), 2020,92(4):323-330.
[4] WIEDMANN M K H, BRUNBORG C, DI IEVA A, et al.Overweight, obesity and height as risk factors for meningioma, glioma, pituitary adenoma and nerve sheath tumor:a large population-based prospective cohort study[J].Acta Oncol, 2017,56(10):1302-1309.
[5] WIEDMANN M, BRUNBORG C, LINDEMANN K, et al.Smoking, obesity and the risk of pituitary adenoma:a large prospective cohort study(The HUNT Study)[J].Eur J Epidemiol, 2016,31(1):95-98.
[6] RINGEL A E, DRIJVERS J M, BAKER G J, et al.Obesity shapes metabolism in the tumor microenvironment to suppress anti-tumor immunity[J].Cell, 2020,183(7):1848-1866.e26.
[7] QIAN B Z, POLLARD J W.Macrophage diversity enhances tumor progression and metastasis[J].Cell, 2010,141(1):39-51.
[8] NOY R, POLLARD J W.Tumor-associated macrophages:from mechanisms to therapy[J].Immunity, 2014,41(1):49-61.
[9] ROSSI M L, JONES N R, ESIRI M M, et al.Mononuclear cell infiltrate and HLA-Dr expression in 28 pituitary adenomas[J].Tumori, 1990,76(6):543-547.
[10] FUJIWARA K, YATABE M, TOFRIZAL A, et al.Identification of M2 macrophages in anterior pituitary glands of normal rats and rats with estrogen-induced prolactinoma[J].Cell Tissue Res, 2017,368(2):371-378.
[11] HESHMATI H M, KUJAS M, CASANOVA S, et al.Prevalence of lymphocytic infiltrate in 1400 pituitary adenomas[J].Endocr J, 1998,45(3):357-361.
[12] ZHANG X, ZHENG J, ZHANG L, et al.Systemic inflammation mediates the detrimental effects of obesity on asthma control[J].Allergy Asthma Proc, 2018,39(1):43-50.
[13] KINOSHITA T, KUDO-SAITO C, MURAMATSU R, et al.Determination of poor prognostic immune features of tumour microenvironment in non-smoking patients with lung adenocarcinoma[J].Eur J Cancer, 2017,86:15-27.
[14] 梅芳芸,尹嘉晶,周东雷,等.袖状胃切除术对甲状腺功能正常的肥胖患者甲状腺功能的影响[J].同济大学学报(医学版),2019,40(4):441-447.
[15] DENG T, LYON C J, BERGIN S, et al.Obesity,inflammation, and cancer[J].Annu Rev Pathol Mech Dis, 2016,11(1):421-449.
[16] SPILL F, REYNOLDS D S, KAMM R D, et al.Impact of the physical microenvironment on tumor progression and metastasis[J].Curr Opin Biotechnol, 2016,40:41-48.
[17] LEE C C, LIN J C, HWANG W L, et al.Macrophage-secreted interleukin-35 regulates cancer cell plasticity to facilitate metastatic colonization[J].Nat Commun, 2018,9(1):3763.
[18] ENGBLOM C, PFIRSCHKE C, PITTET M J.The role of myeloid cells in cancer therapies[J].Nat Rev Cancer, 2016,16(7):447-462.
[19] WYNN T A, CHAWLA A, POLLARD J W.Macrophage biology in development, homeostasis and disease[J].Nature, 2013,496(7446):445-455.
[20] MALIK M T, KAKAR S S.Regulation of angiogenesis and invasion by human pituitary tumor transforming gene(PTTG)through increased expression and secretion of matrix metalloproteinase-2(MMP-2)[J].Mol Cancer, 2006,5:61.
[21] ARANGO DUQUE G, DESCOTEAUX A.Macrophage cytokines:involvement in immunity and infectious diseases[J].Front Immunol, 2014,5:491.
[22] RUFFELL B, CHANG-STRACHAN D, CHAN V, et al.Macrophage IL-10 blocks CD8+ T cell-dependent responses to chemotherapy by suppressing IL-12 expression in intratumoral dendritic cells[J].Cancer Cell, 2014,26(5):623-637.
[23] CASSETTA L, POLLARD J W.Targeting macrophages:therapeutic approaches in cancer[J].Nat Rev Drug Discov, 2018,17(12):887-904.
[24] ZHOU Z Y, PENG Y R, WU X Y, et al.CCL18 secreted from M2 macrophages promotes migration and invasion via the PI3K/Akt pathway in gallbladder cancer[J].Cell Oncol(Dordr), 2019,42(1):81-92.
[25] WANG W, LIU Y, GUO J, et al.miR-100 maintains phenotype of tumor-associated macrophages by targeting mTOR to promote tumor metastasis via Stat5a/IL-1ra pathway in mouse breast cancer[J].Oncogenesis, 2018,7(12):97.
[26] ZHU F, LI X, CHEN S, et al.Tumor-associated macrophage or chemokine ligand CCL17 positively regulates the tumorigenesis of hepatocellular carcinoma[J].Med Oncol, 2016,33(2):17.
[27] ZHOU S L, ZHOU Z J, HU Z Q, et al.Tumor-associated neutrophils recruit macrophages and T-regulatory cells to promote progression of hepatocellular carcinoma and resistance to sorafenib[J].Gastroenterology, 2016,150(7):1646-1658.e17.
[28] WANG Y, WENG X, WANG L, et al.HIC1 deletion promotes breast cancer progression by activating tumor cell/fibroblast crosstalk[J].J Clin Invest, 2018,128(12):5235-5250.
[29] SCHEU S, ALI S, RULAND C, et al.The C-C chemokines CCL17 and CCL22 and their receptor CCR4 in CNS autoimmunity[J].Int J Mol Sci, 2017,18(11):2306.