到目前为止,全球有超过2.4亿人患有临床症状的骨关节炎,其中大约28%为60岁以上的老年患者[1-3]。骨关节炎(osteoarthritis,OA)常累及膝关节,可诱发关节水肿,造成关节畸形,影响患者的日常活动[4-6],且长时间的炎症可导致剧烈的慢性疼痛[7-8]。关节软骨不仅可以降低关节的受力,还可以减少关节的摩擦力[9-11],因此从广义上来说,OA病变即软骨病变。但由于关节内部结构及软骨中各种细胞因子交互复杂,OA的病理生理机制至今不明确。
随着MRI技术的飞速发展,MRI的应用对于评估骨关节疾病蕴含着巨大潜力[12-13]。Shao等[14]用超短回波磁共振成像(ultrashort echo magnetic resonance imaging,UTE MRI)动态监测TKA术后离体股骨髁软骨标本的变化,结果表明,UTE MRI成像具有准确、无创的特点,有利于诊断早期OA,并对其行早期干预。本研究将UTE MRI成像用于评估OA的严重程度,并用Mankin评分辅助OA分级并验证UTE MRI成像对于评估OA的准确性。
1 资料与方法
1.1 一般资料
选取2020年6月—12月同济大学附属第十人民医院骨科因OA行人工全膝关节置换术(total knee arthroplasty, TKA)的18例患者离体股骨髁软骨标本。纳入标准:患者年龄60~75岁;行单侧全膝关节置换手术。排除标准:类风湿性关节炎、股骨头坏死、关节周围骨折、4周内行免疫治疗或者镇痛治疗等治疗措施、感染、神经性关节病、肢端肥大症、骨软骨瘤;近1年内行膝关节镜手术;近6个月关节内注射或系统性使用(口服、静脉或肌内注射)类固醇药物。
1.2 方法
1.2.1 磁共振扫描 对所有患者的离体股骨髁软骨标本进行UTE MRI扫描。标本离体后清除股骨髁周围软组织,然后经过股骨髁中心层面取厚度约为5 mm的厚片,用生理盐水浸过的纱布包绕后放入-80 ℃冰箱,待MRI扫描,扫描使用3.0T MRI扫描仪。离体股骨髁软骨标本薄片放置在全氟溴辛烷溶液中,扫描时标本及线圈均置于MRI扫描仪正中央,标本的长轴与B0磁场平行。扫描序列为2D UTE T2*序列,图像只采集标本中央单层图,每个序列扫描用时3 min。当进行MRI的感兴趣区采集时,每个股骨髁标本的关节软骨分别于各层(软骨钙化层及表层关节软骨)从左向右依次采集5个感兴趣区进行UTE T2*分析,具体采集方法见图1。

图1 离体标本采集方法
Fig.1 Collection method of isolated specimens
1.2.2 免疫组织化学法 将扫描后的离体股骨髁软骨标本用乙二胺四乙酸浸泡脱钙,然后分为两部分,一部分行Safanin-O染色,由有8年关节软骨研究经验的病理学医生根据Mankin评分标准进行评级。1级为正常软骨组织(Mankin得分为0~1分),2级为轻度软骨退变(2~5分),3级为中度软骨退变(6~9分),4级为重度软骨退变(10~14分),见表1。所有股骨髁标本的关节软骨的采集方法与MRI所使用的相一致。根据病理染色Mankin评分标准从行全膝关节置换手术的患者中选取3组:2级OA组(Mankin评分2~5分)、3级OA组(Mankin评分6~9分)、4级OA组(Mankin评分10~14分);每组6例患者,共18例患者。将此3组患者Safanin-O染色后剩下的一部分离体股骨髁软骨标本切片,用免疫荧光法分析切片中CCL2、CCL3、CCR5表达情况。
表1 Mankin评分标准
Tab.1 Mankin scoring criteria

评分项目得分结构变化 正常0 软骨表面不规则1 血管翳出现合并软骨表面不规则2 软骨破坏至中间层3 软骨破坏至深层4 软骨破坏至钙化层5 软骨结构完全破坏6细胞数量 细胞数量正常0 弥漫性细胞增生1 细胞成簇状分布2 细胞数减少3Saf-O染色程度 正常0 轻度降低1 中度降低2 严重降低3 无染色4潮线 完好无损1 有血管结构穿行0
1.3 统计学处理
结果以![]() 表示,各组均数间两两比较行随机区组设计的单因素方差分析q检验,经SPSS 20.0统计学软件包进行处理。P<0.05为差异有统计学意义。
表示,各组均数间两两比较行随机区组设计的单因素方差分析q检验,经SPSS 20.0统计学软件包进行处理。P<0.05为差异有统计学意义。
2 结 果
2.1 3组患者一般情况比较
3组患者的年龄、体质量指数(body mass index, BMI)、性别差异均无统计学意义,见表2。
表2 三组患者一般情况比较
Tab.2 Comparison of general conditions in three groups![]()

项目2级OA组3级OA组4级OA组P年龄/岁66.50±3.2769.00±3.9070.50±3.620.167BMI/(kg·m-2)26.78±1.9426.10±1.2526.45±1.050.703男/女3/32/44/20.514
2.2 OA级别高组的患者磁共振影像显示骨关节炎严重
本次研究将所有患者离体股骨髁软骨标本先行磁共振扫描,然后行Safanin-O染色Mankin评分,根据Mankin评分结果将OA患者分为三级并入组,OA级别越高磁共振显示骨关节破坏越严重,见图2、表3。
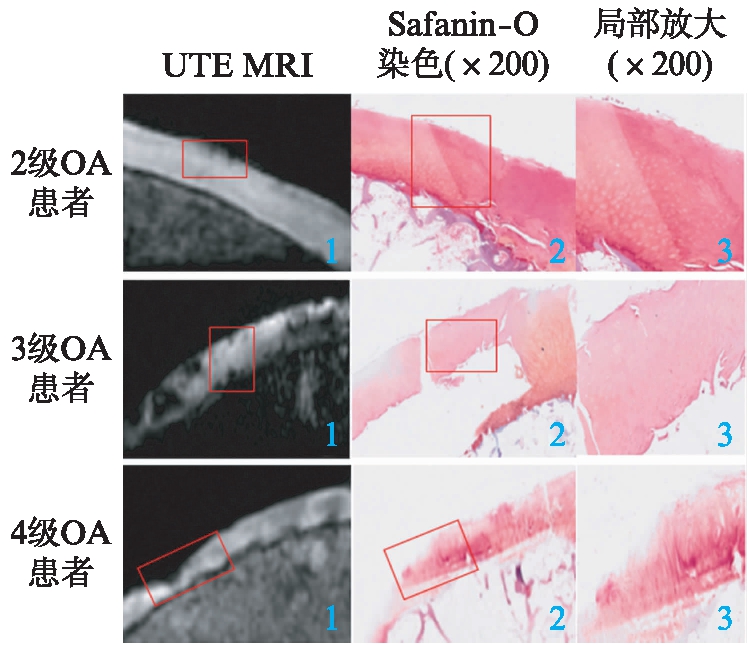
图2 离体股骨髁软骨标本UTE MRI成像
Fig.2 UTE MRI imaging of isolated femoral condyle cartilage specimens
表3 部分不同等级OA股骨髁标本Safanin-O染色后的Mankin评分
Tab.3 Mankin score in different grades of some OA femoral condyle specimens after Safanin-O staining
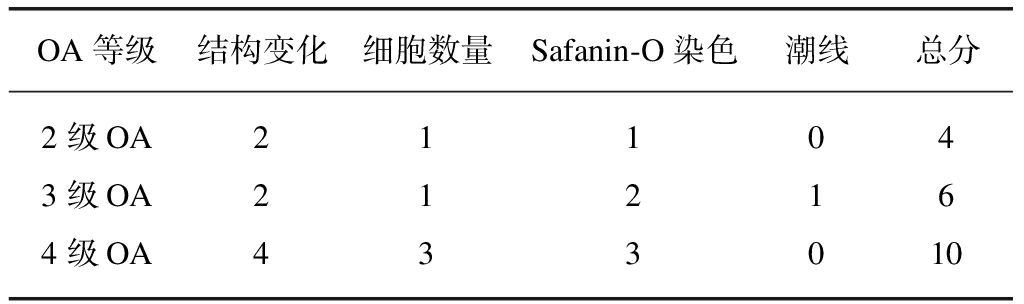
OA等级结构变化细胞数量Safanin-O染色潮线总分2级OA211043级OA212164级OA433010
2.3 OA级别高组患者的股骨髁CCL2、CCL3及CCR5表达增加
本次研究根据Mankin评分将OA患者的股骨髁标本分为三级,OA级别高组的患者骨关节破坏严重,且其股骨髁标本CCL2表达增加,CCL3及CCR5表达也增加,见表4及图3~5。
表4 不同等级OA股骨髁标本CCL2、CCL3、CCR5的表达阳性百分比
Tab.4 Percentage of CCL2, CCL3, CCR5 in different grades of OA femoral condyle specimens![]()
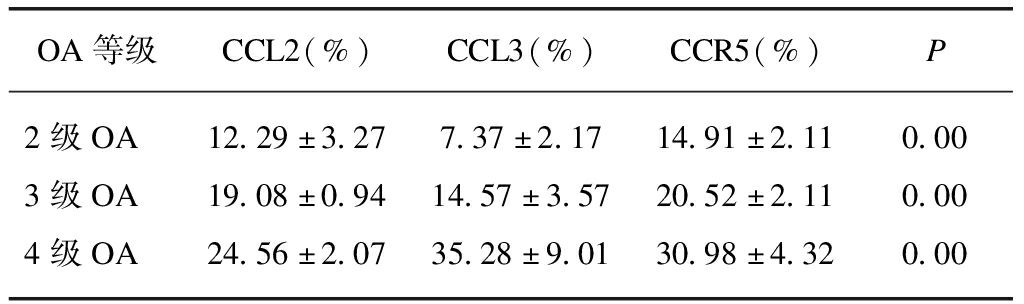
OA等级CCL2(%)CCL3(%)CCR5(%)P2级OA12.29±3.277.37±2.1714.91±2.110.003级OA19.08±0.9414.57±3.5720.52±2.110.004级OA24.56±2.0735.28±9.0130.98±4.320.00
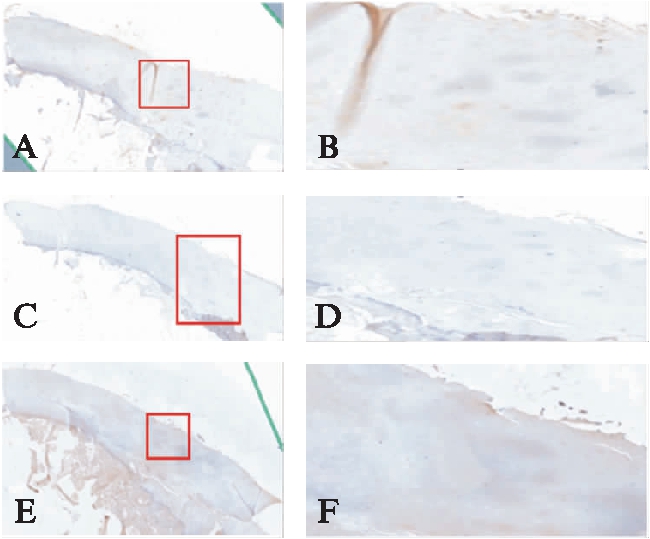
图3 Mankin评分为4分的2级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
Fig.3 Immunohistochemical staining of CCL2, CCL3, and CCR5 in isolated femoral condyle cartilage specimen of Grade 2 OA patient with Mankin score of 4 points(×200)
A:CCL2染色后扫描的股骨髁标本完整病理图片;B:股骨髁标本CCL2病理表达阳性区域放大图片;C:CCL3染色后扫描的股骨髁标本完整病理图片;D:股骨髁标本CCL3病理表达阳性区域放大图片;E:CCR5染色后扫描的股骨髁标本完整病理图片;F:股骨髁标本CCR5病理表达阳性区域放大图片
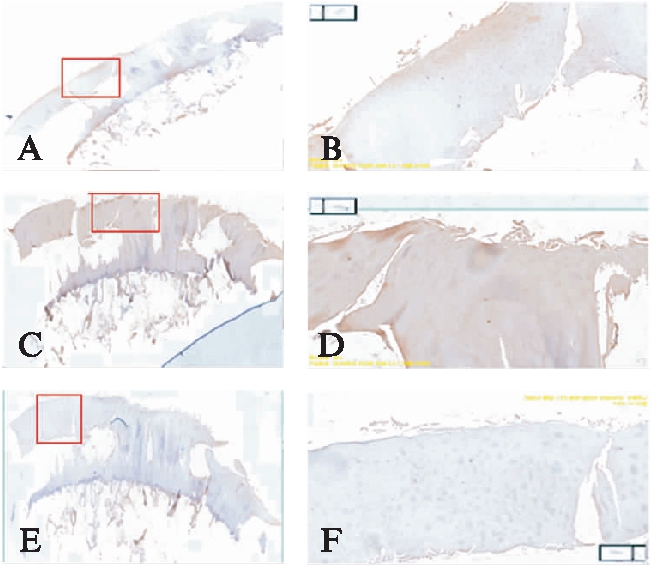
图4 Mankin评分为6分的3级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
Fig.4 Immunohistochemical staining of CCL2, CCL3, and CCR5 in isolated femoral condyle cartilage specimen of Grade 3 OA patient with Mankin score of 6 points(×200)
A:CCL2染色后扫描的股骨髁标本完整病理图片;B:股骨髁标本CCL2病理表达阳性区域放大图片;C:CCL3染色后扫描的股骨髁标本完整病理图片;D:股骨髁标本CCL3病理表达阳性区域放大图片;E:CCR5染色后扫描的股骨髁标本完整病理图片;F:股骨髁标本CCR5病理表达阳性区域放大图片
3 讨 论
早中期OA患者常伴发关节疼痛,临床多采用关节腔内注射药物治疗;一项Meta分析表明,关节腔内注射药物只能暂时缓解OA患者疼痛及软骨变性,无法根治[15];OA患者在早中期缺乏有效的干预手段[16]。晚期OA病变主要为软骨变性脱落,目前彻底根治OA最有效的治疗方法是TKA,只有这种疗法可以恢复晚期OA患者的关节活动[4],但是TKA手术价格高昂且易发生术后疼痛,对TKA手术患者造成二次痛苦[17]。其他治疗手段如保守治疗、关节腔内注射治疗等都不能彻底解决骨关节炎损伤的问题。造成这一现象的主要原因是目前OA的发生发展机制尚不清楚,因此不能有效地对OA行早期干预与治疗。故目前须探讨OA发生发展中趋化因子表达机制,在OA的早期或者超早期进行诊断与干预,有效地减少老年患者中晚期OA的发生率,降低患者行TKA的概率。
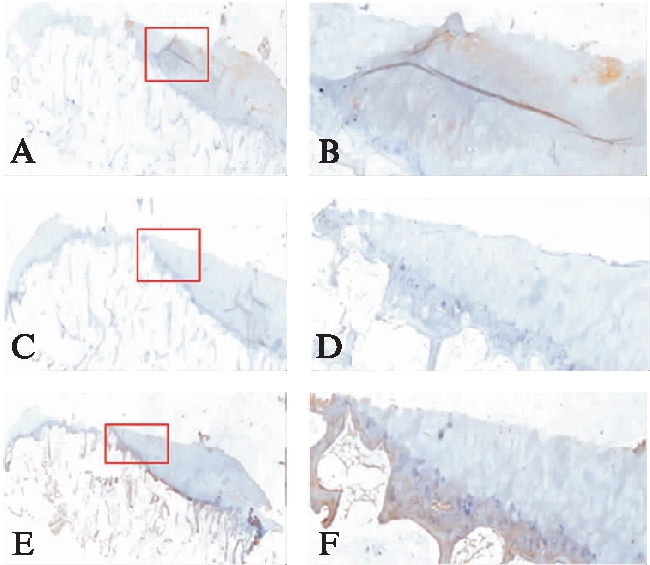
图5 Mankin评分为10分的4级OA患者离体股骨髁软骨标本CCL2、CCL3、CCR5的病理染色成像
Fig.5 Immunohistochemical staining of CCL2, CCL3, and CCR5 in isolated femoral condyle cartilage specimen of Grade 4 OA patient with Mankin score of 10 points(×200)
A:CCL2染色后扫描的股骨髁标本完整病理图片;B:股骨髁标本CCL2病理表达阳性区域放大图片;C:CCL3染色后扫描的股骨髁标本完整病理图片;D:股骨髁标本CCL3病理表达阳性区域放大图片;E:CCR5染色后扫描的股骨髁标本完整病理图片;F:股骨髁标本CCR5病理表达阳性区域放大图片
CCL2是CC类趋化因子家族中的成员,可调控疼痛的发生与发展[18-20];CCL3参与调控糖尿病小鼠神经病理性疼痛发展[21]。CCR5是一种7跨膜G蛋白偶联受体,在疼痛的发生与发展过程中有重要作用[22]。研究表明,在OA患者中,炎症因子及趋化因子的增加可诱发并加剧骨关节炎疼痛,加速骨关节功能退化[3]。有文献报道,CCR5表达上调可加重OA的骨质破坏[23],且严重膝关节炎患者血浆的CCL3浓度也会增高[24]。也有研究显示,CCL2在OA患者的软骨破坏及炎症进展中有重要作用,而CCR5作用甚微[25]。所以CCL2及CCR5在OA中对骨关节软骨损伤作用尚存在争论,故CCL2、CCL3及CCR5在骨关节炎发生发展中的表达及作用机制需进一步确认。
研究表明,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)可刺激CCL2表达,CCL2诱发巨噬细胞聚集并使其极化为M1型巨噬细胞和M2型巨噬细胞[26]。M1型巨噬细胞是分泌促炎因子的促炎型细胞,M2型巨噬细胞是抗炎型细胞[27];M1和M2型巨噬细胞的失衡情况可以直接反映膝关节OA的严重程度。相比正常时,M1型巨噬细胞越多,M2型巨噬细胞越少,膝关节OA病理越严重[28]。OA患者骨质破坏越严重,其M1型巨噬细胞数量远超过M2型巨噬细胞。有研究[29]先在OA患者中注射一种新型成像剂,然后用CT扫描观察OA患者骨关节中巨噬细胞的动态变化;结果提示OA患者严重程度和巨噬细胞的数量有显著关系。相对于CT扫描,UTE MRI基本不具有放射性,用于临床更利于患者接受,所以本次研究用UTE MRI评估OA患者的严重程度,并探讨其股骨髁软骨中趋化因子的表达情况。
本研究将OA患者术后的股骨髁软骨离体标本行UTE MRI扫描,扫描完成后Safanin-O染色,根据Mankin评分对标本分级入组;每组标本行免疫组化检测其中趋化因子的表达情况。结果显示,相对于低级别OA组,高级别OA组中CCL2、CCL3、CCR5表达增加。本研究结果表明,UTE MRI可用于评估OA的严重程度;且CCL2、CCL3、CCR5的表达与OA患者的关节破坏严重程度呈正相关。据此,可采用UTE MRI的方法在早期诊断骨关节炎且阻断关节中CCL2、CCL3、CCR5的高表达,达到延缓甚至治疗OA的目的。但此次研究尚有欠缺,研究中没有探讨CCL2、CCL3、CCR5通过何种机制影响膝关节中巨噬细胞的表达,后续还需进一步试验证明。
[1] HUNTER D J, BIERMA-ZEINSTRA S.Osteoarthritis[J].Lancet, 2019,393(10182):1745-1759.
[2] NELSON A E.Osteoarthritis year in review 2017:clinical[J].Osteoarthr Cartil, 2018,26(3):319-325.
[3] NEES T A, ROSSHIRT N, ZHANG J J, et al.Synovial cytokines significantly correlate with osteoarthritis-related knee pain and disability:inflammatory mediators of potential clinical relevance[J].J Clin Med, 2019,8(9):E1343.
[4] WALLACE I J, WORTHINGTON S, FELSON D T, et al.Knee osteoarthritis has doubled in prevalence since the mid-20th century[J].PNAS, 2017,114(35):9332-9336.
[5] LEE S H, HWANG J H, KIM D H, et al.Clinical outcomes of transcatheter arterial embolisation for chronic knee pain:mild-to-moderate versus severe knee osteoarthritis[J].Cardiovasc Intervent Radiol, 2019,42(11):1530-1536.
[6] YAMADA E F, OLIN L C, PONTEL C L, et al.Sida tuberculata reduces oxidative stress and pain caused by the knee osteoarthritis[J].J Ethnopharmacol, 2020,248:112277.
[7] BELLUZZI E, STOCCO E, POZZUOLI A, et al.Contribution of infrapatellar fat pad and synovial membrane to knee osteoarthritis pain[J].Biomed Res Int, 2019,2019:6390182.
[8] HARIKESAVAN K, CHAKRAVARTY R D, MAIYA A G.Influence of early mobilization program on pain, self-reported and performance based functional measures following total knee replacement[J].J Clin Orthop Trauma, 2019,10(2):340-344.
[9] WACHOWSKI M M, WALDE T A, BALCAREK P, et al.Total knee replacement with natural rollback[J].Ann Anat, 2012,194(2):195-199.
[10] TSUKUDA Y, ONODERA T, ITO M, et al.Therapeutic effects of intra-articular ultra-purified low endotoxin alginate administration on an experimental canine osteoarthritis model[J].J Biomed Mater Res A,2015,103(11):3441-3448.
[11] 吴志安,赵文杰,彭沪.3种手术方式治疗内侧间室骨关节炎的疗效比较[J].同济大学学报(医学版),2017,38(3):103-107.
[12] 关清,汤光宇,华婷,等.前交叉韧带急性和慢性损伤的核磁共振诊断价值比较研究[J].同济大学学报(医学版),2019,40(1):82-86.
[13] JURAS V, CHANG G, REGATTE R R.Current status of functional MRI of osteoarthritis for diagnosis and prognosis[J].Curr Opin Rheumatol, 2020,32(1):102-109.
[14] SHAO H, CHANG E Y, PAULI C, et al.UTE bi-component analysis of T2* relaxation in articular cartilage[J].Osteoarthritis Cartilage, 2016,24(2):364-373.
[15] PHILLIPS M, VANNABOUATHONG C, DEVJI T, et al.Differentiating factors of intra-articular injectables have a meaningful impact on knee osteoarthritis outcomes:a network meta-analysis[J].Knee Surg Sports Traumatol Arthrosc, 2020,28(9):3031-3039.
[16] 杨哲,李明强,纪超凡,等.滑膜细胞代谢在类风湿关节炎中作用的研究进展[J].中国临床医学,2019,26(05):787-790.
[17] PAISH H L, BALDOCK T E, GILLESPIE C S, et al.Chronic, active inflammation in patients with failed total knee replacements undergoing revision surgery[J].J Orthop Res, 2019,37(11):2316-2324.
[18] JIANG H W, CUI H, WANG T, et al.CCL2/CCR2 signaling elicits itch-and pain-like behavior in a murine model of allergic contact dermatitis[J].Brain Behav Immun, 2019,80:464-473.
[19] WU X B, JING P B, ZHANG Z J, et al.Chemokine receptor CCR2 contributes to neuropathic pain and the associated depression via increasing NR2B-mediated currents in both D1 and D2 dopamine receptor-containing medium spiny neurons in the nucleus accumbens shell[J].Neuropsychopharmacology, 2018,43(11):2320-2330.
[20] ZHENG Y, QIN L, ZACAR AS N V, et al.Structure of CC chemokine receptor 2 with orthosteric and allosteric antagonists[J].Nature, 2016,540(7633):458-461.
AS N V, et al.Structure of CC chemokine receptor 2 with orthosteric and allosteric antagonists[J].Nature, 2016,540(7633):458-461.
[21] ROJEWSKA E, ZYCHOWSKA M, PIOTROWSKA A, et al.Involvement of macrophage inflammatory protein-1 family members in the development of diabetic neuropathy and their contribution to effectiveness of morphine[J].Front Immunol, 2018,9:494.
[22] PIOTROWSKA A, KWIATKOWSKI K, ROJEWSKA E, et al.Maraviroc reduces neuropathic pain through polarization of microglia and astroglia—Evidence from in vivo and in vitro studies[J].Neuropharmacology, 2016,108:207-219.
[23] TAKEBE K, RAI M F, SCHMIDT E J, et al.The chemokine receptor CCR5 plays a role in post-traumatic cartilage loss in mice, but does not affect synovium and bone[J].Osteoarthritis Cartilage, 2015,23(3):454-461.
[24] ZHAO X Y, YANG Z B, ZHANG Z J, et al.CCL3 serves as a potential plasma biomarker in knee degeneration(osteoarthritis)[J].Osteoarthr Cartil, 2015,23(8):1405-1411.
[25] RAGHU H, LEPUS C M, WANG Q, et al.CCL2/CCR2, but not CCL5/CCR5, mediates monocyte recruitment, inflammation and cartilage destruction in osteoarthritis[J].Ann Rheum Dis, 2017,76(5):914-922.
[26] NAKAWAKI M, UCHIDA K, MIYAGI M, et al.Sequential CCL2 expression profile after disc injury in mice[J].J Orthop Res, 2020,38(4):895-901.
[27] MIYAGI M, UCHIDA K, TAKANO S, et al.Macrophage-derived inflammatory cytokines regulate growth factors and pain-related molecules in mice with intervertebral disc injury[J].J Orthop Res, 2018, doi: 10.1002/jor 23888.
[28] LIU B L, ZHANG M Q, ZHAO J M, et al.Imbalance of M1/M2 macrophages is linked to severity level of knee osteoarthritis[J].Exp Ther Med, 2018,16(6):5009-5014.
[29] KRAUS V B, MCDANIEL G, HUEBNER J L, et al.Direct in vivo evidence of activated macrophages in human osteoarthritis[J].Osteoarthritis Cartilage, 2016,24(9):1613-1621.