Nectin-3(nectin cell adhesion molecule-3)位于人类染色体3q13.13,编码黏附蛋白家族的一个成员。该基因的产物是一种Ca2+非依赖性的细胞间黏附分子,属于免疫球蛋白超家族,在各种细胞间连接及细胞间通讯中起作用,参与调节细胞的定向运动、增殖和存活[1-2]。该基因在人体的各种组织和细胞广泛表达,如成纤维细胞[3]、上皮细胞[4]、神经元(尤其是海马体和大脑皮质)[5]、造血细胞和精子细胞[6]。Nectin-3在细胞间接触[7]、精子的成熟[8],神经元间突触的有序连接过程[9]中发挥着重要的作用。Nectin-3表达与肿瘤的发生和发展有密切关系,可能是抑制乳腺癌细胞侵袭的分子[10],也有研究表明该基因有可能作为诊断卵巢癌发生的标志分子[11]。另外,染色体平衡易位为46,XY,t(1;3)(q31.3; q13.13)在双侧先天性白内障并伴有中枢神经系统异常和轻度发育迟缓的男性患者中被检测到,该易位导致Nectin-3表达明显降低,提示该患者的表型与Nectin-3表达异常有关[12];同时,Nectin-3敲除小鼠出现晶状体在内的眼部发育异常[13]。因此,Nectin-3可能是人类眼部发育的关键基因之一。数据库中(https:∥www.ncbi.nlm.nih.gov/gene)显示Nectin-3有多个转录本,目前尚未见关于该基因不同转录本的研究报道。本研究将分析目前数据库中共有的Nectin-3这3个转录本及其产物的序列,构建3个转录本的荧光融合蛋白的真核细胞表达质粒,初步探究其表达及亚细胞定位,并且观察新生小鼠眼球Nectin-3的表达。
1 材料与方法
1.1 实验动物
饲养于同济大学动物房的清洁级C57小鼠,购自上海斯莱克实验动物有限公司。光照昼夜节律,自由进食、饮水。本实验严格遵守国家科学技术委员会《实验动物管理条例》、同济大学医学院《实验动物使用和管理条例》及动物伦理学相关条例(动物伦理证书编号:TJAA06320401),并符合美国视觉与眼科学研究学会(ARVO)在眼科研究领域中对动物实验的要求。所有动物实验操作方法均遵循中国卫生部制定的动物使用规则以及动物福利要求。
1.2 主要试剂与仪器
HeLa细胞、HEK293细胞购自美国ATCC公司;pEGFP-CMV-C1表达载体购自美国默赛飞公司;高糖DMEM完全培养基、0.25%胰酶EDTA购自上海源培生物科技股份有限公司;胎牛血清(FBS)购自上海碧云天生物技术有限公司;高效真核转染试剂VigoFect购自英国Vigorous Bio公司;Anti-Nectin-3购自美国Sigma-Aldrich公司、Anti-Nectin-3(Abcam ab63931)、Anti-eEGFP、HRP标记山羊抗兔IgG、HRP标记山羊抗小鼠IgG购自香港BBI生命科学有限公司。
1.3 氨基酸序列比对
在NCBI数据库(https:∥www.ncbi.nlm.nih.gov/gene/25945)中下载3条Nectin-3同源异构体的氨基酸序列,同源异构体1(NP_056295.1)同源异构体2(NP_001230215.1),同源异构体3(NP_001230217.1)。利用Clustal Omega(https:∥www.ebi.ac.uk/Tools/msa/clustalo/)进行氨基酸序列比对,比对结果导入Jalview软件中进行多序列编辑。
1.4 细胞培养
HEK293T细胞、HeLa细胞均使用含10% FBS的高糖DMEM培养液于37 ℃,5% CO2培养。细胞生长至90%融合时,用胰酶消化,一定比例进行传代培养,1周2~3次。
1.5 Nectin-3的3种剪接变体表达载体的构建
通过NCBI-GENE数据库(https:∥www.ncbi.nlm.nih.gov/gene)查询目的基因序列,目的基因序列由苏州金唯智生物科技有限公司合成。根据空载质粒pEGFP-CMV-C1的多克隆位点和编码序列分析,选择Xho1和BamH1分别作为上下游酶切位点。分别将目的基因序列及载体在37 ℃下进行Xho1和BamH1双酶切过夜后,1%琼脂糖凝胶电泳,凝胶回收及DNA纯化。随后,双酶切后的载体及目的片段利用T4 DNA连接酶于16 ℃连接过夜,热激法将连接产物分别转入感受态细胞,挑取单克隆菌落扩增,提取质粒并酶切鉴定。构建好的质粒根据不同的同源异构体分别命名为piso1、piso2和piso3。
1.6 细胞转染及过表达蛋白质的获得
于6孔板中用无抗生素的含10% FBS的高糖DMEM培养液培养293T、HeLa细胞或3T3细胞,细胞计数后按3×105/孔铺盘,培养12 h后进行转染。转染时将2 μL高效真核转染试剂VigoFect加入50 μL NaCl中,混匀,静置5 min,再加入0.5~2 μg对应质粒,混匀,静置15 min。将混合液滴入培养皿,轻摇混匀,培养24 h。
将培养的细胞从培养箱取出,吸弃培养基,用预冷的PBS洗2~3次,加入400 μL RIPA+cocktail溶液吹打细胞直至全部从培养皿底部吹下。将裂解液转移至预冷EP管中,4 ℃摇匀45 min,摇匀结束后4 ℃ 12 000 r/min 离心15 min,保留上清液,BCA法测浓度后加入5×loading buffer,95 ℃ 10 min金属浴变性备用。
1.7 Western印迹法检测
根据蛋白质分子量大小制胶,上样后先80 V电泳至Marker分开,再120 V电泳至条带分离宽度合适。200 mA恒流转膜90 min。5%脱脂牛奶封闭1 h。一抗按1∶1 000稀释,室温孵育2 h,TBST洗膜5 min×3次,二抗按1∶5 000稀释,室温孵育1 h,TBST洗膜5 min×3次。ECL显影。检测蛋白质表达情况。
1.8 免疫细胞染色
将HeLa细胞接种到包被盖玻片的12孔板上,以2×104个细胞/孔接种在含10% FBS DMEM中12 h。使用转染试剂VigoFect分别用Nectin-3的3个剪接变体的荧光融合蛋白重组质粒转染细胞24 h。PBS洗涤细胞3次,4%多聚甲醛溶液固定10 min,25 ℃ DAPI染料(0.5 μg/mL)细胞核复染1 min,透明指甲油封片。荧光显微镜或激光共聚焦显微镜下观察,拍照。
1.9 免疫组织化学法检测
将出生后1 d野生小鼠取眼球固定于4%多聚甲醛,请公司将组织做成眼球组织蜡块后,切3 μm白片,切片置于60 ℃烘箱,烤片2 h后,二甲苯脱蜡,梯度乙醇水化。组织切片于3%H2O2中,室温孵育10 min,双蒸水冲洗后放入预热100 ℃的EDTA抗原修复液中孵育10 min。自然冷却至室温。Anti-Nectin-3抗体1∶200 4 ℃孵育过夜。HRP标记山羊抗兔IgG二抗中室温孵育1 h,DAB显色,苏木精复染、水洗,脱水后树胶封片。空白对照用PBS代替一抗。
2 结 果
2.1 Nectin-3 3种剪接变体之间序列分析及比较
人类Nectin-3基因(Gene ID:25945)在目前数据库中共有的3个转录本为:转录本1(NM_015480.3)、转录本2(NM_001243286.2)和转录本3(NM_001243288.2),分别相应翻译成3个同源异构体:iso1(NP_056295.1)、iso2(NP_001230215.1)和iso3(NP_001230217.1)。Nectin-3编码iso1和iso2的起始密码子位置相同,与编码iso3的起始密码子的位置不同,提示iso3与iso1和iso2的时空表达和/或表达的调控机制可能不同,见图1。3个同源异构体的氨基酸序列比对表明,iso1的55~356 aa、iso2的55~356 aa和iso3的32~333 aa序列完全一致,均由碱基序列相同的区域编码;iso1和iso2的N端氨基酸序列完全相同,但与iso3的N端氨基酸序列不同;这3个同源异构体的C端氨基酸均互不相同。数据库记录及生物信息学分析显示,iso1由549 aa组成,1~57 aa可能是信号肽,58~403 aa是胞外区域,405~425 aa为跨膜区域,433~549 aa为胞内区域;其中58~167 aa为免疫球蛋白样的可变结构域(variable domain, V),170~265 aa和269~355 aa均为免疫球蛋白样的恒定结构域(C2, a constant~2 domain);iso2由366 aa组成,其中58~167 aa为V结构域,170~265 aa和269~355 aa均为C2结构域;iso3由487 aa组成,其中35~144 aa为V结构域,147~242 aa和246~332 aa均为C2结构域。这3个同源异构体均具有Ig样结构域,提示它们均可能在细胞间识别、细胞表面受体、肌肉结构和免疫系统等方面发挥功能。这3个同源异构体中,只有iso1可能存在跨膜序列;iso1和iso3的C端均存在和在胚胎细胞连接的信号传导和组织中发挥作用的AFDN蛋白结合的保守基序A/EXYV(图1)。根据氨基酸数量其分子量预测,iso1可能为61 000,iso2可能为39 000,iso3可能为54 000。3个同源异构体的序列完全一致的区域中有7个氨基酸位点可能是N-连接糖基化位点。另外,iso1蛋白质中第367、373和374 aa可能是O-连接糖基化位点。
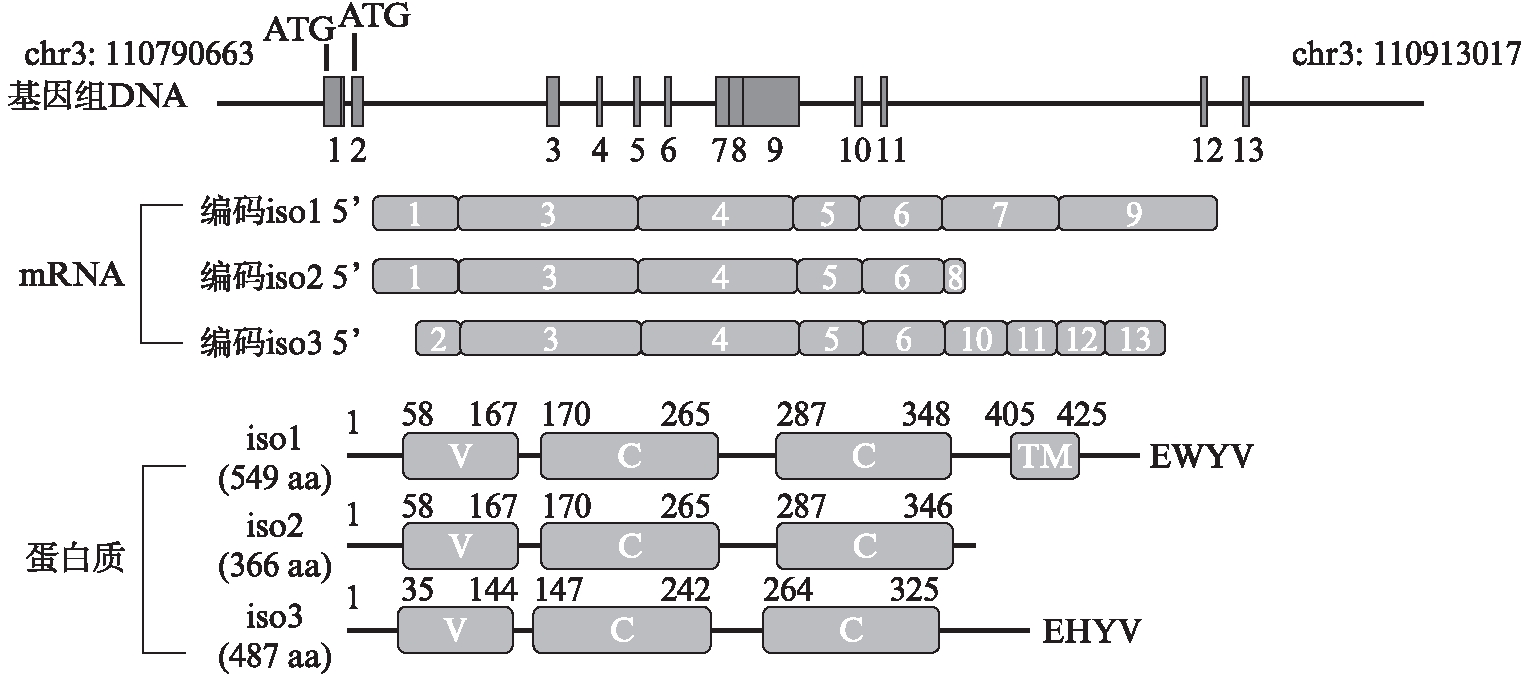
图1 人类Nectin-3基因及其产物示意图
Fig.1 Schematic diagram of human Nectin-3 gene
基因组DNA和mRNA上的数字1~13代表编码3个同源异构体中任意一个的核苷酸序列;V代表免疫球蛋白样的可变结构域;C为免疫球蛋白样的恒定结构域;TM代表跨膜区域;蛋白质上的数字代表氨基酸的位置。
2.3 Nectin-3的三个剪接变体的荧光融合蛋白重组质粒表达验证
3种同源异构体的荧光融合蛋白重组质粒piso1、piso2和piso3分别单独转染入293T细胞,在3个不同时间点(24、36和48 h)收集细胞并提取蛋白,用anti-GFP抗体进行Western印迹法检测观察到,piso1表达的蛋白在30 000处有明显条带,piso2表达的蛋白除了在30 000处有明显条带,在48 000有较弱条带,piso3表达的蛋白在75 000处有较弱条带,这条带与根据氨基酸序列预测的分子量基本一致。在检测的时间点中,24 h蛋白表达量最高,之后蛋白质表达量逐渐下降,见图2A。用anti-Nectin-3抗体进行Western印迹法检测,结果显示piso2表达的蛋白在48 000处有明显条带,比根据氨基酸序列预测的分子量更小;piso1表达的蛋白在90 000处有明显条带,piso3表达的蛋白在75 000 处有明显条带,与根据氨基酸序列预测的分子量基本一致,见图2B。另外,对3个同源异构体的表达质粒两两组合进行共转染,24 h后收集细胞并提取蛋白,用anti-GFP抗体进行Western印迹法检测。在质粒转染量各为0.75 μg的条件下,piso2和piso3共转染后,在80 000处的piso3表达的蛋白变弱,分别在63 000处和30 000处的piso2表达的蛋白也均变弱,见图2C。而同样进行同源异构体的表达质粒两两组合共转染后,用anti-Nectin-3抗体进行Western印迹法检测,piso2和piso3共转染后,在80 000处几乎无piso3表达的蛋白,图2D。
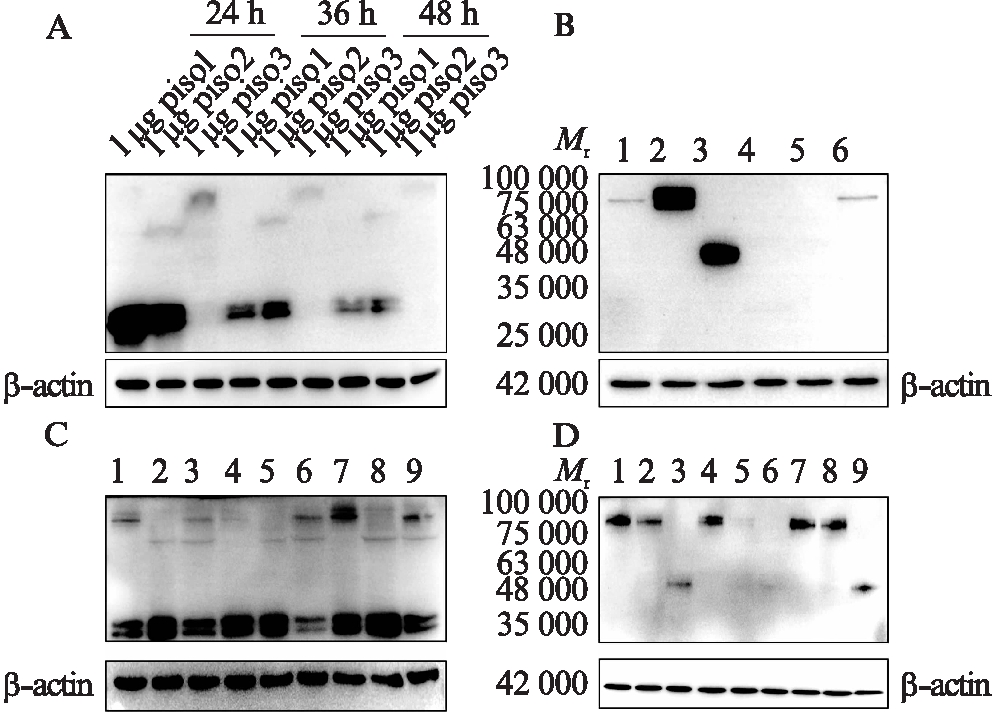
图2 Nectin-3剪接变体荧光融合蛋白重组质粒表达的蛋白鉴定
Fig.2 Identification of protein expressed by recombinant plasmid of Nectin-3 splice variant fluorescent fusion protein
A:转染后24、36和48 h收集细胞,anti-GFP孵膜;B:转染24 h后收集细胞,anti-Nectin-3孵膜,各泳道分别转染的质粒为,1:piso3、2:piso1、3:piso2、4:peGFP、5:无质粒;6:piso3;C:2个不同同源异构体的质粒共转;转染24 h后收集细胞,anti-GFP孵膜,1:0.25 μg piso1+0.25 μg piso3+1.5 μg peGFP,2:0.25 μg piso1+0.25 μg piso2+1.5 μg peGFP,3:0.25 μg piso2+0.25 μg piso3+1.5 μg peGFP,4:0.5 μg piso1+0.5 μg piso3+1.0 μg peGFP,5:0.5 μg piso1+0.5 μg piso2+1.0 μg peGFP,6:0.5 μg piso2+0.5 μg piso3+1.0 μg peGFP,7:0.75 μg piso1+0.75 μg piso3+0.5 μg peGFP,8:0.75 μg piso1+0.75 μg piso2+0.5 μg peGFP,9:0.75 μg piso2+0.75 μg piso3+0.5 μg peGFP;D:2个不同同源异构体的质粒共转;转染24 h后收集细胞,anti-Nectin-3孵膜,各泳道分别转染的质粒量同图2C
2.4 Nectin-3的3个剪接变体的荧光融合蛋白重组质粒亚细胞定位
3个同源异构体的荧光融合蛋白重组质粒piso1、piso2和piso3分别单独转染入HeLa细胞中,24 h后进行细胞免疫荧光实验和共聚焦显微镜下观察及拍照。Nectin-3的3个同源异构体均带有eGFP标签,绿色荧光一定程度上反映3个蛋白质的亚细胞定位。Nectin-3的iso1与iso2的绿色荧光主要呈现于细胞质中,有部分与细胞核的蓝色荧光相融合,说明iso1与iso2可能在细胞核和细胞质中均有表达。Nectin-3的iso3绿色荧光可见于细胞质中,细胞核未见绿色荧光信号,表明iso3可能只表达于细胞质中,见图3。Nectin-3的3个同源异构体的亚细胞定位存在差异,提示它们可能发挥不同的功能。
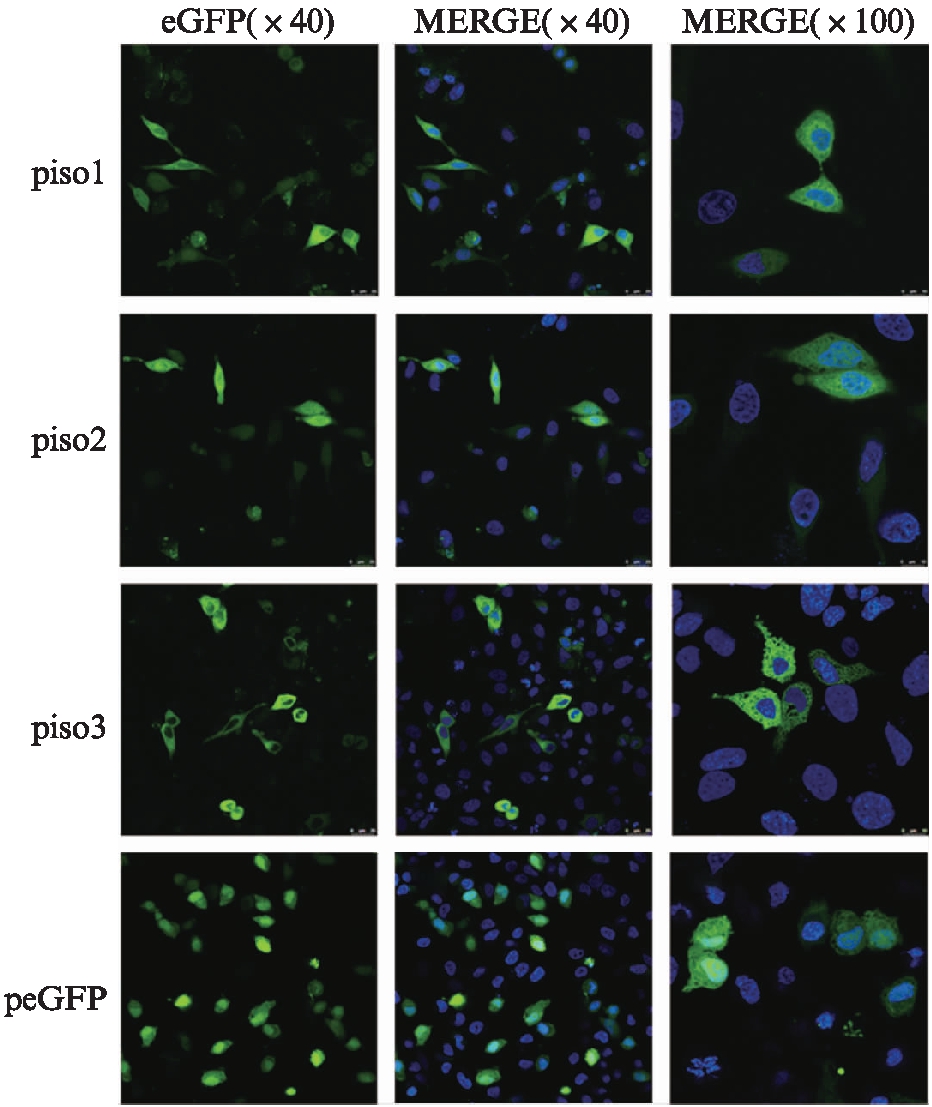
图3 Nectin-3的3个同源异构体的亚细胞定位
Fig.3 The subcellular localization of three homologous isoforms of Nectin-3
图3 第1列为Nectin-3的同源异构体1,2,3和空载体peGFP的亚细胞定位;第2列为蛋白表达位置和细胞核荧光融合图(×40);第3列为蛋白表达位置和细胞核荧光融合图(×100)
2.5 小鼠眼球组织中Nectin-3蛋白的表达
进一步了解内源性Nectin-3在组织细胞中的表达情况,本研究采用DAB免疫组织化学实验检测新生小鼠眼球中Nectin-3的表达。PBS代替Nectin-3抗体作为阴性对照组,其他步骤均和实验组相同。Nectin-3蛋白的表达可见于新生小鼠眼球的视网膜上皮细胞、晶状体上皮细胞和纤维细胞、和睫状体色素和非色素上皮细胞之间,见图4。Nectin-3主要见于细胞质中,在细胞核中未见Nectin-3表达。
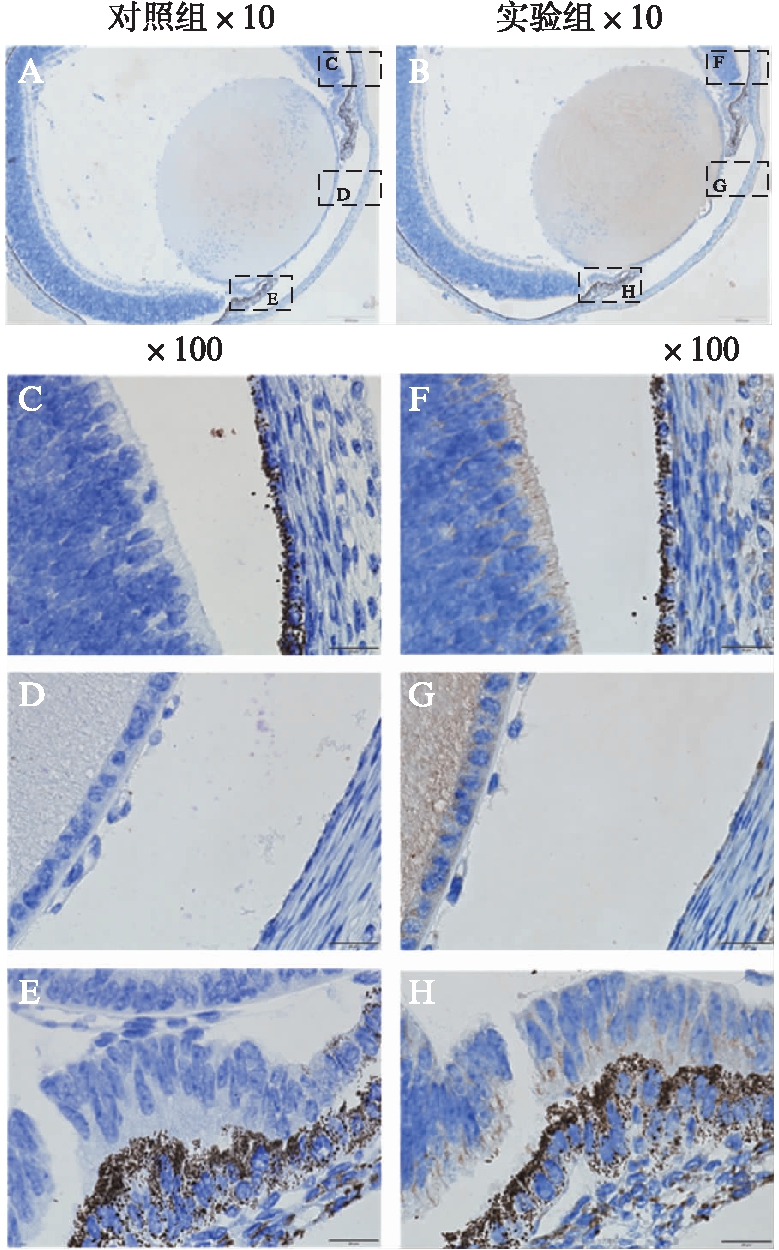
图4 小鼠眼球组织免疫组化
Fig.4 Immunohistochemical staining of mouse eyeball tissue
对照组为PBS取代一抗;将黑色虚框放大100倍,分别代表视网膜色素上皮细胞区域(C和F)、晶状体上皮细胞区域(D和G)和睫状体色素和非色素上皮细胞之间区域(E和H)
3 讨 论
Nectin-3蛋白包含3个结构,一个含有3个Ig样结构域的胞外区域,一个跨膜区域和一个胞质尾区域。与NECTIN蛋白家族其他成员一样,Nectin-3具有很多分子特性,不同的区域与不同蛋白结合发挥作用。首先是作为Ca2+非依赖性的细胞间黏附分子的特性。通过形成同源-顺式二聚体,再通过胞外区域形成同源或异源-反式二聚体从而形成细胞间黏附。Nectin-3的胞外区具有3个免疫球蛋白样结构域,第1个免疫球蛋白样结构域通过与NECTIN-1蛋白结合形成反式二聚体[14],第2个免疫球蛋白样结构域的存在与细胞间的黏附有关[15],关于第3个免疫球蛋白样结构域的作用目前还没有发现。但是,由于NECTIN家族之间胞外段的三个免疫球蛋白样结构域与家族中其他成员有高度的同源性[16],有研究表明,NECTIN-1蛋白的第3个免疫球蛋白样结构域不仅起结构作用,并且与特定功能有关可以与成纤维细胞生长因子受体结合作为NECTIN-1下游信号[17],因此预测Nectin-3也有类似的作用,但还需要进一步验证。Nectin-3可以通过其胞质尾与afadin蛋白(一种肌动蛋白丝,可以连接Nectin-3与细胞骨架)相互作用。也能通过其胞质尾与Par3(pulmonary adenoma resistance 3, Par3)蛋白相连,Par3是一种细胞极性蛋白,它能和其他细胞极性蛋白aPKC(atypical protein kinase C)和Par-6(pulmonary adenoma resistance 6)形成复合物参与细胞极化。
目前数据库中,人类Nectin-3基因(Gene ID:25945)的转录本中被公认的有3个。它们编码的蛋白质氨基酸序列的差异主要表现于N端和C端,它们中间有302个氨基酸序列完全一致,均有1个V结构域和2个C结构域。Iso3的启动子和其他2个同源异构体与编码iso3的起始密码子的位置不同(图1),提示iso3与iso1和iso2的时空表达和/或表达的调控机制可能不同。Nectin-3编码iso3的起始密码子与编码iso1和iso2的起始密码子位置不同,iso3与iso1和iso2的启动子也可能不同,因此不同同源异构体的表达可能具有组织细胞特异性,并且它们表达的调控机制很可能不同。人类基因通过选择性剪接产生多个转录本,翻译多个同源异构体,从而在细胞生理、发育调节以及肿瘤的发生、转移发挥各自的功能[18]。Nectin-3基因的3个同源异构体的表达、亚细胞定位及其功能尚不明确。
构建3个同源异构体的荧光融合蛋白重组质粒piso1、piso2和piso3,根据氨基酸序列预测它们表达的蛋白质大小依次可能为90 000、65 000和80 000。将这些质粒转染入293T细胞,用anti-Nectin-3抗体或anti-GFP抗体进行Western印迹法检测发现piso1表达的蛋白在分子量30 000和90 000处有明显条带,piso2表达的蛋白在30 000处和48 000处均有条带,piso3表达的蛋白在80 000处有明显条带。以前有研究报道过GPR37在HEK293细胞中表达,其蛋白产物的胞外N-末端在E167和Q168之间受到金属蛋白酶介导的有限蛋白水解[19]。本课题推测piso1和piso2表达的蛋白可能被某种酶切割,从而利用胞外域脱落来主动调节表面分子的表达和功能,并调节多种细胞和生理过程。对3个同源异构体的表达质粒两两组合进行共转,本研究观察到piso2和piso3共转后,在80 000处的piso3表达的蛋白变弱,分别在48 000处和30 000处的piso2表达的蛋白也均变弱,本研究推测iso3和iso2的表达可能存在互相抑制。3个质粒单独转染细胞,比较3个不同时间点的蛋白质表达量,推测24 h后这3个同源异构体的荧光融合蛋白可能都逐渐降解。
Nectin-3同源异构体的3个质粒瞬时转染HeLa细胞,24 h后进行细胞免疫荧光实验,iso3主要表达于细胞质,iso1和iso2在细胞质和细胞核中均表达。根据NLS mapper预测[20],iso1和iso2中13~42 aa的序列可能为核定位信号,但这还有待进一步实验证明。组织细胞中内源性Nectin-3的表达情况将有助于进一步了解其表达和功能。Nectin-3在新生小鼠眼球的晶状体上皮细胞和纤维细胞、视网膜神经节细胞和睫状体色素和非色素上皮细胞之间区域均有表达,细胞内表达主要在细胞质中,但尚不能确定是哪个同源异构体表达。晶状体的胚胎发育是一个非常有序的过程,在晶状体发育中,有研究发现Nectin-3在小鼠胚胎期晶状体发育中表达的过程,在小鼠E13.5时期观察到Nectin-3表达于晶状体上皮细胞,随着晶状体的发育,在E18.5时期,Nectin-3逐渐的在整个晶状体上皮细胞与纤维细胞接触区域表达[21]。因此Nectin-3可能在眼发育过程中起重要作用。
本研究通过生物信息学初步分析人的细胞黏附蛋白Nectin-3这3个可变剪接体及其编码的蛋白质的序列特点;根据Western印迹法结果推测,iso1和iso2可能被某种酶切割;通过细胞免疫荧光发现3个同源异构体亚细胞定位不同;新生小鼠眼球的免疫组织化学实验预示Nectin-3可能在眼发育过程中起重要作用。这些实验结果将有助于Nectin-3的功能深入研究,也在丰富选择性剪接研究方面有一定的意义。
[1] KAKUNAGA S, IKEDAW, SHINGAI T, et al.Enhancement of serum-and platelet-derived growth factor-induced cell proliferation by Necl-5/Tage4/poliovirus receptor/CD155 through the Ras-Raf-MEK-ERK signaling[J].J Biol Chem, 2004,279(35):36419-36425.
[2] DEVILARD E, XERRI L, DUBREUIL P, et al.Nectin-3(CD113)interacts with Nectin-2(CD112)to promote lymphocyte transendothelial migration[J].PLoS One, 2013,8(10):e77424.
[3] YAMADA T, KURAMITSU K, RIKITSU E, et al.Nectin and junctional adhesion molecule are critical cell adhesion molecules for the apico-basal alignment of adherens and tight junctions in epithelial cells[J].Genes Cells, 2013,18(11):985-998.
[4] GUPTA P, ZHANG Z F, SUGIMAN-MARANGOS S N, et al.Functional defects in Clostridium difficile TcdB toxin uptake identify CSPG4 receptor-binding determinants[J].J Biol Chem, 2017,292(42):17290-17301.
[5] WANG X X, LI J T, XIE X M, et al.Nectin-3 modulates the structural plasticity of dentate granule cells and long-term memory[J].Transl Psychiatry, 2017,7(9):e1228.
[6] YOUNG J S, GUTTMAN J A, VAID K S, et al.Tubulobulbar complexes are intercellular podosome-like structures that internalize intact intercellular junctions during epithelial remodeling events in the rat testis[J].Biol Reprod, 2009,80(1):162-174.
[7] FUJITO T, IKEDAW, KAKUNAGA S, et al.Inhibition of cell movement and proliferation by cell-cell contact-induced interaction of Necl-5 with nectin-3[J].J Cell Biol, 2005,171(1):165-173.
[8] INAGAKI M, IRIE K, ISHIZAKI H, et al.Role of cell adhesion molecule nectin-3 in spermatid development[J].Genes Cells, 2006,11(9):1125-1132.
[9] GENG X Q, MANDAI K J, MARUO T, et al.Regulatory role of the cell adhesion molecule nectin-1 in GABAergic inhibitory synaptic transmission in the CA3 region of mouse Hippocampus[J].Genes Cells, 2016,21(1):88-98.
[10] MARTIN T A, LANE J, HARRISON G M, et al.The expression of the Nectin complex in human breast cancer and the role of Nectin-3 in the control of tight junctions during metastasis[J].PLoS One, 2013,8(12):e82696.
[11] XU F X, SI X Q, WANG J, et al.Nectin-3 is a new biomarker that mediates the upregulation of MMP2 and MMP9 in ovarian cancer cells[J].Biomedecine Pharmacother, 2019,110:139-144.
[12] LACHKE S A, HIGGINS A W, INAGAKI M, et al.The cell adhesion gene PVRL3 is associated with congenital ocular defects[J].Hum Genet, 2012,131(2):235-250.
[13] INAGAKI M, IRIE K, ISHIZAKI H, et al.Roles of cell-adhesion molecules nectin 1 and nectin 3 in ciliary body development[J].Development, 2005,132(7):1525-1537.
[14] FABRE S, REYMOND N, COCCHI F, et al.Prominent role of the Ig-like V domain in trans-interactions of nectins.Nectin-3 and nectin 4 bind to the predicted C-C′-C″-D beta-strands of the nectin1 V domain[J].J Biol Chem, 2002,277(30):27006-27013.
[15] YASUMI M, SHIMIZU K, HONDA T, et al.Role of each immunoglobulin-like loop of nectin for its cell-cell adhesion activity[J].Biochem Biophys Res Commun, 2003,302(1):61-66.
[16] TAKAI Y, NAKANISHI H.Nectin and afadin:novel organizers of intercellular junctions[J].J Cell Sci, 2003,116(Pt 1):17-27.
[17] BOJESEN K B, CLAUSEN O, ROHDE K, et al.Nectin-1 binds and signals through the fibroblast growth factor receptor[J].J Biol Chem, 2012,287(44):37420-37433.
[18] LIU Y Z, LIU X, LIN C W, et al.Noncoding RNAs regulate alternative splicing in Cancer[J].J Exp Clin Cancer Res, 2021,40(1):11.
[19] MATTILA S O, TUUSA J T, PET J
J -REPO U E.The Parkinson’s-disease-associated receptor GPR37 undergoes metalloproteinase-mediated N-terminal cleavage and ectodomain shedding[J].J Cell Sci, 2016,129(7):1366-1377.
-REPO U E.The Parkinson’s-disease-associated receptor GPR37 undergoes metalloproteinase-mediated N-terminal cleavage and ectodomain shedding[J].J Cell Sci, 2016,129(7):1366-1377.
[20] KOSUGI S, HASEBE M, TOMITA M, et al.Systematic identification of cell cycle-dependent yeast nucleocytoplasmic shuttling proteins by prediction of composite motifs[J].Proc Natl Acad Sci USA, 2009,106(25):10171-10176.
[21] LACHKE S A, HIGGINS A W, INAGAKI M, et al.The cell adhesion gene PVRL3 is associated with congenital ocular defects[J].Hum Genet, 2012,131(2): 235-250.