传统观念认为,左心室早、中期的舒张功能障碍是伴随年龄增长的正常生理现象。然而随着超声心动图检测的普及和流行病学调查的深入,越来越多的研究对该观点提出质疑。舒张功能异常发生于多数心脏疾病的早期,主要表现为舒张早期左心室松弛异常、舒张中晚期心肌顺应性降低及左心室充盈受损[1]。在不考虑引起心力衰竭(以下简称心衰)原发病因的情况下,进行性的舒张功能障碍与心房颤动、心衰以及心源性猝死直接相关。研究者将未诊断为充血性心衰且收缩功能保持正常的舒张功能障碍定义为亚临床舒张功能障碍(preclinical diastolic dysfunction, PDD)[2]。目前,针对PDD的原创性研究相对较少,但现有研究确已证实其在人群中并不少见。PDD不仅是心肌功能损伤的一种潜在表现,且在慢性心衰的发病机制、转归及预后中发挥着重要作用。因此,本文基于现有证据,通过对PDD临床特点、流行病现状及其与心衰等不良结局事件的关联进行综述,以期为心衰危险人群的早期干预提供借鉴,进而延迟PDD患者的症状发展并改善其预后结局。
1 PDD的定义
一般而言,舒张功能障碍是指左室心肌的力学性质异常,包括异常的左室舒张扩张性、充盈受损以及松弛缓慢或延迟[1]。同时,左室充盈压增高导致继发性肺动脉高压(pulmonary hypertension, PH),造成机体肺弥散能力下降,进一步增加心脏前负荷。而心肌细胞受损时会介导产生炎症介质,使机体出现全身性微血管炎症,进一步加剧心室舒张功能障碍。当心室僵硬度增加、心肌弛缓持续加重,造成病理性心脏结构异常时,发展为心衰的进程将不可逆转[3]。
相较于一般意义的舒张功能障碍,PDD在病理生理机制上与舒张功能障碍类似,即舒张期左心室充盈受损、心肌顺应性降低[4],此时左室充盈压增高、左房高压和肺部充血[5],导致患者运动耐受力降低[6]、生活质量下降[7]等一系列健康问题。然而,PDD更侧重于心室在舒张功能受损的同时,收缩功能保持正常,且机体尚未出现明显的心衰症状,在疾病预防中处于更前端的位置。在早期研究中,PDD的定义较为模糊,Abhayaratna等[7]将PDD仅作为舒张功能障碍的前期阶段来进行界定;Redfield等[8]则将未诊断为心衰的舒张功能障碍定义为PDD;Pascual等[9]认为存在两个以上舒张功能指标改变的舒张功能障碍即为亚临床阶段,但以上研究均未对心室收缩功能有所限制,仅将其作为心室功能的评判指标之一来进行测量。然而,收缩功能是否改变对于舒张功能的诊断分级具有一定影响,射血分数是否保留被认为是舒张功能分级的重要前提[10],Wan等[2]认为对于PDD的判断应将收缩功能保持正常(LVEF≥50%)作为诊断条件之一,即PDD是指未诊断为充血性心衰且收缩功能保持正常的舒张功能障碍,是当前较为全面的一种评判标准。当前舒张功能障碍主要可分为3级[11]。轻度: 心肌早期松弛性减低;中度: 心肌松弛能力受损,心室充盈压增高;重度: 限制型充盈障碍,心肌顺应性严重受损。结合Wan等对PDD的定义,可以发现其在舒张功能障碍的不同分级范围内均存在一定比例[2,8],与当前对于舒张功能障碍的单一评级并不存在完整的包含关系,但PDD作为一种常见的疾病阶段[7-8],目前已被证明其与心衰发病[12]、全因死亡率增高[13]等不良结局密切相关。同时PDD具有更好的实际应用价值,便于在社区等大样本人群场所进行风险筛查,从而实现心衰危险人群的早期识别与风险预防。
2 PDD的评估和筛查要点
2.1 基于心脏超声检测的评估
评估左室舒张功能的金标准是通过左室压力-容积曲线得出等容舒张时间常数(即Tau指数)[14],也就是压力下降速度最大值时的左室压力除以此时的压力下降速度。目前大多应用于基础研究领域,临床研究领域应用较少。
因侵入性操作风险及检测成本较高,不适合对大样本人群进行筛查,在实际操作中常常采用超声心动图等无创性检测手段作为间接估测方法[15]。当前,对于射血分数保留的患者,舒张功能障碍的评估常采用以下4个指标: (1) 二尖瓣瓣环e′速度(室间隔e′<7 cm/s,侧壁e′<10 cm/s);(2) 平均E/e′>14;(3) 左房容积指数>34 mL/m2;(4)三尖瓣反流峰值速度>2.8 m/s,其中两个以上指标均未超过临界值,则提示舒张功能正常;两个以上指标超过临界值,则提示舒张功能异常;恰好两个指标达到临界值,则需进一步结合临床表现进行判断。当患者在收缩功能保持正常(LVEF≥50%)时发生舒张功能障碍,且尚未出现心衰症状则可初步诊断为PDD。此外,由于部分心衰患者静息时的左室充盈压会保持正常而仅在用力时升高[16],因此也有学者认为常规超声心动图在临床环境中难以分辨是否为PDD[17],主张采用舒张压超声心动图作为筛查手段[18],当提示PDD时则需进一步结合多普勒超声检查等进行诊断。然而,其临床适用性尚需进一步进行探讨。
2.2 脑钠肽(brain natriuretic peptide, BNP)及相关因素对评估的影响
此前有研究证实,BNP及N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide, NT-pro BNP)作为反映心室功能的重要指标,在左心室收缩功能筛查中具有良好的应用价值[19],因此有学者探索了其在PDD筛查方面的应用可能[20]。其中Görmüs等[21]根据NT-pro BNP预测左心室舒张功能障碍的ROC曲线分析发现,当NT-pro BNP以57.94 pg/mL为界值(灵敏度=93%,特异度=81%)时,能够准确检测糖尿病患者的左心室舒张功能障碍(AUC=0.960,P=0.000 1)。Luers等[22]也得出了类似的结论,认为当糖尿病患者的NT-pro BNP超过209.5 pg/mL时,应接受超声心动图检查以作进一步诊断,建议将NT-pro-BNP纳入舒张功能障碍的初级筛查系统之中。身体质量指数(body mass index, BMI)作为一种测量简便的常见心血管疾病预测指标[23],多项研究表明BMI升高与左心室舒张功能受损密切相关[9,24],但有基于心肌应变率(myocardial strain rate)的研究分析发现人体脂肪组织的分布相比于BMI对于舒张功能的下降具有更强的预测效果[25],提示舒张功能的下降可能与局部器官的脂肪分布具有更强关联。基于相关指标的测量特性,当前证据提示,针对PDD的筛查应以超声心动图、BNP、BMI等指标作为筛查手段,最终结合其他临床信息在高危人群中进行诊断。
3 PDD的流行病学现状
由于舒张功能障碍与射血分数受损并不完全同步,收缩功能保留的舒张功能障碍患者在不同分级的舒张功能障碍中均有分布,因此多采用舒张功能障碍的流行病学研究作为当前PDD研究的参考。
国外研究中,Redfield等[8]通过对2 042名社区中45岁以上人群的PDD现状调查研究,发现约82.6%的人群收缩功能保持正常(LVEF>50%),收缩功能正常人群中约25.5%患有舒张功能障碍。在高危人群(年龄>65岁且诊断为高血压或冠心病)中出现舒张功能障碍的比例则更高: 轻度舒张功能障碍患病率达47.6%,中重度舒张功能患病率达16.5%。Abhayaratna等[7]对老年人群舒张功能障碍的调查结果与之类似,约有29%的人群患有收缩功能保持正常(LVEF>50%)的舒张功能障碍(即PDD)。Lam等[26]对Framingham研究中的老年队列进行调查发现,人群中约36%患有舒张功能障碍。此外,一项针对欧美国家的系统综述发现,60岁以上老年人群中舒张功能障碍的中位患病率为36.0%(15.8%~52.8%)(n=3 892),80岁以上老年人舒张功能障碍患病率则达到51.3%(n=924)[27]。然而本研究中并未对样本人群的心室收缩功能进行说明,因而其数据参考意义有限。
目前国内对于PDD的研究尚属薄弱,相关的流行病学调查也相对较少。研究首次基于全国第六次人口普查数据对心衰及心室功能障碍的流行病学特征进行总结,发现我国35岁以上一般人群舒张功能障碍的加权患病率(weighted prevalence)达35.5%,射血分数保留(LVEF≥50%)的舒张功能障碍(PDD)的粗患病率(crude prevalence)达48.92%[28]。在年龄特征上,舒张功能障碍表现出随年龄升高而上升的趋势;在地理特征上,城市人口舒张功能障碍的患病率(45.7%)高于农村地区(29.7%),重度左室舒张功能障碍则在农村地区患病率更高(2.3% vs 0.3%);在性别特征上,则未体现出明显差异,这可能与该研究纳入的女性样本人群雌激素作用尚未完全消除有关。崔晓通[29]则对我国上海地区社区老年人群的舒张功能障碍状况进行了调查,显示在65岁以上人群中的患病率约为39.6%,同样表现出患病率随年龄增长而升高的特征;其中老年女性的患病率(43.6%)明显高于男性(33.5%),与老年女性轻度舒张功能障碍人群相比,中重度患者的年龄更大。综合而言,舒张功能障碍的患病率约为30%~40%,且呈现出舒张功能随年龄增加而逐渐衰退、在农村地区患病率更高的特征,在性别方面的患病差异则需考虑到当前研究所纳入的样本人群年龄特征进一步探讨。
4 PDD与射血分数保留的心衰的潜在关系
依据左室射血分数的差异,心衰可分为射血分数降低的心衰(heart failure with reduced ejection fra-ction, HFrEF)、射血分数中等的心衰(heart failure with mild-range ejection fraction, HFmrEF)和射血分数保留的心衰(heart failure with preserved ejection fraction, HFpEF)[30]。其中HFpEF作为一种高发病率、高死亡率的疾病,其特点为同心重塑、左室充盈压增高,根据中国心衰中心注册研究,HFpEF在我国住院心衰患者类型中的比例约为43%,已成为我国心衰的主要类型[31]。过去20年间,临床上对收缩功能障碍为主要表型的HFrEF有了较充分的认识,而对HFpEF的发生发展却始终争议不断。究其原因,主要与舒张功能评估的复杂性有关。
从流行性学角度来看,舒张功能障碍患者会在各种共病因素的作用下发生心衰。大量研究表明,舒张功能障碍患者中约有2%会在1年内确诊心衰,而受不同共病种类的影响,舒张功能障碍患者的3年及5年心衰累计发病率分别达到8%~10%及10%~30%[26,32-37](表1)。一般而言,主要共病包括心源性因素和非心源性因素两类,前者主要包括糖尿病、肥胖、高血压、冠心病等因素,后者主要有慢性肾病、肺通气受限、贫血等因素[2]。尽管对于从PDD进展为心衰过程中的性别差异尚不明确[8],但根据HFpEF的女性患病人群占比更高、HFrEF的男性患病人群占比更高的流行病学特点来看[38],性别差异可能在PDD进展为心衰的过程中具有一定影响。
表1 PDD患者的心衰发病概率
Tab.1 The incidence of heart failure in PDD patients
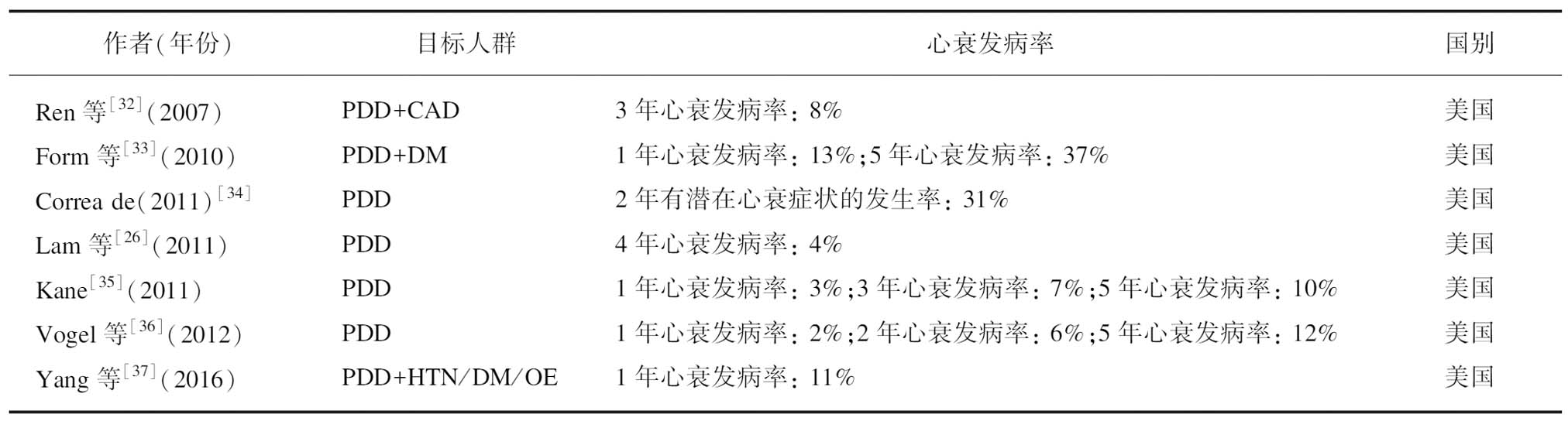
作者(年份)目标人群心衰发病率国别Ren等[32〛(2007)PDD+CAD3年心衰发病率: 8%美国Form等[33〛(2010)PDD+DM1年心衰发病率: 13%;5年心衰发病率: 37%美国Correa de(2011)[34〛PDD2年有潜在心衰症状的发生率: 31%美国Lam等[26〛(2011)PDD4年心衰发病率: 4%美国Kane[35〛(2011)PDD1年心衰发病率: 3%;3年心衰发病率: 7%;5年心衰发病率: 10%美国Vogel等[36〛(2012)PDD1年心衰发病率: 2%;2年心衰发病率: 6%;5年心衰发病率: 12%美国Yang等[37〛(2016)PDD+HTN/DM/OE1年心衰发病率: 11%美国
DM: 糖尿病,CAD: 冠心病;HTN: 高血压;OE: 肥胖
从病理生理学角度而言,在代偿性心肌肥厚阶段,左心室对血流充盈不全的不耐受迫使左心房压力代偿增高,以保证充足的充盈容量[4],此时舒张功能受损,收缩功能仍保持正常,然而随着病程迁延,舒张功能受损进一步加重,心室发生不可逆的代偿性重构,即进展为心衰阶段,机体开始出现明显的呼吸困难、水肿等症状,对运动的耐受性明显降低。而整体纵向应变(global longitudinal strain, GLS)作为导致机体运动耐力降低的重要病理基础,与心室舒张功能障碍共同反映了心肌受损的情况,在心衰症状的发生过程中也可能存在相互作用,共同促进心衰的进展[39]。此外,由于雌激素参与机体一氧化氮代谢与肌细胞钙离子的转运,使其具有血管舒张特性,雌性激素随年龄升高而降低导致冠状动脉微血管循环受损[40],而这种微血管循环受损被认为是导致左室肥大、纤维化,进而造成左室舒张功能障碍的原因之一[41],最终在性别中表现出不同的心血管疾病风险差异[42]。
5 PDD与其他心血管疾病及全因死亡的关系
PDD和HFpEF的病理生理过程与非心源性疾病(例如肥胖/代谢综合征、高血压、糖尿病、慢性肾病、贫血、COPD)所致的全身性炎症密切相关[43],慢性全身性炎症会引起冠状动脉微血管内皮炎症,从而导致间质纤维化与心肌肥厚[44]。因此PDD患者可能会出现除心衰以外的其他心血管事件结局,全因死亡事件的发生率也随之增加。
有研究表明舒张功能障碍与新发房颤风险增加[45]及消融术后房颤复发风险增加[46]密切相关,研究通过对9 591例PDD患者长达10年的结局随访研究发现,有4.7%的患者出现了新发房颤[47]。Vogel等[36]的研究也发现E/A与房颤发生之间具有相关关系。此外,一项大样本队列研究发现,射血分数保留的舒张功能障患者的心源性死亡率和全因死亡率分别为5.1%和19.4%,单独舒张功能参数中二尖瓣舒张早期血流速度、间隔e′、E/e′、LAVi与心血管死亡风险增加密切相关[13]。Shah等[48]也发现,异常e′、E/e′、LAVi、左房直径等参数与全因性死亡率增高及心源性住院事件增加之间具有相关关系。这表明PDD作为一种常见的疾病阶段,对心血管系统的影响不仅仅体现在心衰中,在以房颤、心源性死亡、心源性住院为代表的其他心血管不良结局也是不容忽视的重要危险因素。
6 展 望
PDD作为识别亚临床阶段患者的疾病诊断具有重要意义,然而当前对其的研究主要集中在国外。我国人口基数大,地区跨度范围广,PDD人群作为未来心衰发病的高危人群,若未能及时识别并采取相应的预防、治疗措施,可进一步进展为以HFpHF为主的各种心血管疾病,严重降低患者的生活质量。因此,应加快在基层医疗机构中进行PDD诊断的推广进程,明晰人群中心衰高危患者的特征,实现心衰高危患者的早期识别,及时采取相应干预措施,在借鉴国外已有研究结果与治疗经验的基础上,探索出适用于我国人群的PDD预防治疗方案。
[1] DESWAL A. Diastolic dysfunction and diastolic heart failure: mechanisms and epidemiology[J]. Curr Cardiol Rep, 2005,7(3): 178-183.
[2] WAN S H, VOGEL M W, CHEN H H. Pre-clinical diastolic dysfunction[J]. J Am Coll Cardiol, 2014,63(5): 407-416.
[3] HILL J A, OLSON E N. Cardiac plasticity[J]. N Engl J Med, 2008,358(13): 1370-1380.
[4] GAASCH W H, ZILE M R. Left ventricular diastolic dysfunction and diastolic heart failure[J]. Annu Rev Med, 2004,55: 373-394.
[5] ZILE M R, BRUTSAERT D L. New concepts in diastolic dysfunction and diastolic heart failure: part Ⅰ: diagnosis, prognosis, and measurements of diastolic function[J]. Circulation, 2002,105(11): 1387-1393.
[6] REDDY Y N V, CARTER R E, OBOKATA M, et al. A simple, evidence-based approach to help guide diagnosis of heart failure with preserved ejection fraction[J]. Circulation, 2018,138(9): 861-870.
[7] ABHAYARATNA W P, MARWICK T H, SMITH W T, et al. Characteristics of left ventricular diastolic dysfunction in the community: an echocardiographic survey[J]. Heart, 2006,92(9): 1259-1264.
[8] REDFIELD M M, JACOBSEN S J, BURNETT J C Jr, et al. Burden of systolic and diastolic ventricular dysfunction in the community: appreciating the scope of the heart failure epidemic[J]. JAMA, 2003,289(2): 194-202.
[9] PASCUAL M, PASCUAL D A, SORIA F, et al. Effects of isolated obesity on systolic and diastolic left ventricular function[J]. Heart Br Cardiac Soc, 2003,89(10): 1152-1156.
[10] PONIKOWSKI P, VOORS A A, ANKER S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology(ESC) developed with the special contribution of the Heart Failure Association(HFA) of the ESC[J]. Eur Heart J, 2016,37(27): 2129-2200.
[11] NAGUEH S F, APPLETON C P, GILLEBERT T C, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography[J]. J Am Soc Echocardiogr, 2009,22(2): 107-133.
[12] KOSMALA W, MARWICK T H. Asymptomatic left ventricular diastolic dysfunction: predicting progression to symptomatic heart failure[J]. JACC Cardiovasc Imaging, 2020,13(1 pt2): 215-227.
[13] PLAYFORD D, STRANGE G, CELERMAJER D S, et al. Diastolic dysfunction and mortality in 436?360 men and women: the National Echo Database Australia(NEDA)[J]. Eur Heart J Cardiovasc Imaging, 2021,22(5): 505-515.
[14] NISHIMURA R A, HOUSMANS P R, HATLE L K, et al. Assessment of diastolic function of the heart: background and current applications of Doppler echocardiography. Part I. Physiologic and pathophysiologic features[J]. Mayo Clin Proc, 1989,64(1): 71-81.
[15] NAGUEHS F, SMISETHO A, APPLETONC P, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American society of echocardiography and the European association of cardiovascular imaging[J]. EurHeart J CardiovascImaging, 2016,17(12): 1321-1360.
[16] KITZMAN D W, HIGGINBOTHAM M B, COBB F R, et al. Exercise intolerance in patients with heart failure and preserved left ventricular systolic function: failure of the Frank-Starling mechanism[J]. J Am Coll Cardiol, 1991,17(5): 1065-1072.
[17] OBOKATA M, KANE G C, REDDY Y N, et al. Role of diastolic stress testing in the evaluation for heart failure with preserved ejection fraction: asimultaneous invasive-echocardiographic study[J]. Circulation, 2017,135(9): 825-838.
[18] NISHI T, KOBAYASHI Y, CHRISTLE J W, et al. Incremental value of diastolic stress test in identifying subclinical heart failure in patients with diabetes mellitus[J]. Eur Heart J Cardiovasc Imaging, 2020,21(8): 876-884.
[19] MCDONAGH T, ROBB S, MURDOCH D, et al. Biochemical detection of left-ventricular systolic dysfunction[J]. Lancet, 1998,351(9095): 9-13.
[20] ALBERTINI J P, COHEN R, VALENSI P, et al. B-type natriuretic peptide, a marker of asymptomatic left ventricular dysfunction in type 2 diabetic patients[J]. Diabetes Metab, 2008,34(4 Pt 1): 355-362.
[21] ![]() U, OZMEN D, OZMEN B, et al. Serum N-terminal-pro-brain natriuretic peptide(NT-pro-BNP) and homocysteine levels in type 2 diabetic patients with asymptomatic left ventricular diastolic dysfunction[J]. Diabetes Res Clin Pract, 2010,87(1): 51-56.
U, OZMEN D, OZMEN B, et al. Serum N-terminal-pro-brain natriuretic peptide(NT-pro-BNP) and homocysteine levels in type 2 diabetic patients with asymptomatic left ventricular diastolic dysfunction[J]. Diabetes Res Clin Pract, 2010,87(1): 51-56.
[22] LUERS C, WACHTER R, KLETA S, et al. Natriuretic peptides in the detection of preclinical diastolic or systolic dysfunction[J]. Clin Res Cardiol, 2010,99(4): 217-226.
[23] ROTH G A, MENSAH G A, JOHNSON C O, et al. Global burden of cardiovascular diseases and risk factors, 1990-2019: update from the GBD 2019 Study[J]. J Am Coll Cardio, 2020,76(25): 2982-3021.
[24] BARBOSA M M, BELEIGOLI A M, DE FATIMA DINIZ M, et al. Strain imaging in morbid obesity: insights into subclinical ventricular dysfunction[J]. Clin Cardiol, 2011,34(5): 288-293.
[25] ZHU L, GU S J, WANG Q R, et al. Left ventricular myocardial deformation: a study on diastolic function in the Chinese male population and its relationship with fat distribution[J]. Quant Imaging Med Surg, 2020,10(3): 634-645.
[26] LAM C S, LYASS A, KRAIGHER-KRAINER E, et al. Cardiac dysfunction and noncardiac dysfunction as precursors of heart failure with reduced and preserved ejection fraction in the community[J]. Circulation, 2011,124(1): 24-30.
[27] VAN RIET E E S, HOES A W, WAGENAAR K P, et al. Epidemiology of heart failure: the prevalence of heart failure and ventricular dysfunction in older adults over time. A systematic review[J]. Eur J Heart Fail, 2016,18(3): 242-252.
[28] HAO G, WANG X, CHEN Z, et al. Prevalence of heart failure and left ventricular dysfunction in China: the China Hypertension Survey, 2012-2015[J]. Eur J Heart Fail, 2019,21(11): 1329-1337.
[29] 崔晓通.社区老年人群左心室舒张功能不全的流行概况与相关因素的研究: 上海心脏健康研究[D].上海: 复旦大学,2014.
[30] BOZKURT B, COATS A J S, TSUTSUI H, et al. Universal definition and classification of heart failure: a report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the universal definition of heart failure: endorsed by the Canadian Heart Failure Society, Heart Failure Association of India, Cardiac Society of Australia and New Zealand, and Chinese Heart Failure Association[J]. Eur J Heart Fail, 2021,23(3): 352-380.
[31] 王华,李莹莹,柴坷,等.中国住院心力衰竭患者流行病学及治疗现状[J].中华心血管病杂志,2019,47(11): 865-874.
[32] REN X S, RISTOW B, NA B, et al. Prevalence and prognosis of asymptomatic left ventricular diastolic dysfunction in ambulatory patients with coronary heart disease[J]. Am J Cardiol, 2007,99(12): 1643-1647.
[33] FROM A M, SCOTT C G, CHEN H H. The development of heart failure in patients with diabetes mellitus and pre-clinical diastolic dysfunction a population-based study[J]. J Am Coll Cardiol, 2010,55(4): 300-305.
[34] CORREA DE SA D D, HODGE D O, SLUSSER J P, et al. Progression of preclinical diastolic dysfunction to the development of symptoms[J]. Heart, 2010,96(7): 528-532.
[35] KANE G C, KARON B L, MAHONEY D W, et al. Progression of left ventricular diastolic dysfunction and risk of heart failure[J]. JAMA, 2011,306(8): 856-863.
[36] VOGEL M W, SLUSSER J P, HODGE D O, et al. The natural history of preclinical diastolic dysfunction[J]. Circ Heart Fail, 2012,5(2): 144-151.
[37] YANG H, NEGISHI K, WANG Y, et al. Echocardiographic screening for non-ischaemic stage B heart failure in the community[J]. Eur J Heart Fail, 2016,18(11): 1331-1339.
[38] BOUTHOORN S, VALSTAR G B, GOHAR A, et al. The prevalence of left ventricular diastolic dysfunction and heart failure with preserved ejection fraction in men and women with type 2 diabetes: a systematic review and meta-analysis[J]. Diab Vasc Dis Res, 2018,15(6): 477-493.
[39] PANDEY A, ALLEN N B, AYERS C, et al. Fitness in young adulthood and long-term cardiac structure and function: the CARDIA study[J]. JACC Heart Fail, 2017,5(5): 347-355.
[40] NELSON M D, WEI J, BAIREY MERZ C N. Coronary microvascular dysfunction and heart failure with preserved ejection fraction as female-pattern cardiovascular disease: the chicken or the egg?[J]. Eur Heart J, 2018,39(10): 850-852.
[41] MYGIND N D, MICHELSEN M M, PENA A, et al. Coronary microvascular function and cardiovascular risk factors in women with angina pectoris and no obstructive coronary artery disease: the iPOWERstudy[J]. J Am Heart Assoc, 2016,5(3): e003064.
[42] ONEGLIA A, NELSON M D, MERZ C N B. Sex differences in cardiovascular aging and heart failure[J]. Curr Heart Fail Rep, 2020,17(6): 409-423.
[43] PAULUS W J, TSCHÖPE C. A novel paradigm for heart failure with preserved ejection fraction: comorbidities drive myocardial dysfunction and remodeling through coronary microvascular endothelial inflammation[J]. J Am Coll Cardiol, 2013,62(4): 263-271.
[44] SHAH S J, KITZMAN D W, BORLAUG B A, et al. Phenotype-specific treatment of heart failure with preserved ejection fraction: a multiorgan roadmap[J]. Circulation, 2016,134(1): 73-90.
[45] TIWARI S, SCHIRMER H, JACOBSEN B K, et al. Association between diastolic dysfunction and future atrial fibrillation in the Tromsø Study from 1994 to 2010[J]. Heart, 2015,101(16): 1302-1308.
[46] KOSIUK J, BREITHARDT O A, BODE K, et al. The predictive value of echocardiographic parameters associated with left ventricular diastolic dysfunction on short-and long-term outcomes of catheter ablation of atrial fibrillation[J]. Europace, 2014,16(8): 1168-1174.
[47] LI D L, QUISPE R, MADAN N, et al. A risk score for predicting atrial fibrillation in individuals with preclinical diastolic dysfunction: a retrospective study in a single large urban center in the United States[J]. BMC Cardiovasc Disord, 2019,19(1): 47.
[48] SHAH A M, CLAGGETT B, KITZMAN D, et al. Contemporary assessment of left ventricular diastolic function in older adults: the atherosclerosis risk in communities study[J]. Circulation, 2017,135(5): 426-439.