外泌体是一类直径30~100 nm由细胞分泌,包含脂质、核酸和蛋白质,在电子显微镜下呈现球状或杯状的亚细胞囊泡状颗粒。外泌体膜的主要成分是脂质和蛋白质,并且富含脂质筏。除蛋白质外,在外泌体腔有各种核酸,包括mRNA、microRNA(miRNA)和其他非编码RNA(ncRNA)。
外泌体是由质膜向内萌芽形成胞内内体产生,并将其作为细胞表面蛋白更新的一种手段。内体进一步进入细胞产生包含直径为40~150 nm的多囊泡体(multivesicular bodies, MVBs)。然后多囊泡体与溶酶体融合,从而降解其内含物或与质膜融合。最后,以外泌体的形式将其内含物释放到细胞外空间。这个过程称为外泌体生物发生,是将外泌体与通过质膜的外芽,质膜的凋亡小体或坏死出现的囊泡区分的依据。
大量研究已证明外泌体参与细胞间通讯、免疫系统调节、细胞生长、能量维持等许多生理功能。外泌体通过配体-受体相互作用、内吞作用、吞噬作用以及与质膜融合等方式,将内含生物信号分子传递到靶细胞,是一种有效的细胞间信息传递手段。比如: 干细胞通过释放外泌体,向其他细胞传递信息,产生干细胞效应;肿瘤组织细胞之间以外泌体为介导,传递信号,促进肿瘤的发生发展[1]。
外泌体及其内容物在一定程度上决定肿瘤细胞的非随机性远端组织转移[1-2],包括肿瘤细胞来源外泌体以及T细胞或成纤维细胞等分泌的外泌体。研究证明,肿瘤细胞通过外泌体改变或者“驯化”局部微环境或远端组织器官,形成有利于肿瘤细胞转移的微环境[1-2]。肿瘤细胞转移之前,靶器官接受肿瘤细胞来源外泌体的信号,建立适合肿瘤细胞生长的微环境,称为转移前微环境(pre-metastatic niche, PMN),包括细胞基质、细胞外基质及免疫系统的改变。除了调控肿瘤微环境,外泌体对肿瘤细胞本身也具有重要调控功能。比如,外泌体调控肿瘤细胞的上皮-间充质转化(epithelial-mesenchymal transi-tion, EMT)和肿瘤细胞的迁移、侵袭能力,进而诱导肿瘤细胞的转移。另外,肿瘤细胞分泌的外泌体对内皮细胞也有影响,改变血管通透性,有利于循环肿瘤细胞穿透血管,进入远端组织(图1)。
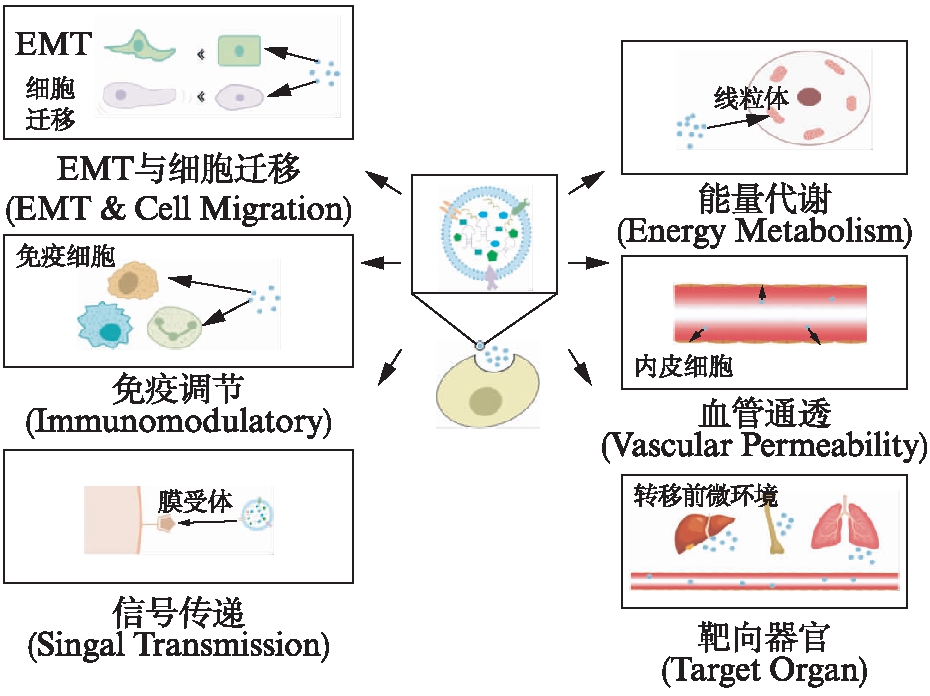
图1 外泌体调控癌细胞转移的途径
Fig.1 The way of exosomes regulating cancer cell metastasis
1 外泌体调控肿瘤转移前微环境
1.1 外泌体通过信号传递直接调控肿瘤转移前微环境
由于肿瘤细胞的异质性,肿瘤细胞可以分泌不同于体细胞的外泌体,在肿瘤细胞-间质细胞之间、肿瘤细胞-肿瘤细胞之间、肿瘤细胞-微环境之间传递信号分子,以构建易于细胞侵袭和转移的肿瘤转移前微环境。研究显示,黑色素瘤来源的外泌体通过淋巴系统运输到前哨淋巴结,将信号分子运送至转移前微环境中,进而调节细胞外基质沉积和血管增殖,有利于黑色素瘤细胞的转移[2]。从MDA-MB-231细胞上清液中提取的外泌体被MCF-7细胞吞噬后,导致MCF-7细胞独立锚定生长能力增强,并且迁移和侵袭能力以剂量依赖性方式增加[3]。非小细胞肺癌(non-small cell lung cancer, NSCLC)细胞外泌体中Podocalyxin的表达降低,进而影响成纤维细胞中整联蛋白的运输,并通过促进肿瘤高度侵袭性细胞外基质沉积,创造了支持肿瘤细胞迁移和侵袭的微环境[4]。
1.2 外泌体通过免疫调节间接调控肿瘤转移前微环境
外泌体有助于肿瘤细胞在转移过程中逃避免疫监视。外泌体介导的免疫抑制与其含有的肿瘤相关抗原和免疫抑制分子相关,这些因子通过负性调控和误导靶向等方式,抑制免疫系统的功能。比如,肝癌细胞来源外泌体中含有14-3-3ζ蛋白,该蛋白可以抑制外周血CD3+T细胞,使原始T细胞偏离从效应T细胞到调节T细胞的分化过程,诱导更多T细胞转化为调节性T细胞,从而导致T细胞耗竭[5]。在侵袭性B细胞淋巴瘤,含有肿瘤特异性抗原的外泌体被分泌到血浆后,可以释放抗原诱导自身抗体与其结合,并针对补体介导的细胞毒性作用产生诱饵功能,从而保护肿瘤细胞免受自身免疫的攻击和补体依赖性细胞的溶解[6]。
肿瘤细胞来源的外泌体还能诱导肿瘤细胞的免疫耐受,使其抗免疫能力增加,进而改变转移前微环境,易于转移发生。比如,乳腺癌患者血浆中分离出的HER2+外泌体可以结合曲妥珠单抗,抑制曲妥珠单抗对乳腺癌细胞增殖的影响,并能诱导肿瘤细胞表达HER2,以增强免疫耐受,达到易于转移的目的[7];直肠癌分泌含有miR-21的外泌体,可以与TLR7结合并诱导肝巨噬细胞极化。活化的巨噬细胞会分泌包括IL-6和S100A家族成员在内的炎性细胞因子,改变转移前微环境,从而支持肿瘤细胞肝转移[8]。
2 外泌体调控肿瘤细胞
2.1 外泌体诱导肿瘤细胞发生EMT
EMT是转移启始的关键步骤。研究表明,肿瘤细胞来源的外泌体作为EMT起始信号的转运载体,将转移信号传递给可转移肿瘤细胞,发生EMT以及转移。比如,肾透明细胞肿瘤干细胞通过外泌体将miR-19b-3p输送到肿瘤细胞,抑制细胞内PTEN的表达,进而诱导其发生EMT[9];在大肠癌中,成纤维细胞分泌来源的外泌体,直接作用于大肠癌细胞,使大肠癌细胞中miR-92a-3p含量上升,激活Wnt/β-catenin通路,导致EMT发生[10];肝癌细胞分泌的外泌体中miR-140-3p可以抑制MAPK/ERK通路活性,增加肌动蛋白α、波动蛋白和N-cadherin的表达,并降低E-cadherin的表达,最终诱导EMT发生和肿瘤转移[11]。
低氧微环境诱导的肿瘤转移,也和外泌体密切相关。肿瘤细胞缺氧条件下产生的外泌体,富集了EMT信号分子。比如,缺氧微环境下,鼻咽癌肿瘤细胞释放的外泌体富含基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13),促进波动蛋白表达,并抑制E-cadherin,诱导EMT发生[12]。骨髓间充质肿瘤干细胞在低氧环境下分泌的外泌体,富含miR-193a-3p、miR-210-3p和miR-5100等,这些microRNA可激活受体上皮肿瘤细胞内STAT3信号,促进EMT相关基因的表达[13]。
2.2 外泌体促进肿瘤细胞能量合成
肿瘤细胞的迁移和转移能力与其代谢模式和能量合成密切相关。外泌体可将代谢底物运输到肿瘤细胞,促进肿瘤细胞的代谢水平及能量合成。癌症相关成纤维细胞来源的外泌体携带氨基酸、脂质和三羧酸循环中间体等代谢物,被肿瘤细胞摄取之后,增强肿瘤细胞糖酵解作用和谷氨酰胺依赖性还原性羧化作用,有助于肿瘤细胞在营养缺乏条件下的生长和转移[14]。外泌体也可以传递代谢影响因子,系统地重新编程能量代谢,增加养分的利用率,从而促进转移。乳腺癌细胞外泌体携带的miR-122,一方面促进肿瘤细胞的葡萄糖代谢,产生更多ATP,有利于细胞的迁移和转移;另一方面通过糖酵解途径减少非肿瘤细胞对葡萄糖的摄取,间接维持肿瘤细胞的营养供应[15]。
2.3 外泌体促进肿瘤细胞迁移
肿瘤细胞迁移能力的获得和运动能力的增强是肿瘤转移的关键步骤,外泌体可以向外分泌相关蛋白直接参与细胞运动。比如,纤维肉瘤细胞分泌的外泌体含有可以与细胞整联蛋白受体结合的纤连蛋白,与受体结合后促进整联蛋白聚集,在细胞前端形成黏附吸引力,并在细胞运动过程中参与形成黏附点的循环,从而促进动态黏附形成和细胞迁移[16];外泌体还可以通过运送信号分子,激活相关通路,形成细胞运动。癌症相关成纤维细胞分泌的CD81阳性外泌体含有Wnt配体Wnt11,被乳腺癌细胞摄取后,激活细胞极性信号通路,促进了细胞的形态学改变和迁移能力[17]。神经胶质瘤细胞将具有致癌性受体EGFRvⅢ的外泌体转移到缺乏该受体的邻近神经胶质瘤细胞中,从而激活了邻近神经胶质瘤细胞中的AKT途径,并赋予这些细胞非锚固依赖性生长的能力,促进了肿瘤转移[18]。
3 外泌体调控血管通透性
肿瘤细胞来源的外泌体参与血管通透性调控。来源于肿瘤的外泌体可以将信号分子直接作用于内皮细胞,改变内皮细胞形态学特征,以促进转移。肝癌细胞来源的外泌体富含miR-103,可以靶向抑制内皮细胞ZO-1表达,增加血管通透性以促进肿瘤细胞转移[19];结直肠癌细胞来源的外泌体将促转移的miR-25-3p转移到内皮细胞,靶向Krüppel样因子2(Krüppel-like factor 2, KLF2)和Krüppel样因子4(KLF4),从而促进血管通透性[20]。
肿瘤细胞来源的外泌体也参与血管再生调控。肝细胞癌来源的外泌体含有赖氨酰氧化酶样4(lysyl oxidase like 4, LOXL4),旁分泌至人脐静脉内皮细胞,促进血管生成[21];LAMA84细胞分泌的外泌体与人脐静脉内皮细胞共培养,显著促进了内皮细胞的细胞间黏附分子(intercellular adhesion molecule-1, CAM-1)、血管细胞黏附分子(vascular cell adhesion molecule-1, VCAM-1)及IL-8表达,在体内可促进血管生成[22]。在卵巢癌细胞外泌体中高表达的可溶性E-cadherin是一种有效的血管生成诱导剂,可以使血管内皮细胞上的cadherin异构化,激活β-catenin和NF-κB信号,以控制突起生长和极化肌动蛋白,促进血管生成[23]。
4 外泌体调控肿瘤细胞对远处转移灶的选择性
在肿瘤细胞对远处转移“定植”器官的选择中,外泌体发挥了重要功能,包括对肿瘤细胞特征的调控、对循环系统微血管通透性的改变及对靶器官转移前微环境的改造。
在小鼠体内,表达血管内皮生长因子受体1骨髓来源树突状细胞在癌细胞发生转移之前就归巢于肺。这些细胞与局部基质相互作用,并为将来的转移性细胞产生受体位点。原发性肿瘤来源的外泌体是该过程的关键介体。转移性黑色素瘤中,骨髓来源树突状细胞直接摄取原发性肿瘤来源表达cMet的黑色素瘤外泌体,促进该细胞在癌细胞到达之前向肺部的浸润,从而促进以血管渗漏和转移为特征的转移前微环境形成[24]。除了向肺中迁移免疫细胞外,在乳腺癌模型中,外泌体还直接靶向肺,诱导肺内血管渗漏,并调节乳腺癌和黑色素瘤中的驻留肺成纤维细胞和上皮细胞[25]。
肿瘤细胞来源外泌体的表面整合素表达特征与肿瘤转移靶器官趋向性也密切相关。比如,整合素α6β4型和α6β1型的外泌体,与肺成纤维细胞和肺上皮细胞有较强的趋向性和相互作用,外泌体α6β4通过促进S100基因表达和Src信号通路来支持成纤维细胞活化,进而诱导肿瘤细胞肺转移[26];表达整联蛋白avb5的PaC的外泌体通过与肝脏中富含纤连蛋白的ECM结合而促进肝嗜有机性,被成熟的Kupffer细胞摄取以促进肝转移[26]。富含透明质酸结合蛋白(cell migration-inducing and hyaluronan-binding protein, CEMIP)外泌体的乳腺肿瘤细胞,容易发生脑转移,而肺转移性乳腺肿瘤细胞分泌的外泌体,未见CEMIP的升高,敲除乳腺肿瘤细胞CEMIP,可显著减轻脑转移的发生[27]。
与其他器官转移不同,骨转移可能是由破骨细胞和成骨细胞功能之间的平衡破坏引起的。在NSCLC骨转移中,高表达Amphiregulin的外泌体与破骨细胞中的EGFR结合并持续活化,导致蛋白水解酶的表达增加,破骨细胞生成促进骨转移[28]。MDA-MB-231外泌体分泌含有参与细胞侵袭的肌动蛋白结合蛋白L-plastin,激活破骨细胞并通过RANK在体内诱导溶骨[29]。
外泌体内miRNA也是肿瘤转移靶器官的重要信号分子。Hashimoto等[30]从前列腺肿瘤细胞来源的外泌体中鉴定了miR-99a-5p、miR-125b-2-3p、miR-141-3p、miR-200a-3p、miR-200b-3p、miR-200c-3p、miR-940和miR-1260a等8种miRNA,这些miRNA可诱导前列腺肿瘤细胞发生骨转移,其中miR-940靶向作用于成骨细胞ARHGAP1和FAM134A,促进骨转移性微环境的形成。乳腺癌细胞来源外泌体中的miR-20a-5p通过靶向SRCIN1来促进破骨细胞的增殖和分化,进而促进乳腺癌细胞骨转移[31]。
5 外泌体的临床相关研究进展
鉴于外泌体独特的功能及其与肿瘤转移的密切相关性,利用临床标本开展的大量研究提示外泌体可作为临床疾病,包括恶性肿瘤的诊断和预后生物标志物。比如,在肺癌中,通过分析患者肺癌细胞外泌体CD317和表皮生长因子受体(epidermal growth factor receptor, EGFR)含量的差异,可用于NSCLC的辅助诊断[32];肿瘤细胞来源外泌体包含的lncRNA也可作为潜在的诊断生物标志物。比如NSCLC患者外泌体内高表达lncRNA MALAT-1,且与TNM分期和淋巴结转移呈正相关[33];外泌体内包含的环状RNA(circRNA)也有潜力用于肿瘤的诊断及治疗预后。敲除肝癌细胞外泌体circPTGR1后,可显著抑制肿瘤细胞的侵袭和迁移,该基因高表达与临床分期和预后有关[34]。
研究显示,外泌体也可作为临床治疗的潜在靶点。将胃癌患者恶性腹水中的外泌体热处理后,能够促进树突状细胞成熟并诱导肿瘤特异性的细胞毒性T淋巴细胞反应,可作为一种有效的肿瘤疫苗[35];CD47高表达的成纤维细胞分泌的外泌体经过工程改造后,可携带特异调控癌基因KrasG12D的发夹RNA[36];在小鼠胰腺癌模型中,这种工程化处理后的外泌体可抑制癌细胞KRAS信号,进而抑制肿瘤生长[36];外泌体样脂质载体可有效激活树突状细胞,在其Ⅰ期临床试验中,低剂量给药就能促进黑色素瘤患者抗原特异性T细胞反应[37]。
6 展 望
随着RNA、蛋白质、代谢等多组学研究的不断进展,外泌体成为生命科学界研究关注的热点之一。外泌体是细胞间通讯的重要信号载体,对肿瘤细胞的迁移、侵袭、转移发挥重要的调控作用。肿瘤细胞来源的外泌体可诱导转移灶形成转移前微环境、诱导肿瘤细胞发生EMT、诱导肿瘤细胞的免疫逃逸、增加肿瘤周围血管的通透性、诱导新生肿瘤周边血管生成等。随着对外泌体认识的不断深入,必将推进外泌体的临床应用,包括对外泌体的液体活检,实现肿瘤早期诊断、肿瘤分型或预后;通过控制肿瘤细胞或免疫细胞分泌外的释放,抑制转移前微环境的形成,进而抑制癌转移;通过改造或者修饰生物工程外泌体,实现患者的特异性靶向给药等。相信在不久的将来,这些展望都将实现并造福于恶性肿瘤患者。
[1] MASHOURI L, YOUSEFI H, AREF A R, et al. Exosomes: composition, biogenesis, and mechanisms in cancer metastasis and drug resistance[J]. Mol Cancer, 2019,18(1): 75.
[2] GOWDA R, ROBERTSONB M, IYER S, et al. The role of exosomes in metastasis and progression of melanoma[J]. Cancer Treat Rev, 2020,85: 101975.
[3] KIA V, MORTAZAVI Y, PARYAN M, et al. Exosomal miRNAs from highly metastatic cells can induce metastasis in non-metastatic cells[J]. Life Sci, 2019,220: 162-168.
[4] NOVO D, HEATH N, MITCHELL L, et al. Mutant p53s generate pro-invasive niches by influencing exosome podocalyxin levels[J]. Nat Commun, 2018,9(1): 5069.
[5] WANG X, SHEN H, ZHANGYUAN G, et al. 14-3-3ζ delivered by hepatocellular carcinoma-derived exosomes impaired anti-tumor function of tumor-infiltrating T lymphocytes[J]. Cell Death Dis, 2018,9(2): 159.
[6] CAPELLO M, VYKOUKAL J V, KATAYAMA H, et al. Exosomes harbor B cell targets in pancreatic adenocarcinoma and exert decoy function against complement-mediated cytotoxicity[J]. Nat Commun, 2019,10(1): 254.
[7] TELLEZ-GABRIEL M, KNUTSEN E, PERANDER M. Current status of circulating tumor cells, circulating tumor DNA, and exosomes in breast cancer liquid biopsies[J]. Int J Mol Sci, 2020,21(24): E9457.
[8] SHAO Y K, CHEN T, ZHENG X, et al. Colorectal cancer-derived small extracellular vesicles establish an inflammatory premetastatic niche in liver metastasis[J]. Carcinogenesis, 2018,39(11): 1368-1379.
[9] WANG L, YANG G, ZHAO D, et al. CD103-positive CSC exosome promotes EMT of clear cell renal cell carcinoma: role of remote MiR-19b-3p[J]. Mol Cancer, 2019,18(1): 86.
[10] HU J L, WANG W, LAN X L, et al. CAFs secreted exosomes promote metastasis and chemotherapy resistance by enhancing cell stemness and epithelial-mesenchymal transition in colorectal cancer[J]. Mol Cancer, 2019,18(1): 91.
[11] ZHANG Q Y, MENC J, DINGX W. Upregulation of microRNA-140-3p inhibits epithelial-mesenchymal transition, invasion, and metastasis of hepatocellular carcinoma through inactivation of the MAPK signaling pathway by targeting GRN[J]. J Cell Biochem, 2019,120(9): 14885-14898.
[12] SHAN Y, YOU B, SHI S, et al. Hypoxia-induced matrix metalloproteinase-13 expression in exosomes from nasopharyngeal carcinoma enhances metastases[J]. Cell Death Dis, 2018,9(3): 382.
[13] ZHANG X, SAI B, WANG F, et al. Hypoxic BMSC-derived exosomal miRNAs promote metastasis of lung cancer cells via STAT3-induced EMT[J]. Mol Cancer, 2019,18(1): 40.
[14] VALASTYAN S, WEINBERGR A. Tumor metastasis: molecular insights and evolving paradigms[J]. Cell, 2011,147(2): 275-292.
[15] BAGHBAN R, ROSHANGAR L, JAHANBAN-ESFAHLAN R, et al. Tumor microenvironment complexity and therapeutic implications at a glance[J]. Cell Commun Signal, 2020,18(1): 59.
[16] SUNG B H, KETOVA T, HOSHINO D, et al. Directional cell movement through tissues is controlled by exosome secretion[J]. Nat Commun, 2015,6: 7164.
[17] LUGA V, ZHANG L, VILORIA-PETIT A M, et al. Exosomes mediate stromal mobilization of autocrine Wnt-PCP signaling in breast cancer cell migration[J]. Cell, 2012,151(7): 1542-1556.
[18] ZHANG L, YU D. Exosomes in cancer development, metastasis, and immunity[J]. Biochim Biophys Acta Rev Cancer, 2019,1871(2): 455-468.
[19] FANG J H, ZHANG Z J, SHANG L R, et al. Hepatoma cell-secreted exosomal microRNA-103 increases vascular permeability and promotes metastasis by targeting junction proteins[J]. Hepatology, 2018,68(4): 1459-1475.
[20] ZENG Z, LI Y, PAN Y, et al. Cancer-derived exosomal miR-25-3p promotes pre-metastatic niche formation by inducing vascular permeability and angiogenesis[J]. Nat Commun, 2018,9(1): 5395.
[21] LI R, WANG Y, ZHANG X, et al. Exosome-mediated secretion of LOXL4 promotes hepatocellular carcinoma cell invasion and metastasis[J]. Mol Cancer, 2019,18(1): 18.
[22] TAVERNA S, FLUGY A, SAIEVA L, et al. Role of exosomes released by chronic myelogenous leukemia cells in angiogenesis[J]. Int J Cancer, 2012,130(9): 2033-2043.
[23] TANG M K S, YUE P Y K, IP P P, et al. Soluble E-cadherin promotes tumor angiogenesis and localizes to exosome surface[J]. Nat Commun, 2018,9(1): 2270.
[24] PEINADO H, ![]() M, LAVOTSHKIN S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nat Med, 2012,18(6): 883-891.
M, LAVOTSHKIN S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET[J]. Nat Med, 2012,18(6): 883-891.
[25] HOSHINO A, COSTA-SILVA B, SHENT L, et al. Tumour exosome integrins determine organotropic metastasis[J]. Nature, 2015,527(7578): 329-335.
[26] HE C J, ZHENG S, LUO Y, et al. Exosome theranostics: biology and translational medicine[J]. Theranostics, 2018,8(1): 237-255.
[27] RODRIGUES G, HOSHINO A, KENIFICC M, et al. Tumourexosomal CEMIP protein promotes cancer cell colonization in brain metastasis[J]. Nat Cell Biol, 2019,21(11): 1403-1412.
[28] TAVERNA S, PUCCI M, GIALLOMBARDO M, et al. Amphiregulin contained in NSCLC-exosomes induces osteoclast differentiation through the activation of EGFR pathway[J]. Sci Rep, 2017,7(1): 3170.
[29] TIEDEMANN K, SADVAKASSOVA G, MIKOLAJEWICZ N, et al. Exosomalrelease of L-plastin by breast cancer cells facilitates metastatic bone osteolysis[J]. Transl Oncol, 2019,12(3): 462-474.
[30] HASHIMOTO K, OCHI H, SUNAMURA S, et al. Cancer-secreted hsa-miR-940 induces an osteoblastic phenotype in the bone metastatic microenvironment via targeting ARHGAP1 and FAM134A[J]. Proc Natl Acad Sci USA, 2018,115(9): 2204-2209.
[31] GUO L, ZHU Y, LI L D, et al. Breast cancer cell-derived exosomal miR-20a-5p promotes the proliferation and differentiation of osteoclasts by targeting SRCIN1[J]. Cancer Med, 2019,8(12): 5687-5701.
[32] JAKOBSEN K R, PAULSEN B S, B☞K R, et al. Exosomal proteins as potential diagnostic markers in advanced non-small cell lung carcinoma[J]. J Extracell Vesicles, 2015,4: 26659.
[33] KARIMZADEHM R, SEYEDTAGHIAM R, SOUDYAB M, et al. Exosomal long noncoding RNAs: insights into emerging diagnostic and therapeutic applications in lung cancer[J]. J Oncol, 2020,2020: 7630197.
[34] ZHANG P F, GAO C, HUANG X Y, et al. Cancer cell-derived exosomal circUHRF1 induces natural killer cell exhaustion and may cause resistance to anti-PD1 therapy in hepatocellular carcinoma[J]. Mol Cancer, 2020,19(1): 110.
[35] ZHONG H, YANG Y, MA S, et al. Induction of a tumour-specific CTL response by exosomes isolated from heat-treated malignant ascites of gastric cancer patients[J]. Int J Hyperthermia, 2011,27(6): 604-611.
[36] TANG Z Y, LI D P, HOU S P, et al. The cancer exosomes: clinical implications, applications and challenges[J]. Int J Cancer, 2020,146(11): 2946-2959.
[37] KRANZ L M, DIKEN M, HAAS H, et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy[J]. Nature, 2016,534(7607): 396-401.