慢性肾脏疾病(chronic kidney disease, CKD)是公认的全球公共卫生问题,CKD增加终末期肾脏疾病的发病风险及心血管疾病发病和死亡,给患者、家庭和社会带来沉重的负担[1-2]。慢性肾脏病的发病原因复杂,已公认的风险因素有老龄、肥胖、高血压、糖尿病等[3]。新型风险因素依然在持续识别和验证中。
研究显示,睡眠时间异常与高血压、代谢失调、心血管病、等多种疾病风险增加相关,而这些疾病均为CKD的启动或维持因素。近期有在美国[4-5]、韩国[6-7]社区人群中开展的研究提示,睡眠时间减少、睡眠时间延长或两者同时存在与CKD风险增加相关,是CKD的候选风险因素。此外,一项在中国香港社区人群中开展的研究发现睡眠时间减少与CKD风险增加相关[8]。然而到目前为止,尚无在中国内地社区人群中报道两者的关系。故本研究将在一个中国大陆老年人群中探索睡眠时间异常是否与CKD相关。
1 资料与方法
1.1 研究对象
研究对象来自于“如皋长寿及衰老队列研究(Rugao Longevity and Ageing Study, RuLAS)”中的“如皋衰老子队列”[9]。在如皋衰老子队列中,本研究对江苏省如皋市江安镇共31个行政村11 198例70~84岁老人按5岁年龄层和性别进行分层随机抽样,抽出1 960例对象,于2014年11—12月对其进行问卷、体检及血液分子标志物检查。最终基线调查样本量1 788例(应答率91.2%)。基线调查完成后,于1.5、3、5年后分别对基线的研究对象进行重测随访调查及重大慢病发病和死因随访调查。本研究采用基线调查(横断面调查)数据,纳入肾功能和睡眠变量完整的1 637例个体。所有调查对象均签知情同意书,研究通过了复旦大学生命科学院伦理委员会批准(批号278)。
1.2 肾功能评估
肾功能用血浆肌酐为基础的CKD Epidemiology Collaboration(CKD-EPI)方程估算estimated glome-rular filtration rate(eGFR)[10]。由于研究对象中eGFR<60者极少,本研究将60 mL/(min·1.73 m2)≤eGFR<90 mL/(min·1.73 m2)定义为轻度肾功能降低(CKD 2期),将eGFR≥90 mL/(min·1.73 m2)定义为肾功能正常[11]。
1.3 睡眠评估
睡眠时间问题如下:“每夜通常实际睡眠多少h?”结果精确到整数。睡眠时间定义如下: 短睡眠时间≤6 h/夜,一般睡眠时间(7~8 h/夜),长睡眠时间≥9 h/夜。以每日一般基础睡眠累计睡眠时间7~8 h/夜睡眠时间作为参照组[12]。
1.4 协变量
本研究分析时纳入以下协变量: 年龄、性别(男或女)、配偶(存活或死亡)、教育水平(文盲、小学、中学及以上)、吸烟(现在吸烟或否)、饮酒(现在饮酒或否)、体重指数(BMI)、腰围、收缩压、舒张压、高尿酸、糖尿病、高总胆固醇(TC)、高三酰甘油(TG)、低密度脂蛋白胆固醇酯(LDL-C)升高[13]、高密度脂蛋白胆固醇酯(HDL-C)降低、脑卒中(脑溢血及脑梗死)、心肌梗死、心力衰竭、认知降低、躯体功能独立与否、抑郁。认知降低定义为长谷川痴呆量表测量分值≤21.5分[14]。躯体功能依赖定义为Katz日常活动指数(activities of daily living, ADL)=18分[15]。抑郁定义为15题老年抑郁量表GDS≥6分[16]。
1.5 统计学方法
本研究使用SAS 9.1.3(SAS Institute Inc, Cary, NC, USA)进行数据统计分析。连续性变量采用![]() 表示,离散型变量采用频数及百分比表示。基线组间差异分析采用Wilcoxon Rank Sum检验或χ2检验。利用二分类Logistic回归分析睡眠时间和肾功能降低之间的关系,计算调整多个变量后的OR、95%CI和相应的P值。P<0.05为差异具有统计学意义。
表示,离散型变量采用频数及百分比表示。基线组间差异分析采用Wilcoxon Rank Sum检验或χ2检验。利用二分类Logistic回归分析睡眠时间和肾功能降低之间的关系,计算调整多个变量后的OR、95%CI和相应的P值。P<0.05为差异具有统计学意义。
2 结 果
2.1 eGFR分类的研究对象基线特征比较
研究对象中,老年男性(n=753)平均年龄为(75.0±3.8)岁,老年女性(n=884)为(75.4±3.9)岁。57.0%男性、51.9%女性存在轻度肾功能降低。参与者平均睡眠为(6.43±1.96) h/夜,其中男性为(6.80±1.87) h,女性为(6.12±1.98) h。轻度eGFR降低组[60~90 mL/(min·1.73 m2)]和正常eGFR组[>90 mL/(min·1.73 m2)]间基线特征比较结果见表1。
表1 eGFR分组的研究对象基线特征
Tab.1 Baseline characteristics of the participants according to eGFR groups ![]()
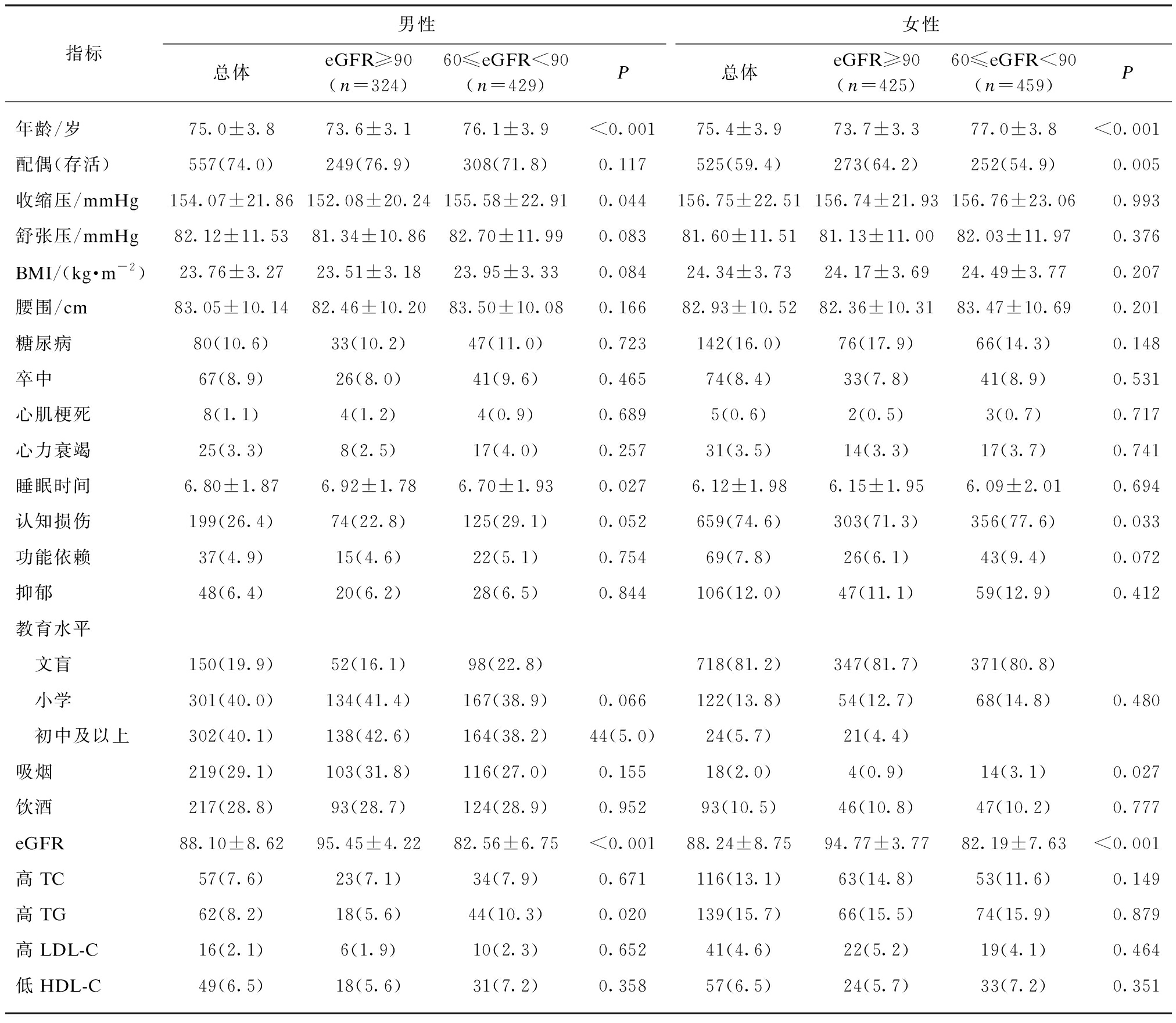
指标男性女性总体eGFR≥90(n=324)60≤eGFR<90(n=429)P总体eGFR≥90(n=425)60≤eGFR<90(n=459)P年龄/岁75.0±3.873.6±3.176.1±3.9<0.00175.4±3.973.7±3.377.0±3.8<0.001配偶(存活)557(74.0)249(76.9)308(71.8)0.117525(59.4)273(64.2)252(54.9)0.005收缩压/mmHg154.07±21.86152.08±20.24155.58±22.910.044156.75±22.51156.74±21.93156.76±23.060.993舒张压/mmHg82.12±11.5381.34±10.8682.70±11.990.08381.60±11.5181.13±11.0082.03±11.970.376BMI/(kg·m-2)23.76±3.2723.51±3.1823.95±3.330.08424.34±3.7324.17±3.6924.49±3.770.207腰围/cm83.05±10.1482.46±10.2083.50±10.080.16682.93±10.5282.36±10.3183.47±10.690.201糖尿病80(10.6)33(10.2)47(11.0)0.723142(16.0)76(17.9)66(14.3)0.148卒中67(8.9)26(8.0)41(9.6)0.46574(8.4)33(7.8)41(8.9)0.531心肌梗死8(1.1)4(1.2)4(0.9)0.6895(0.6)2(0.5)3(0.7)0.717心力衰竭25(3.3)8(2.5)17(4.0)0.25731(3.5)14(3.3)17(3.7)0.741睡眠时间6.80±1.876.92±1.786.70±1.930.0276.12±1.986.15±1.956.09±2.010.694认知损伤199(26.4)74(22.8)125(29.1)0.052659(74.6)303(71.3)356(77.6)0.033功能依赖37(4.9)15(4.6)22(5.1)0.75469(7.8)26(6.1)43(9.4)0.072抑郁48(6.4)20(6.2)28(6.5)0.844106(12.0)47(11.1)59(12.9)0.412教育水平 文盲150(19.9)52(16.1)98(22.8)718(81.2)347(81.7)371(80.8) 小学301(40.0)134(41.4)167(38.9)0.066122(13.8)54(12.7)68(14.8)0.480 初中及以上302(40.1)138(42.6)164(38.2)44(5.0)24(5.7)21(4.4)吸烟219(29.1)103(31.8)116(27.0)0.15518(2.0)4(0.9)14(3.1)0.027饮酒217(28.8)93(28.7)124(28.9)0.95293(10.5)46(10.8)47(10.2)0.777eGFR88.10±8.6295.45±4.2282.56±6.75<0.00188.24±8.7594.77±3.7782.19±7.63<0.001高TC57(7.6)23(7.1)34(7.9)0.671116(13.1)63(14.8)53(11.6)0.149高TG62(8.2)18(5.6)44(10.3)0.020139(15.7)66(15.5)74(15.9)0.879高LDL-C16(2.1)6(1.9)10(2.3)0.65241(4.6)22(5.2)19(4.1)0.464低HDL-C49(6.5)18(5.6)31(7.2)0.35857(6.5)24(5.7)33(7.2)0.351
1 mmHg=0.133 kPa;eGFR单位为mL/(min·1.73 m2)
老年男性eGFR降低组较eGFR正常组睡眠时间更短[(6.70±1.93)vs(6.92±1.78)h/夜,P=0.027]。不论男女,eGFR降低组较eGFR正常组更年老、高尿酸比例更高。老年男性eGFR降低组收缩压更高,有更高比例的高TG。而老年女性eGFR降低组较eGFR正常组配偶存活百分比更低。
2.2 睡眠时间与eGFR降低的Logistic回归分析
老年男性和女性睡眠时间与eGFR降低的关联分析结果见表2~3。老年男性睡眠时间不足及延长比例分别为45.0%和11.8%,老年女性分别为60.4%和7.6%。Logistic回归分析显示女性睡眠时间不足(≤6 h/夜)及睡眠时间延长均(≥9 h/夜)与eGFR降低的风险不相关,而老年男性睡眠时间不足(≤6 h/夜)与eGFR降低的风险增加相关(OR=1.47,95%CI: 1.06~2.04,P=0.021)。校正配偶存活、吸烟、饮酒、教育水平、BMI、腰围、收缩压、舒张压、高尿酸、糖尿病、高总胆固醇、高三酰甘油、高LDL-C、低HDL-C、脑卒中、心肌梗死、心力衰竭、认知降低、躯体功能依赖、抑郁等一系列协变量后显著性依然存在,提示睡眠时间不足对肾功能降低的影响独立于这些因素而存在。但本研究未发现老年男性睡眠时间眼延长与eGFR降低的风险相关(表2)。
表2 男性睡眠时间与轻度肾功能损伤的Logistic回归分析
Tab.2 Logistic regression analysis of the sleep length and mild renal function impairment among males
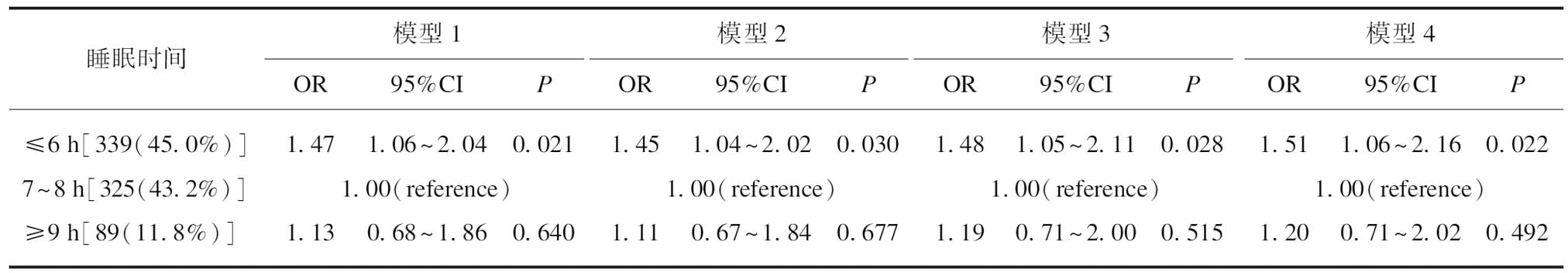
睡眠时间模型1模型2模型3模型4OR95%CIPOR95%CIPOR95%CIPOR95%CIP≤6h[339(45.0%)〛1.471.06~2.040.0211.451.04~2.020.0301.481.05~2.110.0281.511.06~2.160.0227~8h[325(43.2%)〛1.00(reference)1.00(reference)1.00(reference)1.00(reference)≥9h[89(11.8%)〛1.130.68~1.860.6401.110.67~1.840.6771.190.71~2.000.5151.200.71~2.020.492
模型1: 校正年龄;模型2: 模型1基础上校正配偶、吸烟、饮酒、教育水平;模型3: 模型2基础上校正BMI、腰围、收缩压、舒张压、高尿酸、糖尿病、高总胆固醇、高三酰甘油、高LDL-C、低HDL-C、脑卒中、心肌梗死、心力衰竭;模型4: 模型3基础上进一步校正认知损伤、躯体功能依赖、抑郁
表3 女性睡眠时间与轻度肾功能损伤的Logistic回归分析
Tab.3 Logistic regression analysis of the sleep length and mild renal function impairment among females
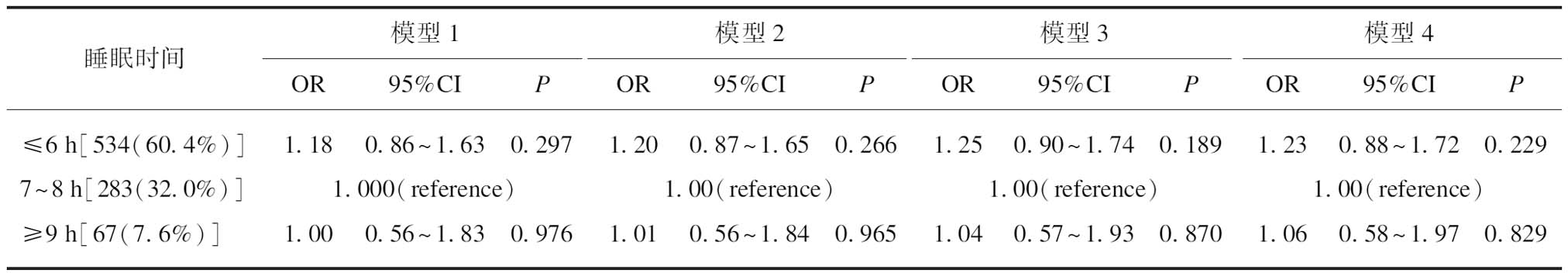
睡眠时间模型1模型2模型3模型4OR95%CIPOR95%CIPOR95%CIPOR95%CIP≤6h[534(60.4%)〛1.180.86~1.630.2971.200.87~1.650.2661.250.90~1.740.1891.230.88~1.720.2297~8h[283(32.0%)〛1.000(reference)1.00(reference)1.00(reference)1.00(reference)≥9h[67(7.6%)〛1.000.56~1.830.9761.010.56~1.840.9651.040.57~1.930.8701.060.58~1.970.829
模型1: 校正年龄;模型2: 模型1基础上校正配偶、吸烟、饮酒、教育水平;模型3: 模型2基础上校正BMI、腰围、收缩压、舒张压、高尿酸、糖尿病、高总胆固醇、高三酰甘油、高LDL-C、低HDL-C、脑卒中、心肌梗死、心力衰竭;模型4: 模型3基础上进一步校正认知损伤、躯体功能依赖、抑郁
3 讨 论
本研究首次报道在中国内地一个社区人群中老年男性慢性睡眠时间不足与eGFR降低的风险增加相关,但未能在老年女性人群中检出此关联,也未发现睡眠时间延长与eGFR降低相关。
短睡眠时间与慢性肾脏病的关联首先在美国社区人群中被报道。Plantinga等[4]在美国国家营养和健康调查(National Health and Nutrition Examination Survey 2005—2008)20岁以上个体中发现短睡眠时间(≤6 h/夜)与轻度CKD[eGFR≥60 mL/(min·1.73 m2)及有蛋白尿]的患病风险增加相关(OR=1.26, 95%CI: 1.04~1.52)。而Sasaki等[17]发现在36~62岁上倒班的日本工人(不是非倒班日本工人)中,短睡眠时间(≤5 h/夜)增加CKD新发CKD[eGFR<60 mL/(min·1.73 m2)])风险。此外,短睡眠时间(≤6 h/夜)还在日本年度体检职员中被发现与发生蛋白尿风险的增加相关[18]。与这些社区及体检人群中观察到的结果类似,在中国农村社区老年人群发现短睡眠时间(≤6 h/夜)与轻度肾功能降低[eGFR<90 mL/(min·1.73 m2)])相关。
睡眠时间不足可能通过激活交感神经系统[19]、升高夜间皮质醇水平[20]、激活内皮素[21]等机制引起慢性肾脏病的发生发展。动物实验证明,睡眠剥夺可导致血压和心率的急性升高,交感神经系统激活,钠潴留增加,葡萄糖代谢的改变。事实上,在一般人群中,睡眠不足与高血压、糖尿病、冠心病等不良后果的风险增加有关,而这些疾病均是肾脏病等风险因素[22-24]。
还有研究报道睡眠时间不足与睡眠时间延长同时与CKD风险增加相关,即睡眠时间长短与CKD的U型相关。Salifu等[5]在18岁以上美国社区人群中发现,睡眠时间≤6 h/夜及≥8 h/夜者自报医生诊断的CKD患病风险增加。在65岁以上而非65岁以下韩国老年社区人群中,≤5 h/夜及≥9 h/夜睡眠时间者出现尿蛋白风险增加[7]。在20岁以上香港社区人群中,≤5 h/夜及≥8 h/夜睡眠时间者新发CKD[eGFR<60 mL/(min·1.73 m2)]风险增加[8]。有意思的是,还有研究发现睡眠时间延长,而非减少与CKD相关。此外,Ye等[25]在中国人糖尿病患者中发现睡眠时间增加与CKD风险。本研究未发现睡眠时间延长与eGFR降低的U型关联,而CKD仅仅与短睡眠相关。不同人群间结果差异的原因尚不清楚。研究人群的差异可能是结果不一致的原因之一。不像睡眠时间过短导致CKD的生物学机制那样易于理解,长睡眠与CKD关联的机制较不清晰,两者的关系可能是双向的。睡眠过长可能是CKD患者中未测量的疾病和状态的症状或结果[6]。
睡眠时间与CKD关联的性别特异性现象值得关注。Choi等[6]仅在韩国发现睡眠时间延长者CKD风险增加仅在女性中存在,男性中却未发现关联。有研究将此解释为睡眠失调对女性的代谢障碍影响更大,进而较男性更影响肾功能[7]。而在本研究老年人群中,仅男性检出睡眠时间减少与eGFR降低关联。男性本身就是CKD的风险因素[26],且CKD的进展在男性中也更快[27]。有研究显示,男性对AngⅡ更敏感,可能放大肾素血管紧张素系统对肾脏降低的效应[28]。因此,睡眠时间不足是否与男性互相作用,从而使男性更加易患肾功能降低,这需要进一步探索。
本研究局限性: 本研究为横断面研究,不能提示睡眠时间不足与肾功能损伤的因果联系。另外,因为现场条件有限,本研究没有测量测蛋白尿,需要在以后的研究中补上。总之,本研究在一个中国内地老年人群中发现睡眠时间不足与男性轻度肾功能降低风险的增加相关,提示保持充足的睡眠对维持老年男性正常肾功能来讲较重要。
[1] GBD MORTALITYAND CAUSESOF DEATH COLLABORATORS. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015[J]. Lancet, 2016,388(10053): 1459-1544.
[2] JHA V, GARCIA-GARCIA G, ISEKI K, et al. Chronic kidney disease: global dimension and perspectives[J]. Lancet, 2013,382(9888): 260-272.
[3] ![]() LU R. Risk factors for chronic kidney disease: an update[J]. Kidney Int Suppl(2011), 2013, 3(4): 368-371.
LU R. Risk factors for chronic kidney disease: an update[J]. Kidney Int Suppl(2011), 2013, 3(4): 368-371.
[4] PLANTINGA L, LEE K, INKER L A, et al. Association of sleep-related problems with CKD in the United States, 2005-2008[J]. Am J Kidney Dis, 2011,58(4): 554-564.
[5] SALIFU I, TEDLA F, PANDEY A, et al. Sleep duration and chronic kidney disease: analysis of the national health interview survey[J]. Cardiorenal Med, 2014,4(3/4): 210-216.
[6] CHOI H, KIM H C, LEE J Y, et al. Sleep duration and chronic kidney disease: the Korean Genome and Epidemiology Study(KoGES)-Kangwha study[J]. Korean J Intern Med, 2017,32(2): 323-334.
[7] YU J H, HAN K, KIM N H, et al. U-shaped association between sleep duration and urinary albumin excretion in Korean adults: 2011-2014 Korea National Health and Nutrition Examination Survey[J]. PLoS One, 2018,13(2): e0192980.
[8] BO Y C, YEOH E K, GUO C, et al. Sleep and the risk of chronic kidney disease: acohort study[J]. J Clin Sleep Med, 2019,15(3): 393-400.
[9] LIU Z Y, WANG Y, ZHANG Y C, et al. Cohort profile: the Rugao longevity and ageing study(RuLAS)[J]. Int J Epidemiol, 2016,45(4): 1064-1073.
[10] KONG X L, MA Y C, CHEN J H, et al. Evaluation of the Chronic Kidney Disease Epidemiology Collaboration equation for estimating glomerular filtration rate in the Chinese population[J]. Nephrol Dial Transplant, 2013,28(3): 641-651.
[11] STEVENS P E, LEVIN A, Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney disease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline[J]. Ann Intern Med, 2013,158(11): 825-830.
[12] LEE M S, SHIN J S, LEE J, et al. The association between mental health, chronic disease and sleep duration in Koreans: a cross-sectional study[J]. BMC Public Health, 2015,15: 1200.
[13] RACHED F, SANTOS R D. The role of statins in current guidelines[J]. Curr Atheroscler Rep, 2020,22(9): 50.
[14] TSUKAMOTO R, AKISAKI T, KURANAGA M, et al. Hasegawa Dementia Scale-revised, for screening of early Alzheimer’s disease in the elderly with type 2 diabetes[J]. Geriatr Gerontol Int, 2009,9(2): 213-215.
[15] LIU Z Y, ZHONG G Z, LI S J, et al. Use of serum albumin and activities of daily living to predict mortality in long-lived individuals over 95 years of age: a population-based study[J]. Age(Dordr), 2015,37(4): 9809.
[16] DENNIS M, KADRI A, COFFEY J. Depression in older people in the general hospital: a systematic review of screening instruments[J]. Age Ageing, 2012,41(2): 148-154.
[17] SASAKI S, YOSHIOKA E, SAIJO Y, et al. Short sleep duration increases the risk of chronic kidney disease in shift workers[J]. J Occup Environ Med, 2014,56(12): 1243-1248.
[18] YAMAMOTO R, NAGASAWA Y, IWATANI H, et al. Self-reported sleep duration and prediction of proteinuria: a retrospective cohort study[J]. Am J Kidney Dis, 2012,59(3): 343-355.
[19] TUREK N F, RICARDO A C, LASH J P. Sleep disturbances as nontraditional risk factors for development and progression of CKD: review of the evidence[J]. Am J Kidney Dis, 2012,60(5): 823-833.
[20] LEPROULT R, COPINSCHI G, BUXTON O, et al. Sleep loss results in an elevation of cortisol levels the next evening[J]. Sleep, 1997,20(10): 865-870.
[21] WEIL B R, MESTEK M L, WESTBY C M, et al. Short sleep duration is associated with enhanced endothelin-1 vasoconstrictor tone[J]. Can J Physiol Pharmacol, 2010,88(8): 777-781.
[22] GRIMALDI D, CARTER J R, VAN CAUTER E, et al. Adverse impact of sleep restriction and circadian misalignment on autonomic function in healthy young adults[J]. Hypertension, 2016,68(1): 243-250.
[23] GANGWISCH J E, HEYMSFIELD S B, BODEN-ALBALA B, et al. Short sleep duration as a risk factor for hypertension: analyses of the first National Health and Nutrition Examination Survey[J]. Hypertension, 2006,47(5): 833-839.
[24] CAPPUCCIO F P, D’ELIA L, STRAZZULLO P, et al. Quantity and quality of sleep and incidence of type 2 diabetes: a systematic review and meta-analysis[J]. Diabetes Care, 2010,33(2): 414-420.
[25] YE Y N, ZHANG L X, YAN W H, et al. Self-reported sleep duration and daytime napping are associated with renal hyperfiltration and microalbuminuria in an apparently healthy Chinese population[J]. PLoS One, 2019,14(8): e0214776.
[26] TAAL M W, BRENNER B M. Predicting initiation and progression of chronic kidney disease: developing renal risk scores[J]. Kidney Int, 2006,70(10): 1694-1705.
[27] COGGINS C H, LEWIS J B, CAGGIULA A W, et al. Differences between women and men with chronic renal disease[J]. Nephrol Dial Transplant, 1998,13(6): 1430-1437.
[28] MILLER J A, ANACTA L A, CATTRAN D C. Impact of gender on the renal response to angiotensin Ⅱ[J]. Kidney Int, 1999,55(1): 278-285.