2型糖尿病(type 2 diabetes mellitus, T2DM)患者轻度认知损伤(mild cognitive impairment, MCI)的发病率明显高于非糖尿病患者[1]。慢性高血糖可导致脑组织微结构及功能发生改变[2];血糖波动可能也是导致MCI的重要因素之一[3]。动物实验发现血糖波动可加重大鼠海马神经元凋亡[4]。海马是学习、记忆等功能重要神经结构,其神经元丢失可能是MCI的神经基础[5]。既往研究将海马作为一个功能整体,探索两者关系,忽略了海马结构与功能的亚区异质性[6-7]。本研究旨在采用基于体素形态学(voxel-based morphometry, VBM)方法[8]对T2DM患者的MR结构像进行分析,探讨海马体积萎缩特点,及血糖波动与海马不同功能分区的相关性。
1 资料与方法
1.1 研究对象与分组
本研究选取2018年10月—2020年9月在复旦大学附属上海市第五人民医院内分泌科住院的T2DM患者92例: 年龄55~75岁,符合2010年中国2型糖尿病防治指南诊断标准且右利手者,均有简易精神状态检查量表(mini-mental state examination, MMSE)评分测试,共有23例患者诊断为T2DM伴MCI,MCI诊断标准: 《2018中国痴呆与认知障碍诊治指南(五): 轻度认知障碍的诊断与治疗》[9]: 存在1个或者多个认知功能领域损害的客观证据,即MMSE评分≥27分为认知功能正常;MMSE评分<27分结合文化程度考虑是否为MCI(文盲>17分,小学>20分,中学(包括中专)>22分,大学(包含大专)>23分)。23例T2DM伴MCI患者中11例因磁共振禁忌证或既往有严重脑血管病史及神经系统疾病史、T2DM急性并发症等因素予以排除: 血管性认知障碍(n=2);严重躯体疾病和烟、酒等物质滥用情况(n=2);抑郁症(n=1);磁共振禁忌证患者(n=2);入院时伴有急性糖尿病并发症,合并急性感染患者(n=2);教育年限<5年者(n=2)。
据此纳入T2DM合并MCI患者12例,男5例,女7例,年龄(68.5±7.3)岁,病程5~10年(中位数6.5年),MMSE评分23~26分(中位数24分)作为T2DM+MCI组;1∶1匹配了无MCI的T2DM患者12例作为对照组(匹配变量为年龄、BMI、糖化血红蛋白、糖尿病病程、教育年限及血压),男6例,女6例,年龄(64.6±4.2)岁,病程5~8年(中位数6.5年),MMSE评分28~30分(中位数29分)。所有患者均签署知情同意书,本研究经复旦大学附属上海市第五人民医院伦理委员会批准〔(2018)伦审(070)〕。
1.2 血糖监测
所有入组患者使用持续葡萄糖检测系统(湖州美奇医疗器械有限公司生产,型号RGMS-1)监测72 h动态血糖,并对采集的数据用系统自动分析软件获得动态血糖指标,包括葡萄糖标准差、有效波动平均幅度、葡萄糖平均值、葡萄糖百分比、葡萄糖最大波动幅度,监测期间不改变既往的降糖方案。
葡萄糖标准差、有效波动平均幅度、葡萄糖最大波动幅度数值越大提示其血糖波动越大;葡萄糖百分比指血糖在某一范围内的时间百分比。
1.3 磁共振影像数据采集及处理
1.3.1 MR高分辨率结构像采集 所有入组患者均完成MR数据采集,采用德国西门子Skyra 3.0T超导MR扫描仪20通道头颈联合相控阵线圈。常规行T2WI、DWI扫描,确定无器质性病变后,进行3D MPRAGE T1WI全脑高分辨率结构像采集。扫描参数: TR=2 300 ms,TE=2.98 ms,TI=900 ms,翻转角=9°,层厚=1 mm,层间隔=0 mm,矩阵为256×256,体素大小为1 mm×1 mm×1 mm。检查注意事项: (1) 橡皮耳塞降低噪声;(2) 泡沫海绵固定头部(减少运动伪影)。
1.3.2 数据处理 为获取海马前后部灰质体积,所有的患者T1高分辨率结构像均采用CAT12工具箱(http:∥www.neuro.uni-jena.de/cat/,版本r1109),其基于MATLAB 2013b和SPM12(http:∥www.fil.ion.ucl.ac.uk/spm/software/SPM12/)进行Dartel组织概率模板对脑组织分割处理,将结构像分割为灰质、白质和脑脊液,使用线性仿射矩阵将T1像配准到蒙特利尔神经科学研究所(MNI)模板上,平滑核为6 mm,最终得到每个受试者的大脑灰质图,进一步根据Fan等[10]的Brainnetome atlas海马分区模板(http:∥atlas.brainnetome.org),将双侧海马分割前部和后部,进行VBM分析。
1.4 统计学方法
组间一般临床资料和MMSE评分的差异比较,采用SPSS 22.0统计软件进行分析,连续变量进行正态性检验后行独立双样本t检验,分类变量行χ2检验。P<0.05为差异有统计学意义。
两组患者海马灰质VBM对比分析: 利用SPM 12软件中的一般线性模型对两组海马灰质密度图进行双样本t检验,以全脑体积、年龄及教育年限作为协变量去除其影响,团块FWE多重比较校正,体素水平P<0.001为差异有统计学意义。利用Dpabi软件(http:∥rfmri.org/)提取T2DM+MCI组海马差异部分的灰质体积值,利用统计学软件SPSS 22.0将灰质体积值与血糖波动性指标及MMSE做线性相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般临床资料及MMSE评分比较
本研究纳入T2DM+MCI组和对照组患者各12例,两组年龄、BMI、糖化血红蛋白、糖尿病病程、教育年限、血压、BMI、空腹血糖、糖化血红蛋白、胆固醇、三酰甘油、高低密度胆固醇、葡萄糖百分比(3.9~10 mmol/L)、葡萄糖百分比(10~13.9 mmol/L)、葡萄糖百分比(<3.9 mmol/L)、葡萄糖平均值、葡萄糖最大波动幅度均无显著性差异(P>0.05)。T2DM+MCI组葡萄糖百分比(>13.9 mmol/L)[(49.3±24.0)% vs (30.4±16.8)%, P=0.027]、葡萄糖标准差[(5.99±1.72) vs (4.03±1.61) mmol/L, P=0.006)]、有效波动平均值[(7.95±3.51) vs (5.67±1.94) mmol/L, P=0.046]、日间血糖平均绝对差[(5.20±3.04) vs (2.89±1.36) mmol/L,P=0.017]、及MMSE评分[(24.2±0.9) vs (29.2±0.2),P<0.001)]显著高于对照组。见表1。
表1 两组患者临床资料及MMSE评分比较
Tab.1 The comparison of clinical data and MMSE scores between the two groups
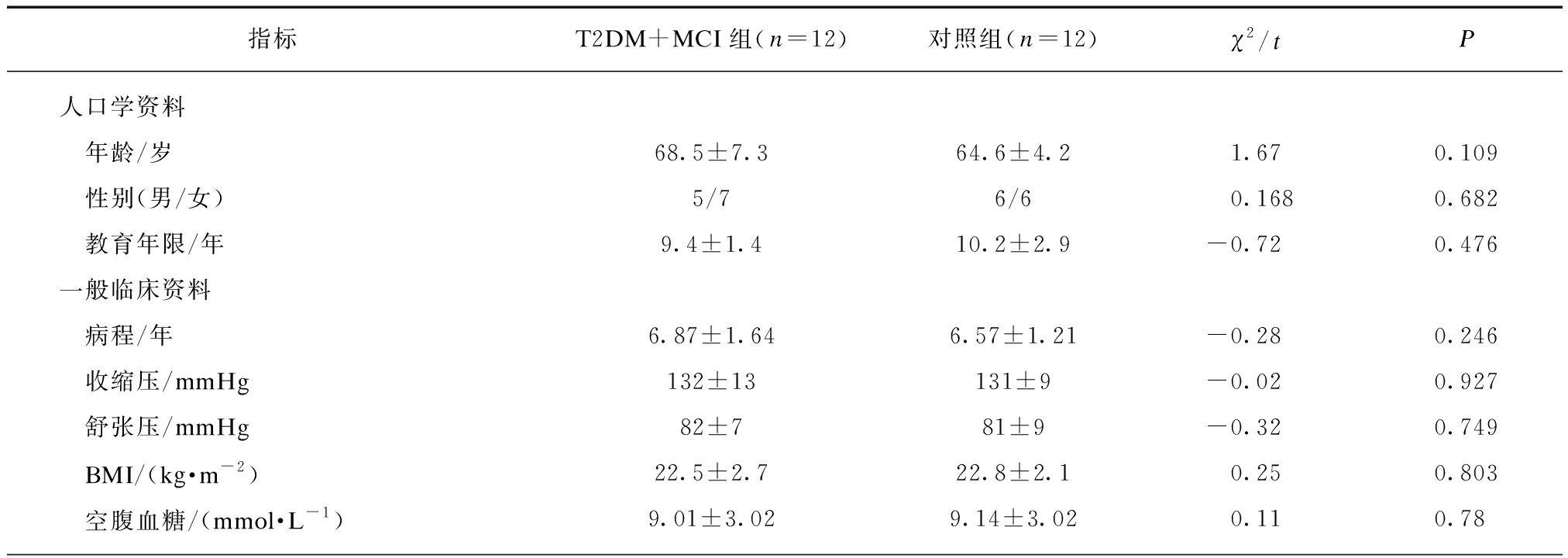
指标T2DM+MCI组(n=12)对照组(n=12)χ2/tP人口学资料 年龄/岁68.5±7.364.6±4.21.670.109 性别(男/女)5/76/60.1680.682 教育年限/年9.4±1.410.2±2.9-0.720.476一般临床资料 病程/年6.87±1.646.57±1.21-0.280.246 收缩压/mmHg132±13131±9-0.020.927 舒张压/mmHg82±781±9-0.320.749 BMI/(kg·m-2)22.5±2.722.8±2.10.250.803 空腹血糖/(mmol·L-1)9.01±3.029.14±3.020.110.78
续表
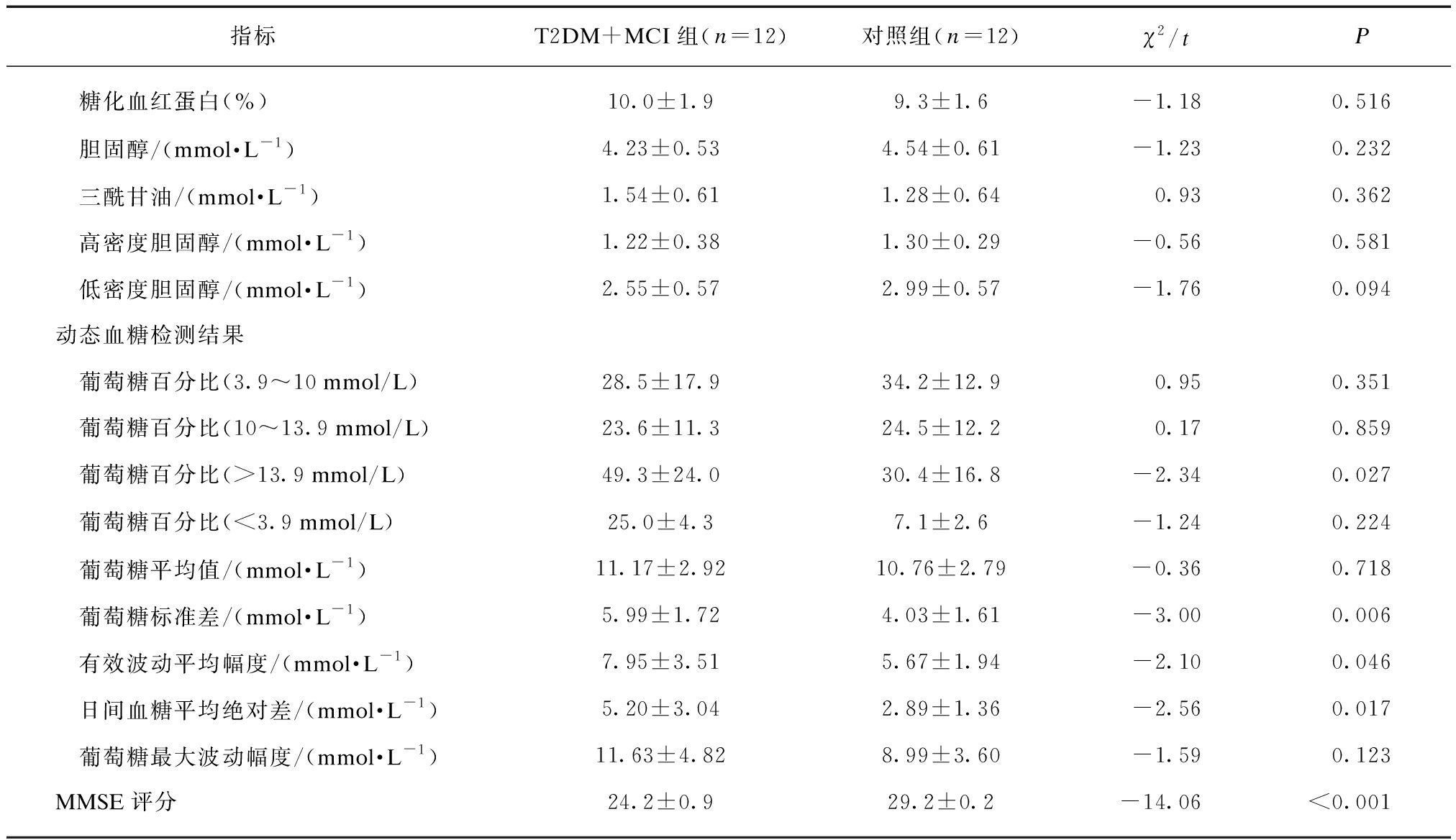
指标T2DM+MCI组(n=12)对照组(n=12)χ2/tP 糖化血红蛋白(%)10.0±1.99.3±1.6-1.180.516 胆固醇/(mmol·L-1)4.23±0.534.54±0.61-1.230.232 三酰甘油/(mmol·L-1)1.54±0.611.28±0.640.930.362 高密度胆固醇/(mmol·L-1)1.22±0.381.30±0.29-0.560.581 低密度胆固醇/(mmol·L-1)2.55±0.572.99±0.57-1.760.094动态血糖检测结果 葡萄糖百分比(3.9~10mmol/L)28.5±17.934.2±12.90.950.351 葡萄糖百分比(10~13.9mmol/L)23.6±11.324.5±12.20.170.859 葡萄糖百分比(>13.9mmol/L)49.3±24.030.4±16.8-2.340.027 葡萄糖百分比(<3.9mmol/L)25.0±4.37.1±2.6-1.240.224 葡萄糖平均值/(mmol·L-1)11.17±2.9210.76±2.79-0.360.718 葡萄糖标准差/(mmol·L-1)5.99±1.724.03±1.61-3.000.006 有效波动平均幅度/(mmol·L-1)7.95±3.515.67±1.94-2.100.046 日间血糖平均绝对差/(mmol·L-1)5.20±3.042.89±1.36-2.560.017 葡萄糖最大波动幅度/(mmol·L-1)11.63±4.828.99±3.60-1.590.123MMSE评分24.2±0.929.2±0.2-14.06<0.001
1 mmHg=0.133 kPa
2.2 海马前后部灰质体积比较
两组患者双侧海马前后部对比结果显示: 与对照组相比,T2DM+MCI组患者双侧海马后部体积明显减小(FWE校正,团块体素数>132,P<0.001),体积减小区域如图1所示;而双侧海马前部体积未见明显变化。
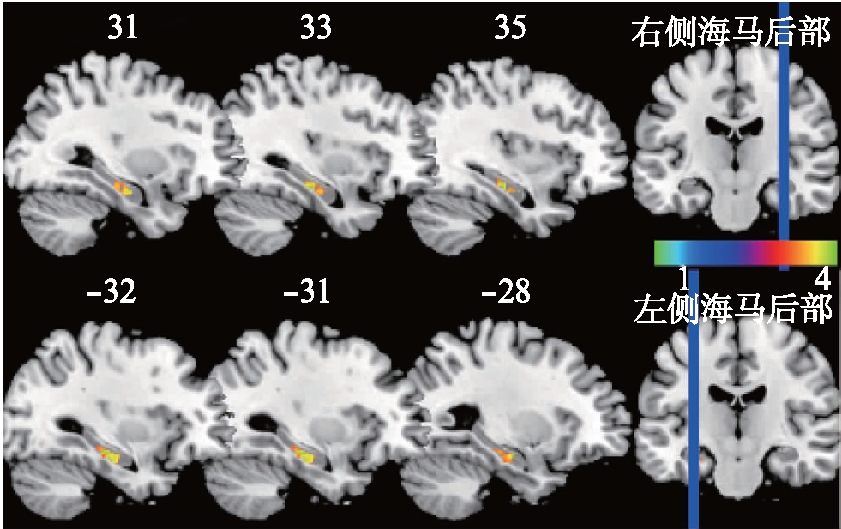
图1 两组间双侧海马后部体积差异图
Fig.1 The volume difference of the bilateral posterior hippocampus between the two groups
T2DM+MCI组患者左侧、右侧海马后部明显减小(FWE校正,团块体素数>132,P<0.001,色阶颜色从左向右提示海马体积萎缩越显著)
2.3 相关性分析
T2DM+MCI组海马后部差异区域的体积和MMSE评分呈显著正相关性(左侧r=0.649,P=0.031;右侧r=0.614,P=0.046),见图2。

图2 T2DM+MCI组患者双侧海马后部体积与MMSE评分相关性
Fig.2 Correlation between volume of bilateral posterior hippocampus and MMSE score in T2DM+MCI group
A: 左侧海马后部与MMSE评分相关性;B: 右侧海马后部与MMSE评分相关性
动态血糖指标与T2DM+MCI组的海马后部差异区域的体积相关分析显示,左侧海马后部与葡萄糖百分比(>13.9 mmol/L)(r=-0.619,P=0.042)、葡萄糖标准差(r=-0.608,P=0.046)、有效波动平均幅度(r=-0.711,P=0.006)和日间血糖平均绝对差(r=-0.610,P=0.043)均呈显著负相关(图3);此外,右侧海马后部与葡萄糖标准差(r=-0.664,P=0.026)、有效波动平均幅度(r=-0.615,P=0.044)和日间血糖平均绝对差(r=-0.701,P=0.004)也均呈显著负相关;与葡萄糖百分比(>13.9 mmol/L)(r=-0.497,P=0.119)无显著相关(图4)。
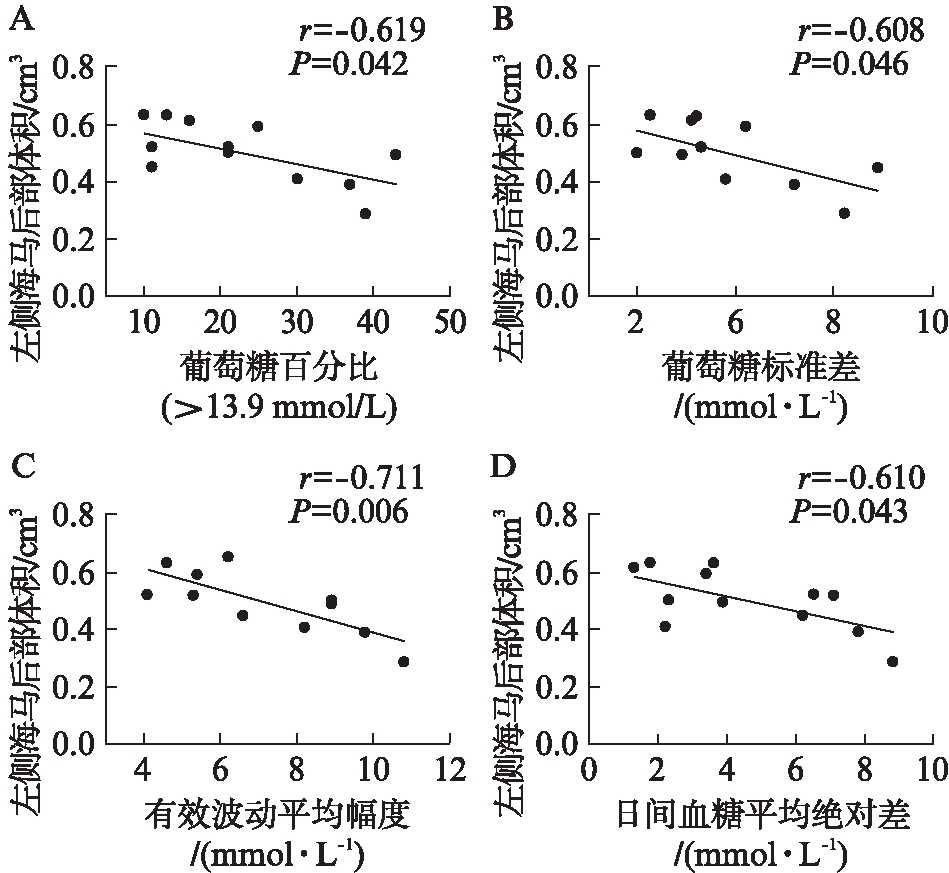
图3 T2DM+MCI组患者左侧海马后部体积与动态血糖指标相关性分析
Fig.3 Correlation between volume of left lateral posterior hippocampus and continuous glucose monitoring index in T2DM+MCI group
A: 与葡萄糖百分比(>13.9 mmol/L)相关性分析;B: 与葡糖糖标准差相关性分析;C: 与有效波动平均幅度相关性分析;D: 与日间血糖平均绝对差相关性分析

图4 T2DM+MCI组患者右侧海马后部体积与血糖波动指标相关性分析
Fig.4 Correlation between volume of right lateral posterior hippocampus and continuous glucose monitoring index in T2DM+MCI group
A: 与葡萄糖百分比(>13.9 mmol/L)相关性分析;B: 与葡萄糖标准差相关性分析;C: 与有效波动平均幅度相关性分析;D: 与日间血糖平均绝对差相关性分析
3 讨 论
T2DM是由于血糖代谢紊乱而导致的全身系统性疾病,中枢神经系统是最易受累的系统之一。认知功能受损是T2DM常见的神经系统症状,主要表现为记忆功能受损,注意能力下降等。糖尿病患者一旦出现认知障碍,即使轻度认知障碍,其血糖管理能力会明显下降,导致血糖难以达标,进而造成恶性循环,严重影响老年人生活质量。有研究发现约13%的T2DM患者认知功能受损,远高于非糖尿病患者[11]。血糖波动对认知功能损伤是不同环节、不同因素共同作用的结果,当前尚缺乏有关血糖波动与认知功能关系的前瞻性研究。血糖波动对认知功能的影响机制尚不明确,其可能机制如下[12-16]: (1) 血 糖急剧的变化会导致脑血流的变化,加重血管内皮的损害,导致T2DM患者认知功能受损越严重;(2) 血糖波动导致的胰岛β细胞受损,胰岛β细胞分泌胰岛素不足,降低了胰岛素对神经的保护作用,尤其影响海马神经元;(3) 血糖波动加剧糖尿病患者炎症介质上调,氧化应激反应加剧;(4) 血糖的快速变化使得神经元周围渗透压发生剧烈波动,加剧海马神经元凋亡。
T2DM患者早期认知功能障碍与海马结构及功能异常有关[17]。海马作为大脑边缘系统的重要组成部分,主要负责学习和记忆及高级认知情感加工功能。本研究发现T2DM+MCI组患者海马体积与T2DM组相比出现了萎缩。近年来,研究报道海马存在着解剖和功能亚分区[18];一项基于大鼠海马神经纤维连接研究发现海马各亚区神经纤维连接了大脑皮层的不同区域[19];有学者采用静息态功能磁共振技术显示了海马前后部与大脑皮层的不同连接方式,将海马根据功能的不同分为了负责情绪、情感调控等功能的前部和负责空间、情景记忆和回忆等功能相关的后部[20-22]。这些研究表明,海马在结构和功能上存在不同的亚区,实现不同的功能可能通过海马体前部和后部两者分工协作完成。Reijmer等[23]认为,T2DM伴MCI患者主要损害短期记忆力能力与学习能力。海马后部主要负责学习记忆能力,本研究结果显示T2DM伴MCI患者海马体积的萎缩主要出现在海马的后部,而前部未见变化。一项针对糖尿病和卒中患者的海马功能亚区研究发现,不同疾病影响海马不同亚区,T2DM患者功能受损区主要位于齿状回[24]。本研究结果发现T2DM+MCI组双侧海马的后部体积与葡萄糖标准差、有效波动平均幅度和日间血糖平均绝对差等血糖波动指标呈明显的相关性。王辉等[4]发现,相较短期血糖高波动性和长期连续性血糖高而言,波动性高血糖比单纯血糖高对海马造成的损伤及功能紊乱更显著。本研究认为T2DM患者血糖波动主要导致海马损伤可能首先发生在后部,而不是整体受损。
本研究同时发现葡萄糖百分比(>13.9 mmol/L)与左侧海马后部体积明显相关,而右侧却不存在显著相关性,可能原因是高血糖对海马的影响首先发生在左侧。在对阿尔茨海默病患者的研究中也发现了这种损伤不平衡性,发现阿尔茨海默病患者左侧脑半球更容易受到损害[25-26]。这一现象可能与右利手有关,右利手患者的左侧海马可能更容易发生缺血和神经元凋亡,但其具体机制尚待进一步研究和阐明。
本研究采用VBM方法分析T2DM患者双侧海马前后部体积改变,发现T2DM患者在出现认知损伤时,较显著萎缩选择性发生在海马后部,萎缩程度与血糖的变异指标具有相关性。因此本研究的发现是对于传统对认知、记忆出现损伤时针对海马整体变化的研究作了一定补充。考虑到本研究样本量相对较小,有一定局限性,因此采用1∶1匹配的病例对照研究,得到的结果相对可靠。后续将进一步扩大样本量并采取纵向变化研究,对解决该问题提供支撑。
[1] LIU S L, LU Y H, CAI X, et al. Glycemic control is related to cognitive dysfunction in elderly people with type 2 diabetes mellitus in a rural Chinese population[J]. Curr Alzheimer Res, 2019,16(10): 950-962.
[2] MORAN C, PHAN T G, CHEN J, et al. Brain atrophy in type 2 diabetes: regional distribution and influence on cognition[J]. Diabetes Care, 2013,36(12): 4036-4042.
[3] BIESSELS G J, DESPA F. Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications[J]. Nat Rev Endocrinol, 2018,14(10): 591-604.
[4] 王辉,蔡月琴,李守业,等.糖尿病血糖波动模型致大鼠海马体的炎性损伤[J].中国比较医学杂志,2013,23(4): 37-43.
[5] GERISCHER L M, FEHLNER A, KÖBE T, et al. Combining viscoelasticity, diffusivity and volume of the Hippocampus for the diagnosis of Alzheimer’s disease based on magnetic resonance imaging[J]. Neuroimage Clin, 2018,18: 485-493.
[6] 李晓丽,章秋,宋宏伟,等.糖尿病患者认知功能与海马结构及其功能变化的相关性研究[J].中国糖尿病杂志,2016,24(9): 792-797.
[7] 赵莲萍,柳瑞芳,陆亚姗,等.2型糖尿病患者海马静息态功能连接研究[J].中国医学影像学杂志,2020,28(7): 482-487.
[8] ASHBURNER J, FRISTON K J. Voxel-based morphometry: the methods[J]. NeuroImage, 2000,11(6 Pt 1): 805-821.
[9] 中国痴呆与认知障碍诊治指南写作组中国医师协会神经内科医师分会认知障碍疾病专业委员会.2018中国痴呆与认知障碍诊治指南(五): 轻度认知障碍的诊断与治疗[J].中华医学杂志,2018,98(17): 1294-1301.
[10] FAN L Z, LI H, ZHUO J J, et al. The human brainnetome atlas: a new brain atlas based on connectional architecture[J]. Cereb Cortex, 2016,26(8): 3508-3526.
[11] AREOSA SASTRE A, VERNOOIJ R W, GONZ LEZ-COLAÇO HARMAND M, et al. Effect of the treatment of type 2 diabetes mellitus on the development of cognitive impairment and dementia[J]. Cochrane Database Syst Rev, 2017,6: CD003804.
LEZ-COLAÇO HARMAND M, et al. Effect of the treatment of type 2 diabetes mellitus on the development of cognitive impairment and dementia[J]. Cochrane Database Syst Rev, 2017,6: CD003804.
[12] TORIMOTO K, OKADA Y, MORI H, et al. Relationship between fluctuations in glucose levels measured by continuous glucose monitoring and vascular endothelial dysfunction in type 2 diabetes mellitus[J]. Cardiovasc Diabetol, 2013,12: 1.
[13] GEIJSELAERS S L C, SEP S J S, CLAESSENS D, et al. The role of hyperglycemia, insulin resistance, and blood pressure in diabetes-associated differences in cognitive performance—the maastricht study[J]. Diabetes Care, 2017,40(11): 1537-1547.
[14] FENG B, HU P, LU S J, et al. Effects of APP 5-mer peptide analogue P165 on the synaptic proteins and insulin signal transduction proteins[J]. Int J Clin Exp Med, 2014,7(3): 549-557.
[15] WHITMER R A. Type 2 diabetes and risk of cognitive impairment and dementia[J]. Curr Neurol Neurosci Rep, 2007,7(5): 373-380.
[16] 李伟,孙娟,殷松楼,等.血糖波动对糖尿病大鼠海马神经元凋亡相关蛋白表达的影响[J].基础医学与临床,2009,29(10): 1065-1069.
[17] 彭丹,李伟,周冬梅,等.2型糖尿病伴急性多发性脑梗死患者焦虑、抑郁情绪与认知功能障碍的相关性[J].中国老年学杂志,2016,36(15): 3711-3712.
[18] DAUGHERTY A M, FLINN R, OFEN N. Hippocampal CA3-dentate gyrus volume uniquely linked to improvement in associative memory from childhood to adulthood[J]. Neuroimage, 2017,153: 75-85.
[19] AGSTER K L, BURWELL R D. Cortical efferents of the perirhinal, postrhinal, and entorhinal cortices of the rat[J]. Hippocampus, 2009,19(12): 1159-1186.
[20] LAZAROV A, ZHU X, SUAREZ-JIMENEZ B, et al. Resting-state functional connectivity of anterior and posterior hippocampus in posttraumatic stress disorder[J]. J Psychiatr Res, 2017,94: 15-22.
[21] LEE J K, FANDAKOVA Y, JOHNSON E G, et al. Changes in anterior and posterior hippocampus differentially predict item-space, item-time, and item-item memory improvement[J]. Dev Cogn Neurosci, 2020,41: 100741.
[22] XU J J, GUAN X J, LI H, et al. Integration and segregation of functional segmented anterior and posterior hippocampal networks in memory performance[J]. Behav Brain Res, 2019,364: 256-263.
[23] REIJMER Y D, VAN DEN BERG E, RUIS C, et al. Cognitive dysfunction in patients with type 2 diabetes[J]. Diabetes Metab Res Rev, 2010,26(7): 507-519.
[24] WU W, BRICKMAN A M, LUCHSINGER J, et al. The brain in the age of old: the hippocampal formation is targeted differentially by diseases of late life[J]. Ann Neurol, 2008, 64(6): 698-706.
[25] 李芸菲,孟凡华,胡绮莉,等.阿尔茨海默病患者选择性损害海马后部的MRI研究[J].同济大学学报(医学版),2020,41(3): 348-352.
[26] DAMOISEAUX J S, SMITH S M, WITTER M P, et al. White matter tract integrity in aging and Alzheimer’s disease[J]. Hum Brain Mapp, 2009,30(4): 1051-1059.