《美国感染病学会2016年更新版念珠菌病处理临床实践指南》(以下简称指南)[1]推荐两性霉素B治疗新生儿侵袭性假丝酵母菌病及假丝酵母菌败血症;未接受过氟康唑预防患者可选氟康唑治疗;新生儿中枢假丝酵母菌感染推荐两性霉素B,氟康唑仅作为初始治疗有效后降阶梯治疗药物。因两性霉素B价格昂贵,容易发生致死性低钾血症和肾毒性等副作用[2],其在国内新生儿真菌败血症的临床应用仍有一定的限制。国内推荐氟康唑为新生儿真菌感染首选[3]。目前新生儿真菌败血症治疗仍具挑战,在中国西部仍有8.7%的病死率[4]。近年来近平滑假丝酵母菌(Candida parapsilosis, C.para)感染逐渐增加,位居假丝酵母菌败血症第2位[5-7],在欧洲、亚洲和南美洲一些医院C.para感染率甚至超过白色假丝酵母菌(Candida albican, C.alb),逐渐成为新生儿重症监护病房重要的真菌感染致病菌。随着极低和超低体重儿的增多,氟康唑预防真菌感染成为新生儿重症监护病房常规,氟康唑在新生儿科临床应用日益增多,耐氟康唑C.para菌株已引起人们重视[8-11]。有报道使用过氟康唑的患者更易发生C.para感染[12]。因此,探讨新生儿近平滑假丝酵母菌败血症(Neonatal Candida parapsilokis sepsis, NCPS)抗真菌药物的选择非常必要。伏立康唑是侵袭性曲霉菌感染的首选药物,但其对假丝酵母菌败血症也有很好的效果[13],新生儿真菌感染使用伏立康唑治疗的研究仍有限[1]。本研究回顾性分析了氟康唑和伏立康唑治疗NCPS的临床效果,以期为NCPS抗真菌药物选择提供参考。
1 资料与方法
1.1 患者来源
选取上海市儿童医院新生儿科2014—2018年收治的NCPS 55例。基本情况见表1。
1.2 新生儿NCPS诊断标准[3,13-14]
(1) 不同部位两份血培养结果均为C.para;(2) 有临床败血症的特点[15],包括体温改变、喂养不耐受、体重不增、呼吸暂停等一项或多项。
1.3 治疗方案[1,3,14]
所有患儿均进行了脑脊液、眼底、骨骼X线、头颅影像学、心超和腹部脏器超声检查。血培养转阴前每3 d复查血培养1次,转阴3 d后再复查1次,连续2次血培养阴性为转阴。用药前均对患儿家属进行了详细告知并签署了知情同意书。氟康唑治疗剂量12 mg/(kg·d)[16],每日1次静脉滴注。伏立康唑治疗剂量: 7 mg/(kg·次),每12小时1次,静脉滴注[17]。2周内血培养转阴者,继续治疗至少2周且所有症状、体征、脑脊液和影像学异常恢复正常停药;满2周未转阴者(从抽血时间开始计算),换为伏立康唑或氟康唑继续治疗,若转阴再继续治疗至少2周,停药指征同前。否则继续更换抗真菌药物,如两性霉素B等。治疗未满2周出现病情进展(发生休克、DIC等)则在积极抗休克、治疗DIC等同时更换为两性霉素B。总疗程3~12周。
1.4 评价标准
包括初始治疗显效和初始治疗不显效。治疗2周内血培养转阴为初始治疗显效;治疗2周血培养持续阳性未转阴或治疗未满2周出现病情进展(包括死亡或病情进展危重家属放弃治疗)为初始治疗不显效。
1.5 研究方法
回顾性分析NCPS治疗情况,根据首选治疗药物分为首选氟康唑治疗组31例和首选伏立康唑治疗组24例,比较两种药物初始治疗显效比例、包括并发中枢感染在内治愈患者整体疗程和病死率。
1.6 统计学方法
采用SPSS 23.0进行统计学分析,非正态分布的计量资料用M(P25,P75)表示,中位数比较采用非参数检验。计数资料用例表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 患儿基本情况
首选氟康唑组和首选伏立康唑组间胎龄、出生体重、入院日龄、发病日龄、性别、分娩方式和胎膜早破、窒息、孕母妊娠期糖尿病和高血压发生比例差异均无统计学意义(P>0.05),见表1。
表1 患儿基本情况
Tab.1 The basic information of patients
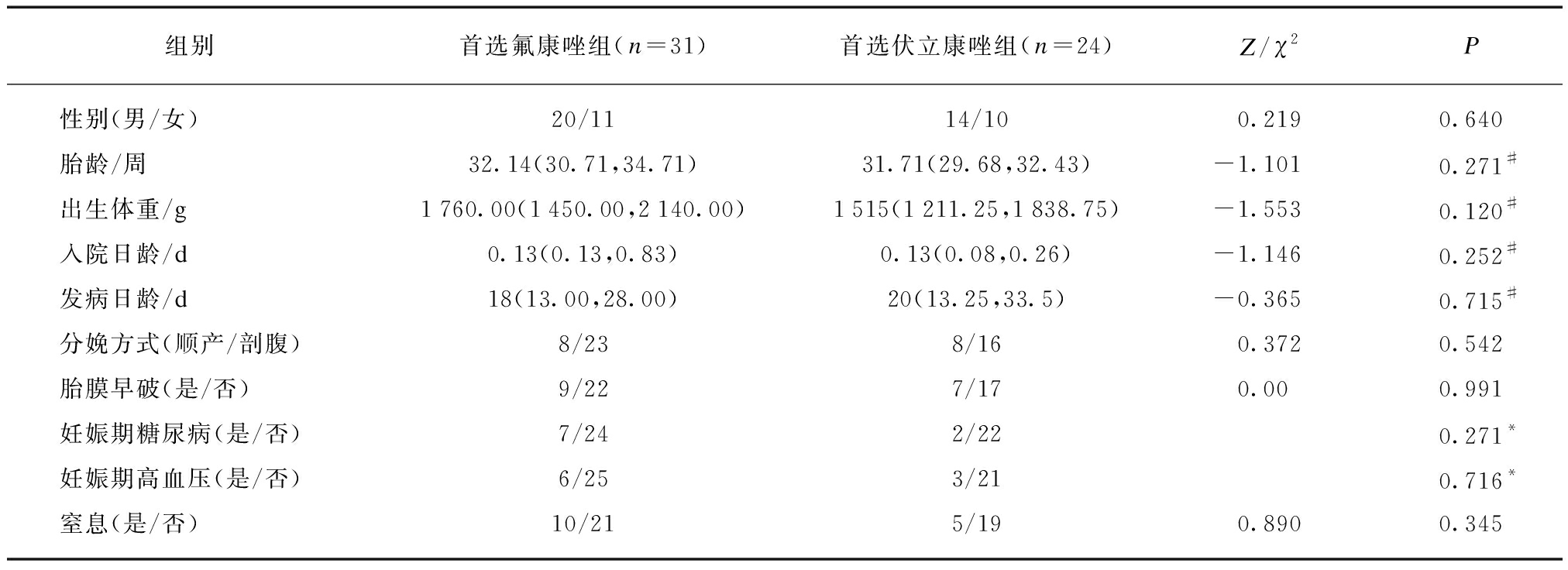
组别首选氟康唑组(n=31)首选伏立康唑组(n=24)Z/χ2P性别(男/女)20/1114/100.2190.640胎龄/周32.14(30.71,34.71)31.71(29.68,32.43)-1.1010.271#出生体重/g1760.00(1450.00,2140.00)1515(1211.25,1838.75)-1.5530.120#入院日龄/d0.13(0.13,0.83)0.13(0.08,0.26)-1.1460.252#发病日龄/d18(13.00,28.00)20(13.25,33.5)-0.3650.715#分娩方式(顺产/剖腹)8/238/160.3720.542胎膜早破(是/否)9/227/170.000.991妊娠期糖尿病(是/否)7/242/220.271*妊娠期高血压(是/否)6/253/210.716*窒息(是/否)10/215/190.8900.345
*为Fisher精确概率,#为非参数检验;计量资料以M(P25,P75)表示
2.2 患儿临床情况
2.2.1 治疗 首选氟康唑组和首选伏立康唑组间抗生素使用时间、静脉营养时间,中心静脉置管比例差异均无统计学意义(P>0.05),见表2。
2.2.2 临床表现 首选氟康唑组和首选伏立康唑组间发热、呼吸暂停、喂养不耐受、腹胀、动脉导管未闭(patent ductus arteriosus, PDA)和新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS)发生比例差异均无统计学意义(P>0.05),见表2。
2.2.3 实验室结果 首选氟康唑组和首选伏立康唑组间血白细胞异常、血小板减少、C反应蛋白(C-reactive protein, CRP)升高、肝功能异常、肾功能异常、头颅影像异常发生比例差异均无统计学意义(P>0.05),见表2。C.para药敏试验氟康唑和伏立康唑均敏感。
2.2.4 合并症 首选氟康唑组和首选伏立康唑组间中枢感染、休克发生比例差异均无统计学意义(P>0.05),见表2。
表2 患儿临床情况
Tab.2 The clinical information of patients
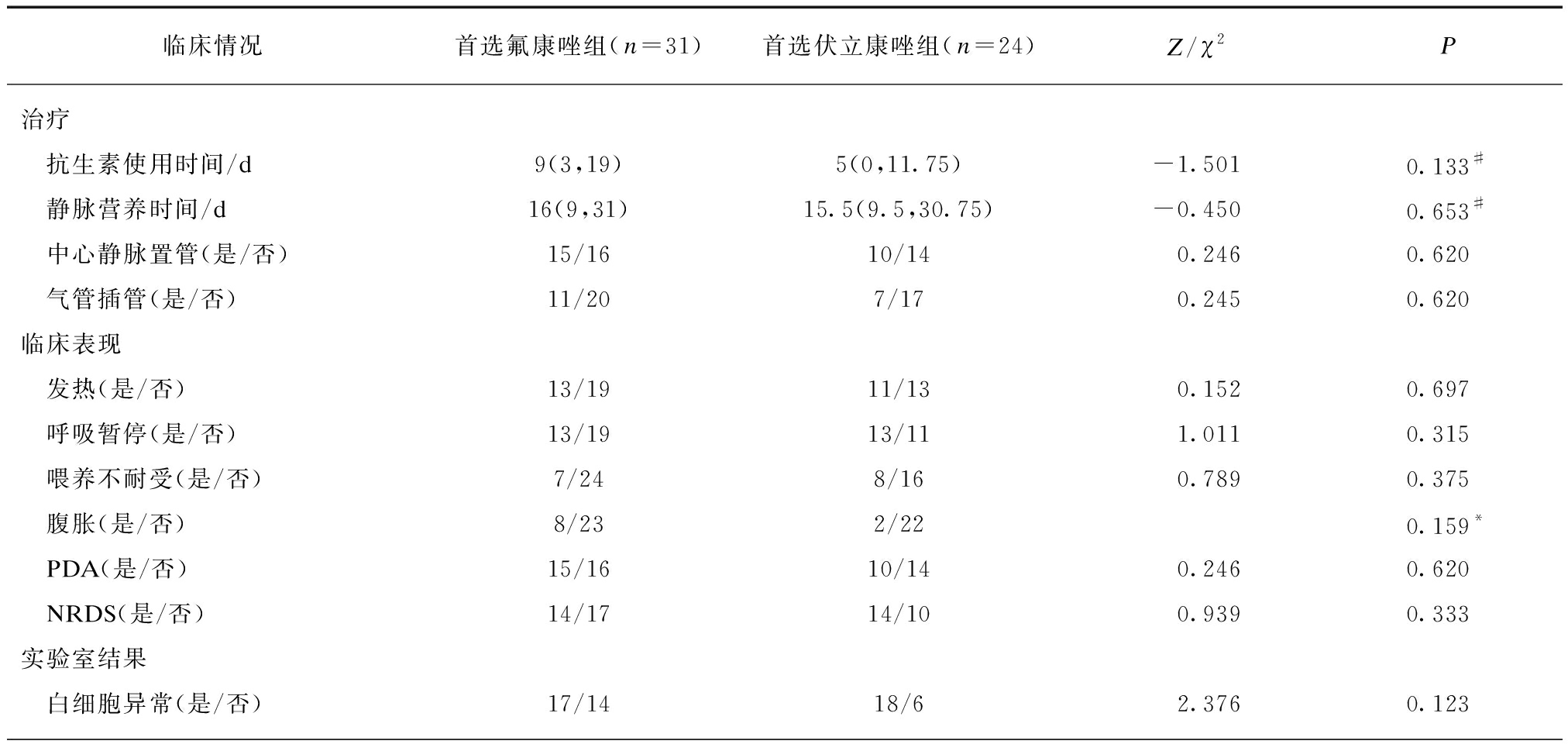
临床情况首选氟康唑组(n=31)首选伏立康唑组(n=24)Z/χ2P治疗 抗生素使用时间/d9(3,19)5(0,11.75)-1.5010.133# 静脉营养时间/d16(9,31)15.5(9.5,30.75)-0.4500.653# 中心静脉置管(是/否)15/1610/140.2460.620 气管插管(是/否)11/207/170.2450.620临床表现 发热(是/否)13/1911/130.1520.697 呼吸暂停(是/否)13/1913/111.0110.315 喂养不耐受(是/否)7/248/160.7890.375 腹胀(是/否)8/232/220.159* PDA(是/否)15/1610/140.2460.620 NRDS(是/否)14/1714/100.9390.333实验室结果 白细胞异常(是/否)17/1418/62.3760.123
续表
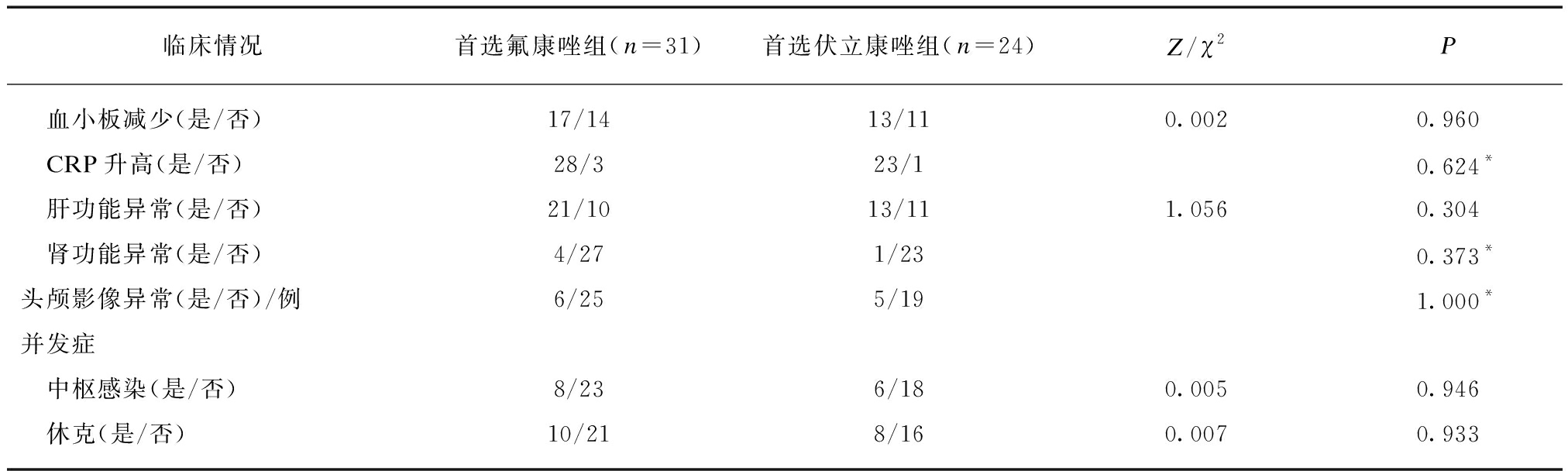
临床情况首选氟康唑组(n=31)首选伏立康唑组(n=24)Z/χ2P 血小板减少(是/否)17/1413/110.0020.960 CRP升高(是/否)28/323/10.624* 肝功能异常(是/否)21/1013/111.0560.304 肾功能异常(是/否)4/271/230.373*头颅影像异常(是/否)/例6/255/191.000*并发症 中枢感染(是/否)8/236/180.0050.946 休克(是/否)10/218/160.0070.933
抗生素时间、静脉营养时间均为发病前的时间,头颅影像异常为发病1周内头颅超声或MRI异常;*为Fisher精确概率,#为非参数检验;计量资料以M(P25,P75)表示
2.3 氟康唑和伏立康唑治疗效果
2.3.1 NCPS氟康唑治疗效果 首选氟康唑治疗31例(包括下文14例中枢感染患者),治愈28例,1例氟康唑治疗10 d因病情进展更换为两性霉素B继续治疗4 d后死亡,2例分别在氟康唑治疗6、8 d后,出现感染性休克和弥散性血管内凝血等病情进展,病情危重,沟通后家属放弃治疗(放弃后均死亡)。首选氟康唑组患者治疗初始显效15例,初始不显效16例。病死率9.68%。首选氟康唑组治愈患者疗程(31.39±12.40) d。28例治愈患者中,15例治疗(6.67±2.19) d(P90=9.6 d)后血培养转阴,明显短于14 d(本科室设定的初始治疗是否显效的界限值)(t=-12.951,P<0.01),疗程(23.13±2.72) d。28例中另外13例治疗至14 d血培养仍持续阳性(以下称需挽救性治疗患者),换为伏立康唑治疗(6.31±2.21) d后血培养转阴(以下称挽救性治疗血培养转阴时间,不包括氟康唑治疗时间),治疗(25.38±10.20) d(以下称挽救性治疗时间,不含氟康唑治疗时间)后治愈,需挽救性治疗患者疗程(氟康唑+伏立康唑前后总疗程)为(40.15±11.31) d。
2.3.2 NCPS伏立康唑治疗效果 首选伏立康唑治疗患者24例,均治愈。初始治疗显效24例,无初始治疗不显效病例,无死亡病例。治疗(7.83±2.41) d后血培养转阴,疗程为(25.83±5.55) d。
2.3.3 NCPS伏立康唑与氟康唑治疗效果比较 首选氟康唑组治疗初始显效比例低于首先伏立康唑组(χ2=6.469,P<0.01);挽救性治疗时间(t=-0.147,P>0.05)和挽救性治疗后血培养转阴时间(t=-1.891,P>0.05)分别与首选伏立康唑治疗组疗程及血培养转阴时间比较,结果差异均无统计学意义;但治愈患者疗程长于首选伏立康唑组(t=2.136,P<0.05)。
2.3.4 NCPS中并发C.para中枢感染患儿氟康唑和伏立康唑治疗效果比较 55例NCPS中,并发C.para 中枢感染14例,未发现有眼底真菌感染,局灶性脓肿灶、骨髓炎和腹膜炎患者。首选氟康唑治疗8例,疗程为(46.38±10.16) d;其中初始治疗显效3例,其疗程为(35.67±2.08) d;初始治疗不显效5例(以下称需挽救性治疗患者),换为伏立康唑继续治疗(38.80±6.38) d(挽救性治疗时间,不包括氟康唑时间)治愈,这些需挽救性治疗患者疗程(氟康唑+伏立康唑前后总疗程)为(52.80±6.38) d。首选伏立康唑治疗组6例,疗程为(33.33±4.46) d,明显短于首选氟康唑组疗程(t=2.919,P=0.013);而与首选氟康唑组挽救性治疗时间比较,差异无统计学意义(t=1.673,P=0.129)。
2.4 药物副作用
治愈病例中未发现皮肤或全身过敏反应,未发生肝肾功能损害或已有肝肾功能损害加重,24例首选伏立康唑和13例伏立康唑营救性治疗患儿整个治疗过程中无眼底检查异常或原有异常加重。
3 讨 论
氟康唑是新生儿包括早产儿侵袭性真菌感染的常用药物[18]。氟康唑主要副作用是肌酐和肝酶升高,发生率为5%[18],其优点则是药物口服后吸收好,口服后不受食物消化、胃液PH和疾病影响,口服生物利用度可达静脉用药的90%。氟康唑和血浆蛋白的结合率低,只有12%,因此更易穿过血脑屏障,在脑和晶体可达血浓度的70%,常用于中枢和眼内感染的治疗[1]。在唾液和肺部的局部浓度可达血液的1.3和1.2倍[19],对这些部位的真菌感染也有很好的效果。另外,氟康唑血浆半衰期长,足月儿血浆半衰期可达70 h,早产儿出生时可达73 h,出生后6 d达53 h,出生后12 d达46 h,其药代动力学特点决定其间断给药也能达到很好预防侵袭性真菌感染的作用[19]。国内将其作为新生儿真菌感染治疗首选药物[3],美国感染病学会2016年更新版《念珠菌病处理临床实践指南》[1]则将其作为未接受氟康唑治疗的假丝酵母菌败血症患儿的备选方案。本研究中首选氟康唑治疗组初始显效15例,初始不显效16例,有效率仅约50%,说明氟康唑对NCPS治疗效果不佳。本研究还发现首选氟康唑组伏立康唑挽救性治疗疗程和首选用伏立康唑组的疗程没有差异,挽救性治疗后血培养转阴时间和首选伏立康唑组也无差异,说明两药前后应用间没有相加效应,表现为无关作用关系[20],进一步说明氟康唑对部分NCPS的治疗无效,表现为治疗失败。尽管氟康唑治疗新生儿真菌感染的报道较多,但有关氟康唑治疗NCPS的报道很少。王欢等[21]报道9例NCPS经氟康唑治疗后治愈7例,死亡1例,放弃1例,治疗有效率要高于本研究,但病例数太少。有关氟康唑治疗成人C.para感染的报道也不多。Liu[8]等报道32例C.para败血症患者,20例接受氟康唑治疗,其余12例接受其他抗真菌药物治疗,结果总共只有20例治愈,治疗有效率不高,也只有大约2/3,与本研究结果不矛盾。
抗真菌治疗失败可能部分与C.para对氟康唑耐药有关[8-11]。Ballot等[22]以氟康唑经验性治疗NCPS 32例,结果发现有16例对氟康唑耐药。氟康唑耐药部分源于其固有的耐药基因[10,23];另一部分则源于获得性耐药机制,即C.para耐药更容易出现于先前用过大扶康或卡泊芬净等抗真菌药物的患者[12,24-26]。虽然本研究体外药敏试验C.para对氟康唑均敏感,但临床表现与体外药敏试验并不总是完全一致[27]。治疗失败除了与耐药机制有关外,还与基础疾病、机体免疫状态、药代动力学和药效动力学等有关[28]。
抗真菌治疗失败判断标准目前尚无共识[28],特别是治疗后进行评估的时间点差异很大[29-30],如Nucci等[28]推荐为抗真菌药物治疗后2周。本研究主要应用血培养结果或病情进展作为初始治疗是否显效的标准,评估时间定在治疗后2周。但本研究发现存活患儿中首选氟康唑初始治疗显效病例血培养转阴时间为(6.67±2.19) d(P90=9.6 d),明显短于14 d,而初始治疗不显效患者14 d时仍然阳性。即从9.6~14 d血培养转阴患者的例数几乎没有太大变化,而且采用伏立康唑挽救性治疗时间和首选伏立康唑治疗时间并无差异。所以将2周作为氟康唑初始治疗显效的判断时间点可能偏长。为了尽可能早地更换抗真菌药物,获得及时有效的治疗,判断疗效的时间有必要缩短,对于氟康唑治疗持续14 d血培养仍阳性的患者提前更换抗真菌药物可能对缩短整体疗程,减少住院时间有益。
伏立康唑是侵袭性曲霉菌感染的首选药物,但其对假丝酵母菌败血症也有很好的效果,研究结果显示伏立康唑治疗非中性粒细胞减少成人假丝酵母菌败血症疗效与两性霉素B继以氟康唑口服疗效相仿[13]。伏立康唑对脑脊液和玻璃体穿透性强[13,31],有利于治疗中枢真菌感染。伏立康唑主要副作用是视觉损害、肝酶升高和皮肤光敏感。因顾虑其副作用多不主张用于2岁以下儿童[2],但临床上新生儿真菌感染伏立康唑治疗并不少见,特别对于难治性真菌败血症新生儿,不少研究发现伏立康唑不仅有效,而且安全[32-34]。2013年,Celik等[32]以伏立康唑治疗17例新生儿侵袭性真菌感染,最终治愈12例,治疗有效率高达70.59%,没有发现相关的副作用。2015年,Atuncu[34]等以伏立康唑成功治愈2例两性霉素B治疗失败的难治性NCPS,未发现相关副作用。本研究中伏立康唑治疗患者24例(包括6例中枢感染),均治愈,亦未发现相关副作用,本研究与上述研究结果一致,说明伏立康唑治疗NCPS有较好的有效性和安全性。
本研究发现首选伏立康唑组NCPS治疗初始显效比例高于首选氟康唑组,成活患者整体疗程短于首选氟康唑组,并发C.para中枢感染患儿疗程也短于首选氟康唑组,病死率明显低于首选氟康唑组,说明伏立康唑在治疗NCPS中可能有一定优势。这种优势可能与伏立康唑较氟康唑对假丝酵母菌有更强的抗菌活性有关[1,13,35];也可能与伏立康唑在新生儿应用较少不易出现耐药株有关。首选伏立康唑可能较氟康唑更适合NCPS的治疗。但伏立康唑在新生儿的临床应用尚缺乏经验,其有效性和安全性仍待进一步明确。
[1] PAPPAS P G, KAUFFMAN C A, ANDES D R, et al. Clinical practice guideline for the management of candidiasis: 2016 update by the infectious diseases society of America[J]. Clin Infect Dis, 2016,62(4): e1-e50.
[2] BERSANI I, PIERSIGILLI F, GOFFREDO B M, et al. Antifungal drugs for invasive Candida infections(ICI) in neonates: future perspectives[J]. Front Pediatr, 2019,7: 375.
[3] 陈超.新生儿真菌感染的诊治[J].中国实用儿科杂志,2011,26(1): 3-6.
[4] FU J J, DING Y L, WEI B, et al. Epidemiology of Candida albicans and non-C.albicans of neonatal candidemia at a tertiary care hospital in Western China[J]. BMC Infect Dis, 2017,17(1): 329.
[5] KUZUCU C, DURMAZ R, OTLU B, et al. Species distribution, antifungal susceptibility and clonal relatedness of Candida isolates from patients in neonatal and pediatric intensive care units at a medical center in Turkey[J]. New Microbiol, 2008,31(3): 401-408.
[6] PFALLER M A, CASTANHEIRA M, MESSER S A, et al. Variation in Candida spp. distribution and antifungal resistance rates among bloodstream infection isolates by patient age: report from the SENTRY Antimicrobial Surveillance Program(2008-2009)[J]. Diagn Microbiol Infect Dis, 2010,68(3): 278-283.
[7] AYDIN F, BAYRAMOGLU G, GULER N C, et al. Bloodstream yeast infections in a university hospital in Northeast Turkey: a 4-year survey[J]. Med Mycol, 2011,49(3): 316-319.
[8] LIU Y, KANG M, YE H, et al. Analysis on clinical characteristics and drug resistance of Candida parapsilosis bloodstream infections in West China Hospital, China, from 2012 to 2015[J]. J Mycol Med, 2018,28(1): 222-226.
[9] CANELA H M S, CARDOSO B, VITALI L H, et al. Prevalence, virulence factors and antifungal susceptibility of Candida spp. isolated from bloodstream infections in a tertiary care hospital in Brazil[J]. Mycoses, 2018,61(1): 11-21.
[10] SANGUINETTI M, POSTERARO B, LASS-FLÖRL C. Antifungal drug resistance among Candida species: mechanisms and clinical impact[J]. Mycoses, 2015,58(Suppl 2): 2-13.
[11] PERLIN D S, SHOR E, ZHAO Y N. Update on antifungal drug resistance[J]. Curr Clin Micro Rpt, 2015,2(2): 84-95.
[12] ALMIRANTE B, RODR GUEZ D, CUENCA-ESTRELLA M, et al. Epidemiology, risk factors, and prognosis of Candida parapsilosis bloodstream infections: case-control population-based surveillance study of patients in Barcelona, Spain, from 2002 to 2003[J]. J Clin Microbiol, 2006,44(5): 1681-1685.
GUEZ D, CUENCA-ESTRELLA M, et al. Epidemiology, risk factors, and prognosis of Candida parapsilosis bloodstream infections: case-control population-based surveillance study of patients in Barcelona, Spain, from 2002 to 2003[J]. J Clin Microbiol, 2006,44(5): 1681-1685.
[13] 中华医学会“念珠菌病诊治策略高峰论坛”专家组.念珠菌病诊断与治疗: 专家共识[J].中国感染与化疗杂志,2011,11(2): 81-95.
[14] 中华医学会重症医学分会.重症患者侵袭性真菌感染诊断与治疗指南(2007)[J].中华内科杂志,2007,46(11): 960-966.
[15] 王暄,任慧娟,唐伦先.脓毒症相关凝血功能障碍的发病机制及诊断进展[J].同济大学学报(医学版),2020,41(4): 523-529.
[16] NELSON J D. 2012-2013 Nelson’s Pediatric Antimicrobial Therapy[M]. Itasca: American Academy of Pediatrics,2012.
[17] HOPE W W, CASTAGNOLA E, GROLL A H, et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: prevention and management of invasive infections in neonates and children caused by Candida spp[J]. Clin Microbiol Infect, 2012,18(Suppl 7): 38-52.
[18] CLERIHEW L, MCGUIRE W. Antifungal therapy for newborn infants with invasive fungal infection[J]. Cochrane Database Syst Rev, 2012(6): CD003953.
[19] SAXÉN H, HOPPU K, POHJAVUORI M. Pharmacokinetics of fluconazole in very low birth weight infants during the first two weeks of life[J]. Clin Pharmacol Ther, 1993,54(3): 269-277.
[20] 沈亮亮,叶元康.氟康唑与5-氟胞嘧啶体外联合抗白念珠菌临床分离株的研究[J].同济大学学报(医学版),2005,26(6): 19-21.
[21] 王欢,肇颖新,金冬梅,等.NICU 9例近平滑假丝酵母菌脓毒血症的临床分析[J].哈尔滨医科大学学报,2018,52(4): 380-382.
[22] BALLOT D E, BOSMAN N, NANA T, et al. Background changing patterns of neonatal fungal Sepsis in a developing country[J]. J Trop Pediatr, 2013,59(6): 460-464.
[23] 刘锦燕,王影,李文静,等.体外氟康唑诱导光滑念珠菌和近平滑念珠菌耐药及相关机制研究[J].诊断学理论与实践,2017,16(5): 510-515.
[24] OXMAN D A, CHOW J K, FRENDL G, et al. Candidaemia associated with decreased in vitro fluconazole susceptibility: is Candida speciation predictive of the susceptibility pattern?[J]. J Antimicrob Chemother, 2010,65(7): 1460-1465.
[25] LORTHOLARY O, DESNOS-OLLIVIER M, SITBON K, et al. Recent exposure to caspofungin or fluconazole influences the epidemiology of candidemia: a prospective multicenter study involving 2 441 patients[J]. Antimicrob Agents Chemother, 2011,55(2): 532-538.
[26] BLANCHARD E, LORTHOLARY O, BOUKRIS-SITBON K, et al. Prior caspofungin exposure in patients with hematological malignancies is a risk factor for subsequent fungemia due to decreased susceptibility in Candida spp.: a case-control study in Paris, France[J]. Antimicrob Agents Chemother, 2011,55(11): 5358-5361.
[27] 王辉,曹彬.真菌体外鉴定和药敏试验的临床意义[J].中华结核和呼吸杂志,2006,29(5): 291-293.
[28] NUCCI M, PERFECT J R. When primary antifungal therapy fails[J]. Clin Infect Dis, 2008,46(9): 1426-1433.
[29] MORA-DUARTE J, BETTS R, ROTSTEIN C, et al. Comparison of caspofungin and amphotericin B for invasive candidiasis[J]. N Engl J Med, 2002,347(25): 2020-2029.
[30] KULLBERG B J, SOBEL J D, RUHNKE M, et al. Voriconazole versus a regimen of amphotericin B followed by fluconazole for candidaemia in non-neutropenic patients: a randomised non-inferiority trial[J]. Lancet, 2005,366(9495): 1435-1442.
[31] null. Pharmacology of systemic antifungal agents[J]. Clin Infect Dis, 2006,43: S28-S39.
[32] CELIK I H, DEMIREL G, OGUZ S S, et al. Compassionate use of voriconazole in newborn infants diagnosed with severe invasive fungal sepsis[J]. Eur Rev Med Pharmacol Sci, 2013,17(6): 729-734.
[33] TURAN O, ERGENEKON E, ![]() LU I M, et al. Combination antifungal therapy with voriconazole for persistent candidemia in very low birth weight neonates[J]. Turk J Pediatr, 2011,53(1): 19-26.
LU I M, et al. Combination antifungal therapy with voriconazole for persistent candidemia in very low birth weight neonates[J]. Turk J Pediatr, 2011,53(1): 19-26.
[34] ALTUNCU E, BILGEN H, SOYSAL A, et al. Successful treatment of Candida parapsilosis fungemia in two preterms with voriconazole[J]. Case Rep Pediatr, 2015,2015: 402137.
[35] OSTROSKY-ZEICHNER L, LASHOF A M L O, KULLBERG B J, et al. Voriconazole salvage treatment of invasive candidiasis[J]. Eur J Clin Microbiol Infect Dis, 2003,22(11): 651-655.