随着二胎政策的放开以及越来越多的女性推迟生育,越来越多高龄患者需要辅助生育,其中最棘手的问题是卵巢低储备(diminished ovarian rese-rve, DOR)。DOR患者因基础卵泡少,通过体外受精(in vitro fertilization, IVF)助孕后需要多次取卵才能获得足够的可移植胚胎。另外,DOR患者常伴随有卵子质量异常、反复胚胎质量差。因此找到可以增加DOR患者卵泡募集及改善胚胎质量的方法,成为临床上亟待解决的问题。
生长激素(growth hormone, GH)在卵巢甾体激素合成和卵泡发育中起重要作用。添加GH协同Gn可增加颗粒细胞上的黄体生成素(luteinizing hormone, LH)受体水平和刺激卵巢芳香化酶的活性,从而改善卵巢对Gn的反应性,促进患者卵泡的募集[1-3]。研究显示,GH与卵母细胞上的GH受体结合,提高卵母细胞中线粒体的活性,提高卵母细胞质量,最终获得更多优质胚胎[4]。临床研究结果显示,在运用GnRH激动剂促排卵的方案中添加GH可以提高卵巢的反应性,从而提高卵泡数量[5]。另有研究显示,在拮抗剂方案促排卵时添加GH也可以增加获卵数及有效胚胎数[6]。研究显示,对DOR患者运用高孕激素状态下促排卵(progestin primed ovarian stimulation, PPOS)方案促排卵,能够有效地抑制其早发LH峰的出现,防止提早排卵,从而为卵泡发育提供更充分的时间,从而获得更多的有效胚胎[7]。既往没有学者对DOR患者采用PPOS方案联合GH控制性促排卵后,是否可以提高卵泡募集及提高胚胎质量的问题进行研究。本研究旨在了解运用PPOS方案对DOR患者促排卵时,添加GH后是否可以增加患者的窦卵泡数、HCG日卵泡数、获卵数及优胚数,以及在哪个年龄段更有效,这对将来GH在临床工作中的应用具有指导意义。
1 资料与方法
1.1 研究对象
回顾性分析2017年11月1日—2019年5月30日于本中心就诊行IVF助孕的DOR患者。
纳入标准: (1) DOR的诊断符合以下3项中任意2项[8]: 基础卵泡刺激素(follicle stimu-lating hormone, FSH)≥10 IU/L;阴道B超提示双侧卵巢窦卵泡计数<7个;2AMH<1.1 ng/mL。(2) 均使用PPOS方案促排卵。(3) 无甲状腺功能减退或亢进等内分泌疾病、肾上腺疾病、下丘脑及垂体病变。(4) 无恶性肿瘤或交界性肿瘤病史。(5) 患者未添加GH周期的取卵时间距离添加GH后的取卵时间间隔不能超过3个月,且间隔时间内患者未进行其他方案促排卵或是运用对卵泡发育有影响的药物(如DHEA等)。(6) 无其他不能耐受妊娠的内外科疾病。(7) 进入促排卵周期前6个月,未使用任何激素类药物或其他影响卵泡发育的药物。
1.2 促排卵方案
所有患者均于月经2~5 d(卵泡发育早期)开始使用尿促性素(HMG,马鞍山丰源制药有限公司)联合安宫黄体酮(MPA,浙江仙琚制药有限公司)促排卵,HMG用药剂量根据患者基础卵泡数、BMI及卵巢反应性决定(用量为75~450 U/d);安宫黄体酮用量根据患者月经2~5 d进入促排卵周期激素六项血值及卵泡发育情况决定,常用量为4、10 mg。促排卵时间为8~14 d。
1.3 研究分组
本研究采用自身对照研究,将同一患者按促排卵周期中是否应用GH以及应用GH的促排卵周期数分组,将未添加GH的促排卵周期纳入A组(对照组,228例);促排卵过程中第1次添加GH的周期纳入B组(治疗组,228例);连续2个促排卵周期均添加GH的纳入C组(治疗组,103例);本研究纳入患者的年龄为25~49岁,根据患者年龄,以5岁为1个年龄层,将A组、B组和C组按各年龄层分为5组,即: <30岁、30~34岁、35~39岁、40~44岁、>45岁,分别对比各年龄阶段用药前和用药后研究指标的差异。
1.4 生长激素添加方法
于月经2~5 d开始运用GH(赛增,长春金赛制药),4 IU隔天皮下注射,直到取卵日,若患者拟下周期继续取卵,则生长激素继续用至下周期取卵日。
1.5 数据收集
1.5.1 HMG及MPA用量 收集患者添加GH前和添加GH后的促排卵周期中HMG用量、MPA用量,对比用药前后HMG及MPA剂量是否存在差异,排除因HMG及MPA用量差异导致的研究结果差异。
1.5.2 基础窦卵泡计数、HCG日卵泡计数 由年资较高,做B超检查经验丰富的同一个主任医师行B超监测卵泡,基础窦卵泡数为月经周期2~5 d进入促排卵周期时的B超计数。HCG日卵泡数,为扳机日B超检测的卵泡数。
1.5.3 获卵数 为取卵日获卵总数。
1.5.4 优质胚胎数 本中心实验室胚胎质量评级系统采用Scott等[9]的评分方法。
胚胎分级分为CP级(致密化胚胎)和Ⅰ~Ⅳ级,胚胎质量由Ⅰ级至Ⅳ级递减,CP级和Ⅰ~Ⅱ级为优质胚胎,Ⅲ级和Ⅳ级为非优质胚胎。
1.6 统计学方法
采用SPSS 25.0系统进行统计学分析,计量资料符合正态分布用![]() 表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
表示,组间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 HMG及MPA用量对比
治疗组和对照组HMG用量、MPA用量差异无统计学意义(P=0.312、0.969,均>0.05),见表1。
表1 HMG和MPA用量
Tab.1 Dosage of HMG and MPA

组别HMG用量/IUMPA用量/mg对照组1227.58±623.7698.82±48.47治疗组1163.36±558.1598.60±56.65P0.3120.969
2.2 A组和B组HCG日卵泡数、获卵数及优质胚胎数比较
B组40~44岁年龄段的HCG日卵泡数、获卵数及优胚数均较A组高(P=0.004、0.000、0.001);B组<30岁及30~34岁年龄段的患者优质胚胎数较A组高(P=0.022、0.014),HCG日卵泡数及获卵数均无差异;B组35~39年龄段及>45岁年龄段患者的HCG日卵泡数、获卵数及优质胚胎数与A组均无差异,见表2。
表2 A组和B组HCG日卵泡数、获卵数及优质胚胎数比较
Tab.2 Comparison of follicle number on HCG day, egg number and quality embryo number between group A and group B
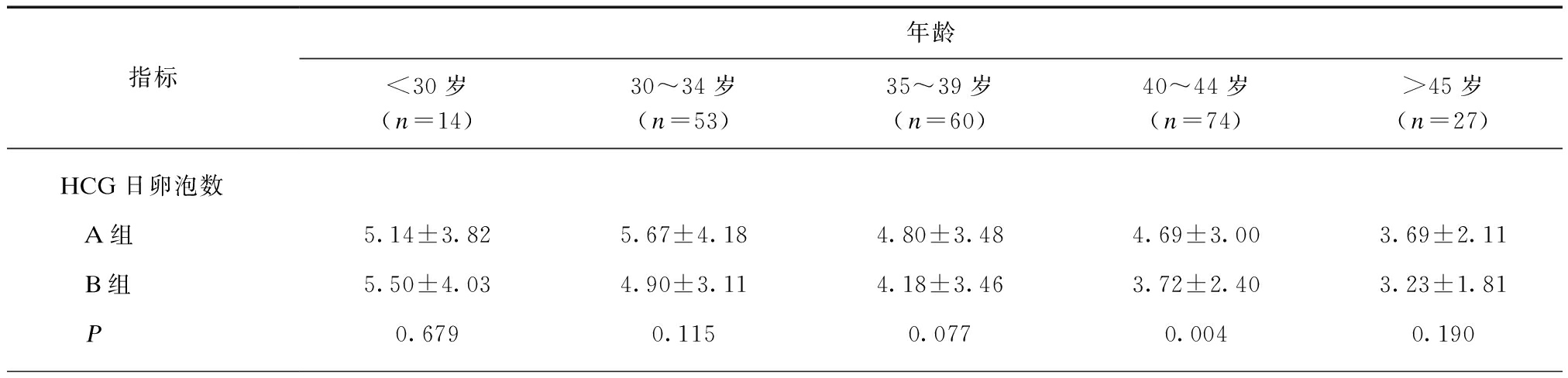
指标年龄<30岁(n=14)30~34岁(n=53)35~39岁(n=60)40~44岁(n=74)>45岁(n=27)HCG日卵泡数 A组5.14±3.825.67±4.184.80±3.484.69±3.003.69±2.11 B组5.50±4.034.90±3.114.18±3.463.72±2.403.23±1.81 P0.6790.1150.0770.0040.190
续表
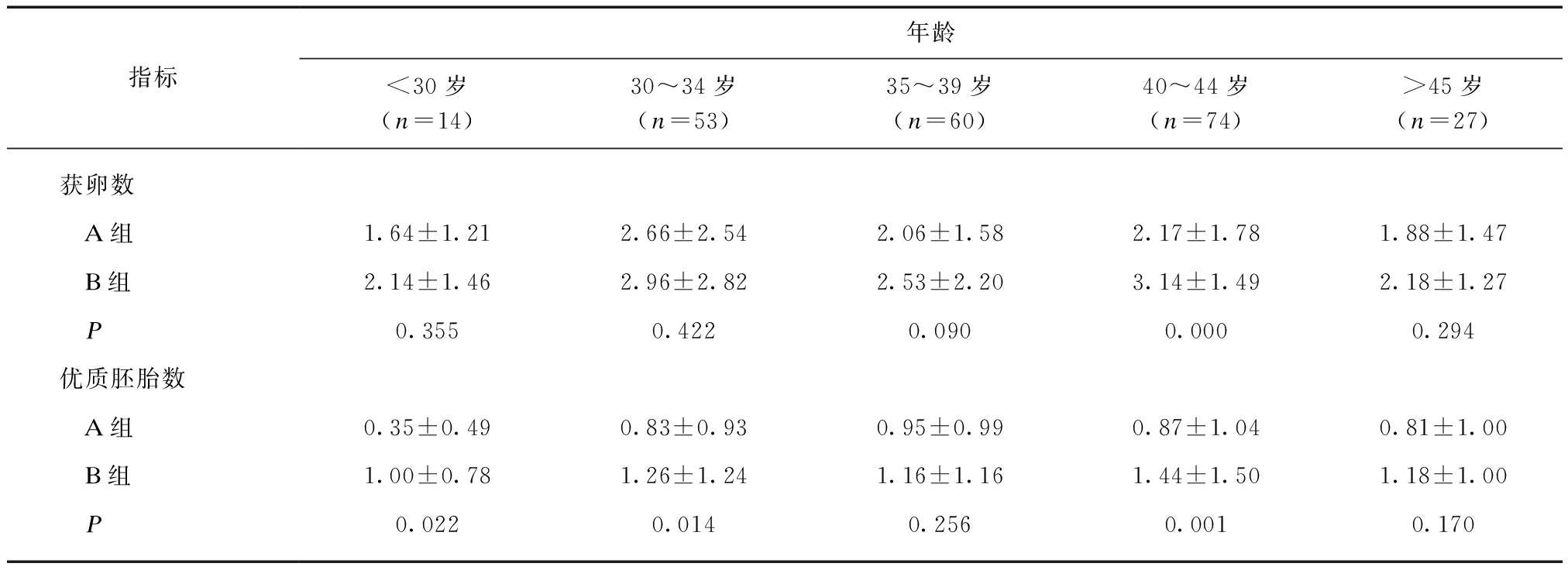
指标年龄<30岁(n=14)30~34岁(n=53)35~39岁(n=60)40~44岁(n=74)>45岁(n=27)获卵数 A组1.64±1.212.66±2.542.06±1.582.17±1.781.88±1.47 B组2.14±1.462.96±2.822.53±2.203.14±1.492.18±1.27 P0.3550.4220.0900.0000.294优质胚胎数 A组0.35±0.490.83±0.930.95±0.990.87±1.040.81±1.00 B组1.00±0.781.26±1.241.16±1.161.44±1.501.18±1.00 P0.0220.0140.2560.0010.170
2.3 A组和C组的基础窦卵泡数、HCG日卵泡数、获卵数及优质胚胎数比较
C组40~44岁年龄段基础卵泡及HCG日卵泡均较A组高(P=0.008、0.010),获卵数及优质胚胎数两组间无差异;C组<30岁及30~34岁年龄段优质胚胎数较A组高,基础卵泡、HCG日卵泡数及获卵数两组间均无差异;C组35~39年龄段及>45岁年龄段患者的HCG日卵泡数、获卵数及优质胚胎数与A组比较均无差异,见表3。
表3 A组和C组的基础窦卵泡数、HCG日卵泡数、获卵数及优质胚胎数比较
Tab.3 Comparison of basal antrum follicles, follicle number on HCG day, egg number and quality embryo number between group A and group C
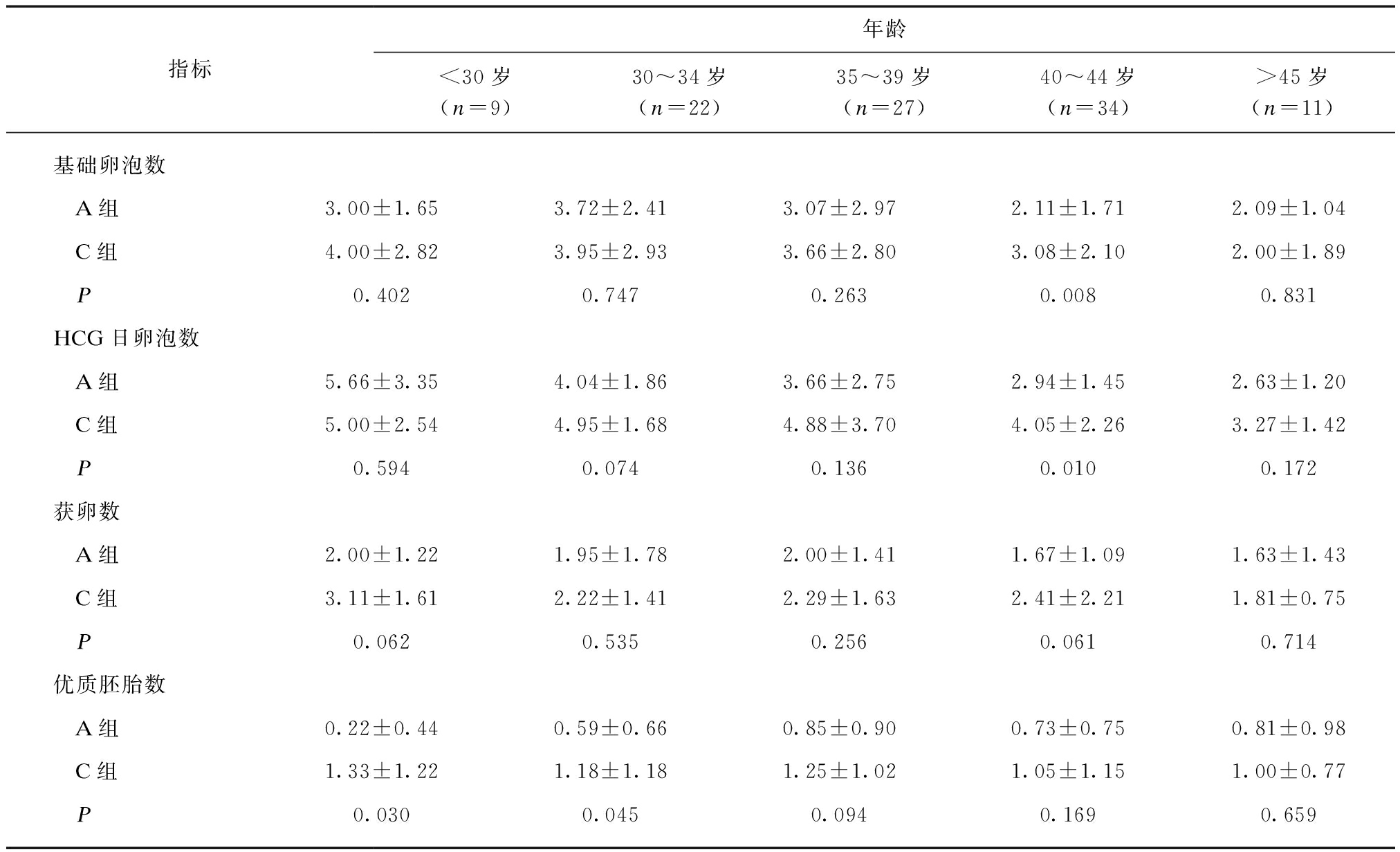
指标年龄<30岁(n=9)30~34岁(n=22)35~39岁(n=27)40~44岁(n=34)>45岁(n=11)基础卵泡数 A组3.00±1.653.72±2.413.07±2.972.11±1.712.09±1.04 C组4.00±2.823.95±2.933.66±2.803.08±2.102.00±1.89 P0.4020.7470.2630.0080.831HCG日卵泡数 A组5.66±3.354.04±1.863.66±2.752.94±1.452.63±1.20 C组5.00±2.544.95±1.684.88±3.704.05±2.263.27±1.42 P0.5940.0740.1360.0100.172获卵数 A组2.00±1.221.95±1.782.00±1.411.67±1.091.63±1.43 C组3.11±1.612.22±1.412.29±1.632.41±2.211.81±0.75 P0.0620.5350.2560.0610.714优质胚胎数 A组0.22±0.440.59±0.660.85±0.900.73±0.750.81±0.98 C组1.33±1.221.18±1.181.25±1.021.05±1.151.00±0.77 P0.0300.0450.0940.1690.659
3 讨 论
生长激素在体内发挥作用有两条途径[10]。第1条途径是通过和靶细胞(如卵巢)上的受体结合,促进细胞分裂和生长;第2条途径是刺激肝脏分泌IGF-1因子,促进大部分的组织生长和细胞分裂。研究显示,GH受体和GH结合蛋白敲除的小鼠,窦卵泡数明显降低,添加IGF-1治疗后窦卵泡数明显增加,从而证实GH通过刺激IGF-1分泌直接或间接的将原始卵泡募集到生长池中,最终增加窦卵泡数量[11]。另有动物研究证实,羊在垂体切除后,2 mm以上的卵泡闭锁,外源性添加促性腺激素后未见卵泡发育,但同时添加GH后可见卵泡发育[12]。由此,证明GH对卵泡发育成熟具有重要作用。线粒体是卵母细胞内重要的产生ATP的器官,线粒体的功能与卵母细胞的质量密切相关[13]。高龄患者线粒体功能下降直接导致了卵母细胞能量匮乏,并进一步影响到卵母细胞的成熟与受精,以及胚胎发育[14]。2010年,Yovich等[15]的研究显示,添加GH可以提高卵母细胞质量,从而提高胚胎的着床率和妊娠率。2015年,Weall等[4]的研究首次揭示人卵母细胞上存在生长激素受体,且较年长女性的卵母细胞的生长激素受体的表达和功能性线粒体数量与较年轻的女性相比明显下降。更有趣的是,对年龄较大的患者进行GH治疗后,其卵母细胞上的功能性线粒体明显增多。由此得出的结论是,GH能通过直接作用方式发挥作用,它可以上调卵母细胞上GH受体的表达,并提高线粒体活性,从而进一步解释了该团队早期研究中观察到添加GH改善卵母细胞质量的现象。
上述研究表明,GH可以增加窦卵泡的募集以及提高卵子质量。因此,本研究将GH运用于DOR患者中,以期能提高患者窦卵泡数,提高卵子质量及优胚数,从而减少患者取卵次数,减少患者IVF助孕时的经济负担。目前很多中心开始在IVF助孕患者促排卵过程中添加GH。Chu等[16]的研究显示,对POR患者应用温和刺激方案联合GH促排卵,可以提高优质胚胎率和妊娠临床率;在拮抗剂方案促排卵时添加GH也可以增加获卵数及有效胚胎数[6]。但并没有学者对应用PPOS方案联合GH促排卵后,IVF助孕患者的窦卵泡数、优质胚数等如何变化,以及在哪个年龄阶段应用GH可以获益更多的问题进行研究。因此,本研究采用PPOS方案对DOR患者进行促排卵,对比添加GH前与添加GH后患者基础窦卵泡数、HCG日卵泡、获卵数及优质胚胎数的变化,结果表明: (1) 添加GH的第1个促排卵周期,在40~44岁年龄段,添加GH后HCG日卵泡数、获卵数及优质胚胎数较添加GH前增加。<35岁 年龄段的患者添加GH后优质胚胎数较添加GH前增加,HCG日卵泡数及获卵数两组间均无统计学差异。(2) 连续添加GH两个促排卵周期后,40~44岁年龄段添加GH后,基础卵泡及HCG日卵泡较添加GH前增加,而获卵数及优质胚胎数两者对比无统计学差异,可能是由于样本量较小的原因。在<35岁年龄段连续添加GH 2个促排卵周期后优质胚胎数较添加GH前增加,基础卵泡、HCG日卵泡数及获卵数两组间均无统计学差异。(3) 35~39岁和>45岁年龄段应用GH前后上述四个指标均无统计学差异。
因此,本研究得出结论: 在应用PPOS方案对DOR患者进行促排卵时,添加GH可以使40~44岁患者窦卵泡数、HCG日卵泡数及优质胚胎数增加,此年龄阶段获益最多。而<35岁患者添加GH后可以提高优质胚胎数量。35~39岁及>45岁年龄组应用GH后未见明显获益。
综上所述,很多研究已证实添加GH可以增加卵泡数目、提高卵子质量及胚胎质量,该结论在动物实验及临床应用中也得到认可。本研究得到相似的结论,并且证明在40~44岁年龄段运用PPOS方案促排卵时,添加GH可以获益更多,<35岁的DOR患者应用GH后可以提高胚胎质量。但各个研究使用GH的剂量及时机不一样也会造成得到的结果不相同。此外,由于样本量有限,还需大样本的前瞻性随机对照实验研究来明确治疗效果。将来为DOR患者PPOS促排卵时,在哪个年龄阶段添加GH可以获得更多的卵子及优质胚胎找到明确方向,添加GH后无明显获益的年龄组尽量避免运用GH,减少患者不必要的用药费用。
[1] HULL K L, HARVEY S. Growth hormone: roles in female reproduction[J]. J Endocrinol, 2001,168(1): 1-23.
[2] HULL K L, HARVEY S. Growth hormone: a reproductive endocrine-paracrine regulator? [J]. Rev Reprod, 2000,5(3): 175-182.
[3] NAKAMURA E, OTSUKA F, INAGAKI K, et al. Mutual regulation of growth hormone and bone morphogenetic protein system in steroidogenesis by rat granulosa cells[J]. Endocrinology, 2012,153(1): 469-480.
[4] WEALL B M, AL-SAMERRIA S, CONCEICAO J, et al. A direct action for GH in improvement of oocyte quality in poor-responder patients[J]. Reproduction, 2015,149(2): 147-154.
[5] SUGAYA S, SUZUKI M, FUJITA K, et al. Effect of cotreatment with growth hormone on ovarian stimulation in poor responders to in vitro fertilization[J]. Fertil Steril, 2003,79(5): 1251-1253.
[6] EFTEKHAR M, AFLATOONIAN A, MOHAMMADIAN F, et al. Adjuvant growth hormone therapy in antagonist protocol in poor responders undergoing assisted reproductive technology[J]. Arch Gynecol Obstet, 2013,287(5): 1017-1021.
[7] KUANG Y P, CHEN Q J, FU Y L, et al. Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J]. Fertil Steril, 2015,104(1): 62-70.e3.
[8] COHEN J, CHABBERT-BUFFET N, DARAI E. Diminished ovarian reserve, premature ovarian failure, poor ovarian responder—a plea for universal definitions[J]. J Assist Reprod Genet, 2015,32(12): 1709-1712.
[9] SCOTT L, ALVERO R, LEONDIRES M, et al. The morphology of human pronuclear embryos is positively related to blastocyst development and implantation[J]. Hum Reprod, 2000,15(11): 2394-2403.
[10] LUCY M C. Growth hormone regulation of follicular growth[J]. Reprod Fertil Dev, 2011,24(1): 19-28.
[11] SLOT K A, KASTELIJN J, BACHELOT A, et al. Reduced recruitment and survival of primordial and growing follicles in GH receptor-deficient mice[J]. Reproduction, 2006,131(3): 525-532.
[12] MARTINS F S, SARAIVA M V, MAGALH ES-PADILHA D M, et al. Presence of growth hormone receptor(GH-R) mRNA and protein in goat ovarian follicles and improvement of in vitro preantral follicle survival and development with GH[J]. Theriogenology, 2014,82(1): 27-35.
ES-PADILHA D M, et al. Presence of growth hormone receptor(GH-R) mRNA and protein in goat ovarian follicles and improvement of in vitro preantral follicle survival and development with GH[J]. Theriogenology, 2014,82(1): 27-35.
[13] EICHENLAUB-RITTER U, WIECZOREK M, LÜKE S, et al. Age related changes in mitochondrial function and new approaches to study redox regulation in mammalian oocytes in response to age or maturation conditions[J]. Mitochondrion, 2011,11(5): 783-796.
[14] 李友筑,颜晓红,吴荣锋,等.序贯培养体系和单一培养体系对人卵母细胞受精和早期胚胎发育的影响[J].吉林大学学报(医学版),2020,46(1): 1-6.
[15] YOVICH J L, STANGER J D. Growth hormone supplementation improves implantation and pregnancy productivity rates for poor-prognosis patients undertaking IVF[J]. Reprod Biomed Online, 2010,21(1): 37-49.
[16] CHU K, PANG W J, SUN N X, et al. Outcomes of poor responders following growth hormone co-treatment with IVF/ICSI mild stimulation protocol: a retrospective cohort study[J]. Arch Gynecol Obstet, 2018,297(5): 1317-1321.