胃癌是我国常见的恶性肿瘤之一[1],其中多数患者初诊时为进展期胃癌。这些患者即使接受手术治疗,其预后仍不理想[2]。研究表明,术前新辅助化疗可有效缩小肿瘤、降期降级、增加R0切除率,从而显著改善患者预后。但肿瘤分期不准确、部分患者对化疗不敏感、肿瘤异质性等可能会使新辅助化疗失败,肿瘤进展并延误手术时机[3]。因此,如何筛选新辅助治疗从而使患者获益,是临床常见问题之一。但现阶段仍缺乏有效预测进展期胃癌患者新辅助化疗疗效的手段。
长链非编码RNA WT1-AS是前期研究筛选出来的候选胃癌抑癌基因[4]。研究表明,WT1-AS在胃癌中表达下调,过表达则显著抑制体内、外胃癌细胞增殖、侵袭、转移。本研究探索WT1-AS预测胃癌患者新辅助化疗之疗效。
1 资料与方法
1.1 一般资料
回顾分析2018年1月—2020年12月同济大学附属东方医院胃肠外科收治的63例行新辅助化疗的进展期胃癌患者的临床资料。所有患者均经内镜活检确诊为胃癌。纳入标准: (1) 年龄>18岁,病理学诊断为胃癌;(2) 符合2018CSCO胃癌指南新辅助治疗原则;(3) 既往未接受任何放化疗;(4) 无明显远处转移;(5) 预计生存时间>1年。排除标准: (1) 合并严重的心、肝和肾等器质性疾病;(2) 合 并远处转移;(3) 既往接受过放化疗、免疫治疗等其他措施。所有患者及其亲属均签署知情同意书,研究符合世界医学会《赫尔辛基宣言》相关要求。
1.2 方法
1.2.1 化疗方案 所有患者术前接受4个周期FLOT方案化疗: 多西他赛50 mg/m2(d1)、奥沙利铂85 mg/m2(d1),亚叶酸钙200 mg/m2(d1),氟尿嘧啶2 600 mg/m2(d1,维持24 h),每2周1次(d1是指第1天用药)。
1.2.2 新辅助疗效评价标准 采用2020年NCCN指南推荐的TRG评分: 0分(完全缓解),1分(接近完全缓解),2分(部分缓解),3分(缓解差或无缓解)。本研究将0~2分定义为有效,3分定义为无效。
1.2.3 细胞培养 胃癌细胞系SGC7901及过表达WT1-AS胃癌细胞SGC7901细胞为实验室保存。使用100 U/mL青霉素、100 μg/mL链霉素以及10%胎牛血清(FBS)的RPMI-1640培养液(Gibco公司),于37 ℃、含5%CO2饱和湿度培养。
1.2.4 qPCR 取术后新鲜胃癌标本组织,使用Trizol(Invitrogen)抽提总RNA,依据说明书使用反转录试剂盒(Promega公司)合成cDNA。按说明使用SBGREEN PCRmaster mix(ABI)进行qRT-PCR,以GAPDH作为内参照。采用相对Ct(threshold cycle)值评估基因的相对表达,2-ΔCt计算mRNA相对表达水平。WT1-AS引物: 5′-GCCTCTCTGTC-CTCTTCTTTGT-3′(正义链), 5′-GCTGTGAGTC-CTGGTGCTTAG-3′(反义链)。GAPDH引物: 5′-TTGGCATCGTTGAGGGTCT-3′(正义链),5′-CAG-TGGGAACACGGAAAGC-3′(反义链)。
1.2.5 细胞凋亡检测 使用Annexin Ⅴ/PI double staining kit(BD biosciences)试剂盒检测细胞凋亡,细胞消化后离心(500×g,5 min),Binding buffer洗脱,加入PI 5 μL、Annexin V 2.5 μL孵育15 min,上机检测。
1.2.6 Western印迹法 采用高效RIPA加蛋白酶抑制剂(北京康为生物科技公司)及磷酸酶抑制剂(CST公司)裂解蛋白,试剂盒测定其浓度(Pierce公司)。蛋白电泳结束后,转印至PVDF膜,5%脱脂奶粉的TBST封闭,一抗孵育过夜,HRP标记二抗孵育2 h(CST公司),超敏发光液(Thermo公司)显影,Tannon机器发光(Tanon公司)。Cleavted caspase3抗体购自CST公司(CST公司),GAPDH抗体购自上海康成公司,兔、鼠二抗购自CST公司。
1.3 统计学方法
采用SPSS 21.0软件进行统计分析。数据以![]() 表示,均数的比较采用t检验,率的比较采用χ2检验,使用多因素Logistic回归分析新辅助疗效的影响因素。P<0.05为差异有统计学意义。
表示,均数的比较采用t检验,率的比较采用χ2检验,使用多因素Logistic回归分析新辅助疗效的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1 新辅助疗效与临床特征相关性
63例纳入患者男34例,女29例,平均年龄(60.7±8.3)岁;Ⅱ期24例,Ⅲ期39例;其中,新辅助治疗有效44例,无效19例。按WT1-AS qPCR中位CT比值(5.26)属WT1-AS高表达26例、低表达37例。如表1所示,新辅助化疗有、无疗效与患者年龄、性别、BMI、肿瘤大小、CEA和淋巴结转移无差异,但与分化程度(χ2=5.377,P=0.020)、TNM分期(χ2=5.740,P=0.017)、WT1-AS表达(χ2=7.287,P=0.007)相关。
表1 胃癌患者新辅助疗效与临床特征相关性
Tab.1 Correlation between neoadjuvant efficacy and clinical characteristics in patients with gastric cancer
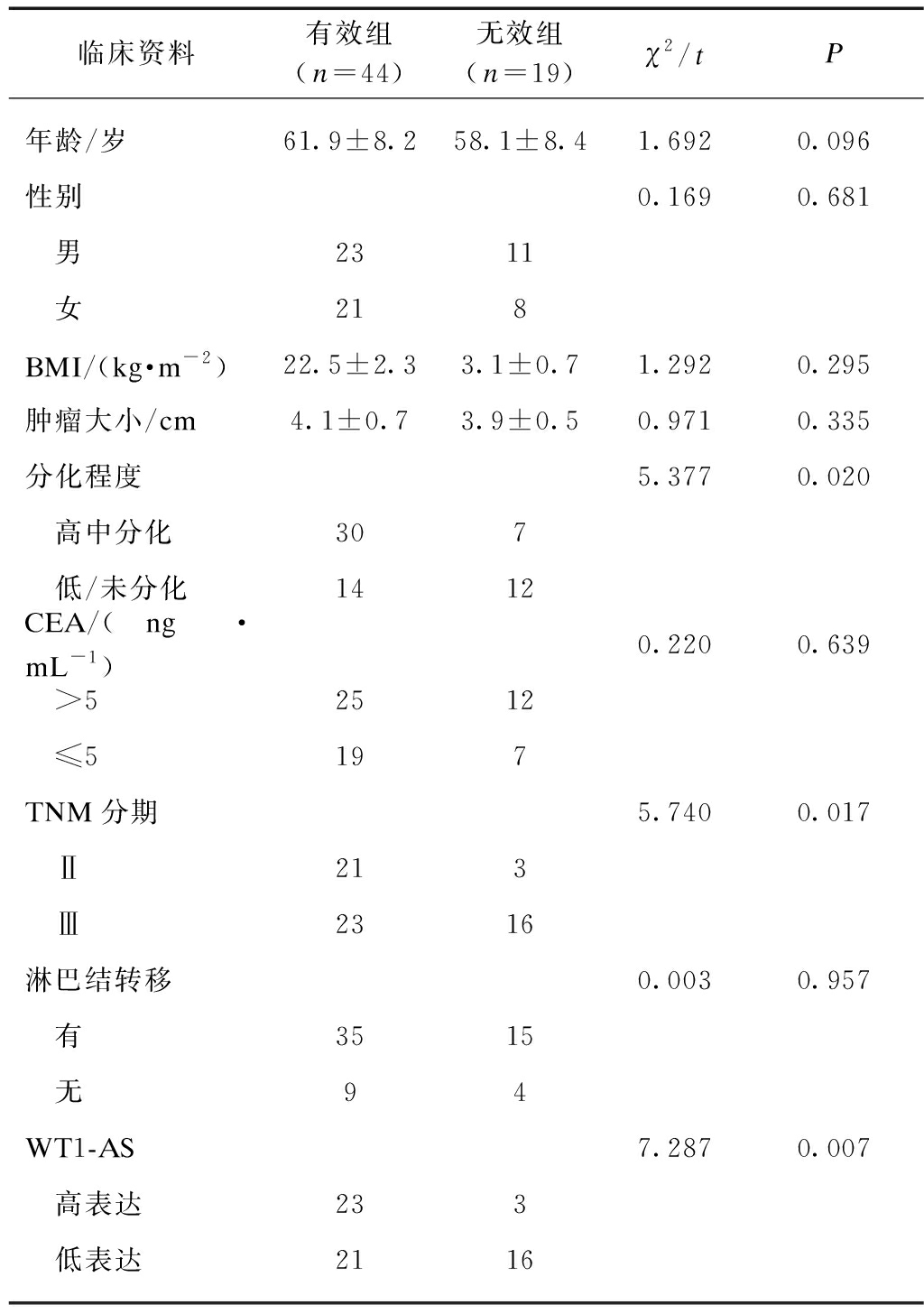
临床资料有效组(n=44)无效组(n=19)χ2/tP年龄/岁61.9±8.258.1±8.41.6920.096性别0.1690.681 男2311 女218BMI/(kg·m-2)22.5±2.33.1±0.71.2920.295肿瘤大小/cm4.1±0.73.9±0.50.9710.335分化程度5.3770.020 高中分化307 低/未分化1412CEA/(ng·mL-1)0.2200.639 >52512 ≤5197TNM分期5.7400.017 Ⅱ213 Ⅲ2316淋巴结转移0.0030.957 有3515 无94WT1-AS7.2870.007 高表达233 低表达2116
2.2 影响胃癌患者新辅助疗效的相关因素
将表1单因素分析有显著意义的变量纳入多因素Logistic回归分析,结果如表2所示,肿瘤分化程度、TNM分期、WT1-AS表达均为化疗有效的独立预测因子)。WT1-AS对应的ROC曲线下面积为0.67(95%CI: 0.529~0.806,P=0.036),灵敏度、特异度分别为52.3%和84.2%,见图1。
表2 影响胃癌患者新辅助疗效的相关因素Logistic回归分析
Tab.2 Logistic regression analysis of related factors affecting neoadjuvant efficacy in patients with gastric cancer
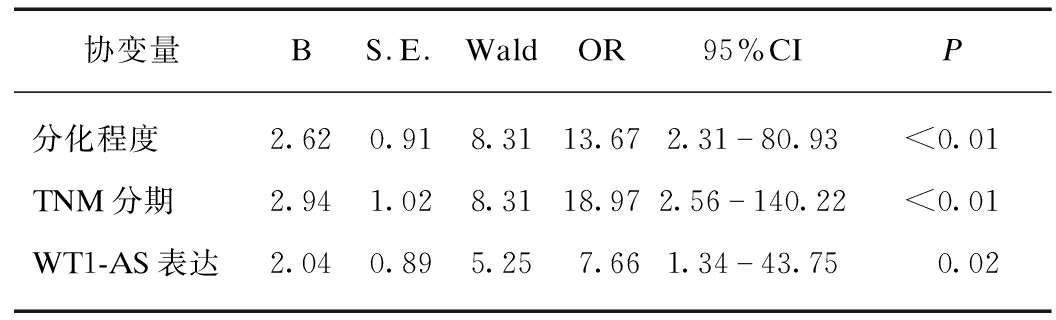
协变量BS.E.WaldOR95%CIP分化程度2.620.918.3113.672.3180.93<0.01TNM分期2.941.028.3118.972.56140.22<0.01WT1-AS表达2.040.895.257.661.3443.750.02
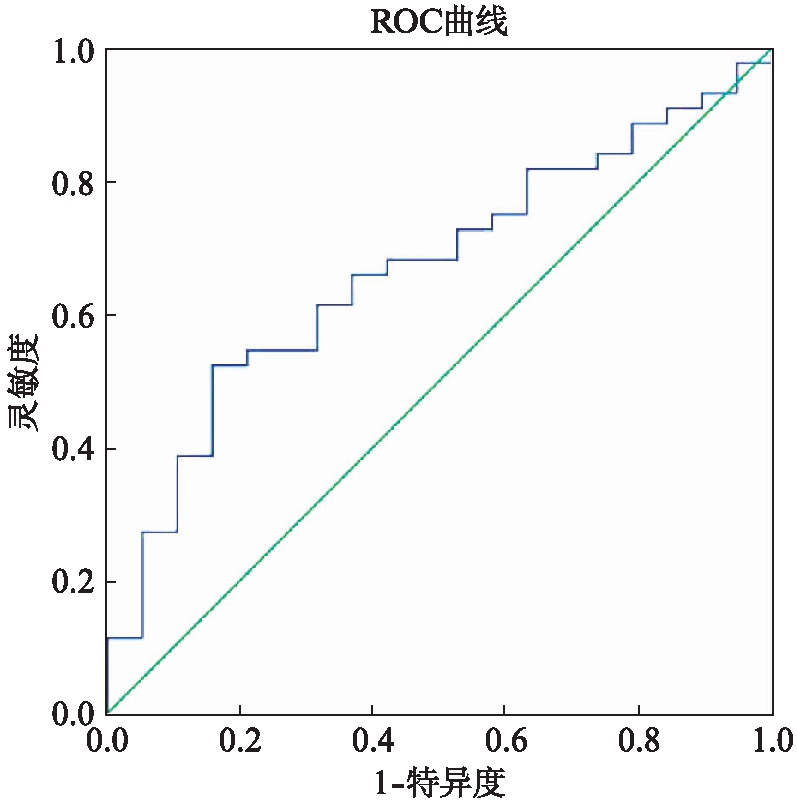
图1 WT1-AS预测新辅助疗效的ROC曲线分析
Fig.1 ROC curve analysis of WT1-AS predicting neoadjuvant efficacy
2.3 WT1-AS促进5-Fu致胃癌细胞凋亡
将不同浓度5-Fu处理48 h的WT1-AS正常表达和过表达的胃癌细胞系SGC7901作凋亡分析,结果如图2所示,随5-Fu(2、4、8 μg/mL)浓度增加,细胞凋亡逐渐增加(P<0.05);WT1-AS过表达组胃癌细胞凋亡百分比高于WT1-AS正常表达组,Western印迹法结果显示过表达组cleaved-3蛋白表达升高。这表明,WT1-AS可促进5-Fu致胃癌细胞凋亡。
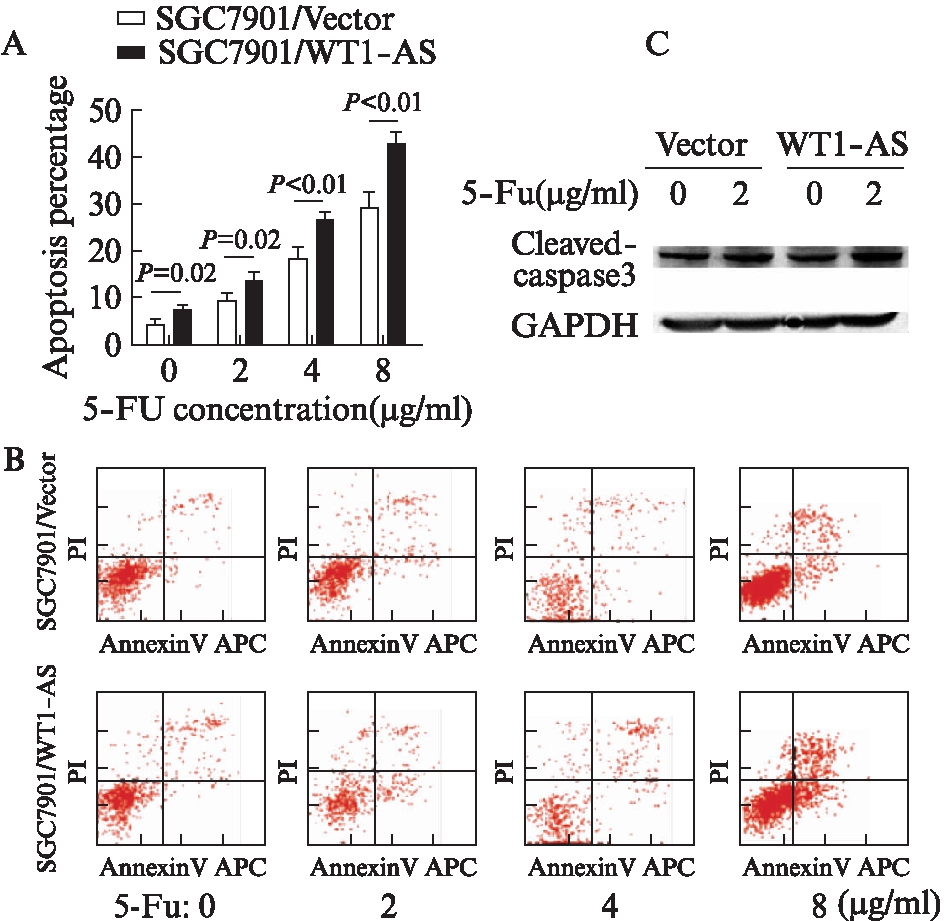
图2 WT1-AS过表达促进5-Fu致胃癌细胞凋亡
Fig.2 Overexpression of WT1-AS promotes apoptosis of gastric cancer cells induced by 5-FU
A: 不同浓度5-Fu处理的WT1-AS正常表达和过表达胃癌细胞凋亡百分比;B: 流式细胞分析凋亡分布图;C: Western印迹法检测凋亡标志物cleaved caspase3表达变化
3 讨 论
胃癌新辅助化疗已被全世界认可,但其疗效仍受诸多因素制约,如术前T分期准确性、化疗药物的选择及敏感性。研究表明,T分期有助于评估新辅助化疗敏感性,并与5年总生存率相关[5]。但增强CT、超声内镜等对术前判断T分期的准确性有限,如CT不易区分肿瘤和化疗后瘢痕,准确率仅为50%左右[6];超声内镜结果易受操作者影响,且难以鉴别T2、T3期肿瘤[7]。据报道,新辅助治疗前患者血清CEA<2.5 g/L可获较高pCR率和肿瘤降期率[8];CEA表达与高pCR率有关,CEA水平是影响pCR的独立因素(OR=2.775,P=0.022)[9]。但这些标志物缺少敏感性、特异度。
近年研究表明,LncRNA可预测肿瘤化疗反应[10-11];生物信息学分析显示BC032585等3个LncRNA与乳腺癌新辅助化疗疗效有关,RAN干扰敲低其表达可上调乳腺癌细胞MDR1表达促进细胞对多种抗癌药物的耐药性[12]。本研究分析了WT-AS表达与胃癌新辅助化疗敏感性的关系,结果表明WT1-AS是新辅助化疗疗效的独立预测因子,WT1-AS高表达预示有较好的化疗反应,提示WT1-AS在进展期胃癌新辅助化疗疗效预测方面可能有潜在价值。
化疗抵抗是胃癌患者化疗治疗失败的主要原因之一,这涉及多种抵抗机制,如肿瘤微环境、药物代谢、DNA修复改变及凋亡基因产物失活等[13]。WT1-AS是一种长链非编码RNA,既往研究表明WT1-AS可抑制胃癌细胞的增殖、迁移,但在化疗中的作用不详。本研究显示,经不同浓度5-Fu处理的WT1-AS过表达胃癌细胞凋亡百分比较高,表明WT1-AS可促进5-Fu致胃癌细胞凋亡,或许提示WT1-AS参与胃癌细胞化疗抵抗是WT1-AS预测进展期胃癌化疗敏感性的可能机制之一。
鉴于本研究上述结果以及研究存在样本量偏小、属回顾性等局限型,如后续能展开大样本、前瞻性深入研究,或许有望使WT1-AS在预测胃癌新辅助化疗疗效方面发挥潜在的临床价值。
[1] Erratum: Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2020,70(4): 313.
[2] 王玮,孙哲,邓靖宇,等.基于多中心大样本数据库的胃癌外科治疗相关数据的整合与分析[J].中华胃肠外科杂志,2016,19(2): 179-185.
[3] ZHOU J C, SHEN J G, SEIFER B J, et al. Approaches and genetic determinants in predicting response to neoadjuvant chemotherapy in locally advanced gastric cancer[J]. Oncotarget, 2017,8(18): 30477-30494.
[4] DU T, ZHANG B G, ZHANG S, et al. Decreased expression of long non-coding RNA WT1-AS promotes cell proliferation and invasion in gastric cancer[J]. Biochim Biophys Acta, 2016,1862(1): 12-19.
[5] WEN B X, ZHANG L N, WANG C T, et al. Prognostic significance of clinical and pathological stages on locally advanced rectal carcinoma after neoadjuvant chemoradiotherapy[J]. Radiat Oncol, 2015,10: 124.
[6] SHIMIZU K, ITO K, MATSUNAGA N, et al. Diagnosis of gastric cancer with MDCT using the water-filling method and multiplanar reconstruction: CT-histologic correlation[J]. AJR Am J Roentgenol, 2005,185(5): 1152-1158.
[7] BLACKSHAW G, LEWIS W G, HOPPER A N, et al. Prospective comparison of endosonography, computed tomography, and histopathological stage of junctional oesophagogastric cancer[J]. Clin Radiol, 2008,63(10): 1092-1098.
[8] DAS P, SKIBBER J M, RODRIGUEZ-BIGAS M A, et al. Predictors of tumor response and downstaging in patients who receive preoperative chemoradiation for rectal cancer[J]. Cancer, 2007,109(9): 1750-1755.
[9] 孙艳武,池畔,徐本华,等.直肠癌新辅助放化疗后病理完全缓解预测因素分析[J].中华胃肠外科杂志,2014,17(6): 556-560.
[10] BAYARMAA B, WU Z P, PENG J, et al. Association of LncRNA MEG3 polymorphisms with efficacy of neoadjuvant chemotherapy in breast cancer[J]. BMC Cancer, 2019,19(1): 877.
[11] SUN M, LIU X X, XIA L Y, et al. A nine-lncRNA signature predicts distant relapse-free survival of HER2-negative breast cancer patients receiving taxane and anthracycline-based neoadjuvant chemotherapy[J]. Biochem Pharmacol, 2021,189: 114285.
[12] ZENG Y, WANG G, ZHOU C F, et al. LncRNA profile study reveals a three-LncRNA signature associated with the pathological complete response following neoadjuvant chemotherapy in breast cancer[J]. Front Pharmacol, 2019,10: 574.
[13] 许玉,程忠平.基于类器官模型的宫颈癌铂类化疗药物敏感性的免疫组化指标分析与探索[J].同济大学学报(医学版),2021,42(1): 68-73.