先天性白内障(congenital cataract, CC)是世界性儿童视力障碍和失明的最常见原因,约四分之一是由遗传缺陷引起的[1]。HSF4(heat shock trans-cription factor 4, HSF4)是热休克转录因子家族的成员[2]。Hsf4基因敲除后,小鼠具有明显的CC表型[3]。
本课题组前期利用Hsf4tm1Xyk基因敲除小鼠对HSF4在白内障发生中的调控作用展开了研究,发现热休克转录因子4b(HSF4b)对波形蛋白(vimentin, VIM)的表达呈现负调控作用[4]。本研究利用Hsf4tm1Xyk基因敲除小鼠模型进一步寻找了HSF4的另一个下游分子αB晶状体蛋白(αB-crystallin, CRYAB),并分析了HSF4b、CRYAB和VIM相互作用的分子机制,旨在为筛选和研发抗白内障药物确定方向。
1 材料与方法
1.1 实验材料及试剂
人晶状体上皮细胞系SRA01/04、pcDNA3.1-HSF4b质粒由中科院健康所孔祥银研究员惠赠;pGL3-Luc、pRL-TK、pTER+载体由中科院健康所金颖研究员惠赠;胎牛血清购自Gibco公司;DMEM/低糖液体培养基、DAPI、多聚甲醛、Triton-X-100均购自Sigma公司;胰酶、青霉素/链霉素购自上海碧云天有限公司;NE-PER核浆分离试剂盒、Light Shift Chemiluminescent EMSA试剂盒、Biotin 3′ End DNA Labeling试剂盒、BCA蛋白定量试剂盒、TRIzol total RNA提取试剂、ECL反应试剂盒、LipofectamineTM2000转染试剂、Dynabeads磁珠均购自Thermo公司;Dual-Luciferase报告基因检测试剂盒购自Promega公司;牛血清白蛋白购自生工生物工程(上海)有限公司;2×Taq PCR Mastermix购自天根生化科技(北京)有限公司;荧光封片剂购自丹麦DakoCytomation公司。
实验中所使用抗αB-crystallin抗体(Ab13497)购自Abcam公司;抗Vimentin抗体(26091)购自New-EastBio公司;抗HSF4b抗体(sc-398645)购自Santa-Cruz公司;Anti-rabbit-Cy3二抗(711-165-152)、Anti-mouse-Cy3二抗(715-165-150)、Anti-rabbit-HRP二抗(711-035-152)、Anti-mouse-HRP二抗(715-035-150)、Anti-goat-HRP二抗(705-035-147)均购自Jackson Immunoresearch Laboratories公司;HRP-con-jugated Beta Actin抗体(HRP-60008)购自Proteintech公司;Alexa Fluor 488 Goat anti-Mouse二抗(A11001)、Alexa Fluor 555 Goat anti-Rabbit二抗(A21429)均购自Invitrogen公司。
1.2 实验动物
Hsf4野生型和Hsf4tm1Xyk基因敲除小鼠由中科院健康所孔祥银研究员惠赠,Hsf4tm1Xyk基因敲除小鼠中Hsf4基因表达功能丧失,不表达HSF4蛋白。本研究严格遵守国家科学技术委员会《实验动物管理条例》、同济大学医学院《实验动物使用和管理条例》及动物伦理学相关条例,并符合美国视觉与眼科学研究学会(ARVO)在眼科研究领域中对动物实验的要求。所有动物操作方法均遵循中国卫生部制定的动物使用规则以及动物福利要求。
1.3 实验方法
1.3.1 SRA01/04细胞培养 使用DMEM/低糖基础培养基,添加10%的胎牛血清和1%的青霉素-链霉素双抗,在37 ℃、5%CO2的恒温培养箱中培养人SRA01/04细胞,细胞传代采用0.05%的胰蛋白酶消化,2 d传代1次。
1.3.2 qPCR 使用TRIzol裂解液裂解组织,抽提RNA,反转录成cDNA,用实时荧光定量PCR检测各基因mRNA的表达,相对表达量根据2-ΔΔCt方法进行数据分析。定量PCR引物见表1。
表1 qPCR引物序列
Tab.1 Primer sequence for qPCR
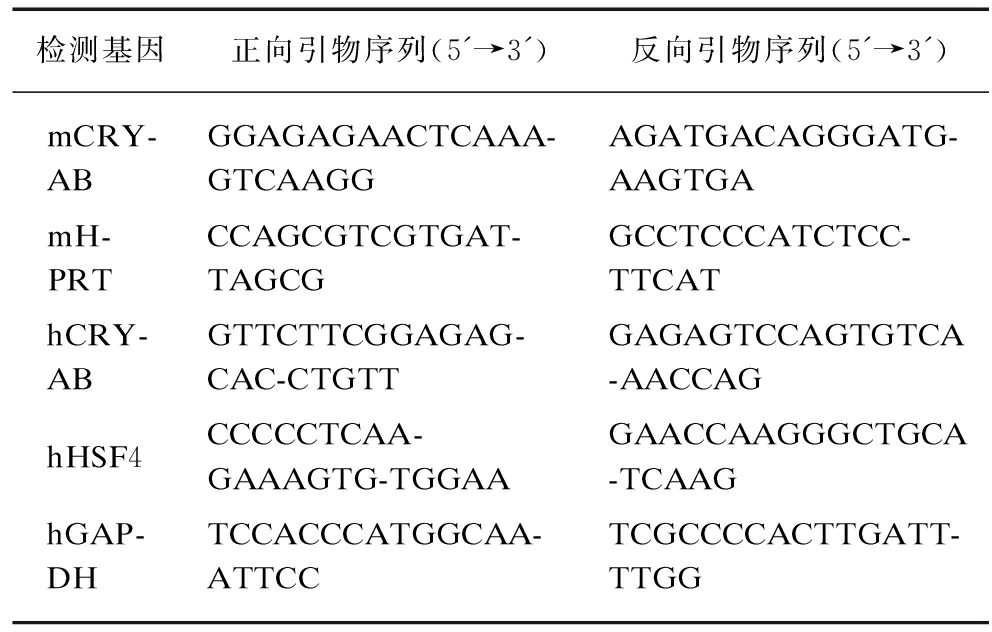
检测基因正向引物序列(5'→3')反向引物序列(5'→3')mCRY-ABGGAGAGAACTCAAA-GTCAAGGAGATGACAGGGATG-AAGTGAmH-PRTCCAGCGTCGTGAT-TAGCGGCCTCCCATCTCC-TTCAThCRY-ABGTTCTTCGGAGAG-CAC-CTGTTGAGAGTCCAGTGTCA-AACCAGhHSF4CCCCCTCAA-GAAAGTG-TGGAAGAACCAAGGGCTGCA-TCAAGhGAP-DHTCCACCCATGGCAA-ATTCCTCGCCCCACTTGATT-TTGG
m: 小鼠;h: 人类
1.3.3 Western印迹法 取小鼠晶状体组织,用RIPA裂解液充分裂解后,进行BCA定量和蛋白质变性。得到的蛋白质提取物用10% SDS-聚丙烯酰胺凝胶上样并经SDS-PAGE电泳后转移到0.45 μm的PVDF膜上。在5%脱脂牛奶中封闭1 h后,分别加入一抗,4 ℃孵育过夜。洗膜后加入相应种属的二抗,室温孵育1 h。ECL显影采集蛋白条带图,并使用Image J软件进行条带分析,以β-actin作为内参,对条带的灰度值进行半定量分析。
1.3.4 免疫荧光染色 取小鼠晶状体组织并用4%多聚甲醛固定后进行冰冻切片,或收集SRA01/04细胞爬片。室温下,用0.25%(细胞用0.1%)的Triton-X-100通透细胞膜10 min,加入2%牛血清蛋白室温封闭30 min,再加入一抗,4 ℃孵育过夜。洗去一抗后加上荧光二抗,室温孵育1 h。加入DAPI标记细胞核后,用封片剂封片。用徕卡SP8激光共聚焦显微镜观察并拍照。
1.3.5 凝胶迁移电泳实验 提取核蛋白后,按照BCA定量法检测蛋白含量,来自人αB-晶状体蛋白(αB-crystallin, CRYAB)基因的野生型探针5′-TGACATCACCATTCCAGAAGCTTCACAAGA-3′,用生物素3′末端DNA标记试剂盒标记。在25 ℃结合缓冲液中结合反应20 min。对于竞争性分析,添加额外的400倍摩尔过量的未标记野生型探针或平行突变探针5′-TGACATCACCATTACATAAGCTT-AACAAGA-3′。对于HSF4b的EMSA分析,加入HSF4b抗体,每次反应2 μL。DNA蛋白质复合物在4%非变性聚丙烯酰胺凝胶中通过电泳分离,然后将DNA-蛋白质复合物转移到尼龙膜上,交联,化学发光法检测。
1.3.6 质粒构建 通过PCR扩增CRYAB启动子DNA。正向引物为5′-TAGATCAGCTCAGGGTT-CCA-3′,反向引物为5′-CGAAGAACTGGTCGAA-3′。将聚合酶链式反应产物亚克隆到pGL3-Luc质粒中,酶切位点为NheI/XhoI得到CRYAB启动子驱动的荧光素酶活性的pGL3-CRYAB-Luc质粒,并测序验证。HSF4b敲减使用pTER+载体,shRNA靶序列如下5′-AGTATTTCAAGCATAGCAA-3′。
1.3.7 染色质免疫共沉淀 SRA01/04细胞过转HSF4b质粒后,用1%甲醛室温交联,加入终浓度为125 mmol/L的甘氨酸以终止交联反应。收集细胞,加入细胞裂解缓冲液,置于冰上10 min后离心(离心半径8 cm,5 000 r/min,5 min),弃上清液后得到细胞核沉淀。加入细胞核裂解缓冲液,将染色质超声至平均长度为0.5~2 kb,离心后(离心半径8 cm,12 000 r/min,15 min)取上清液,留1/10作为样品内参。用稀释缓冲液10倍稀释,经1 mg/mL BSA和0.1 mg/mL ssDNA处理的protein A sepharose预清除后,加入对照IgG或识别特异目的蛋白的抗体在4 ℃混合旋转孵育过夜。加入经1 mg/mL BSA和0.1 mg/mL ssDNA处理的protein A sepharose沉淀蛋白-染色质复合物,孵育2 h,洗涤后用10% Chelex-100 beads水溶液95 ℃变性10 min,离心(离心半径8 cm,12 000 r/min,5 min)获得俘获的DNA。通过PCR扩增分析免疫沉淀的DNA片段,正向引物为5′-CGCGCGTGCCTGCTTGGGATTC-3′,反向引物为5′-GAGCGGCTGGGGGGAGTGGA-3′。
1.3.8 双报告荧光素酶检测试剂盒检测荧光素酶活性 将SRA01/04细胞接种在24孔板中,用不同定量的pcDNA3.1-HSF4b(0~400 ng,不足用pc-DNA3.1补齐)、pGL3-CRYAB-Luc(250 ng)和pRL-TK(10 ng)共转染。24 h后,根据试剂盒说明书,用双荧光素酶分析系统分析细胞裂解物,相对荧光素酶活性由pRL-TK活性标准化,用其比值代表转录因子的活性。
1.3.9 免疫共沉淀 将Dynabeads G磁珠预先包被鼠源IgG、鼠源抗Vimentin抗体,清洗待用;用RIPA充分裂解晶状体,离心后(离心半径8 cm,12 000 r/min,10 min)取上清液,用BCA法进行蛋白定量调浓度至1 mg/mL,留取1/10总晶状体蛋白作为样品内参,其余样品分两组加入预包被磁珠中,室温交联1 h,清洗蛋白质结合的磁珠,再洗脱蛋白质,将上样样品变性后,进行Western印迹法分析,使用抗CRYAB抗体作为一抗进行检测。
1.4 统计学方法
采用Image J对图像进行数据分析。所有定量实验至少重复3次。图中数据表示为![]() 统计学比较采用t检验。P<0.05为差异有统计学意义。
统计学比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB表达下调
CRYAB是晶状体的主要结构蛋白,对维持晶状体的透明发挥着重要的作用。本实验中,首先检测Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB的表达情况。通过Western印迹法检测发现,8周龄Hsf4tm1Xyk基因敲除小鼠的晶状体中,CRYAB表达显著下调(P<0.05),并且mRNA水平的变化与蛋白的变化相一致(P<0.05),见图1A、B。考虑到白内障发病的时程等因素可能的影响,对出生后1 d小鼠晶状体的CRYAB表达水平也进行了检测。结果表明,无论在蛋白水平(P<0.05)还是mRNA水平(P<0.05),Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB的表达都显著下调(图1C、D)。同时,免疫荧光结果显示(图1E),CRYAB在出生后1 d的Hsf4tm1Xyk基因敲除小鼠晶状体中表达已经明显减少。以上结果表明,Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB表达下调。
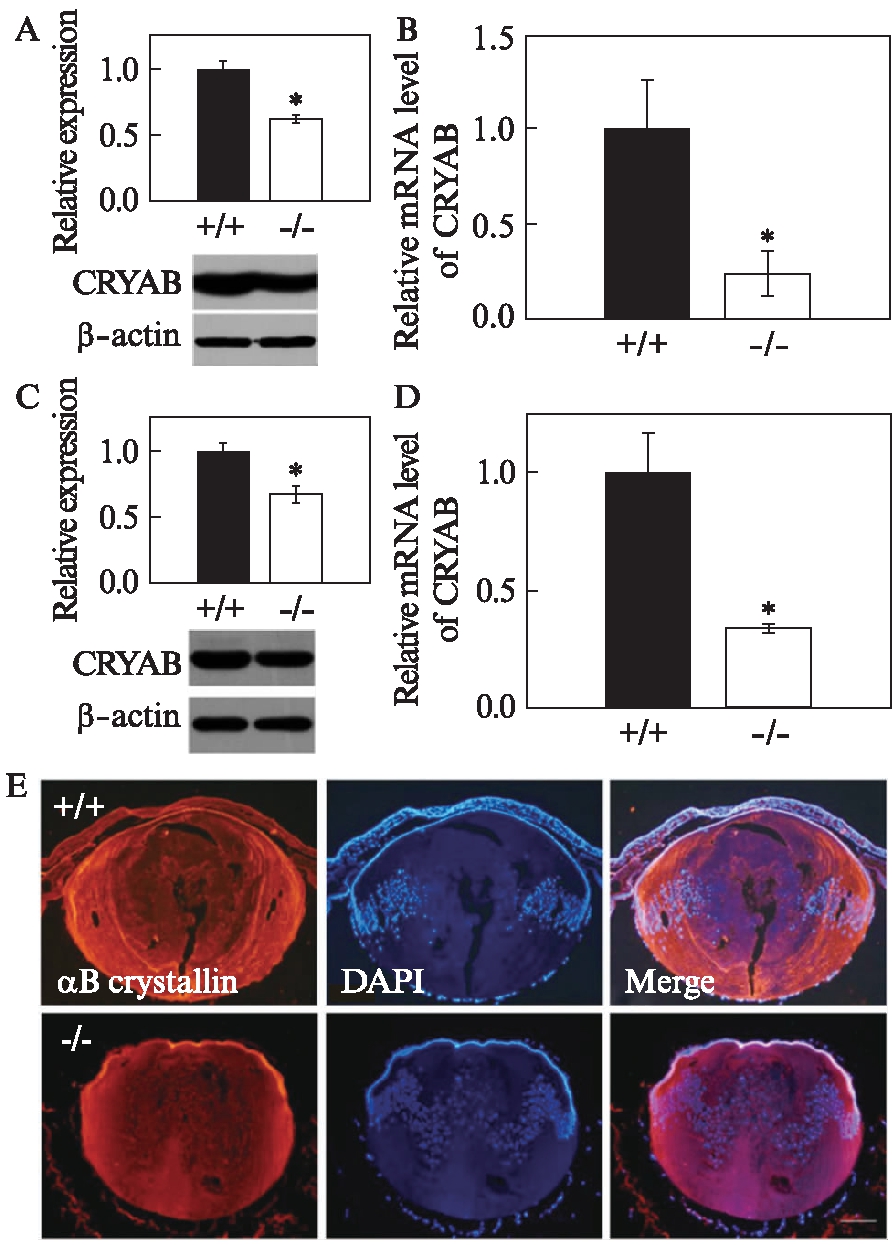
图1 Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB表达下调
Fig.1 The expression of αB-crystallin in the lens of Hsf4tm1Xyk-knockout mice is down-regulated
A: 8周野生型和Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB表达水平;B: 8周野生型和Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB的mRNA表达水平;C: 出生后第1天野生型和Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB的蛋白表达水平;D: 出生后第1天野生型和Hsf4tm1Xyk基因敲除小鼠晶状体中CRYAB的mRNA表达水平;E: 出生后第1天野生型和Hsf4tm1Xyk基因敲除小鼠的晶状体中CRYAB表达的免疫荧光图(标尺: 100 μm);数据结果表示为![]()
为了确认上述结果,在体外试验中,利用HSF4b过表达和HSF4敲减两种方式在SRA01/04细胞中检测CRYAB的表达情况。可以看到,在SRA01/04细胞中,HSF4b过表达后,CRYAB蛋白表达呈上升趋势,mRNA水平也与其一致(图2A、B、C);HSF4敲减后,无论蛋白水平还是mRNA水平,CRYAB的表达都呈现出下降趋势(图2D、E、F)。这与体内观察到的结果相一致。
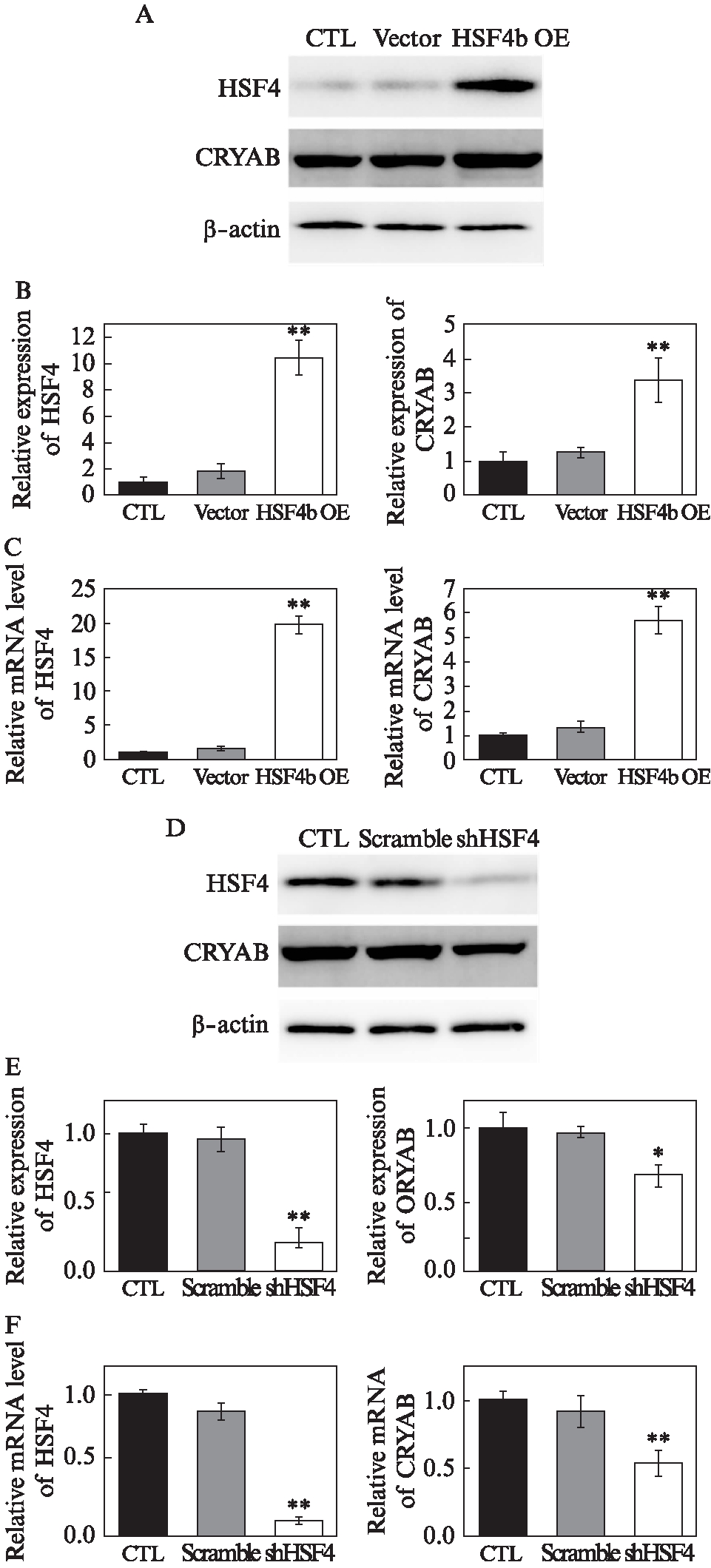
图2 HSF4b能够在体外影响CRYAB的表达
Fig.2 Effects on CRYAB expression by HSF4b
A、B: Western印迹法检测HSF4b过表达(OE)晶状体上皮细胞中HSF4、CRYAB的蛋白表达水平;C: qPCR检测HSF4b OE晶状体上皮细胞中HSF4、CRYAB的mRNA表达水平;D、E: Western印迹法检测shHSF4晶状体上皮细胞中HSF4、CRYAB的蛋白表达水平;F: qPCR检测shHSF4晶状体上皮细胞中HSF4、CRYAB的mRNA表达水平;数据结果表示为![]()
2.2 HSF4b能直接与CRYAB的启动子区结合并激活表达
已知HSF4b的主要作用是转录因子,对CRYAB转录启动区进行了分析和预测,发现存在经典热休克调控元件(heat shock element, HSE)的序列元件。为进一步研究HSF4b是否直接可以直接结合在该区域,进行了凝胶迁移电泳实验。提取过表达HSF4b的晶状体上皮细胞的核蛋白,CRYAB启动子区域含有HSE的序列作为野生型探针,并用突变了HSE的结合位点碱基作为突变探针(图3A)。
凝胶迁移实验的结果所示(图3B): 第1泳道是野生型探针;第2泳道加入了野生型探针以及核蛋白提取物,可以看到有迁移出现,说明野生型探针和核蛋白能够结合;第3泳道是冷探针的竞争实验,第4泳道是突变冷探针的竞争实验,说明探针结合位点的特异性,即与预测的HSE结合;第5泳道加入了抗HSF4b抗体,有超迁移条带(supershift)出现,说明探针是特异结合到HSF4b上。这一凝胶迁移实验结果说明,HSF4b可以直接与CRYAB的启动子HSE区域结合。
同时,通过染色质免疫共沉淀实验,将过表达HSF4b的晶状体上皮细胞的蛋白与DNA交联在一起,而后将交联的DNA打成片段化,利用HSF4b的抗体对与HSF4b结合的DNA进行富集,发现CRYAB启动子区域能被富集下来,而IgG作为对照却没有被富集下来,也表明HSF4b可以直接与CRYAB启动子相结合(图3C)。
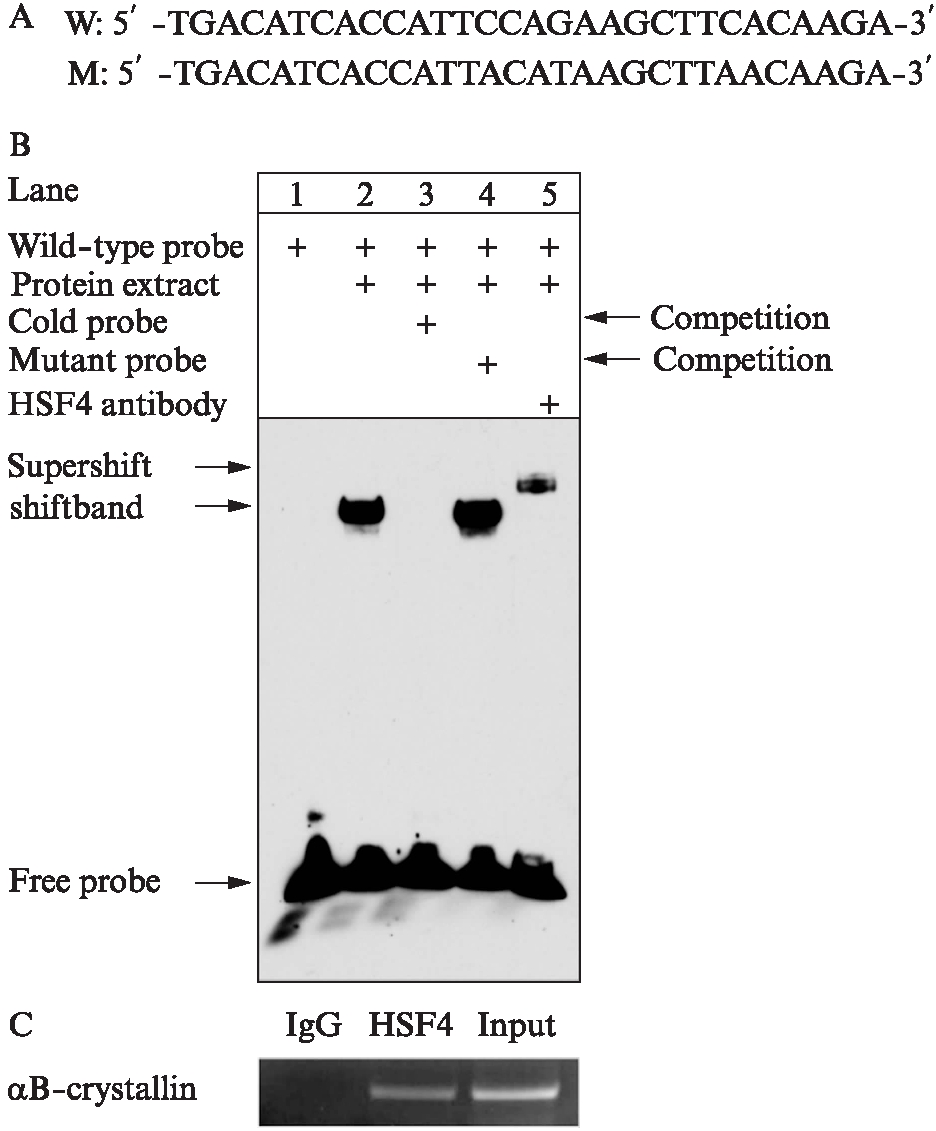
图3 HSF4b直接与CRYAB的启动子结合并激活表达
Fig.3 HSF4b is directly bound to the promoter of αB-crystallin
A: CRYAB启动子中假定的HSF4b结合元件的序列;B: 凝胶迁移实验结果;C: 染色质免疫共沉淀实验结果;n=3
已经确认HSF4b可以直接结合在CRYAB含有HSE元件的区域。为了检验HSF4b对下游CRYAB的转录调控的性质,构建了含HSE元件的CRYAB启动子区域的pGL3-CRYAB-Luc载体。将表达HSF4b的载体和pGL3-CRYAB-Luc质粒共转染到SRA01/04细胞中,利用双荧光素酶报告基因实验检测HSF4b对CRYAB基因表达的调节作用。结果显示,在HSF4b存在的情况下,CRYAB启动子驱动的荧光素酶活力增强并呈剂量依赖性,表明HSF4b对CRYAB基因的表达起到转录激活的作用(图4)。结合凝胶迁移实验和染色质共沉淀的实验结果,表明HSF4b可以直接结合到CRYAB启动子区域并激活CRYAB的表达。
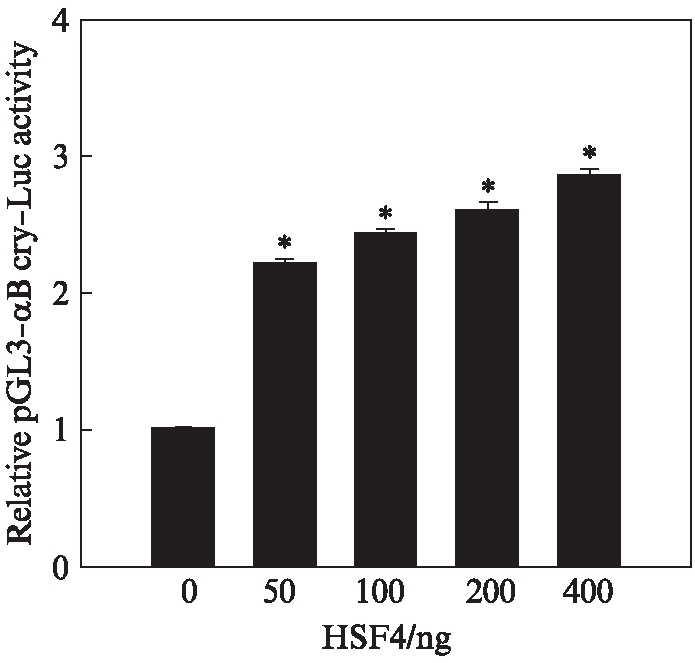
图4 HSF4b对CRYAB的表达起激活作用
Fig.4 HSF4b activates CRYAB expression
数据结果表示为![]()
2.3 CRYAB与VIM具有相互作用
课题组之前的研究发现,HSF4可与VIM启动子区结合并抑制VIM表达[4],本实验通过过表达HSF4b和敲减HSF4,也呈现出同样的趋势。因此,假设在小鼠白内障的晶状体中,CRYAB与VIM相互作用可能会稳定晶状体稳态。为验证二者之间是否存在相互作用,利用晶状体上皮细胞SRA01/04细胞对CRYAB和VIM染色后,用Image J软件对不同颜色强度通道也进行了分析,可以看到在核外区域(蓝色基线区域),CRYAB和VIM呈现出确定的分子间的空间靠近(图5A、B)。在确定二者在空间上的伴随分布前提下,使用野生型小鼠晶状体蛋白样本进行了免疫共沉淀实验。沉淀后通过Western印迹法分析,结果表明CRYAB与VIM具有相互作用(图5C)。
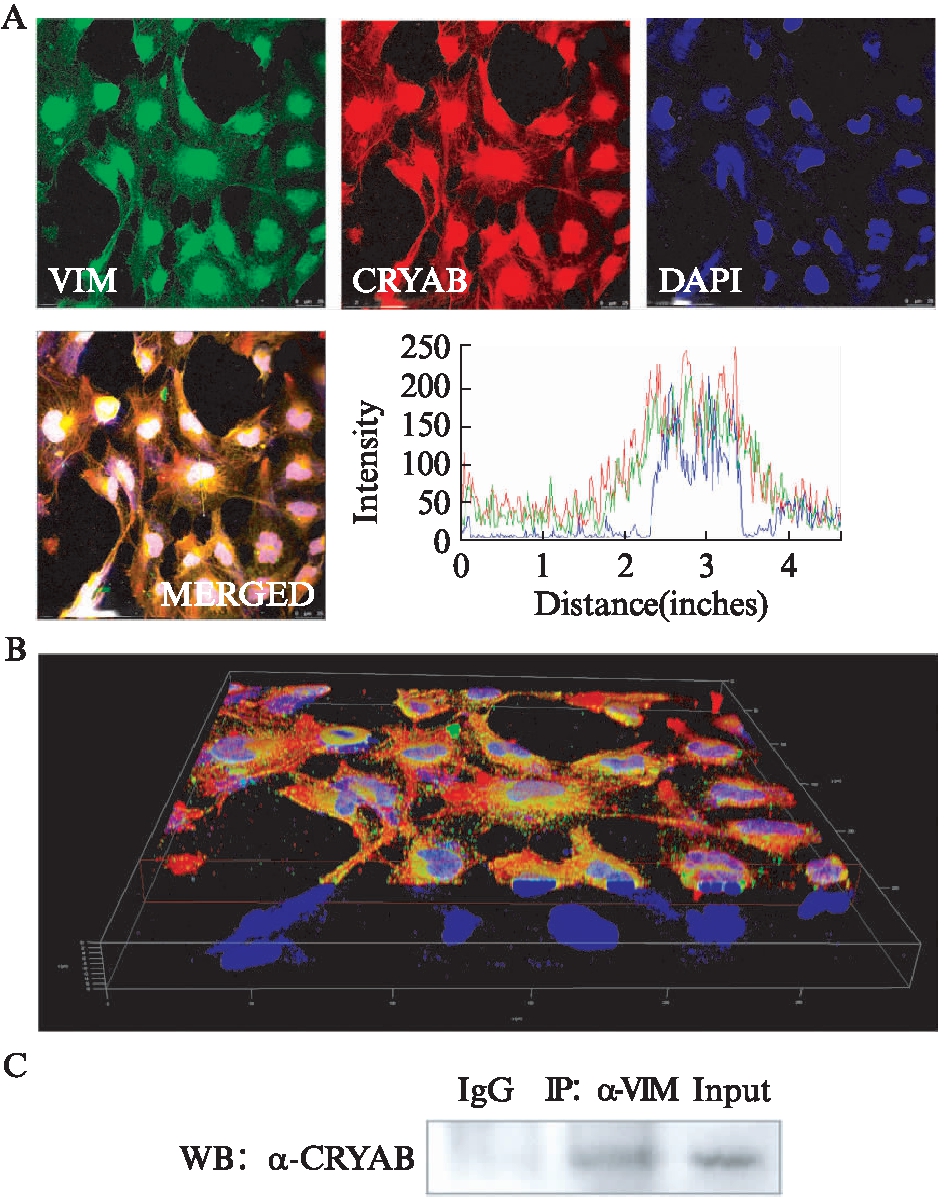
图5 CRYAB与VIM具有相互作用
Fig.5 αB-crystallin has an interaction with Vimentin in vitro and in vivo
A: 晶状体上皮细胞中CRYAB、Vimentin共定位表达的免疫荧光图及荧光共定位定量分析(标尺: 25 μm);B: 通过Confocal逐层扫描和三维图像重建得到的立体三维图像;C: 野生型小鼠晶状体样本免疫共沉淀分析;n=3
3 讨 论
白内障是以眼的晶状体发生了影响视觉功能的混浊为特征的眼病,是世界范围内致盲的主要原因之一[5]。据世界卫生组织估计,全世界受到白内障影响的患者高达9 500万人,甚至有超过2 500万成年人和儿童因患有白内障而导致失明[6]。根据发病时间,白内障可简单分为先天性或年龄相关性,而在CC患者中,有25%~50%的病例是由遗传改变引起的[3]。CC缺陷与编码各种晶状体蛋白、细胞骨架蛋白、间隙连接蛋白及相关功能转录因子的基因突变有关[7]。有研究报道,在小鼠中靶向HSF4的缺失会导致晶状体纤维细胞缺陷和白内障,表明HSF4与晶状体发育密不可分[8]。
HSF4属于热休克转录因子家族,该家族的成员在维持细胞蛋白质稳态、介导细胞分化和发育中起着重要的调节作用[9]。近年来,针对HSF4在晶状体发育和白内障发生的研究受到更多重视。根据对中国人群的调查,包含CRYAB、Hsf4等18个基因被筛选为CC的候选基因[10]。HSF4可以通过结合启动子中的HSE来介导DNA损伤修复[11]。之前的研究发现,Hsf4tm1Xyk基因敲除小鼠全部发生白内障,此外存在有眼球和晶状体均较小、虹膜粘连、晶状体囊膜破裂、前房深且有溢出物等眼部并发症[4,8]。这些并发症可能与晶状体整体发育异常有关。越来越多的研究显示,HSF4在晶状体发育过程中是一个重要的转录因子,表示为两个交替转录的同工型HSF4a和HSF4b。鉴于仅HSF4b在晶状体中表达,本研究仅对突变型HSF4b亚型进行了评估[12],并对HSF4b调控晶状体发育的机制进行了深入研究。
在研究HSF4b导致白内障发生的机制时,寻找HSF4b的下游靶基因至关重要,尤其是在HSF4b在调节晶状体纤维细胞分化中起到的作用。VIM是HSF4b的下游靶蛋白之一。HSF4缺失后,晶状体内VIM呈现出表达增强,导致晶状体细胞脱核过程异常,诱发晶状体发育异常和白内障的发生[4]。而本研究关注的CRYAB是晶状体结构蛋白之一,在晶状体中广泛表达。以往遗传学研究发现,CRYAB突变可以以显性遗传或者隐形遗传的方式引起CC,因此被认为是遗传性白内障的重要相关基因之一[13-14]。在分子功能层面上,大量体外试验证明,CRYAB缺失会影响细胞内对蛋白分子的自组装相关的稳态维持,例如淀粉样蛋白聚集体的形成和细胞的衰老[15];在其他组织中还可以保护肌动蛋白微丝的完整性,免受细胞外应激的影响[16-17]。
本研究通过系列实验,证明了CRYAB是HSF4b下游靶分子之一。HSF4b能够直接结合在CRYAB基因转录调控区的HSE元件上,并激活CRYAB的表达。在Hsf4tm1Xyk基因敲除小鼠中,由于HSF4b的缺失,引起CRYAB表达激活减少,导致CRYAB表达减低;继而,CRYAB基础表达量的减低,损伤了维持晶状体的结构蛋白和维持其透明性的能力。这一结果说明,HSF4b对CRYAB的激活作用在晶状体正常发育过程中是必不可少的。CRYAB表达减少,是HSF4基因敲除小鼠以及HSF4突变患者异常晶状体发育和白内障形成的分子机制之一。
VIM是之前发现的另一个HSF4b的下游靶分子,HSF4b对VIM的表达主要表现为抑制作用。有体外试验证明,CRYAB以ATP不依赖的方式极大地抑制了GFAP和VIM的体外组装,并且该抑制也独立于CRYAB多肽的磷酸化状态[18]。基于这一体外试验的假设,本研究进一步证实,HSF4b能够调控二者的表达,HSF4的缺失可以引起CRYAB的减少与VIM的升高,二者共同作用导致VIM组装增强,影响晶状体细胞正常分化过程中的脱核过程[4],导致晶状体发育异常和白内障的发生。
在晶状体发育与白内障的发生过程中,CRYAB是HSF4b的重要靶基因之一。HSF4b对CRYAB的表达调控和CRYAB与VIM的相互作用都可以作为白内障的干预治疗靶点,为今后研发治疗白内障的药物和基因治疗等非手术治疗提供了理论依据。
[1] LI J Y, CHEN X J, YAN Y B, et al. Molecular genetics of congenital cataracts[J]. Exp Eye Res, 2020,191: 107872.
[2] ANAND D, AGRAWAL S A, SLAVOTINEK A, et al. Mutation update of transcription factor genes FOXE3, HSF4, MAF, and PITX3 causing cataracts and other developmental ocular defects[J]. Hum Mutat, 2018,39(4): 471-494.
[3] FUJIMOTO M, IZU H, SEKI K, et al. HSF4 is required for normal cell growth and differentiation during mouse lens development[J]. EMBO J, 2004,23(21): 4297-4306.
[4] MOU L S, XU J Y, LI W Y, et al. Identification of vimentin as a novel target of HSF4 in lens development and cataract by proteomic analysis[J]. Invest Ophthalmol Vis Sci, 2010,51(1): 396-404.
[5] MOCHIZUKI T, MASAI I. The lens equator: a platform for molecular machinery that regulates the switch from cell proliferation to differentiation in the vertebrate lens[J]. Dev Growth Differ, 2014,56(5): 387-401.
[6] CVEKL A, ASHERY-PADAN R. The cellular and molecular mechanisms of vertebrate lens development[J]. Development, 2014,141(23): 4432-4447.
[7] SHIELS A, BENNETT T M, HEJTMANCIK J F.Cat-Map: putting cataract on the map[J]. Mol Vis, 2010,16: 2007-2015.
[8] SHI X H, CUI B, WANG Z G, et al. Removal of Hsf4 leads to cataract development in mice through down-regulation of gamma S-crystallin and Bfsp expression[J]. BMC Mol Biol, 2009,10: 10.
[9] PIRKKALA L, NYK NEN P, SISTONEN L. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond[J]. FASEB J, 2001,15(7): 1118-1131.
NEN P, SISTONEN L. Roles of the heat shock transcription factors in regulation of the heat shock response and beyond[J]. FASEB J, 2001,15(7): 1118-1131.
[10] CAO Z F, ZHU Y H, LIU L J, et al. Novel mutations in HSF4 cause congenital cataracts in Chinese families[J]. BMC Med Genet, 2018,19(1): 150.
[11] CUI X K, ZHANG J, DU R, et al. HSF4 is involved in DNA damage repair through regulation of Rad51[J]. Biochim Biophys Acta, 2012,1822(8): 1308-1315.
[12] LIANG L N, LIEGEL R, ENDRES B, et al. Functional analysis of the Hsf4(lop11) allele responsible for cataracts in lop11 mice[J]. Mol Vis, 2011,17: 3062-3071.
[13] LIU M G, KE T, WANG Z X, et al. Identification of a CRYAB mutation associated with autosomal dominant posterior polar cataract in a Chinese family[J]. Invest Ophthalmol Vis Sci, 2006,47(8): 3461-3466.
[14] ZHANG J F, LIU J, WU J L, et al. Progression of the role of CRYAB in signaling pathways and cancers[J]. Onco Targets Ther, 2019,12: 4129-4139.
[15] LAUNAY N, GOUDEAU B, KATO K, et al. Cell signaling pathways to alphaB-crystallin following stresses of the cytoskeleton[J]. Exp Cell Res, 2006,312(18): 3570-3584.
[16] MISHRA S, WU S Y, FULLER A W, et al. Loss of αB-crystallin function in zebrafish reveals critical roles in the development of the lens and stress resistance of the heart[J]. J Biol Chem, 2018,293(2): 740-753.
[17] BENNARDINI F, WRZOSEK A, CHIESI M. Alpha B-crystallin in cardiac tissue. Association with actin and desmin filaments[J]. Circ Res, 1992,71(2): 288-294.
[18] NICHOLL I D, QUINLAN R A. Chaperone activity of alpha-crystallins modulates intermediate filament assembly[J]. EMBO J, 1994,13(4): 945-953.