胰岛素抵抗(insulin resistance, IR)在高血压、高血脂、糖尿病、冠心病、高尿酸血症、代谢综合征等疾病的发生和发展过程中起重要的作用[1-3]。诊断IR的金标准是高胰岛素正葡萄糖钳夹试验[4]。但是,该试验具有侵入性,且耗时长、技术要求高,不能大规模应用于人群胰岛素敏感性检测。目前,在临床上主要用稳态模型胰岛素抵抗指数(homeostasis model assessment, HOMA-IR)间接评估人体胰岛素抵抗[5-6]。2型糖尿病患者IR使胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性分泌过多的胰岛素而产生高胰岛素血症。本文探讨男性2型糖尿病患者IR的相关影响因素,旨在找到简单有效的影响因素以判断IR。
1 资料与方法
1.1 研究对象和诊断标准
收集同济大学附属杨浦医院2018年5月—2019年11月门诊及住院男性T2DM患者576例。诊断符合1999年美国糖尿病协会(American Dia-betes Association, ADA)诊断标准[7],均未使用胰岛素。排除标准: (1) 1型糖尿病患者;(2) 有严重肝肾功能异常;(3) 严重并发症: 如糖尿病酮症酸中毒,合并肺部感染、肝脓肿等;(4) 继发性糖尿病患者;(5) 妊娠糖尿病患者;(6) 合并多囊卵巢综合征、皮质醇增多症、甲状腺功能减退及亢进、垂体瘤等患者。
1.2 方法
1.2.1 一般参数测量及标准 调查对象均测量身高、体重,计算体重指数(body mass index,BMI),BMI≥28 kg/m2为肥胖。测量血压,患者安静、平卧10 min,侧右上臂血压,高血压的诊断标准及分级标准采用2005年中国高血压防治指南推荐标准[8]。腰围(waist circumference, WC)测量取垂直站立姿势,双足分开25~30 cm,使体重均匀分布,用腰腹围测量尺于右侧腋中线胯骨上缘和第12肋下缘连线的中点,沿水平方向围绕腹部1周,紧贴而不压迫皮肤进行测量;臀围(hip circumference, HC)臀部向后最突出部位的水平围长。高血压的判定标准根据收缩压≥140 mmHg(1 mmHg=0.133 kPa),或舒张压≥90 mmHg,或已经用降压药者。血尿酸≥420 μmol/L,诊断高尿酸血症。HOMA-IR≥2.8诊断为IR[9]。
1.2.2 其它指标测定 所有患者均于清晨空腹采集静脉血,空腹血糖(fasting blood glucose, FBG)采用葡萄糖氧化酶法。糖化血红蛋白(hemoglobin A1c, HbA1c)应用高压液相法测定。胰岛素、C肽采用电光化学法(Roche Cobase 411罗氏公司,德国)。生化指标,包括肝肾功能采用常规自动生化分析仪测定。血脂谱测定: 总胆固醇(total cho-lesterol, TC)、三酰甘油(triglyceride, TG)采用酶法(GPO-PAP法和COP-PAP法); 高密度脂蛋白(high density lipoprotein, HDL) 低密度脂蛋白(low density lipoprotein, LDL)用匀相测定法。内脏脂肪和皮下脂肪用体脂仪测量(Omron dualscan HDS-2000,欧姆龙健康医疗株式会社,日本三重县)。
1.2.3 公式计算 通过以下公式计算指标,HOMA-IR=FPG×FINS/22.5;BMI=体重(kg)/身高2(m2);腰臀比(waist-to-hip ratio, WHR)=腰围(cm)/臀围(cm)。
1.3 统计学处理
采用SPSS 19.0统计软件,正态分布资料以![]() 表示,组间均数差异用Student’s t检验;构成比的差异用χ2检验;非正态分布资料结果以P50(P25, P75)表示,组间差异采用2个独立样本的非参数检验;胰岛素抵抗与其影响因子间关系用二元Logistic回归分析。P<0.05为差异有统计学意义。
表示,组间均数差异用Student’s t检验;构成比的差异用χ2检验;非正态分布资料结果以P50(P25, P75)表示,组间差异采用2个独立样本的非参数检验;胰岛素抵抗与其影响因子间关系用二元Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料比较
男性2型糖尿病患者胰岛素抵抗组与非胰岛素抵抗组相比,身高、心率、碱性磷酸酶(alkaline pho-sphatase, ALP)、肌酐(creatinine, Cr)、尿素氮(blood urea nitrogen, BUN)、HDL、LDL、促甲状腺素(thyroid-stimulating hormone, TSH)、游离三碘甲腺原氨酸(free triiodothyronine, FT3)、游离四碘甲腺原氨酸(free tetraiodothyronine, FT4)、尿白蛋白与尿肌酐比值(urinary albumin to creatinine, ALB/Cr)两组差异无统计学意义(均P>0.05);而胰岛素抵抗组患者年龄较轻,体重、BMI、WC、HC、WHR、内脏脂肪、皮下脂肪、总脂肪、FBG、餐后血糖(postprandial blood glucose, PBG)、HbA1c、空腹胰岛素、餐后2 h胰岛素、空腹C肽、餐后2 h C肽、丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate transaminase, AST)、尿酸(uric acid, UA)、TG、TC均高于非胰岛素抵抗组,两组差异有统计学意义(均P<0.001),见表1。
表1 两组基线数值比较
Tab.1 Baseline values between the two groups![]()
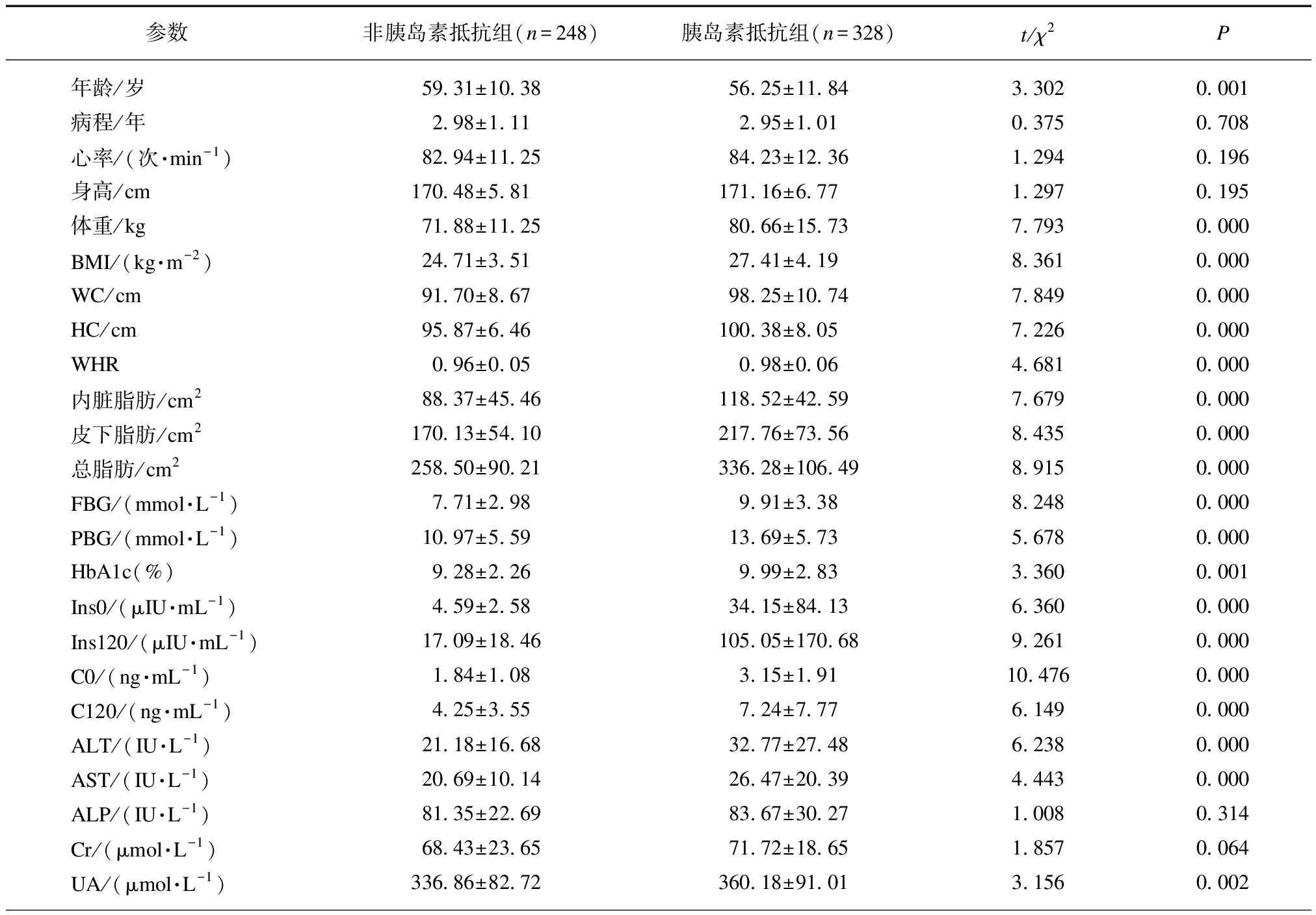
参数非胰岛素抵抗组(n=248)胰岛素抵抗组(n=328)t/χ2 P年龄/岁59.31±10.3856.25±11.843.3020.001病程/年2.98±1.112.95±1.010.3750.708心率/(次·min-1)82.94±11.2584.23±12.361.2940.196身高/cm170.48±5.81171.16±6.771.2970.195体重/kg71.88±11.2580.66±15.737.7930.000BMI/(kg·m-2)24.71±3.5127.41±4.198.3610.000WC/cm91.70±8.6798.25±10.747.8490.000HC/cm95.87±6.46100.38±8.057.2260.000WHR0.96±0.050.98±0.064.6810.000内脏脂肪/cm288.37±45.46118.52±42.597.6790.000皮下脂肪/cm2170.13±54.10217.76±73.568.4350.000总脂肪/cm2258.50±90.21336.28±106.498.9150.000FBG/(mmol·L-1)7.71±2.989.91±3.388.2480.000PBG/(mmol·L-1)10.97±5.5913.69±5.735.6780.000HbA1c(%)9.28±2.269.99±2.833.3600.001Ins0/(μIU·mL-1)4.59±2.5834.15±84.136.3600.000Ins120/(μIU·mL-1)17.09±18.46105.05±170.689.2610.000C0/(ng·mL-1)1.84±1.083.15±1.9110.4760.000C120/(ng·mL-1)4.25±3.557.24±7.776.1490.000ALT/(IU·L-1)21.18±16.6832.77±27.486.2380.000AST/(IU·L-1)20.69±10.1426.47±20.394.4430.000ALP/(IU·L-1)81.35±22.6983.67±30.271.0080.314Cr/(μmol·L-1)68.43±23.6571.72±18.651.8570.064UA/(μmol·L-1)336.86±82.72360.18±91.013.1560.002
续表
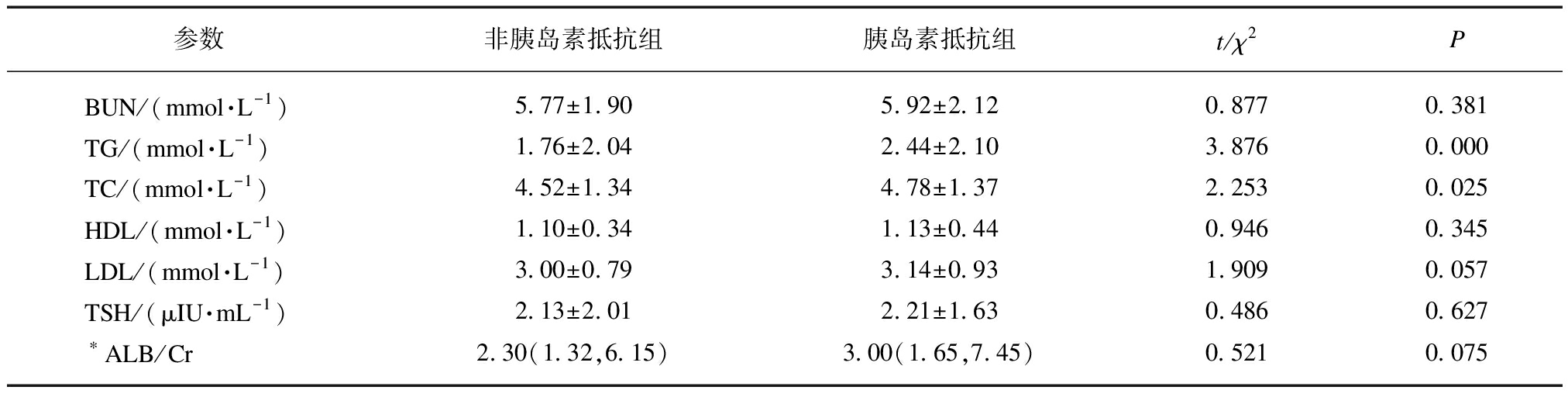
参数非胰岛素抵抗组胰岛素抵抗组t/χ2 PBUN/(mmol·L-1)5.77±1.905.92±2.120.8770.381TG/(mmol·L-1)1.76±2.042.44±2.103.8760.000TC/(mmol·L-1)4.52±1.344.78±1.372.2530.025HDL/(mmol·L-1)1.10±0.341.13±0.440.9460.345LDL/(mmol·L-1)3.00±0.793.14±0.931.9090.057TSH/(μIU·mL-1)2.13±2.012.21±1.630.4860.627∗ALB/Cr2.30(1.32,6.15)3.00(1.65,7.45)0.5210.075
*ALB/Cr为非正态分布; Ins0: 空腹胰岛素;Ins120: 餐后2 h胰岛素;C0: 空腹C肽;C120: 餐后2 h C肽
2.2 胰岛素抵抗组与非抵抗组其他疾病构成比
男性2型糖尿病患者576例,非胰岛素抵抗组248例(43.1%),胰岛素抵抗组328例(56.9%),胰岛素抵抗组肥胖症、高血压病、高脂血症,高尿酸血症比例高于非胰岛素抵抗组(P<0.01、P<0.01、P<0.01、P<0.05),见表2。
表2 男性2型糖尿病患者胰岛素抵抗与 其他疾病患病情况
Tab.2 Prevalence of insulin resistance and other diseases in male patients with type 2 diabetes mellitus
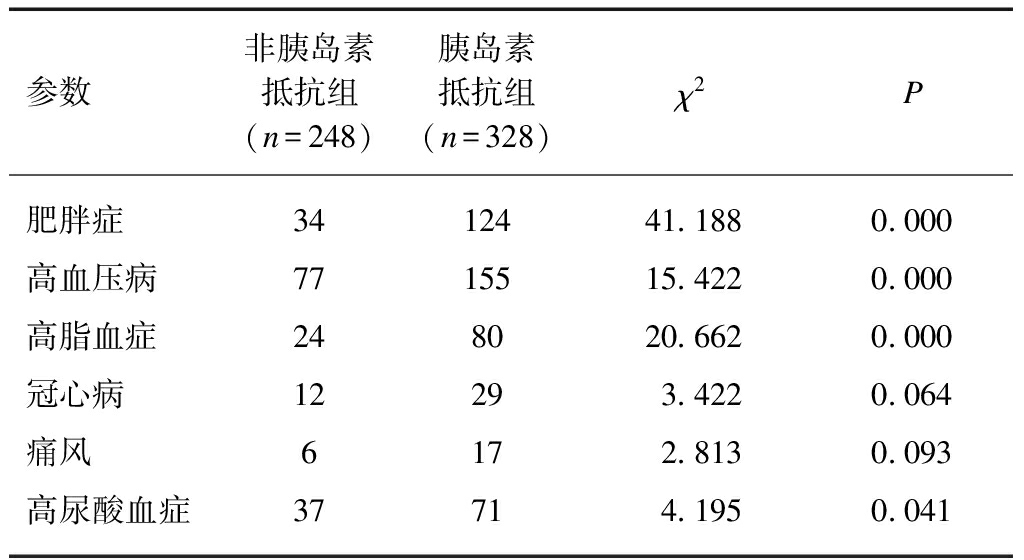
参数非胰岛素抵抗组(n=248)胰岛素抵抗组(n=328)χ2P肥胖症3412441.1880.000高血压病7715515.4220.000高脂血症248020.6620.000冠心病12293.4220.064痛风6172.8130.093高尿酸血症37714.1950.041
2.3 胰岛素抵抗指数与一般临床指标的相关性
两变量相关分析提示,胰岛素抵抗指数与WC(r=0.119,P=0.004)、WHR(r=0.117,P=0.005)、内脏脂肪(r=0.089,P=0.044)和总脂肪(r=0.095,P=0.032)呈正相关关系,见表3。
表3 胰岛素抵抗指数与一般指标的相关系数
Tab.3 Correlation coefficient between insulin resistance index and general indexes
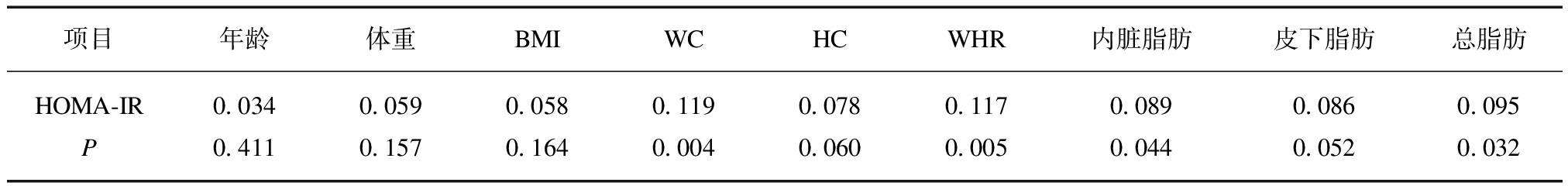
项目年龄体重BMIWCHCWHR内脏脂肪皮下脂肪总脂肪HOMA-IR0.0340.0590.0580.1190.0780.1170.0890.0860.095P0.4110.1570.1640.0040.0600.0050.0440.0520.032
2.4 胰岛素抵抗与影响因子相关性
二元Logistic回归分析显示,胰岛素抵抗做为因变量,年龄、体重、BMI、WC、HC、内脏脂肪、皮下脂肪、TG、TC、HDL、LDL做为自变量。内脏脂肪(OR=1.007, P=0.028)、皮下脂肪(OR=1.009,P=0.014)、TG(OR=1.147,P=0.046)与胰岛素抵抗有关,见表4。
表4 胰岛素抵抗与影响因素相关性
Tab.4 Correlation between insulin resistance and influencing factors
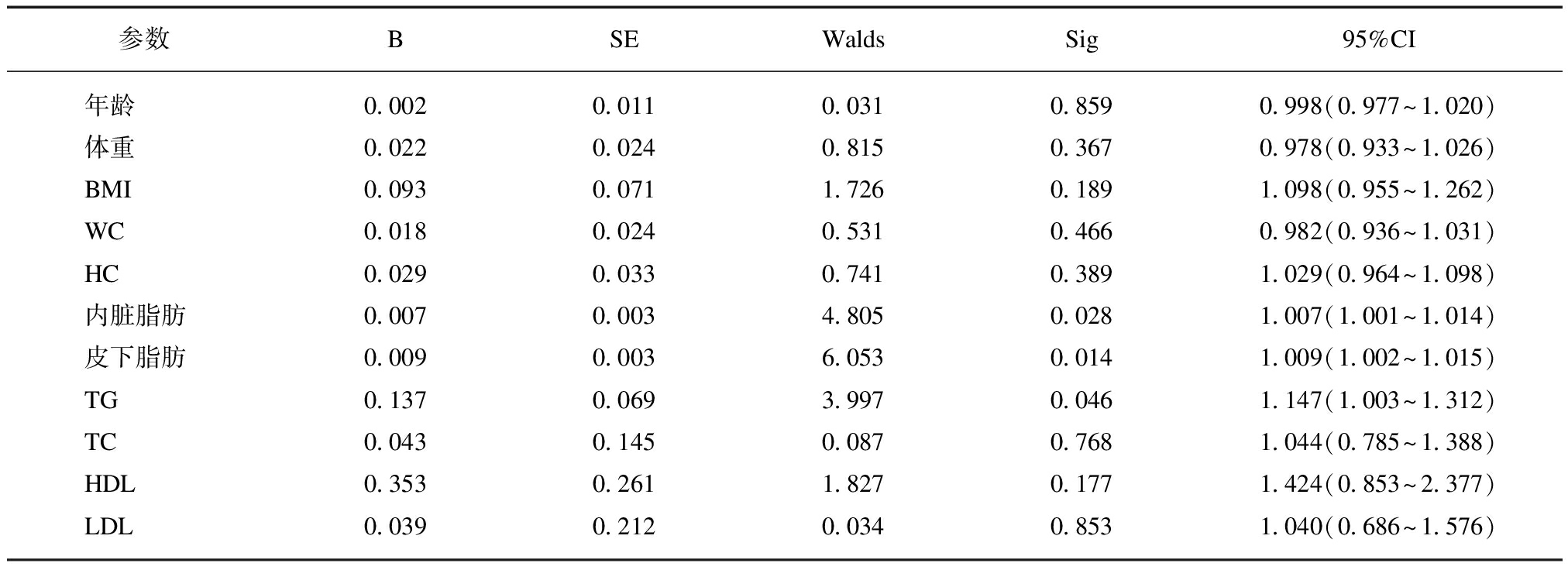
参数BSEWaldsSig95%CI年龄0.0020.0110.0310.8590.998(0.977~1.020)体重0.0220.0240.8150.3670.978(0.933~1.026)BMI0.0930.0711.7260.1891.098(0.955~1.262)WC0.0180.0240.5310.4660.982(0.936~1.031)HC0.0290.0330.7410.3891.029(0.964~1.098)内脏脂肪0.0070.0034.8050.0281.007(1.001~1.014)皮下脂肪0.0090.0036.0530.0141.009(1.002~1.015)TG0.1370.0693.9970.0461.147(1.003~1.312)TC0.0430.1450.0870.7681.044(0.785~1.388)HDL0.3530.2611.8270.1771.424(0.853~2.377)LDL0.0390.2120.0340.8531.040(0.686~1.576)
3 讨 论
糖尿病已经成为全球健康问题,据我国流行病学调查显示中国成人糖尿病患病率为10.9%,包括既往已知糖尿病患病率4.0%和新诊断糖尿病患病率6.9%,而且40岁以下患者占5.9%[10]。2型糖尿病主要病理生理是IR,伴或不伴有胰岛素分泌不足。
基础研究提示IR发生的机制如下: (1) 胰岛素基因突变[11],从而造成产生的胰岛素结构异常,胰岛素的生物活性下降;(2) 胰岛素抗体的生成[12],使胰岛素不能有效地与其受体结合而发挥作用;(3) 胰岛素分解过快;(4) 胰岛素受体结构和功能异常,导致胰岛素和受体结合困难或结合后不能发挥作用;(5) 胰岛素和受体结合后信号转导通路异常[13];(6) 炎症因子、氧化应激干扰胰岛素信号转导及引起内皮功能异常[14-15];(7) 其他一些因素还包括瘦素抵抗、维生素D缺乏、吸烟等[16]。
临床研究发现,IR是动脉粥样硬化性心血管疾病、高血压、血脂异常等疾病的原因之一[3,17-18],长期IR引起的高血糖导致机体出现各种并发症,大血管并发症如冠心病、脑卒中、肾动脉硬化及下肢疼痛间歇性跛行;微血管并发症如糖尿病肾病及糖尿病视网膜病变;神经病变;糖尿病足。所以研究IR的发生机制、特点及相关影响因素,有助于对2型糖尿病及其并发症更好地进行预防与治疗。
本研究提示,男性2型糖尿病伴IR患者体重、体重指数、腰围、臀围、腰臀比、内脏脂肪、皮下脂肪及总脂肪均高于非胰岛素抵抗组,且IR与WC、WHR、内脏脂肪和总脂肪成正相关关系,提示男性2型糖尿病患者IR与肥胖,特别是中心性肥胖关系密切。因腹部脂肪组织异常堆积,导致了机体对胰岛素的敏感性下降,胰腺功能受损更加严重[19]。本研究虽然得出IR组BMI及WC高于非IR组,但在相关性分析中只得出HOMA-IR与WC存在正相关关系,并没有得出HOMA-IR与BMI相关性有统计学意义。虽然两者均是代表肥胖的指标,但BMI表示“单位”身高的体脂含量而与体脂分布关系不大,所以它只是间接地相对反映体脂含量,不能反映脂肪的分布。二元Logistic回归分析可以一步一步的筛选自变量,最终留下的自变量中,内脏脂肪、皮下脂肪、TG与IR有关,提示男性2型糖尿病患者IR与腹部脂肪关系最为密切,虽然也纳入了WC,但没有达到统计学意义,提示腹部脂肪,包括内脏脂肪和腹部皮下脂肪较WC更能反映IR的情况。二元Logistic回归分析也显示血脂中的TG与IR有关,这与以往的结论一致[3]。在其他疾病构成上,IR组肥胖症、高血压病、高脂血症,高尿酸血症比例高于非胰岛素抵抗组, 提示IR与代谢综合征组成成分存在明显的相关性。
本研究有一定局限性,性激素对胰岛素抵抗有一定影响,尤其是女性,绝经后妇女性激素的改变与胰岛素抵抗的产生有关。雄激素、性激素结合球蛋白参与了胰岛素抵抗的形成,高水平的雌激素可引起胰岛素抵抗。该研究没有做男性激素水平对胰岛素抵抗的影响。
综上所述,2型糖尿病患者本身存在IR,腹部脂肪的异常堆积和高TG血症又进一步加重了IR,导致机体对胰岛素敏感性降低。腹部脂肪和TG的测定,测量简便、廉价、无创,与IR有密切的关系。因此可以作为最简便的IR的筛查方法,而降低腹部脂肪含量,降低TG水平,对男性2型糖尿病患者来说,是降低IR的重要手段,具有实际应用价值。
[1] 郭庆妍,朱翠玲,卜乐,等.不同体质量指数糖尿病患者胰岛素分泌及胰岛功能的特点[J].同济大学学报(医学版),2018,39(1): 83-88.
[2] JANCZURA M, DROPINSKI J, GIELICZ A, et al. Potential roles of psychological and oxidative stress in insulin resistance: a cohort-based study[J].Diabetol Metab Syndr, 2020,12: 58.
[3] MA M L, LIU H B, YU J, et al. Triglyceride is independently correlated with insulin resistance and islet beta cell function: a study in population with different glucose and lipid metabolism states[J]. Lipids Health Dis, 2020,19(1): 121.
[4] DONGA E, DEKKERS O M, CORSSMIT E, et al. Insulin resistance in patients with type 1 diabetes assessed by glucose clamp studies: systematic review and meta-analysis[J].Eur J Endocrinol, 2015,173(1): 101-109.
[5] BORAI A, LIVINGSTONE C, KADDAM I, et al. Selection of the appropriate method for the assessment of insulin resistance[J]. BMC Med Res Methodol, 2011,11 : 158.
[6] FERREIRA-HERMOSILLO A, IBARRA-SALCE R, RODR GUEZ-MALACARA J, et al. Comparison of indirect markers of insulin resistance in adult patients with Double Diabetes[J]. BMC Endocr Disord, 2020,20(1): 87.
GUEZ-MALACARA J, et al. Comparison of indirect markers of insulin resistance in adult patients with Double Diabetes[J]. BMC Endocr Disord, 2020,20(1): 87.
[7] World Health Organization. Definition diagnosis and classification of diabetes mellitus and its complication: Part 1: report to a WHO consultation: diagnosis and classification of diabetes mellitus[EB/OL].[2021-07-06]. https:∥www.staff.ncl.ac.uk/philip.home/who_dmg.pdf
[8] 李立明,饶克勤,孔灵芝,等.中国居民2002年营养与健康状况调查[J].中华流行病学杂志,2005,26(7): 478-484.
[9] 贾伟平.中国人群胰岛素抵抗的状况[J].国外医学内分泌学分册,2002,22(4): 264.
[10] WANG L M, GAO P, ZHANG M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. JAMA, 2017,317(24): 2515-2523.
[11] XIAO X, LIU L, XIAO Y, et al. Novel frameshift mutation in the insulin(INS) gene in a family with maturity onset diabetes of the young(MODY)[J]. J Diabetes, 2019,11(1): 83-86.
[12] XIAO Y, LI X, CHAO C, et al. Severe insulin resistance due to insulin antibodies[J]. J Diabetes, 2018,10(7): 611-613.
[13] LEIBIGER B, MOEDE T, PASCHEN M, et al. PI3K-C2α knockdown results in rerouting of insulin signaling and pancreatic beta cell proliferation[J]. Cell Rep, 2015,13(1): 15-22.
[14] MAUER J, CHAURASIA B, GOLDAU J, et al. Signaling by IL-6 promotes alternative activation of macrophages to limit endotoxemia and obesity-associated resistance to insulin[J]. Nat Immunol, 2014,15(5): 423-430.
[15] CHEN T, XING J, LIU Y. Effects of telmisartan on vascular endothelial function. innammation and insulin resistance in patients with coronary heart disease and diabetes mellitus[J]. Exp Ther Med, 2018,15(1): 909-913.
[16] 杨大伟,王民登,吴标良,等.胰岛素抵抗的研究进展[J].右江医学,2019,47(6): 472-475.
[17] ORMAZABAL V, NAIR S, ELFEKY O, et al. Association between insulin resistance and the development of cardiovascular disease[J].Cardiovasc Diabetol, 2018,17(1): 122.
[18] D’ELIA L, STRAZZULLO P. Excess body weight, insulin resistance and isolated systolic hypertension: potential pathophysiological links[J]. High Blood Press Cardiovasc Prev, 2018,25(1): 17-23.
[19] 莫帅帅,孙立娟.超重/肥胖2型糖尿病患者腹部脂肪分布与胰岛素抵抗的相关性[J].中国实验诊断学,2020,24(1): 57-59.