类风湿关节炎(rheumatoid arthritis, RA)是一种常见自身免疫性疾病。T细胞异常活化和功能紊乱是其重要发病因素[1]。白细胞介素4(interleukin-4, IL-4)是具有多种生物学活性的细胞因子,常扮演着抗炎因子的角色[2]。共刺激分子CD30是肿瘤坏死因子(tumor necrosis factor, TNF)受体超家族成员,与配体结合后,可引起细胞分化、细胞因子分泌、细胞增殖或者凋亡等生物学效应[3]。CD30的表达呈激活依赖性,IL-4是其表达重要条件之一[4]。本研究拟探讨IL-4在RA中的另外一种作用,即通过影响RA患者外周血中T淋巴细胞表面CD30的表达及细胞因子的产生对RA患者炎症反应发挥负性调节作用。
1 资料与方法
1.1 研究对象
选取2018年3月—2020年6月在同济大学附属东方医院风湿免疫科就诊的46例RA患者为研究对象(RA组)。RA诊断均符合美国风湿病协会1987修订的分类标准和美国风湿病协会/欧洲抗风湿联盟2010修订的RA分类标准(排除标准: 合并严重心脑血管疾病、感染、病毒性肝炎、自身免疫性疾病,明显的实验室检查异常或半年内使用过免疫抑制剂者)。选取同期41例本院健康体检者为对照组。RA组和对照组的性别、年龄差异无统计学意义。本研究经同济大学附属东方医院伦理委员会批准通过,且所有研究对象均已签署知情同意书。
1.2 试剂与仪器
人可溶性CD30(soluble CD30, sCD30)ELISA试剂盒购自奥地利Bender Med Systems公司;人IL-4 ELISA试剂盒购自美国R & D公司;人淋巴细胞分离液购自美国GE Healthcare公司;FITC-抗人CD3抗体、BV421-抗人CD30抗体、BV421-IgG1同型抗体、PE-A抗人IFN-γ抗体、PE-A抗人IL-17抗体、抗人CD3激动型功能抗体、抗人CD28激动型功能抗体均购自美国eBioscience公司;重组人IL-4蛋白购自美国R & D公司。FACS caliber流式细胞仪购自美国BD公司,酶标仪购自美国One Lambda公司;CO2细胞培养箱和超净工作台购自美国Thermo公司。
1.3 方法
1.3.1 标本采集 抽取2 mL受试者空腹外周血置于含促凝剂的真空采血管中离心(离心半径10 cm,3 000 r/min,10 min),吸取上清液保存于-80 ℃超低温待测。分别抽取10例RA患者和10例健康人10 mL 外周血置于肝素钠抗凝的采血管中,室温放置,4 h内分离外周血单个核细胞(peripheral blood mononuclear cells, PBMC)进行后续细胞培养刺激试验。
1.3.2 ELISA法测定sCD30及IL-4水平 按照ELISA试剂盒说明书测定血清中sCD30及IL-4水平,利用酶标仪测量450 nm波长处标准品和待测样本的吸光度值(A450),制作标准曲线并计算各样本中sCD30和IL-4的水平。
1.3.3 Ficoll法密度梯度离心分离PBMC 新鲜采集的外周血标本用HBSS缓冲液按照体积比1∶1稀释,加至淋巴细胞分离液上层离心(离心半径15 cm,1 500 r/min,30 min)。取中间白膜层至无菌PBS缓冲液中离心(离心半径15 cm,1 500 r/min,5 min),洗涤2次,获得PBMC。
1.3.4 重组IL-4对PBMC刺激培养 将分离洗涤后的PBMC重悬在含有10%人AB血清、1%丙酮酸钠、1%非必需氨基酸、1%双抗的RPMI 1640细胞培养液中,计数后把PBMC浓度调整至2×106 mL。而后接种于96孔细胞培养板内(培养板提前用抗人CD3单抗1 μg/mL和抗人CD28单抗1 μg/mL,4 ℃过夜处理,每孔200 μL,置于37 ℃、5%浓度CO2培养箱内进行培养。根据实验设计先用不同浓度的(0、12.5、25、50、100 ng/mL)重组人IL-4蛋白刺激5 d;对照组给与等体积的PBS,在开始细胞培养的同时即给与所需剂量的重组IL-4,隔天进行细胞换液的同时补加相应剂量的重组人IL-4。根据此部分结果,后续研究选择50 ng/mL的重组IL-4蛋白继续在上述培养条件下进行。
1.3.5 细胞染色及流式细胞仪检测 细胞培养第5天,每孔均加入佛波醇酯(50 ng/mL)、离子霉素(1 μg/mL)刺激2 h后加入高尔基体阻断剂(10 μL/mL)继续培养3 h,收集细胞于流式细胞管内,PBS洗涤重悬后加入5 μL抗人CD3-FITC荧光抗体和5 μL抗人CD30-BV421荧光抗体进行表面染色,混匀后置于4 ℃、避光条件下孵育20 min,后用含5%BSA的PBS洗涤2次后用细胞固定和破膜试剂对细胞通透处理,加入5 μL PE-A荧光标记的抗人IFN-γ抗体或者PE-A荧光标记的IL-17A抗体,室温避光孵育30 min。PBS洗涤重悬后采用BD FACS Callibur流式细胞仪进行上机检测。应用Flowjo 10.0软件分析数据,分析圈门顺序为: FSC/SSC散点图上圈定目标淋巴细胞群(图1A),然后依据FITC通道圈定CD3+细胞(图1B),接下来用同型对照确定CD30表达荧光阴性范围分析CD3+细胞群内CD30分子表达百分率(图1C),及CD30+、CD30-T细胞群内IFN-γ+细胞(图1E)、IL-17+细胞(图1F)的表达百分率。

图1 CD3+CD30+T细胞设门及该亚群与胞内IFN-γ、IL-17共表达的设门策略及典型流式图
Fig.1 CD3+CD30+T cell gating strategy and typical flow cytometry for co-expression of CD3+CD30+T cells with IFN-γ and IL-17
A: FSC/SSC散点图中圈定目标淋巴细胞群;B: 淋巴细胞门中圈出CD3+T细胞;C: CD30的同型对照;D: 在CD3+T细胞中圈出CD30+细胞;E: 继续在CD30+细胞和CD30-细胞中分别圈出IFN-γ+细胞和IL-17+细胞
1.4 统计学处理
采用GraphPad Prism 8.0软件包对数据进行统计学分析和图表制作。计量资料以![]() 表示,两组间差异分析选用非配对或配对t检验。两变量间的相关性采用Pearson相关分析。P<0.05为差异具有统计学意义。
表示,两组间差异分析选用非配对或配对t检验。两变量间的相关性采用Pearson相关分析。P<0.05为差异具有统计学意义。
2 结 果
2.1 研究对象的临床资料
本研究共选取RA患者46例,男性6例、女性40例;年龄22~84岁,平均(51.80±9.50)岁;病程0.5~20年,平均(6.50±5.50)年;DAS28评分3.89~7.41分,平均(4.23±1.42)分。健康对照者41例,男性4例、女性37例;年龄24~61岁,平均(50.40±7.80)岁。RA患者与对照组的性别构成及年龄相比较差异无统计学意义,见表1。
表1 研究对象临床资料
Tab.1 Clinical data of study subjects

项目RA组对照组年龄/岁51.8±9.5050.4±7.80女/男40/637/4病程/年6.5±5.50/肿胀关节数(0~28)1.78±2.06/疼痛关节数(0~28)4.36±1.89/ESR/(mm·h-1)27.45±13.4512.35±3.25CRP/(mg·L-1)24.36±12.562.58±4.23RF/(IU·mL-1)157.34±178.56/抗CCP/(IU·mL-1)310.78±145.45/DAS28-ESR4.23±1.42/
ESR: 红细胞沉降率;CRP: C反应蛋白;RF: 类风湿因子;抗CCP: 抗环瓜氨酸肽
2.2 RA患者外周血清中sCD30、IL-4含量升高
采用ELISA方法检测RA血清和对照组血清中IL-4及sCD30含量,结果发现,与对照者比较,RA患者血清中sCD30和IL-4含量均升高,差异具有统计学意义(P<0.000 1,P<0.01),见表2。
表2 RA组和对照组外周血清中sCD30和 IL-4的表达水平
Tab.2 The expression levels of sCD30 and IL-4 in peripheral serum of RA patients and healthy controls

组别sCD30/(ng·mL-1)IL-4/(pg·mL-1)RA组(n=46)8.61±0.68∗∗∗∗25.22±1.59∗∗对照组(n=41)3.09±0.3520.16±0.39
与对照组相比,****P<0.000 1,**P<0.01
2.3 RA患者血清中sCD30和IL-4水平存在正相关性
采用Pearson相关性分析RA患者血清中sCD30和IL-4含量相关性,发现二者存在正相关,差异有统计学意义(P<0.01),见图2。

图2 RA患者血清中sCD30和IL-4相关性分析
Fig.2 Correlation analysis between sCD30 and IL-4 in serum of RA patients
2.4 重组人IL-4蛋白显著促进RA患者PBMC来源T细胞上CD30分子表达
重组人IL-4可以促进体外培养RA患者PBMC来源T细胞上CD30分子表达,表达升高程度与IL-4浓度呈剂量依赖,见图3。
在无IL-4刺激条件下,RA患者外周血中CD30表达高于对照组(P<0.05),而以50 ng/mL的重组人IL-4刺激体外培养的RA患者和对照组来源的PBMC,CD3+T细胞上表达CD30均明显增加,差异有统计学意义(P<0.01),见图4。
2.5 重组人IL-4蛋白抑制CD3+CD30+T细胞内IFN-γ、IL-17表达变化
用抗CD3及抗CD28刺激培养RA患者及对照组来源PBMC,结果发现RA患者CD3+CD30+T细胞内细胞因子IL-17较对照组明显升高(P<0.05)。在加入IL-4后RA及对照组CD3+CD30+T细胞内细胞因子IFN-γ、IL-17含量均较IL-4空白组明显减少(P<0.05),而CD30-T细胞内两种细胞因子的分泌无明显改变,见图5。

图3 不同浓度重组人IL-4蛋白对RA体外培养 PBMC中T细胞上CD30表达情况
Fig.3 Effects of different concentrations of recombinant human IL-4 protein on CD30 expression on T cells in PBMCs cultured in vitro in patients
PBMC取自5例RA患者,每个实验重复3次,同时设置3个复孔

图4 IL-4促进RA及对照组体外培养PBMC 中CD3+T细胞上CD30分子表达
Fig.4 IL-4 induced the expression of CD30 on CD3+ T cells of PBMC in vitro in both RA Patients and controls PBMC分别取自10例RA患者和10例对照组,每个实验重复3次,同时设置3个复孔
3 讨 论
IL-4是Howard在1982年首次发现,主要由活化Th2细胞、肥大细胞、嗜碱性粒细胞等细胞产生的一种多效性细胞因子,可抑制T细胞促炎型细胞因子如TNFα、IL-6等分泌,同时也是促使Naive T细胞向Th2细胞分化的关键细胞因子,在多种自身免疫性疾病中扮演着抗炎因子的作用[5]。
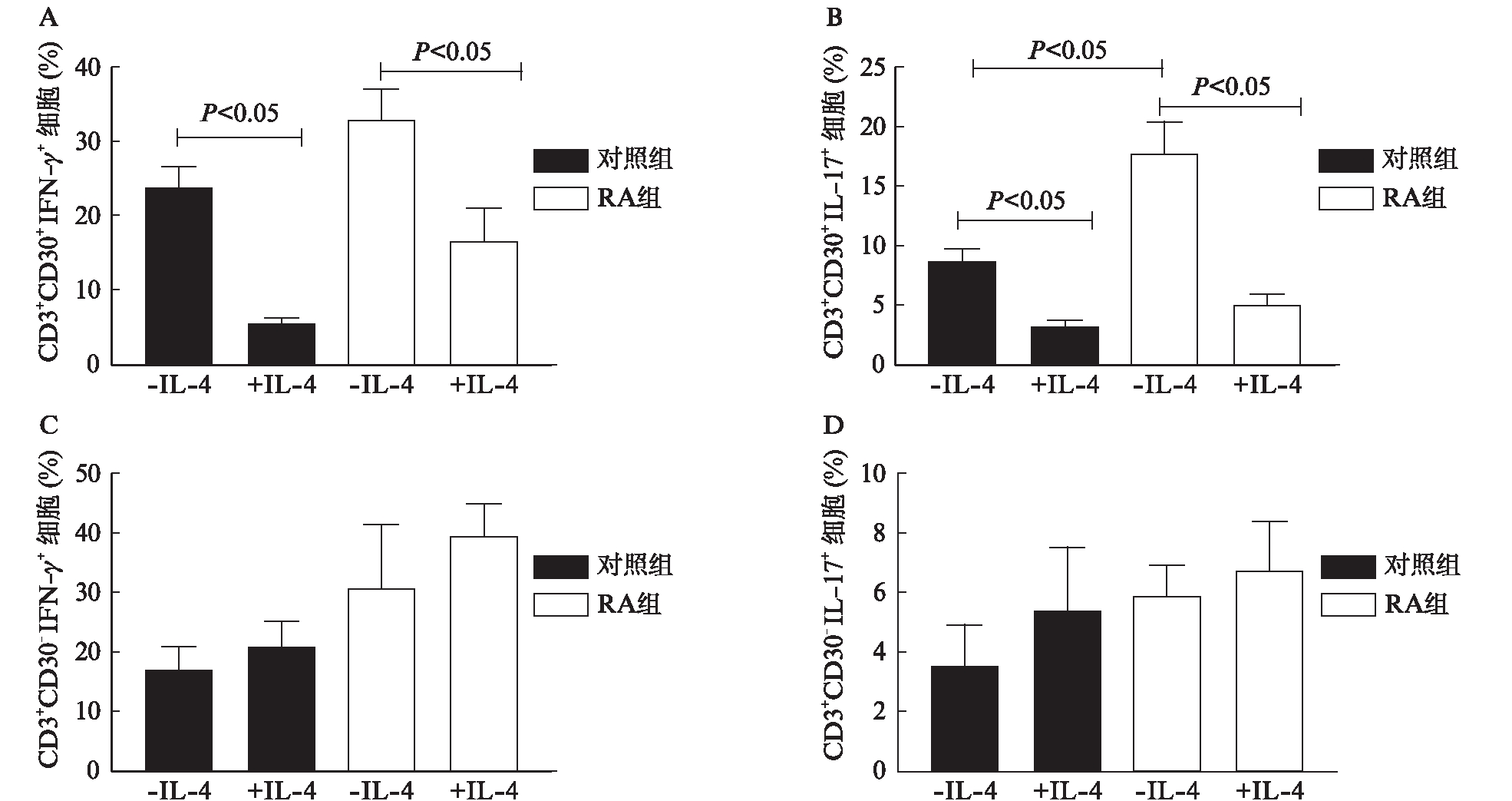
图5 重组人IL-4蛋白处理对CD30+和CD30-T细胞内IFN-γ、IL-17表达的影响
Fig.5 The effects of recombinant human IL-4 on the expression of IFN-γ and IL-17 in CD30+ or CD30- T cells. PBMC分别取自6例RA患者和6例对照组,每个实验重复3次,同时设置3个复孔
A~D依次代表RA组和对照组来源PBMC在重组人IL-4处理后CD3+CD30+和CD3+CD30-T细胞内IFN-γ、IL-17的产生变化
RA是以慢性侵蚀性关节炎为主要临床特征的自身免疫性疾病,CD4+T(Th)细胞和CD8+T(Tc)细胞共同参与该病的疾病过程[6-7]。干扰素γ是Th1和Tc1型细胞因子,可通过激活单核细胞、巨噬细胞从而诱导MHC-Ⅰ型和MHC-Ⅱ型抗原表达,进而提高抗原提呈能力,刺激并增强RA的炎症反应。IL-17是Th17和Tc17亚群的特征性细胞因子,是功能强大的促炎性细胞因子,可通过多种途径促进滑膜增生、破骨增加及成骨减少。RA患者T细胞功能异常通常表现为产生细胞因子之间的不平衡,其中TNF-α、IL-17、IL-6等促炎性细胞因子水平较高,具有促炎作用的Th1和Th17细胞亚群在RA中是介导RA疾病过程主要的T细胞亚群,而具有抑炎作用的IL-4和IL-13等细胞因子水平相对较低或升高幅度不如促炎细胞因子明显。大量研究表明,RA患者外周血和关节局部T细胞亚群表达异常,纠正T细胞亚群失衡可能是RA免疫治疗的关键。在胶原诱导性小鼠关节炎模型中研究发现,IL-4对抑制CIA模型的关节炎发生至关重要。也有研究者发现RA患者中IL-4可抑制IL-17的分泌,IL-4受体的遗传多态性可影响人类免疫系统调节致炎主要细胞因子IL-17的产生[8]。
本研究结果证实,RA患者外周血清中IL-4水平较对照组升高,提示RA疾病活动时抑炎细胞因子IL-4亦有反馈性升高,参与机体的免疫调控。共刺激分子是T活化的必要条件,目前已发现多种共刺激分子参与RA致病过程[9]。CD30分子是TNF受体超家族成员之一,目前已证实活化的T、B等细胞均可表达该分子。跨膜表达的CD30分子胞外区部分可被金属蛋白酶剪切后脱落形成化学性质较为稳定的sCD30,被认为与膜型CD30具有很好的相关性。CD30配体激活淋巴细胞表面的CD30后可诱导出多种生物学效应,包括活化、增殖、分化和细胞死亡。近年的研究提示该信号在免疫反应中具有重要的调节作用,可能是T细胞亚群平衡重要的调节分子[10]。目前在多种临床疾病中均发现CD30有异常表达,针对抗CD30的靶向治疗在淋巴瘤、银屑病等疾病中已有明显疗效[11-12]。临床研究也发现抗CD30单抗对淋巴瘤同时患有类风湿关节炎的患者治疗后两种疾病同时得到缓解[13]。
本研究结果发现,RA患者外周血中sCD30含量显著高于对照组,提示CD30分子在RA疾病过程中存在异常改变。RA患者外周血清中IL-4与sCD30含量存在正相关,提示RA疾病中IL-4和CD30有潜在关联性。此前有报道称,Cabrera等[14]发现系统性红斑狼疮患者外周血单个核细胞中CD3+T细胞表面CD30表达与细胞内IL-4水平有明显正相关[13]。Gilfillan等[15]研究发现CD30分子在活化的T细胞上表达需要通过CD28进行共刺激或IL-4作为外源性细胞因子。Nakamura等[16]研究发现外源性IL-4能够诱导活化T细胞表达CD30分子,而内源性IL-4可维持CD30分子的持续表达,在内源性IL-4缺如的情况下,Th2谱系细胞也会丧失CD30分子的表达能力。在肿瘤的研究中也发现在犬肥大细胞瘤细胞系NI-1和C2中,CD30分子是IL-4的调节靶标[17]。这些研究均提示IL-4对CD30表达及功能可能具有调节作用,但是产生的具体效应尚不明确。
本研究随后的结果显示IL-4对PBMC来源的T细胞上CD30分子表达具有促进作用,并呈浓度依赖性,体外抗CD3及抗CD28刺激活化培养条件下,RA患者CD3+CD30+T细胞内细胞因子IL-17含量明显高于对照组,提示RA患者炎性环境下活化T细胞虽然表达CD30分子增多,但不足以抑制促炎细胞因子的产生,而IL-4进一步刺激T细胞CD30的表达,则可下调CD3+CD30+T细胞分泌IFN-γ、IL-17,但对CD30-T细胞分泌细胞因子无明显影响。本研究结果提示,IL-4具有抑炎作用,该作用可能与调节T细胞上CD30表达,下调促炎因子分泌有关。
T细胞与抗原提呈细胞等细胞表面多对协同刺激分子相互作用产生T细胞活化的第二信号,根据所产生效应的不同,可将协同刺激分子分为正性共刺激分子和负性共刺激分子。本研究结果提示,IL-4可促进T细胞表面CD30分子的表达并下调其分泌促炎细胞因子水平,CD30的功能更倾向于负性共刺激分子,而IL-4是其调控分子之一,如何采用现代先进的医学技术,有效调控CD30分子表达,可能是RA治疗的新选择。
[1] SCHERER H U, H UPL T, BURMESTER G R. The etiology of rheumatoid arthritis[J]. J Autoimmun, 2020,110: 102400.
UPL T, BURMESTER G R. The etiology of rheumatoid arthritis[J]. J Autoimmun, 2020,110: 102400.
[2] DONG C, FU T, JI J, et al. The role of interleukin-4 in rheumatic diseases[J]. Clin Exp Pharmacol Physiol, 2018,45(8): 747-754.
[3] SO T, ISHII N. The TNF-TNFR family of Co-signal molecules[J]. Adv Exp Med Biol, 2019,1189: 53-84.
[4] MAR N N D, GARC
N N D, GARC A L F. The role of CD30 and CD153(CD30L) in the anti-mycobacterial immune response[J]. Tuberculosis(Edinb), 2017,102: 8-15.
A L F. The role of CD30 and CD153(CD30L) in the anti-mycobacterial immune response[J]. Tuberculosis(Edinb), 2017,102: 8-15.
[5] CHEN Z, BOZEC A, RAMMING A, et al. Anti-inflammatory and immune-regulatory cytokines in rheumatoid arthritis[J]. Nat Rev Rheumatol, 2019,15(1): 9-17.
[6] SMOLEN J S, ALETAHA D, BARTON A, et al. Rheumatoid arthritis[J]. Nat Rev Dis Primers, 2018, 4: 18001.
[7] VYAS S P, HANSDA A K, GOSWAMI R. Rheumatoid arthritis: ‘melting pot’ of T helper subsets[J]. Inter Revi Immunol, 2019,38(5): 212-231.
[8] SUN Y H, WEI S T, ZONG S H. Correlation between IL-4 gene polymorphismas well as its mRNA expressionand rheumatoid arthritis[J]. Eur Rev Med Pharmacol Sci, 2017,21(17): 3879-3885.
[9] ZHANG Q X, VIGNALI D A. Co-stimulatory and co-inhibitory pathways in autoimmunity[J]. Immunity, 2016,44(5): 1034-1051.
[10] SUZUKI A S, YAGI R, KIMURA M Y, et al. Essential role for CD30-transglutaminase 2 axis in memory Th1 and Th17 cell generation[J]. Front Immunol, 2020,11: 1536.
[11] NAKAZATO T, TAKANASHI S, HIRANO M, et al. Brentuximab vedotin is effective for rheumatoid arthritis in a patient with relapsed methotrexate-associated Hod-gkin lymphoma[J]. Ann Hematol, 2018,97(8): 1489-1491.
[12] YUE D, YOU Y, ZHANG X Q, et al. CD30L/CD30 protects against psoriasiform skin inflammation by suppressing Th17-related cytokine production by Vγ4+ γδ T cells[J]. J Autoimmun, 2019,101: 70-85.
[13] NAKAZATO T, TAKANASHI S, HIRANO M, et al. Brentuximab vedotin is effective for rheumatoid arthritis in a patient with relapsed methotrexate-associated Hod-gkin lymphoma[J]. Ann Hematol, 2018,97(8): 1489-1491.
[14] CABRERA C M, URRA J M, CARRE O A, et al. Differential expression of CD30 on CD3 T lymphocytes in patients with systemic lupus erythematosus[J]. Scand J Immunol, 2013,78(3): 306-312.
O A, et al. Differential expression of CD30 on CD3 T lymphocytes in patients with systemic lupus erythematosus[J]. Scand J Immunol, 2013,78(3): 306-312.
[15] GILFILLAN M C, NOEL P J, PODACK E R, et al. Expression of the costimulatory receptor CD30 is regulated by both CD28 and cytokines[J]. J Immunol, 1998, 160(5): 2180-2187.
[16] NAKAMURA T, LEE R K, NAM S Y, et al. Reciprocal regulation of CD30 expression on CD4+ T cells by IL-4 and IFN-γ[J]. J Immunol, 1997,158(5): 2090-2098.
[17] BAUER K, HADZIJUSUFOVIC E, CERNY-REITERER S, et al. IL-4 down regulates expression of the target receptor CD30 in neoplastic canine mast cells[J]. Vet Comp Oncol, 2017,15(4): 1240-1256.