认知功能障碍(cognitive impairment, CI)是慢性肾脏病的常见并发症[1],进入维持性血液透析(maintenance hemodialysis, MHD)的慢性肾脏病患者CI患病率更是明显增高[2]。MHD患者人体成分检测常用于MHD患者营养及水负荷的评估,研究证实营养不良是CI的危险因素[3],但是MHD患者人体成分与CI之间相关性鲜见报道。本研究分析MHD患者人体成分与CI的关系。
1 资料与方法
1.1 研究对象
选取2020年3月—2020年12月在首都医科大学宣武医院及北京市昌平区医院血液透析室的MHD患者作为研究对象,入选标准: (1) 年龄>18岁,每周透析3次,每次4 h,透析时间>3个月;(2) 采用聚砜膜透析器,使用德国Fresenius 4008S型血液透析机,透析血流量200~300 mL/min,透析液流量500 mL/min,温度35.5~36.5 ℃;(3) 使用碳酸盐透析液,透析液中钠离子138 mmol/L,钙离子1.25~1.50 mmol/L,钾离子2.0~3.0 mmol/L;(4) 签署知情同意书。排除标准: (1) 有心脏起搏器植入、金属支架植入、金属假牙、肢体缺如、严重水肿、恶性肿瘤、结核、甲状腺功能亢进;(2) 痴呆;(3) 既往曾确诊脑出血、脑梗死;(4) 视力、听力障碍等无法配合认知功能评估;(5) 近3个月曾因感染、急性心脑血管疾病等原因住院。本研究获得首都医科大学宣武医院伦理委员会批准(批件号[2019]130号)。
1.2 方法
1.2.1 一般情况 收集MHD患者的年龄、性别、受教育时间、MHD原发病、合并症(高血压、糖尿病)、Charlson合并症指数、透析龄(月)、透析前血压、心率等基本资料。
1.2.2 认知功能的评估及CI的判定 对MHD患者应用简易智力状态检查量表(mini-mental state examination, MMSE)及蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)[4]进行认知评估,评估需由经过专业培训的医生进行,如受教育年限≤12年,MoCA增加1分,总分不超过30分,所有MHD患者均于透析治疗前完成。根据MoCA结果对MHD患者进行分组,MoCA<26分判定为认知CI[5]。
1.2.3 MHD患者的Charlson合并症指数 得分为所有合并症及年龄权值。合并症评分: 共涉及16类疾病,不同疾病对应不同权重,每类疾病被赋予1、2、3、6分权重,其中1分包括: 心肌梗死、充血性心力衰竭、周围性血管疾病、脑血管疾病、痴呆、慢性阻塞性肺疾病、结缔组织疾病、消化性溃疡、糖尿病(不伴合并症)、轻度肝脏疾病;2分包括: 糖尿病(伴合并症)、中或重度慢性肾病、偏瘫、白血病、恶性淋巴瘤、实体瘤(非转移性);3分包括: 中或重度的肝脏疾病;6分包括: 转移性实体瘤、获得性免疫缺陷综合征。年龄评分: 年龄≤40岁(0分),41~50岁(1分),51~60岁(2分),61~70岁(3分),≥71岁(4分)。
1.2.4 MHD患者的实验室检查资料 包括透析前血红蛋白、尿素、肌酐、尿酸、白蛋白、前白蛋白、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、三酰甘油、碱性磷酸酶、钙、磷、镁、透析充分性(单室模型尿素清除指数,spKt/V)、全段甲状旁腺素、25羟维生素D3、β2微球蛋白、铁蛋白、转铁蛋白饱和度、叶酸、维生素B12、C反应蛋白。
1.2.5 人体成分检测 应用BCM(德国费森尤斯)测量,由同一位医师于每周第二次透析结束后测量。透析患者取平卧位,静息平卧10 min,采用非造瘘或置管侧肢体进行测量。确保测量时无手机、金属等干扰。测量得到体重指数(body mass index, BMI)、过多水负荷(over hydration, OH)、瘦体组织质量(lean tissue mass, LTM)、脂肪质量(fat tissue mass, FAT,指纯脂肪质量)、脂肪组织质量(adipose tissue mass, ATM,指纯脂肪质量加上脂肪组织水分)、体重质量(body cell mass, BCM)、瘦体重指数(lean tissue index, LTI,LTM/身高2)、脂肪组织指数(fat tissue index, FTI,ATM/身高2)、身体总体水(total body water, TBW)、细胞外水分(extracellular water, ECW)、细胞内水分(intracellular water, ICW)、ECW/ICW、ECW/BCM。
1.2.6 匹配方法 应用SPSS 23.0统计软件进行病例对照1∶1匹配,匹配因素包括性别、年龄(±5岁)、受教育时间(±3年)、合并高血压、合并糖尿病。
1.3 统计学处理
应用SPSS 23.0统计软件进行数据的统计学处理。正态分布的连续变量采用![]() 描述,非正态分布的连续变量采用P50(P25,P75)描述,组间比较采用两独立样本t检验及秩和检验;分类资料用率表示,组间比较采用χ2检验。采用Spearman相关性分析对认知功能评分与人体成分的相关性进行分析。CI的危险因素分析采用单因素及多因素Logistic回归分析,求得相关变量对CI的优势比(OR值),P<0.05表示差异有统计学意义。
描述,非正态分布的连续变量采用P50(P25,P75)描述,组间比较采用两独立样本t检验及秩和检验;分类资料用率表示,组间比较采用χ2检验。采用Spearman相关性分析对认知功能评分与人体成分的相关性进行分析。CI的危险因素分析采用单因素及多因素Logistic回归分析,求得相关变量对CI的优势比(OR值),P<0.05表示差异有统计学意义。
2 结 果
2.1 一般情况
MHD患者CI的患病率为55.83%(105/180)。根据纳入与排除标准,经过1∶1匹配后,纳入MHD患者120例,CI组与非CI组各60例,CI组与非CI组男女比例一致(均为男性39例,女性21例),平均年龄为(62.48±8.55)岁。MHD原发病: 慢性肾小球肾炎37例(30.83%),糖尿病肾病33例(27.50%),其他50例(41.67%)。
2.2 认知功能与人体成分的相关性分析
MoCA评分与LTM呈正相关,与TBW及ECW呈负相关(P<0.05),见表1。
表1 MMSE、MoCA与人体成分的相关分析
Tab.1 Correlation analysis of MMSE, MoCA and body composition
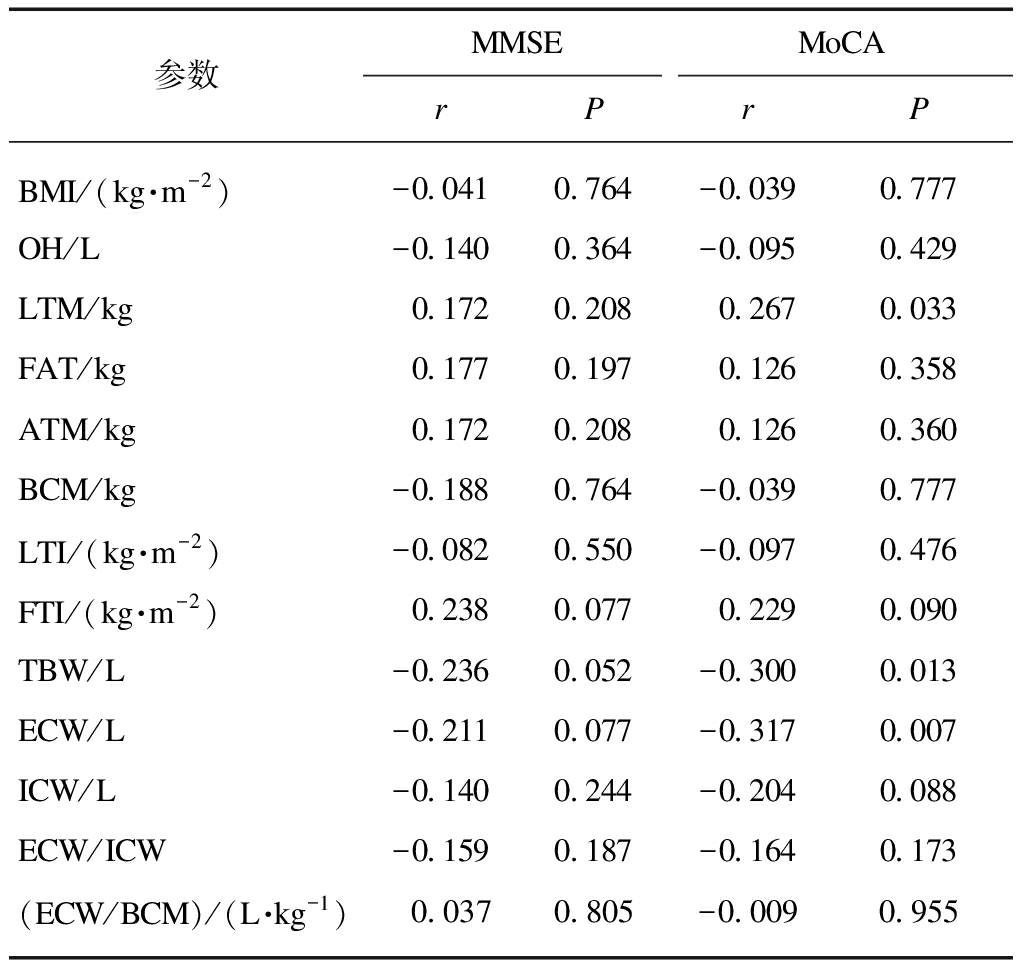
参数MMSEMoCArPrPBMI/(kg·m-2)-0.0410.764-0.0390.777OH/L-0.1400.364-0.0950.429LTM/kg0.1720.2080.2670.033FAT/kg0.1770.1970.1260.358ATM/kg0.1720.2080.1260.360BCM/kg-0.1880.764-0.0390.777LTI/(kg·m-2)-0.0820.550-0.0970.476FTI/(kg·m-2)0.2380.0770.2290.090TBW/L-0.2360.052-0.3000.013ECW/L-0.2110.077-0.3170.007ICW/L-0.1400.244-0.2040.088ECW/ICW-0.1590.187-0.1640.173(ECW/BCM)/(L·kg-1)0.0370.805-0.0090.955
2.3 CI组与非CI组认知功能与临床资料比较
CI组的MMSE及MoCA得分均明显低于非CI组(P<0.05),CI组Charlson合并症指数高于非CI组(P<0.05),CI组白蛋白低于非CI组(P<0.05),其他指标两组间差异无统计学意义(P>0.05),见表2。
2.4 CI组与非CI组人体成分之间的比较
CI组LTM低于非CI组(P<0.05),CI组TBW、ECW、ICW高于非CI组(P<0.05),其他指标两组间差异无统计学意义(P>0.05),见表3。
2.5 MHD患者CI的危险因素分析
将表2及表3中P<0.1的变量进行单因素Logistic回归分析。Lowrie等发现血清白蛋白水平是透析患者生存率的最强预测因子,血清白蛋白>40 g/L组的死亡风险最低。故本研究将白蛋白40 g/L作为分界值,将MHD患者的Charlson合并症指数的中位数、前白蛋白、LTM、TBW、ECW、ICW的均数作为分界值,发现Charlson合并症指数≥5分LTM<33 kg、TBW≥34 L、ECW≥16 L是MHD患者发生CI的危险因素(P<0.05),见表4。将上述指标带入多因素Logistic回归分析,发现Charlson合并症指数≥5分(OR=12.839,95%CI 2.659~61.997,P=0.001)、LTM<33 kg(OR=5.284,95%CI 1.029~27.150,P=0.046)是MHD患者CI的独立危险因素,见表5。
表2 MHD患者CI组与非CI组一般情况与临床资料的比较
Tab.2 Comparison of general condition and clinical data between CI group and non-CI group in MHD patients![]()
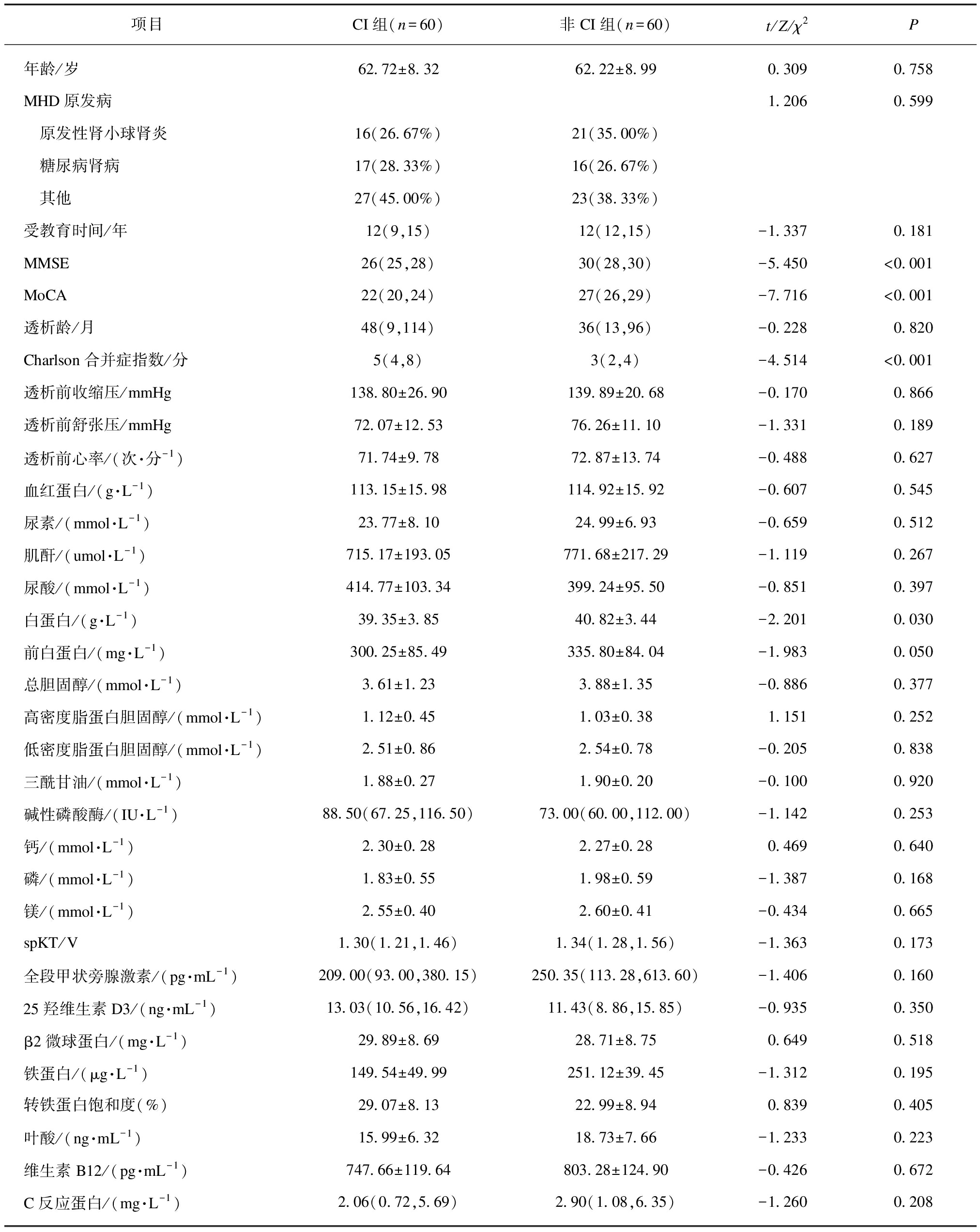
项目CI组(n=60)非CI组(n=60)t/Z/χ2P年龄/岁62.72±8.3262.22±8.990.3090.758MHD原发病1.2060.599 原发性肾小球肾炎16(26.67%)21(35.00%) 糖尿病肾病17(28.33%)16(26.67%) 其他27(45.00%)23(38.33%)受教育时间/年12(9,15)12(12,15)-1.3370.181MMSE26(25,28)30(28,30)-5.450<0.001MoCA22(20,24)27(26,29)-7.716<0.001透析龄/月48(9,114)36(13,96)-0.2280.820Charlson合并症指数/分5(4,8)3(2,4)-4.514<0.001透析前收缩压/mmHg138.80±26.90139.89±20.68-0.1700.866透析前舒张压/mmHg72.07±12.5376.26±11.10-1.3310.189透析前心率/(次·分-1)71.74±9.7872.87±13.74-0.4880.627血红蛋白/(g·L-1)113.15±15.98114.92±15.92-0.6070.545尿素/(mmol·L-1)23.77±8.1024.99±6.93-0.6590.512肌酐/(umol·L-1)715.17±193.05771.68±217.29-1.1190.267尿酸/(mmol·L-1)414.77±103.34399.24±95.50-0.8510.397白蛋白/(g·L-1)39.35±3.8540.82±3.44-2.2010.030前白蛋白/(mg·L-1)300.25±85.49335.80±84.04-1.9830.050总胆固醇/(mmol·L-1)3.61±1.233.88±1.35-0.8860.377高密度脂蛋白胆固醇/(mmol·L-1)1.12±0.451.03±0.381.1510.252低密度脂蛋白胆固醇/(mmol·L-1)2.51±0.862.54±0.78-0.2050.838三酰甘油/(mmol·L-1)1.88±0.271.90±0.20-0.1000.920碱性磷酸酶/(IU·L-1)88.50(67.25,116.50)73.00(60.00,112.00)-1.1420.253钙/(mmol·L-1)2.30±0.282.27±0.280.4690.640磷/(mmol·L-1)1.83±0.551.98±0.59-1.3870.168镁/(mmol·L-1)2.55±0.402.60±0.41-0.4340.665spKT/V1.30(1.21,1.46)1.34(1.28,1.56)-1.3630.173全段甲状旁腺激素/(pg·mL-1)209.00(93.00,380.15)250.35(113.28,613.60)-1.4060.16025羟维生素D3/(ng·mL-1)13.03(10.56,16.42)11.43(8.86,15.85)-0.9350.350β2微球蛋白/(mg·L-1)29.89±8.6928.71±8.750.6490.518铁蛋白/(μg·L-1)149.54±49.99251.12±39.45-1.3120.195转铁蛋白饱和度(%)29.07±8.1322.99±8.940.8390.405叶酸/(ng·mL-1)15.99±6.3218.73±7.66-1.2330.223维生素B12/(pg·mL-1)747.66±119.64803.28±124.90-0.4260.672C反应蛋白/(mg·L-1)2.06(0.72,5.69)2.90(1.08,6.35)-1.2600.208
表3 MHD患者CI组与非CI组人体成分的比较
Tab.3 Comparison of body composition between CI group and non-CI group in MHD patients![]()
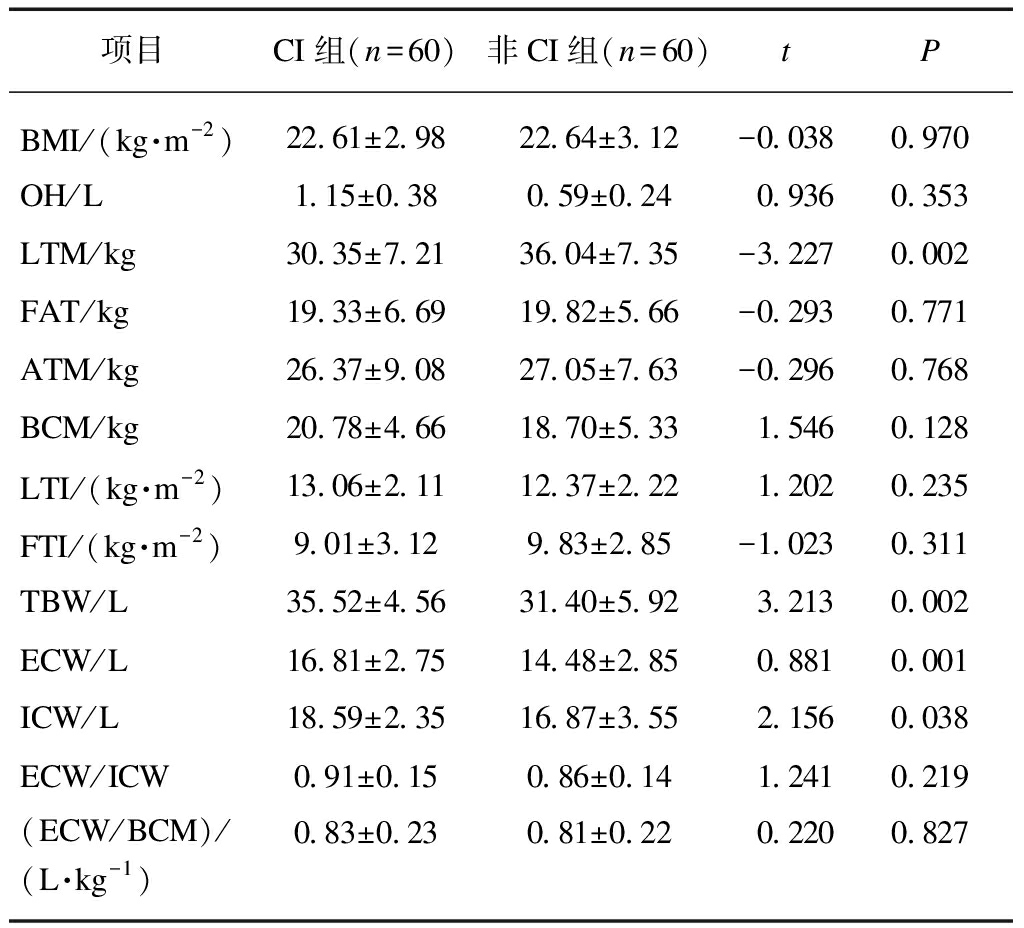
项目CI组(n=60)非CI组(n=60)tPBMI/(kg·m-2)22.61±2.9822.64±3.12-0.0380.970OH/L1.15±0.380.59±0.240.9360.353LTM/kg30.35±7.2136.04±7.35-3.2270.002FAT/kg19.33±6.6919.82±5.66-0.2930.771ATM/kg26.37±9.0827.05±7.63-0.2960.768BCM/kg20.78±4.6618.70±5.331.5460.128LTI/(kg·m-2)13.06±2.1112.37±2.221.2020.235FTI/(kg·m-2)9.01±3.129.83±2.85-1.0230.311TBW/L35.52±4.5631.40±5.923.2130.002ECW/L16.81±2.7514.48±2.850.8810.001ICW/L18.59±2.3516.87±3.552.1560.038ECW/ICW0.91±0.150.86±0.141.2410.219(ECW/BCM)/(L·kg-1)0.83±0.230.81±0.220.2200.827
表4 MHD患者CI的单因素Logistic回归分析结果
Tab.4 Results of univariate Logistic regression analysis of CI in MHD patients

变量POR95%CICharlson合并症指数≥5分0.0016.8452.253~20.801白蛋白<40g/L0.0642.0170.960~4.238前白蛋白<315mg/L0.0682.1970.942~5.123LTM<33kg0.0153.4311.268~9.279TBW≥34L0.0173.3601.242~9.092ECW≥16L0.0034.9821.724~14.398ICW≥18L0.1092.2460.836~6.037
表5 MHD患者CI的多因素Logistic回归分析结果
Tab.5 Results of multivariate Logistic regression analysis of CI in MHD patients

变量POR95%CICharlson合并症指数≥5分0.00112.8392.659~61.997LTM<33kg0.0465.2841.029~27.150TBW≥34L0.5381.6790.322~8.747ECW≥16L0.1014.4240.748~26.183
3 讨 论
本研究以MoCA=26分为分界值发现MHD患者CI的患病率为55.83%,与国内外大多数研究结果一致[6-7]。本研究发现MHD患者认知功能下降与体内水分增加、LTM降低相关。合并症增加及LTM下降是MHD患者发生CI的危险因素。
本研究发现MoCA与TBW、ECW呈负相关,且CI组MHD患者TBW、ECW、ICW高于非CI组,但是多因素Logistic回归未发现体内水分增加是MHD患者CI的独立危险因素。目前关于体内水分与认知功能关系的研究极少。ECW/ICW、ECW/TBW常作为容量负荷的指标[8]。新加坡的一项横断面研究发现2型糖尿病的患者ECW/TBW增加与认知功能下降独立相关[9]。该研究认为其可能的机制为高ECW/TBW通过增加脉压导致动脉硬化,继而损害大脑微血管系统及导致脑白质变性等。Futami等[10]发现老年心力衰竭患者ECW/TBW与认知评分呈负相关。而美国一项针对疗养院老人的横断面研究却发现ECW/TBW与认知功能无相关性[11]。MHD患者普遍存在容量负荷增加,该因素是否也是CI发生风险增加的一个因素值得进一步研究。
本研究发现MoCA与LTM呈正相关,且LTM降低是MHD患者发生CI的独立危险因素。目前临床上BCM测量LTM被认为是评价肌肉质量的“金标准”[12]。MHD患者普遍存在肌肉质量的下降[13],并且随着透析时间的延长下降更为明显[14]。LTM降低是MHD患者不良预后的危险因素[15-16]。本研究与多数社区人群人体成分及与认知功能的研究结果一致。英国一项接近200万例的回顾性队列研究发现BMI<20 kg/m2的中老年人患痴呆的风险大大增加[17]。我国上海的一项横断面研究亦发现低体重与CI相关[18]。Sui等[19]发现男性骨骼肌密度与认知功能呈正相关。台湾的一项研究发现肌少症增加CI发生率[20]。而MHD患者人体成分与认知功能的研究较少。Lee等[21]发现合并CI的MHD患者骨骼肌肌肉指数降低,骨骼肌肌肉指数与CI呈负相关。造成MHD患者LTM下降的可能原因: (1) MHD患者食欲不振导致蛋白质摄入不足;(2) 限制水的摄入导致能量摄入不足;(3) 血液透析本身导致一些营养物质的丢失。本研究提示了MHD患者人体成分尤其是LTM与认知功能之间的关系,那么可能的机制是什么?有研究认为MHD患者的LTM下降与CI有共同的病理途径即炎症反应,而CI反过来导致患者活动能力及饮食摄入下降,进一步加剧了LTM减少[21]。未来还需要多中心大样本的研究来进一步探讨。
目前国内外一般人群人体成分与认知功能的研究较多,但MHD患者该方面研究较少。本研究是横断面研究,仅能提示MHD患者人体成分与认知功能的相关性,且样本量较小,另外未考虑到比如抑郁等影响患者认知功能的其他因素,可能存在混杂偏倚。
综上所述,本研究发现LTM降低是MHD患者发生CI的危险因素,BCM作为临床工作中无创简易的人体成分测量工具,能够及早发现患者的营养不良,促进我们及时干预,改善预后。
[1] DREW D A, WEINER D E, SARNAK M J. Cognitive impairment in CKD: pathophysiology, management, and prevention[J]. Am J Kidney Dis, 2019,74(6): 782-790.
[2] MURRAY A M, TUPPER D E, KNOPMAN D S, et al. Cognitive impairment in hemodialysis patients is common[J]. Neurology, 2006,67(2): 216-223.
[3] ABDULAN I M, ONOFRIESCU M, STEFANIU R, et al. The predictive value of malnutrition for functional and cognitive status in elderly hemodialysis patients[J]. Int Urol Nephrol, 2019,51(1): 155-162.
[4] TIAN R, GUO Y D, YE P P, et al. The validation of the Beijing version of the Montreal cognitive assessment in Chinese patients undergoing hemodialysis[J]. PLoS One, 2020,15(1): e0227073.
[5] 温洪波,张振馨,牛富生,等.北京地区蒙特利尔认知量表的应用研究[J].中华内科杂志,2008(01): 36-39.
[6] LUO Y, MURRAY A M, GUO Y D, et al. Cognitive impairment and associated risk factors in older adult hemodialysis patients: a cross-sectional survey[J]. Sci Rep, 2020,10(1): 12542.
[7] ANGERMANN S, SCHIER J, BAUMANN M, et al. Cognitive impairment is associated with mortality in hemodialysis patients[J]. J Alzheimers Dis, 2018,66(4): 1529-1537.
[8] GUO Q Y, YI C Y, LI J Y, et al. Prevalence and risk factors of fluid overload in Southern Chinese continuous ambulatory peritoneal dialysis patients[J]. PLoS One, 2013,8(1): e53294.
[9] LOW S, NG T P, LIM C L, et al. Higher ratio of extracellular water to total body water was associated with reduced cognitive function in type 2 diabetes[J]. J Diabetes, 2021,13(3): 222-231.
[10] FUTAMI S, ISHIKAWA J, JUBISHI C, et al. Prevalence and determinants of cognitive impairment in elderly patients with heart failure-pilot study in a geriatric hospital[J]. Circ Rep, 2020,2(5): 265-270.
[11] KEHAYIAS J J, RIBEIRO S M, SKAHAN A, et al. Water homeostasis, frailty and cognitive function in the nursing home[J]. J Nutr Health Aging, 2012,16(1): 35-39.
[12] 李靓,王颖,檀敏,等.血液透析患者人体测量学指标与肌肉质量的相关性研究[J].中国血液净化,2017,16(11): 736-740.
[13] KOEFOED M, KROMANN C B, JULIUSSEN S R, et al. Nutritional status of maintenance dialysis patients: low lean body mass index and obesity are common, protein-energy wasting is uncommon[J]. PLoS One, 2016,11(2): e0150012.
[14] HANNA R M, GHOBRY L, WASSEF O, et al. A practical approach to nutrition, protein-energy wasting, sarcopenia, and Cachexia in patients with chronic kidney disease[J]. Blood Purif, 2020,49(1-2): 202-211.
[15] BARROS A, COSTA B E, MOTTIN C C, et al. Depression, quality of life, and body composition in patients with end-stage renal disease: a cohort study[J]. Braz J Psychiatry, 2016,38(4): 301-306.
[16] FUKASAWA H, KANEKO M, NIWA H, et al. Lower thigh muscle mass is associated with all-cause and cardiovascular mortality in elderly hemodialysis patients[J]. Eur J Clin Nutr, 2017,71(1): 64-69.
[17] QIZILBASH N, GREGSON J, JOHNSON M E, et al. BMI and risk of dementia in two million people over two decades: a retrospective cohort study[J]. Lancet Diabetes Endocrinol, 2015,3(6): 431-436.
[18] CUI G H, GUO H D, XU R F, et al. The association of weight status with cognitive impairment in the elderly population of a Shanghai suburb[J]. Asia Pac J Clin Nutr, 2013,22(1): 74-82.
[19] SUI S X, WILLIAMS L J, HOLLOWAY-KEW K L, et al. Skeletal muscle density and cognitive function: a cross-sectional study in men[J]. Calcif Tissue Int, 2021,108(2): 165-175.
[20] HSU Y H, LIANG C K, CHOU M Y, et al. Association of cognitive impairment, depressive symptoms and sarcopenia among healthy older men in the veterans retirement community in southern Taiwan: a cross-sectional study[J]. Geriatr Gerontol Int, 2014,14(Suppl 1): 102-108.
[21] LEE H, KIM K, AHN J, et al. Association of nutritional status with osteoporosis, sarcopenia, and cognitive impairment in patients on hemodialysis[J]. Asia Pac J Clin Nutr, 2020,29(4): 712-723.