肥胖患者中约有75%的人患有糖尿病,随着人口老龄化,老年2型糖尿病(type 2 diabetes mellitus, T2DM)合并肥胖的患病率逐渐上升[1]。老年T2DM合并肥胖患者会同时存在胰岛β细胞功能减退和胰岛素抵抗,老年患者活动能力下降也会进一步增加患者的BMI[2]。膳食纤维包括可溶性和不可溶性膳食纤维,可通过调节肠道微生物进而对机体产生有益影响,其摄入量与糖尿病发病风险呈负相关[3]。未被消化的膳食纤维可以被微生物在盲肠和结肠中发酵,其发酵产物主要是短链脂肪酸(short-chain fatty acids, SCFAs),包括乙酸(acetic acid, Ace)、丙酸(propionic acid, Pro)、异丁酸(isobutyric acid, i-But)、丁酸(butyric acid, But)、异戊酸(isovaleric acid, i-Pen)和戊酸(pentanoic acid, Pen)。肠道中的SCFAs主要是乙酸、丙酸和丁酸,约占所有SCFAs的95%以上[4]。有研究显示,短链脂肪酸对糖尿病具有调节作用,膳食纤维或SCFAs会改变肠道菌群结构和丰度,促进有益菌的增殖维护菌群平衡,在疾病治疗中具有调节作用[5]。丁酸可以激活胚胎干细胞中调控胰腺早期发育的基因,进而增加胰岛β细胞分化及胰岛素基因的表达[6]。肥胖是T2DM是最常见的共患疾病,并且本身也是一系列并发症的重要危险因素[7]。因此,本研究拟通过观察受试者摄入含缓释碳水化合物肠内营养制剂,观察干预前后血糖及粪便中短链脂肪酸的变化,有助于更好地管理老年T2DM合并肥胖患者的饮食。
1 资料与方法
1.1 一般资料
选取40例同济大学附属第十人民医院内分泌科的住院患者。本研究对糖尿病的诊断标准采用2010年美国糖尿病协会颁布的新标准[8]。肥胖的诊断标准参照《中国超重/肥胖医学营养治疗专家共识》[9]。
入选标准如下。(1) 糖化血红蛋白(hemoglobin A1C, HbAlc)≥6.5%,空腹血糖(fasting blood glucose, FBG)>7.0 mmol/L;(2) 口服降糖药;(3) 年龄65~80岁;(4) BMI≥28 kg/m2。
排除标准如下。(1) 近3个月内使用胰岛素、抗生素、微生物活菌制剂、乳果糖、膳食补充剂或中药等治疗;(2) 近3个月内体重不稳定;(3) 正在接受低碳水化合物膳食(如Atkins膳食)治疗;(4) 患有1型糖尿病、急慢性感染性疾病、糖尿病急性慢性并发症等;(5) 严重的心理障碍或意识障碍,不便于交流者,吸烟、酗酒;(6) 妊娠、哺乳期妇女或有妊娠计划的女性;(7) 已经参加其他临床试验等。
剔除标准如下。(1) 出现严重不良反应的受试者,仅进行安全性分析;(2) 不愿意继续参加该试验的受试者;(3) 干预期间无法坚持实施干预方案的受试者等。
最终共有33名完成研究,入组患者按照随机数字表法被随机分为干预组(n=16)和对照组(n=17)。两组患者的年龄、性别、BMI、FBG、HbAlc、空腹胰岛素(fasting insulin, FINS)、空腹C肽(fasting C-peptide, FCP)、胰岛素抵抗指数(homeostasis model of asses-sment for insulin resistence index, HOMA-IR)、理论能量摄入与实际能量摄入、理论蛋白质摄入与实际蛋白质摄入、血清三酰甘油(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)、腰围(waist circumference, WC)、腰臀脂肪比率(waist/hip ratio, WHR)、C反应蛋白(C-reactive protein, CRP)等差异均无统计学意义(均P>0.05),具有可比性,见表1。
表1 两组患者各项指标的比较
Tab.1 Comparison of various indicators between two groups of patients![]()
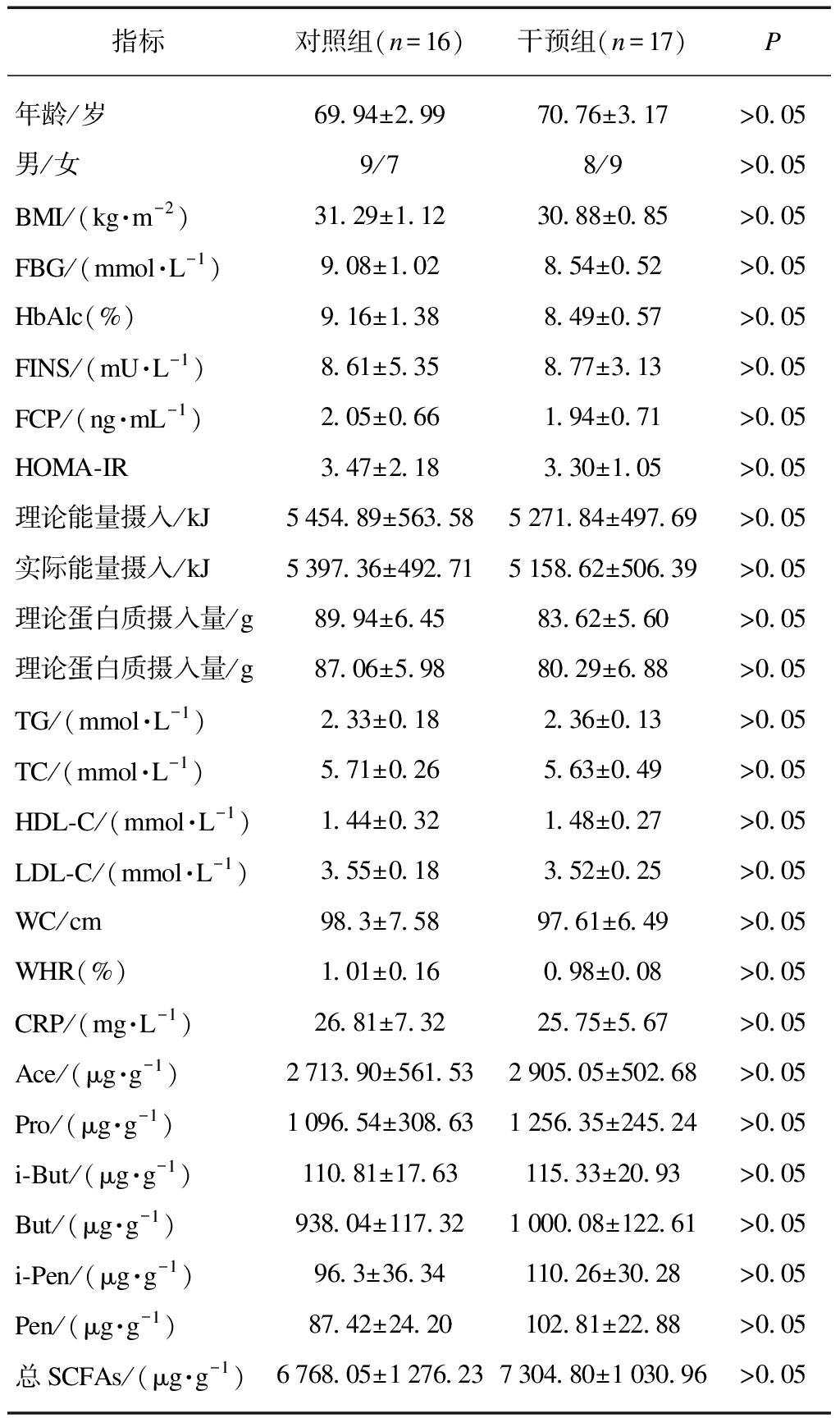
指标对照组(n=16)干预组(n=17)P年龄/岁69.94±2.9970.76±3.17>0.05男/女9/78/9>0.05BMI/(kg·m-2)31.29±1.1230.88±0.85>0.05FBG/(mmol·L-1)9.08±1.028.54±0.52>0.05HbAlc(%)9.16±1.388.49±0.57>0.05FINS/(mU·L-1)8.61±5.358.77±3.13>0.05FCP/(ng·mL-1)2.05±0.661.94±0.71>0.05HOMA-IR3.47±2.183.30±1.05>0.05理论能量摄入/kJ5454.89±563.585271.84±497.69>0.05实际能量摄入/kJ5397.36±492.715158.62±506.39>0.05理论蛋白质摄入量/g89.94±6.4583.62±5.60>0.05理论蛋白质摄入量/g87.06±5.9880.29±6.88>0.05TG/(mmol·L-1)2.33±0.182.36±0.13>0.05TC/(mmol·L-1)5.71±0.265.63±0.49>0.05HDL-C/(mmol·L-1)1.44±0.321.48±0.27>0.05LDL-C/(mmol·L-1)3.55±0.183.52±0.25>0.05WC/cm98.3±7.5897.61±6.49>0.05WHR(%)1.01±0.160.98±0.08>0.05CRP/(mg·L-1)26.81±7.3225.75±5.67>0.05Ace/(μg·g-1)2713.90±561.532905.05±502.68>0.05Pro/(μg·g-1)1096.54±308.631256.35±245.24>0.05i-But/(μg·g-1)110.81±17.63115.33±20.93>0.05But/(μg·g-1)938.04±117.321000.08±122.61>0.05i-Pen/(μg·g-1)96.3±36.34110.26±30.28>0.05Pen/(μg·g-1)87.42±24.20102.81±22.88>0.05总SCFAs/(μg·g-1)6768.05±1276.237304.80±1030.96>0.05
1.2 方法
1.2.1 医学营养干预及饮食管理 每位受试者均签署知情同意书。对所有受试者均进行饮食及运动教育,均按照医嘱服用降糖药。按照2013年的糖尿病医学营养治疗专家共识[10]中的营养治疗原则设计个体化食谱,每日提供并摄入83.62 kJ/kg,蛋白质1.0 g/kg,脂肪供能比为20%~30%,碳水化合物供能比为40%~55%。两组受试者餐次均为5餐,即早、中晚餐和上午、下午点心。干预组患者接受医学营养干预,用含缓释碳水化合物的肠内营养制剂(添加了抗性淀粉、低聚果糖,并且每100 g含膳食纤维3.46 g)替代早餐及晚餐,每餐52 g,冲调于200 mL温开水中,可提供能量920.48 kJ和蛋白质11 g;对照组患者的一日饮食均接受个体化食谱饮食。在干预期间,干预组和对照组患者使用的降糖药物剂量不变,同时给予综合性干预措施,如饮食、锻炼、健康生活方式等方面指导。
所有患者均纳入由临床营养科医生组成的微信群,在群内发放科普资料,便于患者查阅和改善依从性;并教会患者如何依据自己的食谱进行食物交换份,要求患者使用电子秤称量食物,以保证每日能量、蛋白质、脂肪及碳水化合物摄入量符合要求;同时为患者发放膳食和运动日记记录本,以随时跟踪和远程指导,要求患者每日在微信群上传每天的饮食,并每4周回访1次且交回膳食和运动日记。
1.2.2 生化指标的检测 所有受试者着单衣,在空腹状态下,脱去鞋子,由专人测量身高和体重,采用上海力衡仪器仪表有限公司TZ120型120 kg身高体重秤进行身高、体重测量;采用软皮尺测量腰围和臀围,并计算BMI;在干预前和干预8周后,清晨未进餐前,抽取静脉血进行检测,使用高效液相色谱法测定HbA1c,葡萄糖氧化酶法测定FBG,电化学发光法测定FINS、FCP,采用罗氏公司Modular DPP型全自动生化分析仪(试剂盒由罗氏公司提供)用紫外酶法检测TG,用胆固醇氧化酶法检测TC、HDL-C和LDL-C,均采用直接法测定;所有生化指标检测均由本院检验科进行完成。
1.2.3 粪便短链脂肪酸的检测 基于气相色谱-质谱联用仪(gas chromatography-mass spectrometry, GC-MS)检测平台的短链脂肪酸分析方法,绝对定量检测6种短链脂肪酸。方法: 干预结束时运用自然排便法收集粪便样本30 mg,加入2颗小钢珠,加入400 μL纯乙醇溶液;-20 ℃静置预冷2 min,研磨机研磨2 min(60 Hz);冰水浴中超声提取20 min;-20 ℃ 静置2 h;离心(离心半径8 cm,12 000 r/min,10 min,4 ℃)后吸取200 μL的上清液,使用0.22 μm 的有机相针孔过滤器过滤后,转移到LC进样小瓶,进行GC-MS分析。在Masshunter定量软件(美国Agilent公司,版本号: B.07.01)中采用默认参数对各离子碎片进行自动识别和积分,并辅助人工检查。以分析物的质谱峰面积为纵坐标,以分析物的浓度为横坐标绘制线性回归标准曲线。样本浓度计算: 将样品分析物的质谱峰面积,代入线性方程中,计算浓度结果。
1.3 统计学处理
采用SPSS 26.0统计软件对数据进行处理,所有数据均以![]() 表示,使用单因素方差分析方法,符合正态分布的资料采用Pearson相关性分析。P<0.05为差异有统计学意义。
表示,使用单因素方差分析方法,符合正态分布的资料采用Pearson相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 血糖及胰岛功能相关参数的变化
干预8周后,与对照组相比,干预组BMI、HbA1c、FBG有所下降(P<0.05),差异有统计学意义;FINS、FCP、HOMA-IR较对照组均有降低(P>0.05),但差异没有统计学意义,见表2。
2.2 血脂及炎症相关参数的变化
干预8周后,与对照组相比,TG、CRP均有下降(P<0.05);干预组TC、LDL-C较对照组有所下降(P>0.05),但差异无统计学意义;干预组HDL-C较对照组有所上升,差异无统计学意义(P>0.05),见表2。
2.3 人体测量指标的变化
干预8周后,干预组与对照组相比,BMI、腰围、腰臀脂肪比率均有下降(P<0.05),见表2。
2.4 粪便短链脂肪酸量的变化
比较两组患者干预8周后粪便中乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸的含量,结果显示干预组患者粪便中SCFAs总量及丁酸的浓度显著高于对照组(P<0.05);而乙酸、丙酸、异丁酸、戊酸、异戊酸、己酸含量比对照组有所升高(P>0.05),但差异没有统计学意义,见表2。
表2 两组患者干预后各项指标的比较
Tab.2 Comparison of various indicators between two groups of patients after intervention![]()
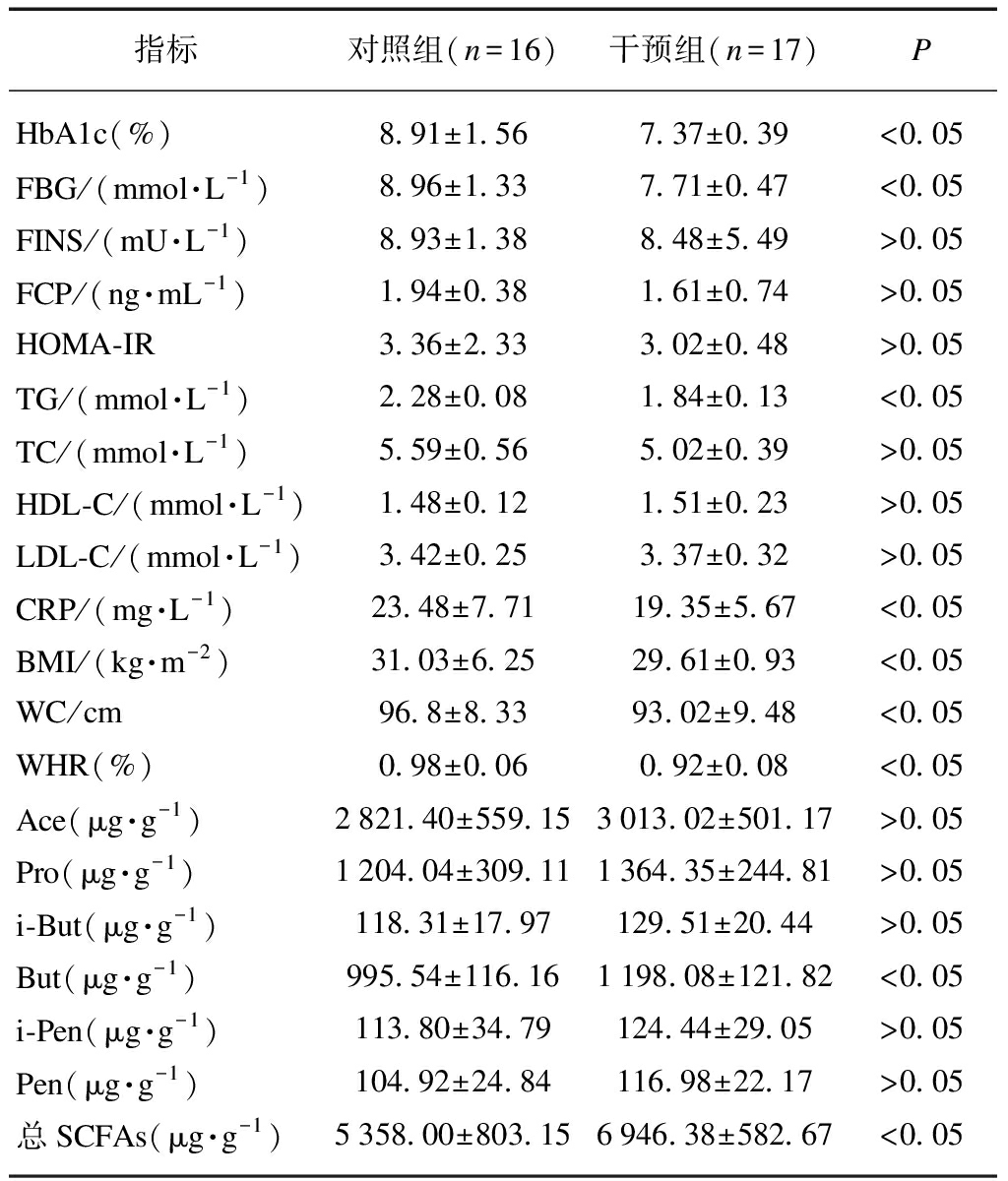
指标对照组(n=16)干预组(n=17)PHbA1c(%)8.91±1.567.37±0.39<0.05FBG/(mmol·L-1)8.96±1.337.71±0.47<0.05FINS/(mU·L-1)8.93±1.388.48±5.49>0.05FCP/(ng·mL-1)1.94±0.381.61±0.74>0.05HOMA-IR3.36±2.333.02±0.48>0.05TG/(mmol·L-1)2.28±0.081.84±0.13<0.05TC/(mmol·L-1)5.59±0.565.02±0.39>0.05HDL-C/(mmol·L-1)1.48±0.121.51±0.23>0.05LDL-C/(mmol·L-1)3.42±0.253.37±0.32>0.05CRP/(mg·L-1)23.48±7.7119.35±5.67<0.05BMI/(kg·m-2)31.03±6.2529.61±0.93<0.05WC/cm96.8±8.3393.02±9.48<0.05WHR(%)0.98±0.060.92±0.08<0.05Ace(μg·g-1)2821.40±559.153013.02±501.17>0.05Pro(μg·g-1)1204.04±309.111364.35±244.81>0.05i-But(μg·g-1)118.31±17.97129.51±20.44>0.05But(μg·g-1)995.54±116.161198.08±121.82<0.05i-Pen(μg·g-1)113.80±34.79124.44±29.05>0.05Pen(μg·g-1)104.92±24.84116.98±22.17>0.05总SCFAs(μg·g-1)5358.00±803.156946.38±582.67<0.05
2.5 粪SCFAs与糖代谢指标的相关性
由表3可知,HbA1c、FCP与粪便中丁酸呈负相关(P<0.05),与乙酸、丙酸、异丁酸、异戊酸、戊酸及总短链脂肪酸无相关性(P>0.05);FINS、FBG、HOMA-IR与乙酸及与总短链脂肪酸水平呈负相关(P<0.05),与丙酸、异丁酸、丁酸、异戊酸、戊酸无相关性(P>0.05)。
表3 老年T2DM合并肥胖患者粪便中SCFAs与糖代谢指标的相关性
Tab.3 Correlation between SCFAs in feces and glucose metabolism in obese elderly patients with T2DM
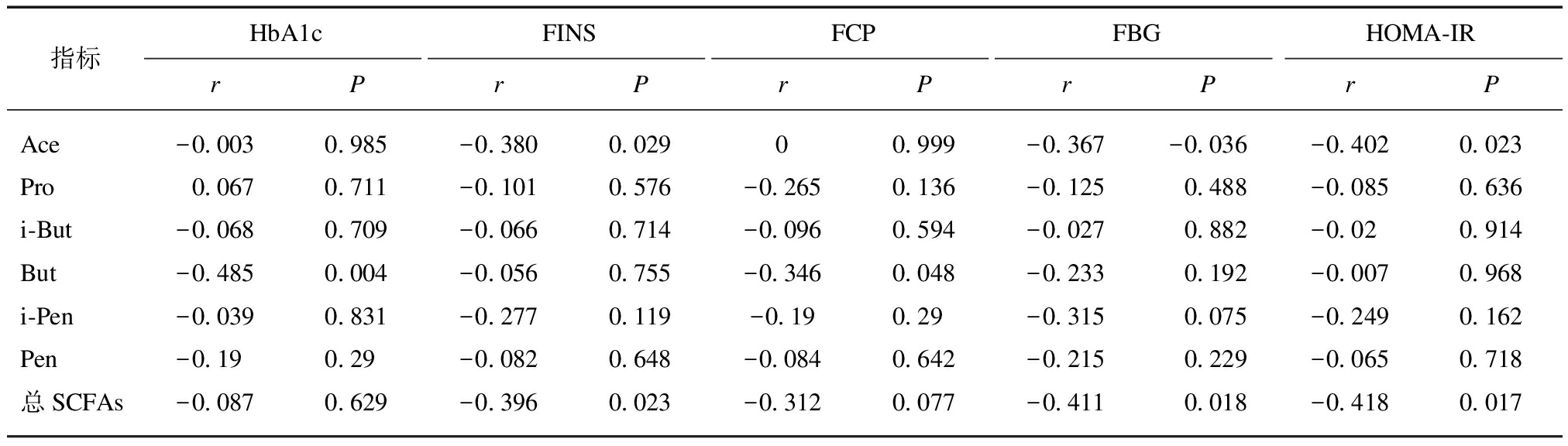
指标HbA1cFINSFCPFBGHOMA-IRrPrPrPrPrPAce-0.0030.985-0.3800.02900.999-0.367-0.036-0.4020.023Pro0.0670.711-0.1010.576-0.2650.136-0.1250.488-0.0850.636i-But-0.0680.709-0.0660.714-0.0960.594-0.0270.882-0.020.914But-0.4850.004-0.0560.755-0.3460.048-0.2330.192-0.0070.968i-Pen-0.0390.831-0.2770.119-0.190.29-0.3150.075-0.2490.162Pen-0.190.29-0.0820.648-0.0840.642-0.2150.229-0.0650.718总SCFAs-0.0870.629-0.3960.023-0.3120.077-0.4110.018-0.4180.017
3 讨 论
对于老年T2DM合并肥胖患者提供积极的医学营养治疗[11],将更加有利于控制血糖及体重管理,也是防治糖尿病慢性并发症的核心[12]。研究表明,服用低血糖指数饮食可能是降低2型糖尿病患者血糖的一种潜在饮食方式[13]。本研究使用的肠内营养制剂包含麦芽糖糊精、抗性淀粉及低聚果糖等缓释碳水化合物成分,每100 g提供3.46 g膳食纤维,血糖指数为30,属于低血糖指数食物。膳食纤维通常是寡糖或多糖,难以被人体消化和吸收,不会直接为人体供能,但在体内能起到抵抗消化酶的分解、缓慢释放葡萄糖的作用,具有较低的胰岛素反应,可控制血糖平衡,减少饥饿感[14-15]。膳食纤维能使膳食黏稠度增高,在胃的排空速度减慢及缓慢的跨小肠黏膜静水层弥散,促使纤维在小肠的转运时间变长,进而延缓了碳水化合物的吸收[16]。本研究结果发现,老年T2DM合并肥胖的患者运用含缓释碳水化合物的肠内营养制剂干预8周后,可有效的降低患者的血糖水平、胰岛素和C肽的分泌,改善胰岛功能。既往研究也显示含缓释碳水化合物的肠内营养制剂可以有效地改善老年T2DM合并肥胖患者的血糖,降低血脂水平、减轻体重、缩小腰围、利于HbA1c达标和提高患者的依从性和满意率[17]。王兴纯等[18]研究显示,使用含缓释碳水化合物肠内营养制剂干预肥胖患者,可减轻肥胖患者体重、改善肥胖患者脂肪分布,同时有效调节血脂和血糖,有利于改善肥胖患者代谢水平,并具有良好的耐受性和安全性。
目前大多数研究多集中于含缓释碳水化合物肠内营养制剂对血糖的影响,而对干预后产生的粪短链脂肪酸研究较少。本研究使用的肠内营养制剂富含低聚果糖和大豆纤维,其中低聚果糖(fructooligo-saccharide, FOS)是不被人体消化吸收,且升血糖指数低于葡萄糖和麦芽糖糊精,可以完整的直接到达大肠的低聚糖类[19-20]。这类膳食纤维能被肠道菌群发酵利用,生成SCFAs,进入肝脏参与代谢,不会引起血糖升高[21]。肠腔内的SCFAs会被肠细胞吸收,进而到达血液循环,影响葡萄糖在肌肉、肝脏和脂肪中的储存。所有这些作用都可以对糖尿病产生有益的影响[22]。近年来的研究表明,糖尿病的病因除了肥胖、遗传和胰岛素自身功能不全外,肠道菌群的结构性失衡也是糖尿病发生的一种可能的重要机制,表现为菌群多样性和稳定性即菌群结构遭到破坏,如有益菌菌群的减少或条件致病菌菌群的增强,诱发肠道产生低度慢性炎症,促使细菌内毒素释放,从而导致胰岛素抵抗。Larsen等[23]发现肠道微生态失衡可能参与糖尿病形成。膳食纤维被肠道菌群代谢所产生的短链脂肪酸,可通过改变菌群结构而显著改善2型糖尿患者的血糖稳态、胰岛素分泌及胰岛素敏感性[24]。本研究通过检测患者粪便中短链脂肪酸的含量显示,运用含缓释碳水化合物的肠内营养制剂干预后,粪便中丁酸及短链脂肪酸总含量增加,这可能与患者血糖代谢进一步改善密切相关。有学者认为短链脂肪酸中的丁酸盐可能是糖尿病治疗中较为重要的一种化学物[25]。另有研究认为SCFAs由厌氧菌分解碳水化合物产生,包括乙酸、丙酸和丁酸,在控制体重,平衡葡萄糖稳态、胰岛素敏感性等方面发挥重要作用,对T2DM的健康至关重要[26],这些与本研究结果一致。膳食纤维为肠道双歧杆菌等益生菌提供食物,促进短链脂肪酸产生有益菌和丁酸合成,为肠道细胞提供了充足的营养[27]。本研究推测含缓释碳水化合物肠内营养制剂对SCFAs的作用与其中的低聚果糖有关,具有调节胃肠道的功能,能够缓解肠道微生态失调,以及通过调节免疫系统和炎症反应维护肠道的屏障功能[28]。本研究将粪便中SCFAs与糖代谢指标进行相关性分析发现: HbA1c、FCP与粪便中丁酸呈负相关,FINS、FBG、HOMA-IR与乙酸及总短链脂肪酸水平呈负相关。
CRP作为机体的急性时相反应蛋白之一,在机体异常状态下的反应灵敏度较高,有研究认为,CRP不仅与糖尿病的微炎性反应状态有关,而且与胰岛素抵抗等方面有着密切联系。T2DM被认为是一种慢性炎症性疾病,肥胖是T2DM是重要的易感因素,而慢性炎症反应在肥胖胰岛素抵抗-糖代谢异常病因链中发挥了重要作用[29]。本研究结果显示,干预后,实验组的CRP表达水平显著低于对照组,说明该肠内营养制剂有助于稳定老年T2DM合并肥胖患者炎症状态。
本研究结果中,干预组FINS、FCP、HOMA-IR较对照组均有降低,但差异无统计学意义,可能与该研究样本量较少以及干预时间比较短有关,后期可以实行更长周期和更多样本的实践。
综上所述,对于老年T2DM合并肥胖患者,在药物治疗的前提下,合理使用适合糖尿病患者的富含缓释淀粉的肠内营养制剂,可以有效地降低患者的血糖水平,改善脂代谢和胰岛功能,增加短链脂肪酸的产生,改善肠道菌群失衡,为老年T2DM合并肥胖的防治提供新思路。
[1] 胡世莲,王静,程翠,等.中国居民慢性病的流行病学趋势分析[J].中国临床保健杂志,2020,23(3): 289-294.
[2] 奚齐红,朱翠玲,杨篷,等.新诊断酮症起病的2型糖尿病患者胰岛素抵抗及胰岛功能分析[J].同济大学学报(医学版),2018,39(2): 84-89.
[3] ISMAIEL M, YANG H, MIN C. Dietary fiber role in type 2 diabetes prevention[J]. Br Food J, 2016,118(4): 961-975.
[4] SUN M M, WU W, LIU Z J, et al. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases[J]. J Gastroenterol, 2017,52(1): 1-8.
[5] KIM C H. Microbiota or short-chain fatty acids: which regulates diabetes?[J]. Cell Mol Immunol, 2018,15(2): 88-91.
[6] 庞博,任军丽,杨修利,等.短链脂肪酸对糖尿病的调节机制及应用[J].食品与营养科学,2018,7(4): 350-356.
[7] 刘金刚,郑成竹,王勇.中国肥胖和2型糖尿病外科治疗指南(2014)[J].中国实用外科杂志,2014,8(11): 499-504.
[8] American Diabetes Association. Standards of medical care in diabetes—2010[J]. Diabetes Care, 2010,33(Suppl 1): S11-61.
[9] 中国超重/肥胖医学营养治疗专家共识编写委员会.中国超重/肥胖医学营养治疗专家共识(2016年版)[J].糖尿病天地(临床),2016,10(10): 451-455.
[10] 王卫庆,宁光,包玉倩,等.糖尿病医学营养治疗专家共识[J].中华内分泌代谢杂志,2013,29(5): 357-362.
[11] CHEEMA G A. Medical Nutrition Therapy for Type-2 Diabetes [J]. Curr Res Diabetes Obes J, 2019,12(4): 84-89.
[12] VISWANATHAN V, KRISHNAN D, KALRA S, et al. Insights on medical nutrition therapy for type 2 diabetes mellitus: an Indian perspective[J]. Adv Ther, 2019,36(3): 520-547.
[13] STENVERS D J, SCHOUTEN L J, JURGENS J, et al. Breakfast replacement with a low-glycaemic response liquid formula in patients with type 2 diabetes: a randomised clinical trial[J]. Br J Nutr, 2014,112(4): 504-512.
[14] VINOY S, LAVILLE M, FESKENS E J M. Slow-release carbohydrates: growing evidence on metabolic responses and public health interest. Summary of the symposium held at the 12th European Nutrition Conference(FENS 2015)[J]. Food Nutr Res, 2016,60(1): 31662.
[15] 蔡颂文,韩婷,韩玉麒,等.富含缓释淀粉高单不饱和脂肪酸型肠内营养制剂对超重的2型糖尿病病人血糖和血脂的影响[J].肠外与肠内营养,2014,21(3): 138-141.
[16] WEICKERT M O. High fiber intake, dietary protein, and prevention of type 2 diabetes[J]. Expert Rev Endocrinol Metab, 2018,13(5): 223-224.
[17] 徐璐,胡竹芳.雅培益力佳SR在老年肥胖2型糖尿病患者饮食管理中的应用[J].实用临床医学,2014,15(9): 32-33.
[18] 王兴纯,黄玥晔,曹涵,等.代餐膳食对单纯性肥胖患者体质量及体脂分布的影响[J].第二军医大学学报,2015,36(4): 450-454.
[19] SIVIERI K, MORALES M L, SAAD S M, et al. Prebiotic effect of fructooligosaccharide in the simulator of the human intestinal microbial ecosystem(SHIME® model)[J]. J Med Food, 2014,17(8): 894-901.
[20] FANG C T, FANG Y P, HUANG Y B, et al. Epidemiology and risk factors of coronary artery aneurysm in Taiwan: a population based case control study[J]. BMJ Open, 2017,7(6): e014424.
[21] LIU F T, LI P, CHEN M X, et al. Fructooligosaccharide(FOS) and galactooligosaccharide(GOS) increase Bifidobacterium but reduce butyrate producing bacteria with adverse glycemic metabolism in healthy young population[J]. Sci Rep, 2017,7(1): 11789.
[22] BRUNKWALL L, ORHO-MELANDER M. The gut microbiome as a target for prevention and treatment of hyperglycaemia in type 2 diabetes: from current human evidence to future possibilities[J]. Diabetologia, 2017,60(6): 943-951.
[23] LARSEN N, VOGENSEN F K, VAN DEN BERG F W, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010,5(2): e9085.
[24] ZHAO L P, ZHANG F, DING X Y, et al. Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J]. Science, 2018,359(6380): 1151-1156.
[25] KHAN S, JENA G. The role of butyrate, a histone deacetylase inhibitor in diabetes mellitus: experimental evidence for therapeutic intervention[J]. Epigenomics, 2015,7(4): 669-680.
[26] SANNA S, VAN ZUYDAM N R, MAHAJAN A, et al. Causal relationships among the gut microbiome, short-chain fatty acids and metabolic diseases[J]. Nat Genet, 2019,51(4): 600-605.
[27] ZHOU T, WANG M, MA H, et al. Dietary fiber, genetic variations of gut microbiota-derived short-chain fatty acids, and bone health in UK biobank[J]. J Clin Endocrinol Metab, 2021,106(1): 201-210.
[28] WEI Y G, YANG H X, ZHU C H, et al. Hypoglycemic effect of ginsenoside Rg5 mediated partly by modulating gut microbiota dysbiosis in diabetic db/db mice[J]. J Agric Food Chem, 2020,68(18): 5107-5117.
[29] 郭丽璇,胡琼英,熊大迁.肠道菌群调控2型糖尿病发生发展的研究进展[J].实用医学杂志,2020,36(9): 1142-1147.