胆囊息肉样病变(polypoid lesions of the gall-bladder, PLG)泛指胆囊壁向腔内呈息肉状生长的隆起样病变的总称,PLG主要包括胆囊肿瘤性病变(胆囊癌、胆囊腺瘤)和非肿瘤病变(胆固醇性息肉、炎性息肉等),不同类型的病变临床治疗方案及其预后差别很大[1]。目前,通常以超声检测息肉的大小作为鉴别诊断的重要指标,息肉最大直径≥1 cm 通常认为是肿瘤性息肉的可能性较大,需手术治疗[2-3],但非肿瘤性息肉患者接受胆囊切除术后,大约20%的患者会产生持续腹痛和约1.7%的患者造成胆管损伤[4-5]。因此,对于直径≥1 cm的胆囊息肉患者,准确鉴别息肉是否为“肿瘤性”成为选择治疗方法的关键。常规超声对胆囊息肉诊断灵敏度较高(32%~90%),但鉴别诊断能力不足,其早期胆囊癌的检出率仅23%[6]。CEUS可实时显示胆囊壁连续性、病灶内部的血管形态及增强模式,有助于提高胆囊肿瘤性息肉样病变的诊断准确率[7],但定性分析的主观性较强,容易出现观察者间的差异[8]。CEUS定量分析软件可绘出病灶内造影剂微泡灌注和消退的时间-强度曲线(time intensity curve, TIC),获得各项定量参数,更能客观反映病灶内血流灌注信息。因此,有必要对CEUS结果增加TIC曲线定量分析。本研究旨在探讨超声造影定性结合定量分析在直径≥1 cm的胆囊肿瘤性息肉鉴别诊断中的应用价值。
1 资料与方法
1.1 一般资料
选取超声科2018年7月—2019年10月于上海健康医学院附属周浦医院就诊的共33例经病理证实的胆囊息肉样病变患者作为研究对象,其中男性患者13例,女性患者20例,年龄54~87岁,平均年龄(65.5±6.4)岁。患者多为常规体检发现胆囊息肉。纳入标准为: (1) 胆囊病变经病理证实;(2) 病灶最大直径≥1 cm;(3) 患者同意进行超声造影检查并自愿签署了超声造影检查知情同意书。排除标准: (1) 年龄<18岁;(2) 孕妇及哺乳期妇女;(3) 严 重肝肾功能不全者;(4) 近期患急性心肌梗死、脑梗死、重度肺动脉高压者。本研究经过上海健康医学院附属周浦医院伦理委员会批准(2021-C-081)。
1.2 仪器与方法
1.2.1 常规超声 使用EPIQ5超声仪器(飞利浦电子集团,荷兰),2~9 MHz凸阵探头,患者空腹8 h以上,取仰卧位。如果有多发性息肉,则选择最大的息肉进行检查。经常规超声检查胆囊及邻近的肝组织,记录病灶的大小、回声、形态、数量、位置、血供情况。
1.2.2 超声造影 超声造影前,需要对患者进行呼吸训练,确保图像的稳定性。超声造影机械指数0.08,选用超声造影剂(SonoVue,意大利Bracco公司),单次静脉注射2.4 mL,然后立即注入5 mL生理盐水。胆囊超声造影时以同深度正常肝脏实质为参照,观察时间约3~5 min。如果初始成像不清楚,则在第一次CEUS后10 min再注射1次。所有的静态与动态图像都存储在硬盘中,以供进一步分析。
1.2.3 观察图像 由两名超声造影经验丰富的医生观察图像,使用双盲法分析。(1) 增强时相: 增强早期(10~30 s)和增强晚期(31~180 s)。(2) 增强水平: 将同深度的正常肝实质作对照组,根据增强程度分为4种,即无增强、低增强、等增强、高增强。(3) 增强模式: 观察病灶内部增强水平,分为均匀、不均匀增强。(4) 胆囊壁: 连续和不连续。
1.2.4 定量分析 为排除患者的呼吸运动对图像造成的影响,定量分析时将使用运动呼吸校正功能。将感兴趣区(region of interest, ROI)放置在增强较为明显的胆囊息肉上,在邻近的同深度正常肝实质中绘制第二个ROI,自动绘制出TIC曲线,计算并记录参数: 上升时间(rise time, RT)、峰值强度(peak intensity, PE)、平均通过时间(mean transit time, MTT)、达峰时间(time to peak, TTP)、消退时间(fall time, FT)和曲线下面积(area under the curve, AUC)。
1.3 统计学处理
使用SPSS Statistics 22.0进行统计分析。偏态分布的计量数据使用P50(P25,P75)表示,组间差异的比较采用和检验进行分析。分类资料分析采用χ2检验和Fisher精确检验,比较非肿瘤性息肉和肿瘤性息肉患者的常规超声和CEUS特征,P<0.05为差异有统计学意义。此后,使用ROC曲线评估有显著差异的超声造影参数的诊断价值,并使用类别变量的加权k统计量和连续变量的组内相关系数来评估观察者间定性和定量分析的一致性。以下用来解释加权k统计量: 0~0.2为较差;0.21~0.40为一般;0.4~0.6为中等;0.61~0.80为较好;0.81~1.00为接近一致。
2 结 果
33例入选患者中非肿瘤性息肉16例,肿瘤性息肉17例。非肿瘤性息肉包括12例胆固醇息肉,4例炎性息肉。肿瘤性息肉包括腺癌12例,腺鳞癌1例,腺瘤4例。
2.1 常规超声
肿瘤性息肉直径均大于非肿瘤性息肉,且呈宽基底形态,差异有统计学意义(P<0.001,P=0.002),彩色多普勒血流成像显示,肿瘤性息肉内存在少量血流信号,而非肿瘤性息肉大部分无血流信号(P=0.001),见表1。
2.2 超声造影定性分析
2.2.1 增强水平 13例胆囊癌增强表现为“慢进快出高增强”,增强晚期均表现为低增强;4例胆囊腺瘤中有3例表现为“慢进同出高增强”,1例表现为低增强,增强晚期表现为低增强;16例胆囊息肉中有14例表现为“快进快出高增强”,2例表现为低增强,增强晚期表现为低增强。
2.2.2 增强模式 17例肿瘤性胆囊息肉中有12例表现为均匀增强,5例表现为不均匀增强;16例非肿瘤性胆囊息肉中有15例表现为均匀增强,1例表现为不均匀增强。
2.2.3 囊壁连续性 17例肿瘤性息肉中有12例囊壁不连续,16例非肿瘤性息肉中囊壁均连续完整(P<0.001),见表1。
表1 33例患者常规超声和超声造影特征的定性分析结果
Tab.1 Results for qualitative analysis of conventional ultrasound and CEUS characteristics in 33 patients

参数非肿瘤性息肉(n=16)肿瘤性息肉(n=17)良性(n=4)恶性(n=13)Pk常规超声特征 大小/cm1.2(1.1,1.4)1.6(1.5,2.1)2.5(1.8,4.6)<0.0010.134 息肉数量(单个/多个)14∶23∶110∶30.854<0.001 息肉的形态(有蒂/无蒂)15∶14∶01∶120.0020.835 息肉回声(低回声/等回声/高回声)10∶5∶11∶2∶17∶6∶00.5890.378 息肉内供(无血管/点状/线形)13∶2∶21∶2∶11∶2∶100.0100.090 胆囊壁连续性(连续/不连续)16∶04∶05∶80.052<0.001CEUS特征 始增时间/s15.0(9.1,28.0)13.8(5.0,26.0)15.0(9.2,27.8)0.387<0.001 息肉内血管构筑形态(点状/单支血管/分支状/曲折或不规则)10∶3∶3∶00∶3∶1∶02∶2∶5∶40.145<0.001 息肉增强模式(均匀性/不均匀性)15∶13∶19∶40.772<0.001 息肉消退速度(慢/同步/快)1∶1∶140∶3∶10∶2∶150.3440.062 胆囊壁连续性(连续/不连续)16∶04∶01∶12<0.0010.0523
2.3 超声造影TIC定量分析
胆固醇息肉、胆囊腺瘤和胆囊癌患者造影图像见图1(TIC曲线: 蓝色曲线为胆囊息肉,黄色曲线为正常肝脏),定量分析结果表明非肿瘤性息肉的RT、MTT、TTP和FT明显短于肿瘤性息肉(P<0.001、P=0.008、P=0.013、P=0.002),见表2。根据ROC曲线,这些定量参数鉴别肿瘤性息肉和非肿瘤性息肉的灵敏度和特异度分别为90%和75.0%,见图2。
表2 CEUS时间-强度曲线的定量分析结果
Tab.2 Results of quantitative analysis for time-intensity curves derived from CEUS examinations

参数非肿瘤性息肉(n=16)肿瘤性息肉(n=17)PkRT/s5.3(2.8,8.0)8.1(5.8,15.6)<0.0010.887PE1228.9(220.4,16567.0)1226.1(83.5,6846.5)0.8990.847MTT/s19.4(4.9,19.5)34.5(15.8,111.3)0.0080.564TTP/s7.9(3.9,21.5)12.5(7.6,33.9)0.0150.887FT/s8.8(4.8,25.8)17.5(12.2,39.6)0.0020.778灌注时间AUC3363.4(486.1,51632.1)8221.3(328.6,22739.9)0.1700.752消退时间AUC6934.5(1034.9,83377.9)14460.9(8695.9,40269.8)0.1430.776
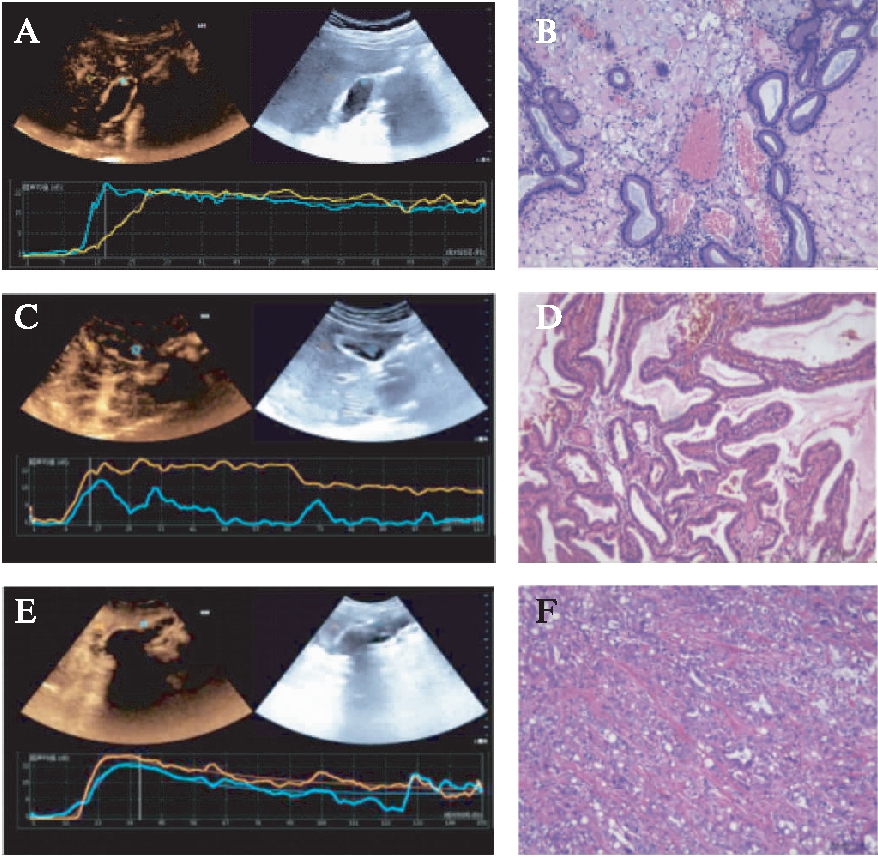
图1 胆囊息肉造影、TIC曲线及病理
Fig.1 Gallbladder polyp CEUS, TIC curve and pathology
A、B: 胆固醇息肉TIC曲线及病理图;C、D: 胆囊腺瘤TIC曲线及病理图;E、F: 胆囊癌TIC曲线及病理图
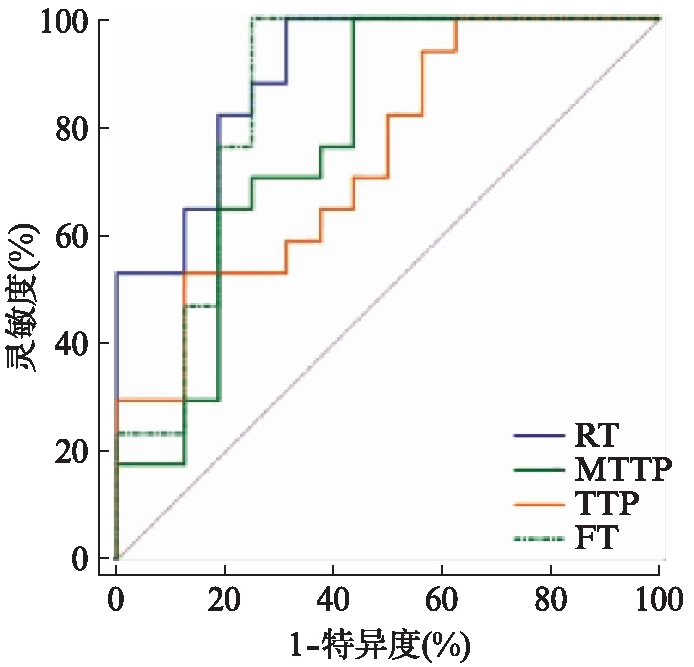
图2 RT、MTTP、TTP和FT的ROC曲线
Fig.2 ROC curve of RT, MTTP, TTP and FT
2.4 CEUS定性及结合定量诊断
根据超声造影表现定性分析,33例患者中诊断准确率为66.7%(22/33),超声造影定性及结合TIC曲线定量分析诊断准确率为87.9%(29/33)。其中,2个良性病变被错误地分类为恶性,而2个恶性病变被误诊为良性,见表3。
表3 CEUS定性及结合定量分析诊断胆囊息肉 良恶性的性能比较
Tab.3 Comparison of CEUS qualitative and quantitative analysis in the diagnosis of benign and malignant gallbladder polyps
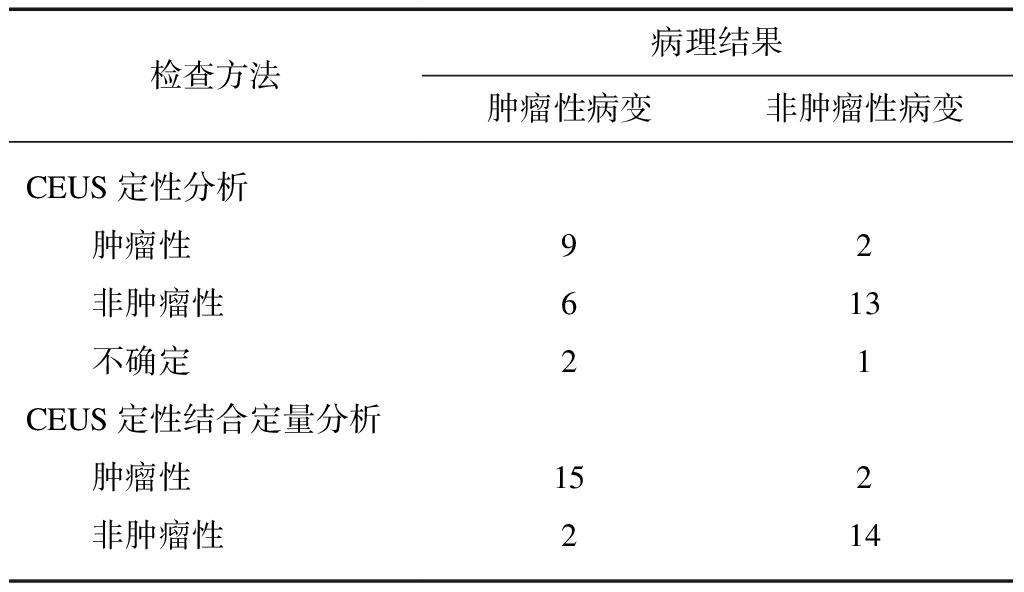
检查方法病理结果肿瘤性病变非肿瘤性病变CEUS定性分析 肿瘤性92 非肿瘤性613 不确定21CEUS定性结合定量分析 肿瘤性152 非肿瘤性214
3 讨 论
胆囊息肉样病变在临床较为常见,分为肿瘤性息肉与非肿瘤性息肉,肿瘤性息肉以腺瘤最为常见,非肿瘤性息肉以胆固醇息肉最为多见[9-10]。临床上对于肿瘤性息肉与非肿瘤性息肉的处理方法不尽相同,胆固醇息肉本质为吞噬了大量胆固醇的泡沫样细胞在胆囊黏膜下的堆积,最终隆起成为息肉样病变,因此胆固醇息肉本身不会转化为恶性肿瘤,无需进行胆囊切除术[11]。胆囊腺瘤尽管是良性肿瘤,却具有一定的恶性可能,已经有研究证实其为癌前病变[12],因此对胆囊息肉是否为肿瘤性的鉴别很有必要。超声是目前检查胆囊息肉样病变的首选影像技术,它可以提供有关胆囊壁、病变特征和邻近肝脏改变的信息,但仅凭常规超声很难鉴别肿瘤性与非肿瘤性息肉[13]。CEUS以其实时、简便、无辐射、无肾毒性等优点被广泛应用于肝肾等器官局灶性病变的诊断[14]。2011年的欧洲超生医学与生物学联合会指南推荐该技术用于肝外器官,包括胆道系统,可以较好的评估胆囊壁的连续性、肿瘤内的微循环,并便于病变部位的定位[15]。
本研究观察了经病理证实的33例PLG的常规超声与超声造影特点,常规超声结果分析表明息肉大小、基底情况、血流信号等的差异在肿瘤性息肉鉴别诊断中具有统计学意义(P<0.001,P=0.002、0.010),这与Cha等[16]的结果一致。因此胆囊息肉大小、基底情况和血流信号是重要的观察指标。其次CEUS结果显示肿瘤性息肉患者中70.6%(12/17)胆囊壁结构受到破坏,非肿瘤性息肉患者胆囊壁均层次清晰、连续性完整(P<0.001)。Liu等[17]研究也表明胆囊壁结构的破坏对胆囊良、恶性病变具有重要的鉴别诊断价值,因此超声造影清晰显示胆囊壁连续性对胆囊良恶性息肉样病变的鉴别具有一定意义。
本研究定量分析结果显示非肿瘤性息肉的RT、MTT、TTP和FT明显短于肿瘤性息肉,差异具有统计学意义,ROC曲线显示这些定量参数诊断灵敏度为90%,特异度为75%。Bae等[8]对直径≥1 cm胆囊息肉的患者进行CEUS定量分析发现,非肿瘤性息肉增强时间短于肿瘤性息肉,国内学者研究也发现,胆囊良性病灶组RT、TTP均短于胆囊癌组[18],这些观点与本研究结果相符合。但是这一结果不同于人们普遍认为恶性病变表现为“快进快出”的灌注模式,特别是在肝脏恶性病变中[19-20]。为解释这一差异,本研究通过分析组织病理学发现,非肿瘤性息肉中特别是胆固醇息肉,与邻近的胆囊壁固有层相比,间质微血管增多,血管腔扩张。相反,肿瘤性息肉虽然增加了微血管[21-22],但与非肿瘤性息肉相比,这些血管腔管径更小,更不明显。这些组织学特征可能会导致两组息肉的CEUS参数,如RT、MTT、TTP和FT在TIC定量分析中的差异。此外,与接受肝动脉和门静脉双重供血的肝脏相比,胆囊和肝脏的血管系统不同,胆囊仅由胆囊动脉供应,并回流到门静脉周围分支,这也可能是导致两者灌注特性不同的原因之一。Xie等[23]的研究结果表明,胆囊癌(91%)比良性胆囊病变(17%)更容易观察到造影剂早期消退,这与本研究结果不一致,这可能是因为研究者并没有进行TIC曲线定量分析,其对CEUS图像定性分析存在一定的主观性,可能对诊断结果造成影响。
本研究结果显示CEUS定性分析诊断肿瘤性息肉的准确率为66.7%,结合TIC曲线定量分析后,诊断肿瘤性息肉的准确率为87.9%,两者结合在诊断胆囊肿瘤性息肉中能提供更多的参考信息。
本研究有几个局限性。(1) 样本量小(n=33),年龄存在差异,本研究设计仅为初步研究,还需进一步大样本的临床研究验证。(2) TIC曲线的参数不但会受到ROI取样部位的影响,患者呼吸频率、心率、代谢速率等个体差异也会造成一定影响,所以可能会出现误差。(3) 本研究中息肉内微血管的评估仅在苏木精和伊红染色的玻片上进行,而内皮细胞标记物(例如CD34)的免疫组织化学染色更能准确地定量评估微血管。
综上所述,常规超声观察指标如息肉大小、基底情况和血流信号等对肿瘤性与非肿瘤性息肉的鉴别诊断有意义,CEUS则更能清晰显示胆囊壁的连续性,是常规超声检查的重要补充,结合分析TIC曲线定量参数有助于提高直径≥1 cm肿瘤性息肉的诊断准确率,可以帮助非肿瘤性息肉患者避免不必要的胆囊切除术。
[1] BONATTI M, VEZZALI N, LOMBARDO F, et al. Gallbladder adenomyomatosis: imaging findings, tricks and pitfalls[J]. Insights Imaging, 2017,8(2): 243-253.
[2] ZHUANG B, LI W, WANG W, et al. Contrast-enhanced ultrasonography improves the diagnostic specificity for gallbladder-confined focal tumors[J]. Abdom Radiol(NY), 2018,43(5): 1134-1142.
[3] MALUENDA F, DIAZNDA F, DIAZ J C, et al. Strategies for the surgical treatment of gallbladder cancer[J].Rev Med Chil, 2005,133: 723-728.
[4] MEACOCK L M, SELLARS M E, SIDHU P S. Evaluation of gallbladder and biliary duct disease using microbubble contrast-enhanced ultrasound[J]. Br J Radiol, 2010,83(991): 615-627.
[5] MISHRA G, CONWAY J D. Endoscopic ultrasound in the evaluation of radiologic abnormalities of the liver and biliary tree[J]. Curr Gastroenterol Rep, 2009,11(2): 150-154.
[6] 唐少珊,富崴,黄丽萍,等.胆囊隆起性病变超声造影增强模式的探讨[J].中国超声医学杂志,2009,25(10): 974-976.
[7] KONG W T, SHEN H Y, QIU Y D, et al. Application of contrast enhanced ultrasound in gallbladder lesion: is it helpful to improve the diagnostic capabilities?[J]. Med Ultrason, 2018,20(4): 420-426.
[8] BAE J S, KIM S H, KANG H J, et al. Quantitative contrast-enhanced US helps differentiating neoplastic vs non-neoplastic gallbladder polyps[J]. Eur Radiol, 2019,29(7): 3772-3781.
[9] PRADHAN S, SHUKLA V K, AGRAWAL S, et al. Sonographic and colour Doppler morphology in carcinoma gallbladder[J]. Indian J Cancer, 2002,39(4): 143-148.
[10] 罗渝昆.超声造影在胆囊息肉样病变诊断中的应用[J].中华医学超声杂志(电子版),2012,9(1): 2-4.
[11] TRIVEDI V, GUMASTE V V, LIU S J, et al. Gallbladder cancer: adenoma-carcinoma or dysplasia-carcinoma sequence?[J]. Gastroenterol Hepatol(NY), 2008,4(10): 735-737.
[12] 乐问津,丁佑铭,易佐慧子,等.胆囊息肉样病变恶变危险因素的Meta分析[J].临床肝胆病杂志,2011,27(9): 934-938.
[13] ITO H, HANN L E, D’ANGELICA M, et al. Polypoid lesions of the gallbladder: diagnosis and followup[J]. J Am Coll Surg, 2009,208(4): 570-575.
[14] CLAUDON M, DIETRICH C F, CHOI B I, et al. Guidelines and good clinical practice recommendations for Contrast Enhanced Ultrasound(CEUS) in the liver-update 2012: a WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS[J]. Ultrasound Med Biol, 2013,39(2): 187-210.
[15] PISCAGLIA F, NOLSØE C, DIETRICH C F, et al. The EFSUMB Guidelines and Recommendations on the Clinical Practice of Contrast Enhanced Ultrasound(CEUS): update 2011 on non-hepatic applications[J]. Ultraschall Med, 2012,33(1): 33-59.
[16] CHA B H, HWANG J H, LEE S H, et al. Pre-operative factors that can predict neoplastic polypoid lesions of the gallbladder[J]. World J Gastroenterol, 2011,17(17): 2216-2222.
[17] LIU L N, XU H X, LU M D, et al. Contrast-enhanced ultrasound in the diagnosis of gallbladder diseases: a multi-center experience[J]. PLoS One, 2012,7(10): e48371.
[18] 孙丽萍,徐辉雄,刘琳娜,等.超声造影在胆囊腺瘤及腺瘤癌变鉴别诊断中的应用价值[J].中华肝胆外科杂志,2013,19: 204-207.
[19] 徐作峰,谢晓燕,吕明德,等.胆囊疾病的超声造影诊断研究[J].中华超声影像学杂志,2007,16(3): 236-238.
[20] ZHENG S G, XU H X, LIU L N, et al. Contrast-enhanced ultrasound versus conventional ultrasound in the diagnosis of polypoid lesion of gallbladder: a multi-center study of dynamic microvascularization[J]. Clin Hemorheol Microcirc, 2013,55(3): 359-374.
[21] WANG W J, YANG Z L, LIU J Q, et al. Identification of CD146 expression, angiogenesis, and lymphangiogenesis as progression, metastasis, and poor-prognosis related markers for gallbladder adenocarcinoma[J]. Tumour Biol, 2012,33(1): 173-182.
[22] 韩扬,徐安安,符雪莲,等.隐匿性胆囊癌的病理学分析[J].同济大学学报(医学版),2017,38(2): 45-50.
[23] XIE X H, XU H X, XIE X Y, et al. Differential diagnosis between benign and malignant gallbladder diseases with real-time contrast-enhanced ultrasound[J]. Eur Radiol, 2010,20(1): 239-248.