自身免疫性肝炎(autoimmune hepatitis, AIH)是一种病因不明、由免疫介导、累及肝脏实质的特发性疾病。AIH的临床特征为反复转氨酶异常、高免疫球蛋白G(immunoglobulin G, IgG)和/或γ-球蛋白血症,血清自身抗体阳性等。组织学上以肝小叶界面炎及汇管区浆细胞浸润为主要特征[1]。自身免疫性肝炎多见于女性,男女发病比例约为1∶(4~6),其分布呈全球性,可发生于任何年龄段,但临床研究表明大部分患者年龄大于40岁。AIH的亚分类是基于现有的自身抗体谱[1],目前检测到的主要自身抗原没有一种是肝脏特异性的,只有极少数是疾病特异性的[2],因此自身抗体不能单独用于诊断该病。AIH目前尚没有特异性的诊断标志物,是参照国际自身免疫性肝炎诊断计分标准进行诊断[3]。
AIH以缓慢起病,症状轻重不一,轻者可无任何不适症状,重者除上腹部不适、黄疸等症状外可合并有腹水、肝性脑病。严重的AIH患者在未经治疗的情况下,确诊后半年内的病死率高达40%。因此,及时诊断并评估预后,尽早给予规范化治疗,对于延缓病情进展有十分重要的意义。因此设计了本项前瞻性研究,对超氧化物歧化酶(superoxide dismutase, SOD)在AIH诊断和预后中的意义加以探索。
1 资料与方法
1.1 研究对象
收集2016年8月1日—2019年8月1日在同济大学附属第十人民医院确诊的自身免疫性肝炎52例,55例健康对照病例来自于同期在该医院体检中心的健康体检者。
纳入及治疗标准参照2008年国际自身免疫性肝炎小组提出的AIH简化诊断积分系统诊断;治疗方案参照2015年中华医学会肝病学分会、中华医学会消化病学分会、中华医学会感染病学分会共同发表的《自身免疫性肝炎诊断和治疗共识》。
纳入对象的资料收集及分组如下。(1) AIH组: 选取符合上述指标的52例AIH患者,年龄20~80岁;男性7例,女性45例。收集的指标包括患者的确诊时的血清SOD、IgG水平,患者入院后均参照治疗标准治疗,并常规予以疏胆利肝治疗,对症处理并发症如腹水、消化道出血等。以上患者疗程中每3个月随访1次,检测血清丙氨酸氨基转移酶(ala-nine aminotransfease, ALT)或天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、IgG水平,以判断病情。治疗维持至AST或ALT、IgG水平降至正常值。(2) 健康对照组(NC组): 收集2016年8月1日—2019年8月1日在同济大学附属第十人民医院体检中心体检的正常人血检生化资料55例,女性46例,男性9例,年龄20~80岁,其年龄性别与AIH组差异无统计学意义(P>0.05),血清SOD水平在正常范围(129~216 U/mL),且标本采集1年后未发现AIH。
1.2 研究方法
按生化检验需求,嘱患者采血前一日晚10点后禁食禁水,采血当天清晨7点抽取空腹血5 mL,存于EDTA抗凝管中,离心收集血清。应用比色法检测血清总SOD活性,以活性129~216 U/mL为参考指标,低于下限值129 U/mL为阳性。
1.3 统计学处理
本试验数据采用SPSS 19.0统计软件处理,性别均衡性比较、SOD与预后分析采用χ2检验;年龄均衡性比较、AIH组与健康对照组临床资料比较、AIH组和健康对照组SOD水平比较采用t检验;对AIH组血清SOD水平与AIH患者临床指标进行相关性分析;血清SOD检测对AIH的诊断价值使用ROC曲线判断,P<0.05为差异有统计学意义。
2 结 果
2.1 基线均衡性比较
AIH组52例(男性7例,女性45例),健康对照组55例(男性9例,女性46例),组间患者性别、年龄差异无统计学意义(P>0.05),有可比性,见表1。
表1 病例组与对照组的人口学对比
Tab.1 Demographic comparison between case group and control group
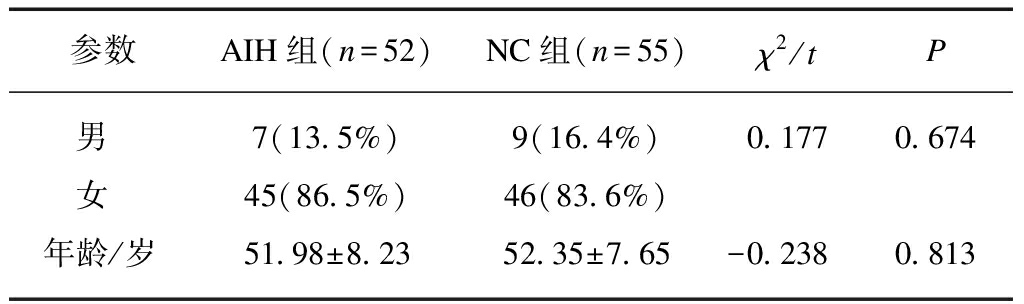
参数AIH组(n=52)NC组(n=55)χ2/tP 男7(13.5%)9(16.4%)0.1770.674 女45(86.5%)46(83.6%)年龄/岁51.98±8.2352.35±7.65-0.2380.813
2.2 两组临床资料比较
两组研究对象的资料比较,AIH组患者的ALT、AST、总胆红素、碱性磷酸酶、γ-谷氨酸转肽酶、血清IgG较健康对照组均升高,差异具有统计学意义(P<0.05),见表2。
2.3 两组SOD水平比较
血清总SOD在AIH组的表达低于健康对照组(t=-9.363,P<0.05),AIH组与健康对照组比较差异有统计学意义。
表2 病例组与对照组临床资料对比
Tab.2 Comparison of clinical data between case group and control group![]()
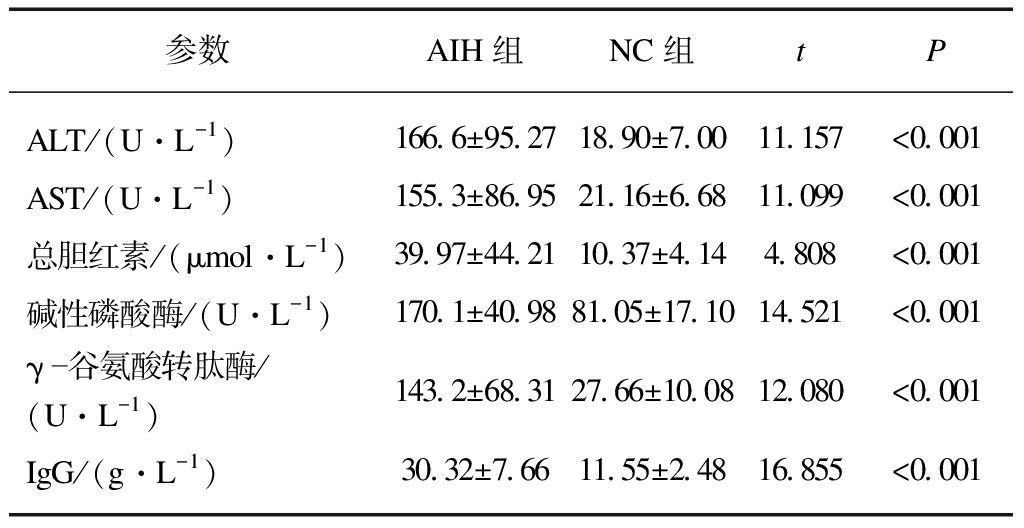
参数AIH组NC组tPALT/(U·L-1)166.6±95.2718.90±7.0011.157<0.001AST/(U·L-1)155.3±86.9521.16±6.6811.099<0.001总胆红素/(μmol·L-1)39.97±44.2110.37±4.144.808<0.001碱性磷酸酶/(U·L-1)170.1±40.9881.05±17.1014.521<0.001γ谷氨酸转肽酶/(U·L-1)143.2±68.3127.66±10.0812.080<0.001IgG/(g·L-1)30.32±7.6611.55±2.4816.855<0.001
2.4 AIH组血清SOD水平与AIH患者临床指标的相关性分析
根据Pearson相关分析,发现AIH患者血清总SOD与ALT、AST、总胆红素、碱性磷酸酶、γ-谷氨酰转肽酶、IgG呈负相关(P<0.01),r值分别为-0.745、-0.741、-0.481、-0.564、-0.682、-0.568,见图1。
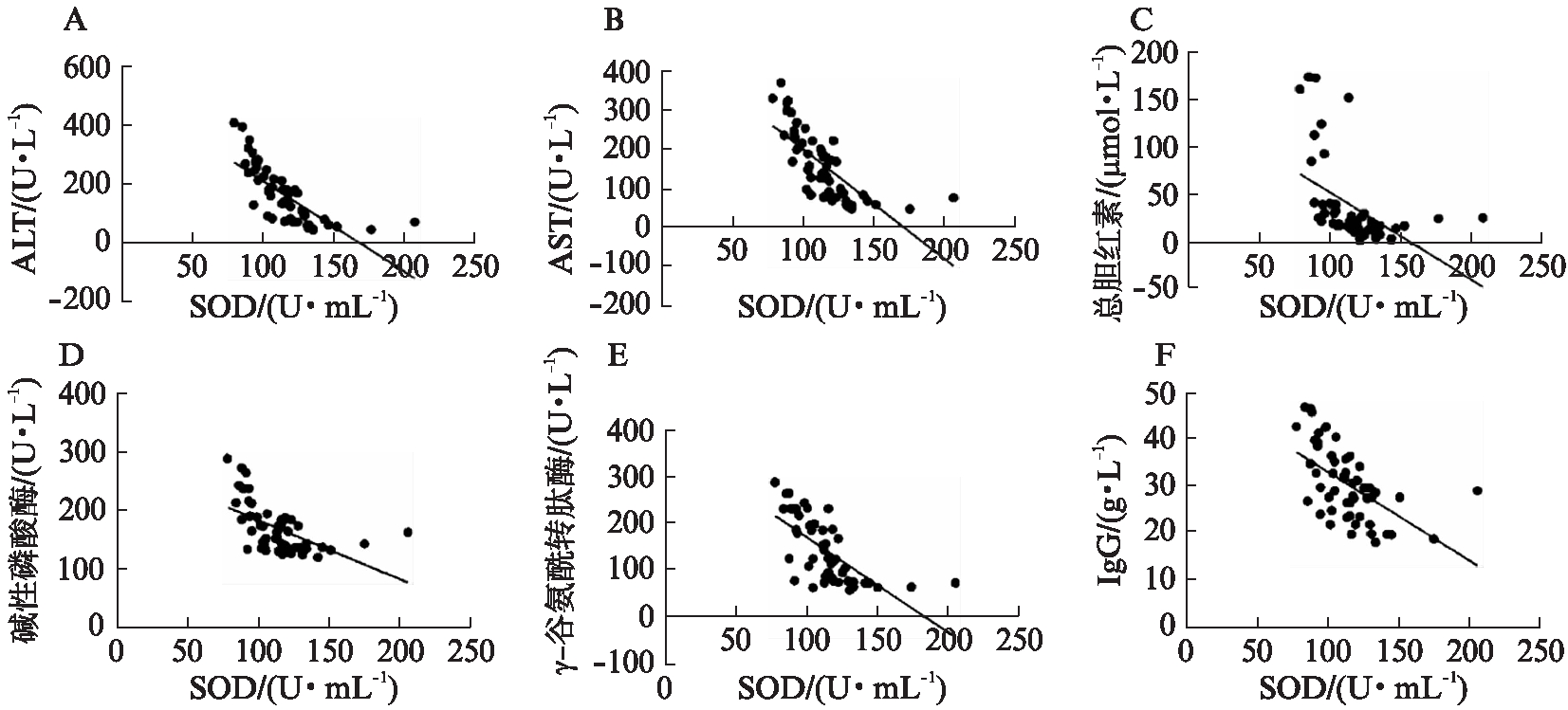
图1 AIH组血清SOD与各临床指标相关性线性分析
Fig.1 Linear analysis of the correlation between serum SOD and clinical indexes in AIH group
2.5 血清SOD水平对AIH的诊断价值
根据受试者工作特征(receiver operating charo-uteristic, ROC)曲线分析,血清总SOD曲线下面积为0.89,与ROC曲线下面积=0.5比较有统计学意义,说明其有诊断价值,见图2。
52例AIH患者中SOD降低的有41例,SOD正常的有11例,55例健康对照中SOD降低的有9例,SOD正常的有46例,算得灵敏度(真阳性率)为78.85%,特异度(真阴性率)为83.64%,Youden指数为0.625,说明该诊断试验真实性可,有临床应用价值。
2.6 血清SOD检测对AIH预后判断的意义
本研究选取了临床表现、肝功能、球蛋白水平作为预后判断的依据,对52例AIH患者治疗前后的上述指标进行了对比。观察应答的时间点为患者经规范化治疗出院后第6个月末。对不同SOD水平患者的预后情况进行χ2检验,结果显示P<0.05,有统计学意义,见表3。OR值为10.88,提示疾病恶化风险因ROC降低这一暴露因素而增加。AIH患者中,预后良好(缓解)和预后不良(未缓解)两类人群SOD的Cut-off值结果为115 U/mL,此时Youden指数显示最大值为0.903。
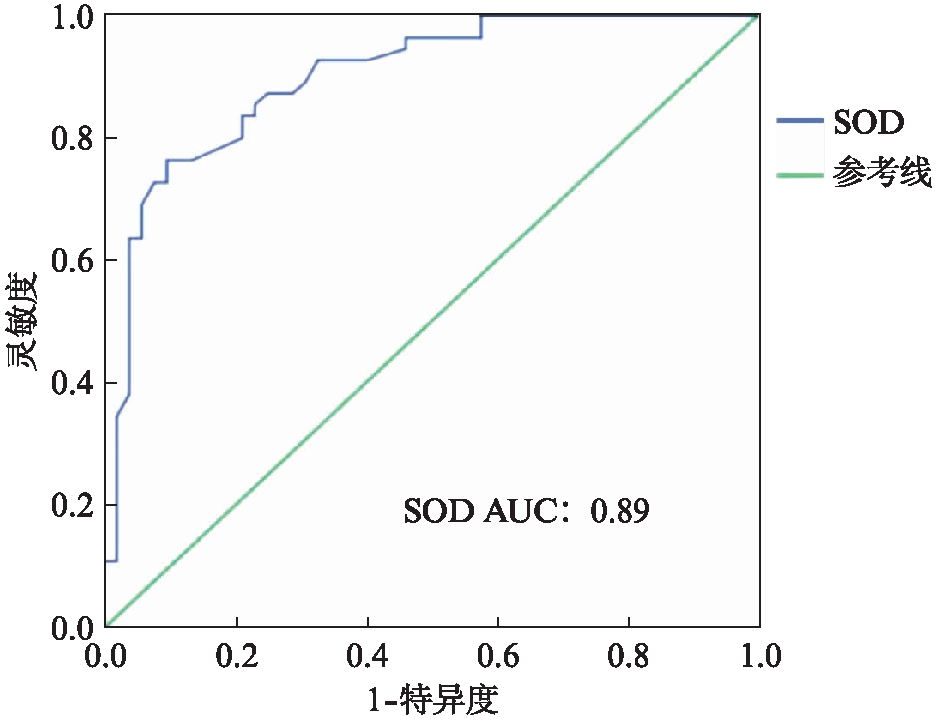
图2 血清SOD水平对AIH的诊断价值的ROC曲线
Tab.2 ROC curve of serum SOD level in the diagnosis of AIH
表3 AIH患者治疗后预后情况分析
Tab.3 Analysis of prognosis of AIH patients after treatment
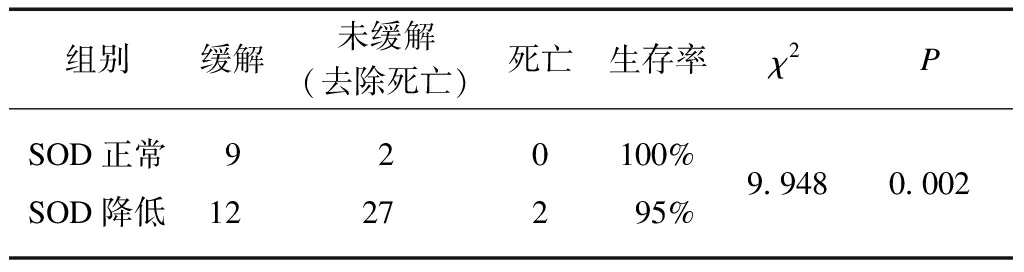
组别缓解未缓解(去除死亡)死亡生存率χ2PSOD正常920SOD降低12272100%95%9.9480.002
完全缓解的判断标准中,生化缓解参照2015年中华医学会肝病学分会等共同发表的《自身免疫性肝炎诊断和治疗共识》,临床上可行的完全缓解的生化标准为ALT/AST、IgG、胆红素和球蛋白水平恢复正常;另,临床表现缓解的标准为腹胀、纳差、黄疸等症状消失
3 讨 论
AIH的诊断分型是根据目前的自身抗体谱进行的。AIH中检测到的主要自身抗原都不是肝脏特异性的,只有极少数是疾病特异性的[4],因此不能用于诊断。AIH血清自身抗体主要为抗核抗体(anti-nuclear antibody, ANA)、抗平滑肌抗体(anti smooth muscle antibody, ASMA)等,由于上述自身抗体特异性差,因此某种自身抗体阳性并不能确诊AIH。1993年IAIHG制订了AIH的诊断积分系统及描述性诊断标准,并于1999年进行了更新[5]。为了在临床实践中推广应用,2008年IAIHG提出了新的AIH简化诊断积分系统。简化诊断积分系统分为自身抗体、肝组织学改变、血清IgG水平及排除病毒性肝炎等4个部分,共计8分,每个组最高计2分。积分达6分者为“可能”的AIH;积分不低于7分者即可确诊AIH[6]。我国一项慢性肝病患者的多中心临床研究结果显示,使用简化积分系统确诊自身免疫性肝炎,灵敏度可达90%,特异度可达95%[7]。但简化积分系统对自身抗体滴度低或血清IgG水平较低甚至正常的不典型患者存在漏诊的可能,或许可以通过其他相关血清学指标协助临床诊断。
同时,自身免疫性肝炎患者临床表现变化多,病情发展较隐匿,医院应对患者进行定期随访,从而有效评估其病情状况。自身免疫性肝炎的治疗效果优于其他自身免疫性肝病,研究发现,有80%的早期AIH患者单纯使用糖皮质激素或联合硫唑嘌呤就能缓解,部分患者对治疗的持续反应可能出现纤维化的消退。因此,自身免疫性肝炎患者在确诊后,及时的预后判断对其早期治疗有着至关重要的作用。目前,仍没有一种可广泛应用于AIH患者确诊后早期判断预后的方法,理想的预后判断方式应操作简便、安全、价格低廉及具有良好的患者依从性。
氧化应激是指机体内来自分子氧的游离基或细胞内活性氧类(reactive oxygen species, ROS)过度产生和(或)抗氧化防御功能减弱,引起两者之间平衡严重破坏,造成组织细胞损伤的一种状态。氧化应激在AIH进展中的作用已有相关研究。在慢性病毒性肝炎[8]、原发性胆汁性肝硬化[9-10]和酒精性肝病[11]中已观察到氧化应激。炎症和脂质过氧化产物如丙二醛或4-羟基壬烯醛(或其加合物)产生的ROS可直接激活肝星状细胞分化成肌成纤维细胞[12-13],导致纤维化和肝硬化。
SOD是一种具有特定生物催化功能,首次从牛红细胞中得到的一种含铜蛋白。1969年,Mccord和Fridovich发现此蛋白能够使得超氧阴离子自由基发生歧化反应,因而将其命名为超氧化物歧化酶[14]。SOD是人体内唯一以自由基为底物进行歧化反应的酶,是自由基的清除剂,它与自由基代谢状态呈负相关,兼具抑制氧化应激、减轻炎症的功能。其基因多态性已被证实与非酒精性脂肪肝患者的肝纤维化程度有关[15]。由于AIH患者体内自由基大量增多,SOD清除自由基而被大量消耗,血清SOD异常的检出往往早于临床症状的出现,它的发生发展与机体氧化应激有关。本研究拟探讨血清SOD与AIH诊断及预后的关系,阐明AIH患者检测血清SOD的临床意义以更好地应用于临床工作。
本研究结果显示,AIH组血清总SOD水平显著降低,AIH组血清总SOD值与健康对照组相比,差异有统计学意义(P<0.05)。国外已有相关文献报道,肝病患者存在SOD活性下降或含量减低[4,9,15-16],本研究进一步在AIH患者中得到了证实。本研究发现,AIH患者血清总SOD较健康对照组低,提示血清SOD的降低可能与AIH的发生有关。SOD是一种具有特殊功能的生物酶,它能有效催化氧自由基并生成O2和H2O2,进而防止超氧离子造成的细胞损伤。抗氧化体系失衡或氧自由基产生过多时将导致多种疾病发生[17-22]。病理情况下,体内自由基产生过量,机体需要消耗更多的SOD来清除氧自由基以保护组织免受损伤。AIH的发生发展与机体抗氧化功能障碍有关,免疫损伤常导致患者体内自由基激增,并且肝功能低下导致SOD生成减少或功能低下,SOD异常往往早于临床症状的发生,故在实际临床工作中,血清SOD活性检测有望作为辅助检测AIH的手段。本研究根据ROC曲线分析,血清总SOD曲线下面积为0.89,有诊断价值。算得灵敏度78.85%,特异度83.64%,Youden指数为0.625,说明该诊断试验有临床应用价值,血清SOD检测可能对AIH的诊断有一定的参考价值,并可与其他相关检查一起,对AIH起辅助的诊断作用。
通过收集AIH患者的相关临床指标并进一步进行Pearson相关分析发现,AIH患者血清总SOD与ALT、AST、总胆红素、碱性磷酸酶、γ-谷氨酰转肽酶、IgG呈负相关(P<0.01)。在临床诊疗过程中,AIH患者的肝功能及IgG水平常被用来进行病情评估。选择性IgG升高是AIH最为突出的血清免疫学特点,通常为正常水平的1.5倍以上。血清IgG水平可反映肝内炎症活动程度,该指标不仅有助于AIH诊断,对于评估病情也具有重要参考价值。Pearson相关分析的结果显示患者血清SOD与肝功能及IgG水平呈负相关,其具体原因和机制仍未明确,但这为AIH的病情评估提供了新思路。由于氧化应激可损伤肝细胞DNA,诱导细胞凋亡,增加炎症细胞因子的产生,猜测AIH的病情进展可能与肝脏细胞氧化还原失衡有关。
目前虽有关于AIH患者其他血清学指标对预后判断的报道,但关于AIH患者血清SOD与预后关系的研究却比较少见。本研究对52例AIH患者治疗前后的临床表现,血清ALT、AST、IgG、胆红素、球蛋白进行对比,对不同SOD水平患者的预后情况进行χ2检验,结果显示P<0.05,有统计学意义,提示血清SOD可能对AIH患者的预后判断有价值,确诊时血清SOD低的患者预后不佳的可能性更大。对AIH患者中疾病未缓解的暴露比值与缓解的暴露比值之比进行计算,得OR值为10.88,提示疾病恶化风险因SOD降低这一暴露因素而增加。还计算了AIH患者中预后良好和预后不良两类人群SOD值的Cut-off值,结果为115。因此,根据本实验结果,认为SOD水平高于115 U/mL的AIH患者预后良好,反之预后不良。其机制可能为自由基生成和清除之间的不平衡引起氧化应激,从而增加氧化产物的形成,减少或耗尽内源性抗氧化保护机制。高反应性的自由基可通过磷脂膜过氧化和蛋白质、DNA氧化损伤细胞,由此可能导致疾病的恶性转化[23]。基于这些发现,我们有理由认为氧化应激水平的升高可通过诱导凋亡通路促进AIH的炎症反应和肝损伤。低SOD水平和肝纤维化之间可能通过氧化应激途径存在潜在联系。了解这一复杂途径也可能为补充抗氧化剂这一治疗干预手段提供理论依据。
本研究表明,血清SOD的降低可能参与了AIH的发病,在临床实际工作中,作为一项可操作性强和准确性高的实验室检查,血清SOD检测有望作为辅助检测的手段,用于AIH的早期诊断及预后判断。
[1] MCFARLANE I G. Definition and classification of autoimmune hepatitis[J]. Semin Liver Dis, 2002,22(4): 317-324.
[2] STRASSBURG C P, MANNS M P. Autoantibodies and autoantigens in autoimmune hepatitis[J]. Semin Liver Dis, 2002,22(4): 339-352.
[3] 王锦辉,陈旻湖.自身免疫性肝炎的诊断和治疗进展[J].广东医学,2008,29(7): 1078-1079.
[4] WIES I, BRUNNER S, HENNINGER J, et al. Identification of target antigen for SLA/LP autoantibodies in autoimmune hepatitis[J]. Lancet, 2000,355(9214): 1510-1515.
[5] ALVAREZ F, BERG P A, BIANCHI F B, et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis[J]. J Hepatol, 1999,31(5): 929-938.
[6] HENNES E M, ZENIYA M, CZAJA A J, et al. Simplified criteria for the diagnosis of autoimmune hepatitis[J]. Hepatology, 2008,48(1): 169-176.
[7] QIU D K, WANG Q X, WANG H, et al. Validation of the simplified criteria for diagnosis of autoimmune hepatitis in Chinese patients[J]. J Hepatol, 2011,54(2): 340-347.
[8] JAIN S K, PEMBERTON P W, SMITH A, et al. Oxidative stress in chronic hepatitis C: not just a feature of late stage disease[J]. J Hepatol, 2002,36(6): 805-811.
[9] KAWAMURA K, KOBAYASHI Y, KAGEYAMA F, et al. Enhanced hepatic lipid peroxidation in patients with primary biliary cirrhosis[J]. Am J Gastroenterol, 2000,95(12): 3596-3601.
[10] ABOUTWERAT A, PEMBERTON P W, SMITH A, et al. Oxidant stress is a significant feature of primary biliary cirrhosis[J]. Biochim Biophys Acta, 2003,1637(2): 142-150.
[11] ALBANO E, CLOT P, PAROLA M, et al. Possible role of ethanol-derived free radicals in the pathogenesis of alcohol-induced liver damage[J]. Springer Netherlands, 1996.
[12] LEE K S, BUCK M, HOUGLUM K, et al. Activation of hepatic stellate cells by TGFα and collagen type I is mediated by oxidative stress through c-myb expression[J]. J Clin Invest, 1995,96(5): 2461-2468.
[13] SVEGLIATI BARONI G, D’AMBROSIO L, FERRETTI G, et al. Fibrogenic effect of oxidative stress on rat hepatic stellate cells[J]. Hepatology, 1998,27(3): 720-726.
[14] MCCORD J M, FRIDOVICH I. Superoxide dismutase. An enzymic function for erythrocuprein(hemocuprein)[J]. J Biol Chem, 1969,244(22): 6049-6055.
[15] LIU W S, BAKER S S, BAKER R D, et al. Antioxidant mechanisms in nonalcoholic fatty liver disease[J]. Curr Drug Targets, 2015,16(12): 1301-1314.
[16] JOHNSON P J, MCFARLANE I G. Meeting report: international autoimmune hepatitis group[J]. Hepatology, 1993,18(4): 998-1005.
[17] PAOLIERI F, PRONZATO C, BATTIFORA M, et al. Infiltrating γ/gd T-cell receptor-positive lymphocytes in Hashimoto’s thyroiditis, Graves’ disease and papillary thyroid cancer[J]. J Endocrinol Invest, 1995,18(4): 295-298.
[18] SHARMA A, RAJAPPA M, SATYAM A, et al. Oxidant/anti-oxidant dynamics in patients with advanced cervical cancer: correlation with treatment response[J]. Mol Cell Biochem, 2010,341(1-2): 65-72.
[19] SILVIS A M, MCCORMICK M L, SPITZ D R, et al. Redox balance influences differentiation status of neuroblastoma in the presence of all-trans retinoic acid[J]. Redox Biol, 2016,7: 88-96.
[20] NAGAYA T, TANAKA N, KIMURA T, et al. Mechanism of the development of nonalcoholic steatohepatitis after pancreaticoduodenectomy[J]. BBA Clin, 2015,3: 168-174.
[21] STRZELCZYK J K, ![]() T, KRAKO-WCZYK
T, KRAKO-WCZYK  , et al. The activity of antioxidant enzymes in colorectal adenocarcinoma and corresponding normal mucosa[J]. Acta Biochim Pol, 2012,59(4): 549-556.
, et al. The activity of antioxidant enzymes in colorectal adenocarcinoma and corresponding normal mucosa[J]. Acta Biochim Pol, 2012,59(4): 549-556.
[22] MAHAJAN M, TIWARI N, SHARMA R, et al. Oxidative stress and its relationship with adenosine deaminase activity in various stages of breast cancer[J]. Indian J Clin Biochem, 2013,28(1): 51-54.
[23] HALLIWELL B, GUTTERIDGE J M, CROSS C E. Free radicals, antioxidants, and human disease: where are we now?[J]. J Lab Clin Med, 1992,119(6): 598-620.