血脑屏障(blood brain barrier, BBB)是专门控制物质从循环系统到脑实质运输的动态系统,可保护大脑免受血液中有毒物质的侵害。BBB完整性的破坏存在于多种中枢神经系统疾病中,包括脑卒中、帕金森病、阿尔茨海默病等,但对于调节BBB结构和功能的分子机制甚少。BBB中具有多种类型的细胞,包括内皮细胞,星形胶质细胞和周细胞[1-7]。牙本质基质蛋白1(dentin matrix protein 1, DMP1)是一种硫酸软骨素蛋白聚糖,最早在成牙本质细胞和成骨细胞的成熟过程中起重要作用[8-9],研究发现也在小鼠大脑、肌肉中表达[10-11],参与器官发育和功能维持。蛋白质水解是DMP1活化的重要步骤。在水解后,DMP1主要以糖基化修饰的N-DMP1-PG形势存在。前序研究发现,DMP1糖基化是体外和体内星形胶质细胞成熟的关键条件,S89G-DMP1小鼠表现出BBB功能障碍主要是由于星形胶质细胞出现皱缩,并且无法正确将终末足靶向定位到内皮细胞或周细胞上,进而丧失对BBB功能的维持作用[12]。同时层粘连蛋白和ZO-1的表达量降低,使血管内皮细胞间的紧密连接松动,最终导致BBB功能障碍。本研究通过单细胞转录组数据,分析对照组与DMP-Tg组的神经元、星形胶质细胞、小胶质细胞等细胞群体的变化和细胞类型特异性基因表达差异,从单细胞分辨率上,探究S89G-DMP1小鼠BBB通透性改变的分子机制。
1 材料与方法
1.1 数据来源
根据C57BL/6J小鼠基因组序列,构建囊括DMP1糖基化位点所在外显子上游的6.6 kb和下游8.2 kb序列的同源重组臂,并在DMP1第6个外显子下游179 bp插入neo阳性筛选序列。构建完成的质粒通过全序列测序确定无误。同源重组质粒通过电转进入小鼠胚胎干细胞(embryonic stem cells, ESCs),经过筛选的3个阳性克隆被移植到Balb/c假孕母鼠子宫内。获得的5个嵌合体雄性小鼠与C57BL/6J雌性小鼠杂交获得F1代小鼠。通过PCR和测序确定了同源重组序列的插入和编码糖基化位点丝氨酸的AGT突变成为甘氨酸的GGT。杂交得到的雄性小鼠与B6.129S4-Gt(ROSA) 26-Sortm1(FLP1) Dym/RainJ(Jackson Laboratories)雌性小鼠杂交以移除neo序列。去除neo序列的子代小鼠通过基因型分析来确定。得到的S89G-DMP1纯合小鼠在使用前均经过PCR确定其基因型,C57BL/6J小鼠用作野生型对照(WT组)小鼠。基因型鉴定引物信息如下。DMP1-Mut-F: 5′-CGCATTGTCTGAGTAGGTGTC-3′;DMP1-WT-F: 5′-GTGCCATTGAAGCATTACC-TCATG-3′;R: 5′-GGTTCTTAC-ATGGGCAGGATAAGC-3′。
选择8~9周龄的S89G-DMP1小鼠与对照组小鼠,通过酶消化方法分离脑组织,制备单细胞悬液并计数,计算活率、上机测序,得到单细胞转录组测序数据。
1.2 单细胞上游分析
使用hisat2(http:∥daehwankimlab.github.io/hisat2/)与stringtie(http:∥ccb.jhu.edu/software/stringtie/)软件,应用标准cellranger流程进行单细胞上游序列比对,比对完的序列进行拼装后得到所有细胞的基因表达矩阵。
1.3 基因表达矩阵的预处理与降维聚类分析
在R语言中使用标准的Seurat(https:∥satijalab.org/seurat/)分析流程对单细胞数据进行过滤、标准化、归一化、PCA主成分分析后,通过TSNE降维算法,得到各细胞亚群的二维聚类图像。
1.4 细胞类型的定义
使用FindAllMarker函数寻找每个细胞亚群的差异基因,比对Cell Marker(http:∥bio-bigdata.hrbmu.edu.cn/CellMarker/)数据库中神经细胞、星形胶质细胞、小胶质细胞、少突胶质细胞等细胞的特征基因,定义每个细胞亚群的具体细胞类型。
1.5 差异基因的GO分析和富集分析
对S89G-DMP1小鼠与野生型(wild type, WT)小鼠同类型细胞的差异基因采用DAVID 6.8数据库进行GO富集分析(Gene Ontology, http:∥geneo-ntology.org/)
1.6 蛋白相互作用网络分析
利用STRING数据库(http:∥string-db.org/)对星形胶质细胞、少突胶质细胞与小胶质细胞中上调的基因分别构建蛋白相互作用网络(protein-protein interaction network, PPI network),置信度为0.5。随后利用Cytoscape 3.7.1软件中的cytoHubba插件计算度值,以此作为关键靶基因的筛选标准。P<0.05内差异有统计学意义。
2 结 果
2.1 细胞聚类结果
利用Seurat软件包对S89G-DMP1与WT组的24 167个细胞的基因表达矩阵进行包括过滤、标准化、归一化、PCA主成分分析等一系列标准预处理流程,再通过t分布随机邻域嵌入(t-distributed sto-chastic neighbor embedding, TSNE)降维算法,得到细胞的二维聚类图像,24 167个细胞根据基因表达谱的相似度可以分为27个细胞亚群,见图1。
2.2 细胞类型定义结果
根据FindAllMarker函数获取各个细胞亚群的特征差异基因,与CellMarker数据库中关于小鼠脑部各细胞类型的特征基因进行比对,可以将数据集中的细胞定义为6种不同的细胞类型,分别为神经细胞、星形胶质细胞、小胶质细胞、少突胶质细胞、内皮细胞与周细胞,见图2(星形胶质细胞: Ntsr2、Htra1、Aqp4、Aldoc;神经细胞: Snap25、Map2、Rbfox3、Syp;小胶质细胞: Ctss、Cx3cr1、Aif1、Ly86;少突胶质细胞: Plp1、Mobp、Mag、Mog)。从细胞比例来看,S89G-DMP1与WT组相比,少突胶质细胞比例明显升高,神经细胞比例明显降低,这可能与BBB功能障碍互为因果,见图3。各细胞类型的特征基因表达热图结果如图4。S89G-DMP1和WT组主要类型聚类分布结果见图5。
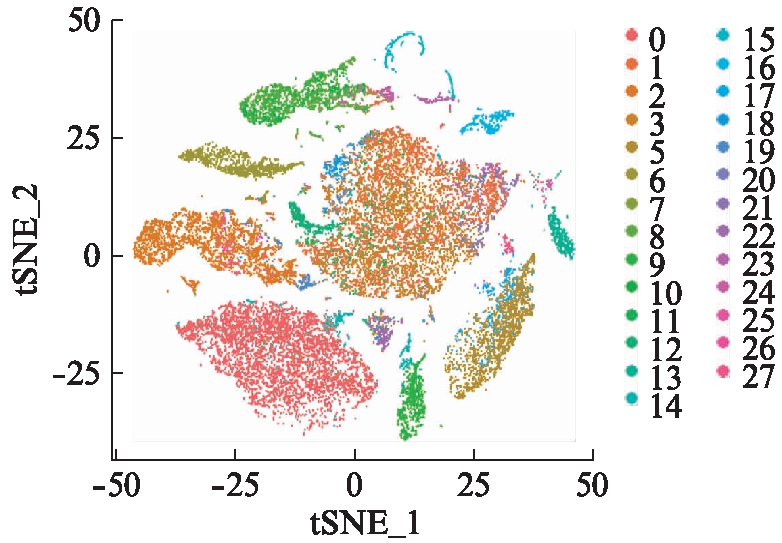
图1 细胞聚类结果(TSNE)
Fig.1 Cell clustering result(TSNE)
细胞聚类图中每一个点代表一个细胞,每一种颜色即代表一种细胞亚群,此图由Seurat包内嵌Dimplot函数绘制
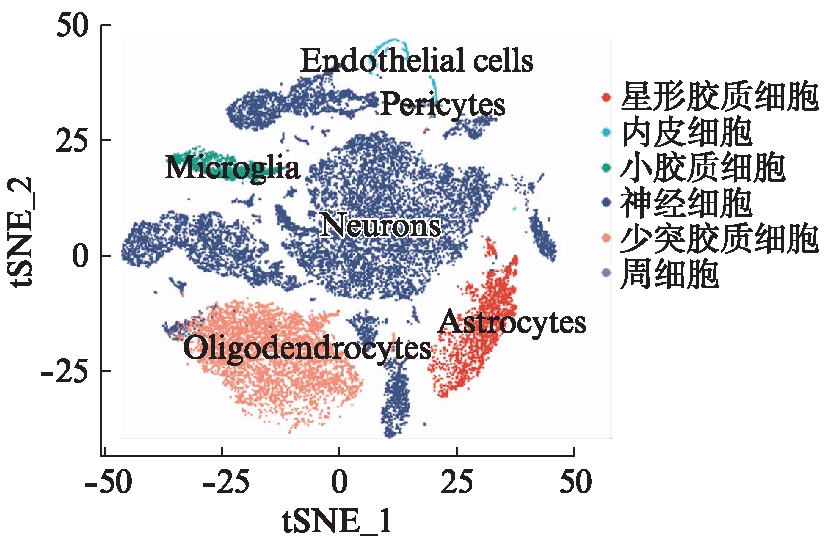
图2 细胞类型定义结果
Fig.2 The result of cell type definition
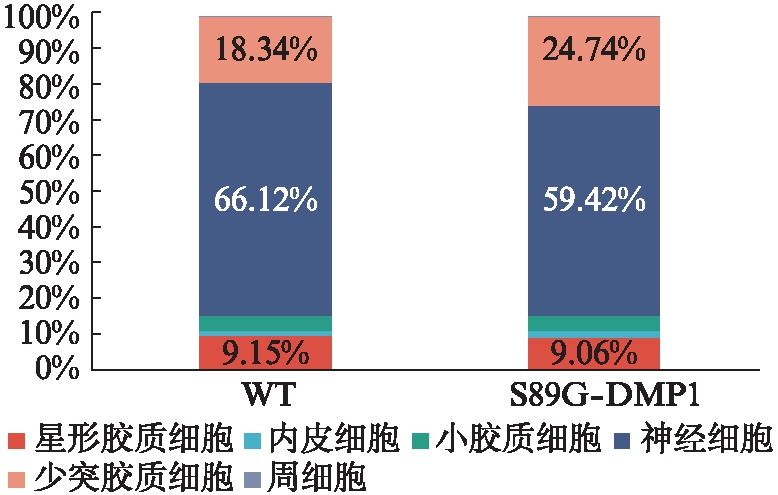
图3 S89G-DMP1与WT组小鼠大脑各细胞类型构成
Fig.3 Composition of brain cell types of mice in S89G-DMP1 and WT groups
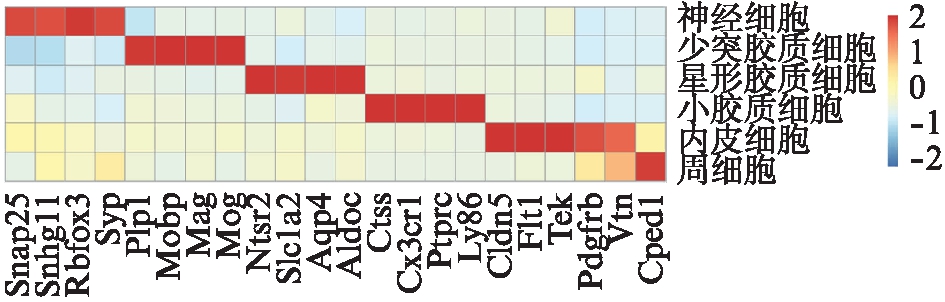
图4 各细胞类型的特征基因表达热图结果
Fig.4 Heat map results of characteristic gene expression in each cell type
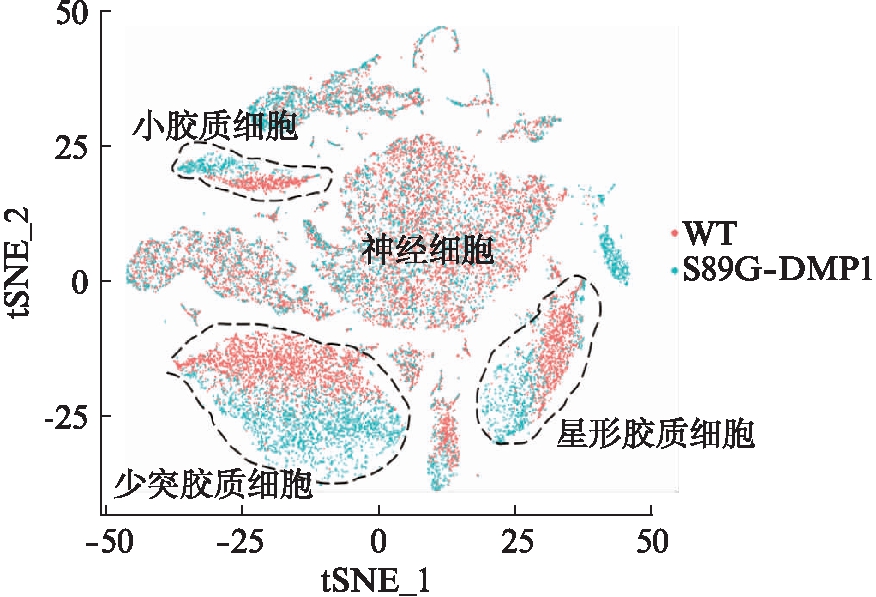
图5 S89G-DMP1和WT组主要细胞类型聚类分布结果
Fig.5 Cluster distribution of main cell types in S89G-DMP1 and WT groups
2.3 差异基因分析
以FDR<0.01且|logFC|≥0.5为筛选条件。S89G-DMP1组与WT组相比,神经细胞共筛选出6个上调基因,15个下调基因,见表1;星形胶质细胞共筛选出12个上调基因,94个下调基因,见表2;少突胶质细胞共筛选出7个上调基因,80个下调基因,见表3;小胶质细胞共筛选出11个上调基因和125个下调基因,见表4。可以看出,S89G-DMP1组与WT组的神经细胞差异基因数目少,在基因表达谱上相似度大。而在星形胶质细胞、小胶质细胞与少突胶质细胞中,S89G-DMP1组基因表达谱发生较大改变,对于基因下调的影响更为显著,且前10位差异基因存在一定重叠,结果表明糖基化DMP1可能同步影响星形胶质细胞、小胶质细胞与少突胶质,从而造成BBB通透性的改变。
2.4 GO分析
对按|logFC|值排序的前100位差异基因进行GO分析结果显示,以FDR<0.01为筛选标准,神经细胞的DEGs共参与78种生物学过程,56种细胞组分和40种分子功能,生物学过程中“神经元迁移”富集程度最高(n=13)。星形胶质细胞的DEGs共参与64种生物学过程,36种细胞组分和59种分子功能,生物学过程中“离子跨膜转运调控”富集程度最高(n=14),其次为“细胞间黏附”(n=17)。少突胶质细胞的DEGs共参与89种生物学过程,45种细胞组分和45种分子功能,生物学过程中富集程度最高的是“细胞间黏附”(n=15)。小胶质细胞的DEGs共参与72种生物学过程,29种细胞组分和46种分子功能,生物学过程中富集程度最高的是“细胞间黏附”(n=17),如图6。可以看出,细胞间黏附可能是糖基化DMP1的主要功能之一,来自星形胶质细胞、少突胶质细胞和小胶质细胞的糖基化N-DMP1-PG可能通过组织ECM(层粘连蛋白,整联蛋白,胶原蛋白等)确保BBB的结构和功能。
2.5 PPI网络分析
图7、图8、图9分别为星形胶质细胞,少突胶质细胞与小胶质细胞中下调表达的差异基因所构成的PPI网络图;图10显示3组筛选得到的前10位关键靶基因存在一定重复(颜色越红代表靶基因的度值越大),可以看出星形胶质细胞、少突胶质细胞与小胶质细胞的调控具有一定协同性。
表1 S89G-DMP1组神经细胞下调表达 差异最大的前10个基因
Tab.1 Top 10 up-regulated genes in astrocytes of S89G-DMP1 group

基因名称描述|LogFC|PUtyY染色体四肽重复蛋白1.304.08×10-5Eif2s3y死盒解旋酶3y链1.234.43×10-74Kdm5d赖氨酸脱甲基酶50.962.12×10-34Plp1含蛋白脂质蛋白10.763.08×10-5Mbp髓鞘碱性蛋白0.691.47×10-146St18锌指转录因子0.644.08×10-5Prr5l类富脯氨酸50.561.81×10-19Unc5d神经突起生长诱导因子受体0.551.02×10-20Usp29泛素特异性肽酶290.554.07×10-92Ddx3y死盒解旋酶3y链0.553.54×10-150
表2 S89G-DMP1组星形胶质细胞下调表达 差异最大的前10个基因
Tab.2 Top 10 down-regulated genes in astrocytes of S89G-DMP1 group
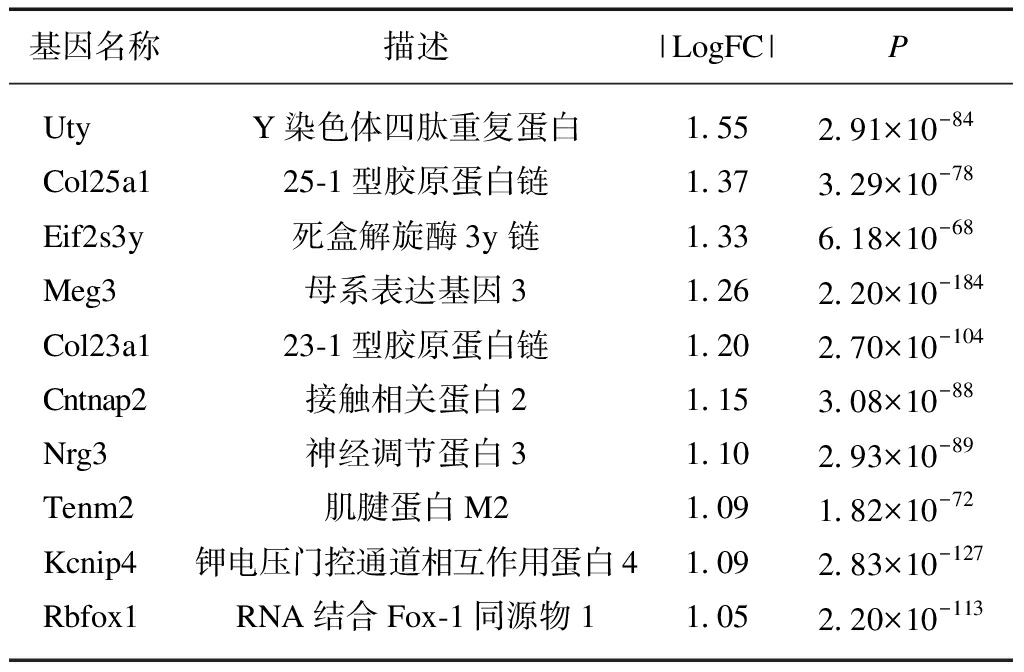
基因名称描述|LogFC|PUtyY染色体四肽重复蛋白1.552.91×10-84Col25a125-1型胶原蛋白链1.373.29×10-78Eif2s3y死盒解旋酶3y链1.336.18×10-68Meg3母系表达基因31.262.20×10-184Col23a123-1型胶原蛋白链1.202.70×10-104Cntnap2接触相关蛋白21.153.08×10-88Nrg3神经调节蛋白31.102.93×10-89Tenm2肌腱蛋白M21.091.82×10-72Kcnip4钾电压门控通道相互作用蛋白41.092.83×10-127Rbfox1RNA结合Fox-1同源物11.052.20×10-113
表3 S89G-DMP1组少突胶质细胞下调表达 差异最大的前10个基因
Tab.3 Top 10 down-regulated genes in astrocytes of S89G-DMP1 group
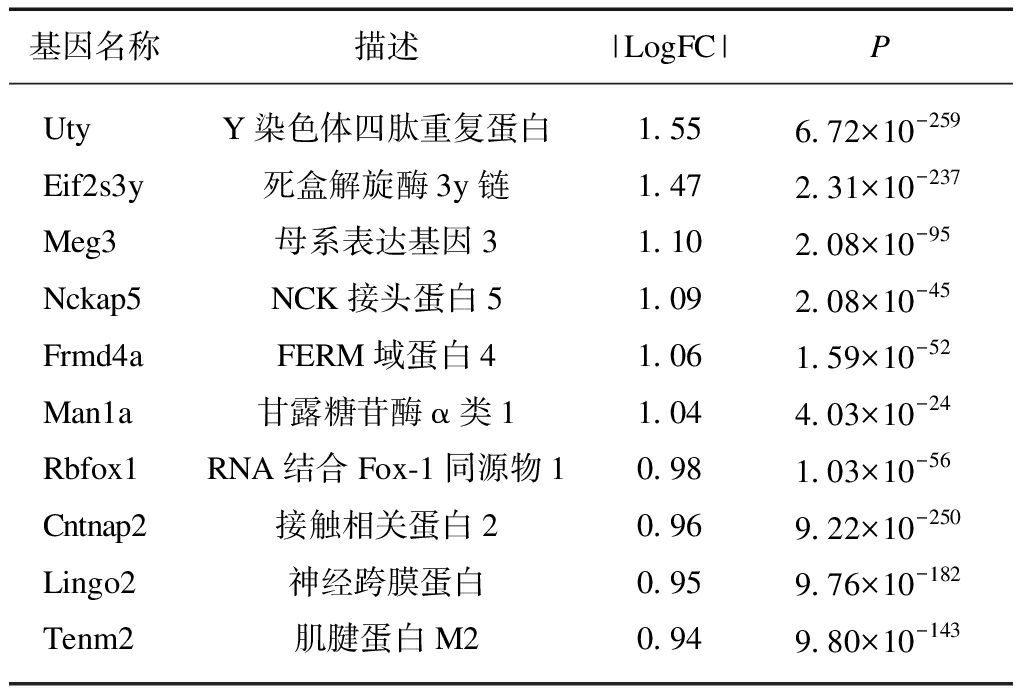
基因名称描述|LogFC|PUtyY染色体四肽重复蛋白1.556.72×10-259Eif2s3y死盒解旋酶3y链1.472.31×10-237Meg3母系表达基因31.102.08×10-95Nckap5NCK接头蛋白51.092.08×10-45Frmd4aFERM域蛋白41.061.59×10-52Man1a甘露糖苷酶α类11.044.03×10-24Rbfox1RNA结合Fox-1同源物10.981.03×10-56Cntnap2接触相关蛋白20.969.22×10-250Lingo2神经跨膜蛋白0.959.76×10-182Tenm2肌腱蛋白M20.949.80×10-143
表4 S89G-DMP1组小胶质细胞下调表达 差异最大的前10个基因
Tab.4 Top 10 down-regulated genes in astrocytes of S89G-DMP1 group

基因名称描述|LogFC|PPcdh9原钙黏附蛋白91.393.73×10-84Grid2谷氨酸离子受体型亚基21.394.42×10-33UtyY染色体四肽重复蛋白1.377.08×10-26Meg3母系表达基因31.375.24×10-111Ptprd蛋白酪氨酸磷酸酶受体D型1.332.80×10-58Lsamp边缘系统相关膜蛋白1.336.73×10-78Cntnap2接触相关蛋白21.314.07×10-53Tenm2肌腱蛋白M21.312.76×10-58Rbfox1RNA结合Fox-1同源物11.304.06×10-75Lingo2神经跨膜蛋白1.225.36×10-38
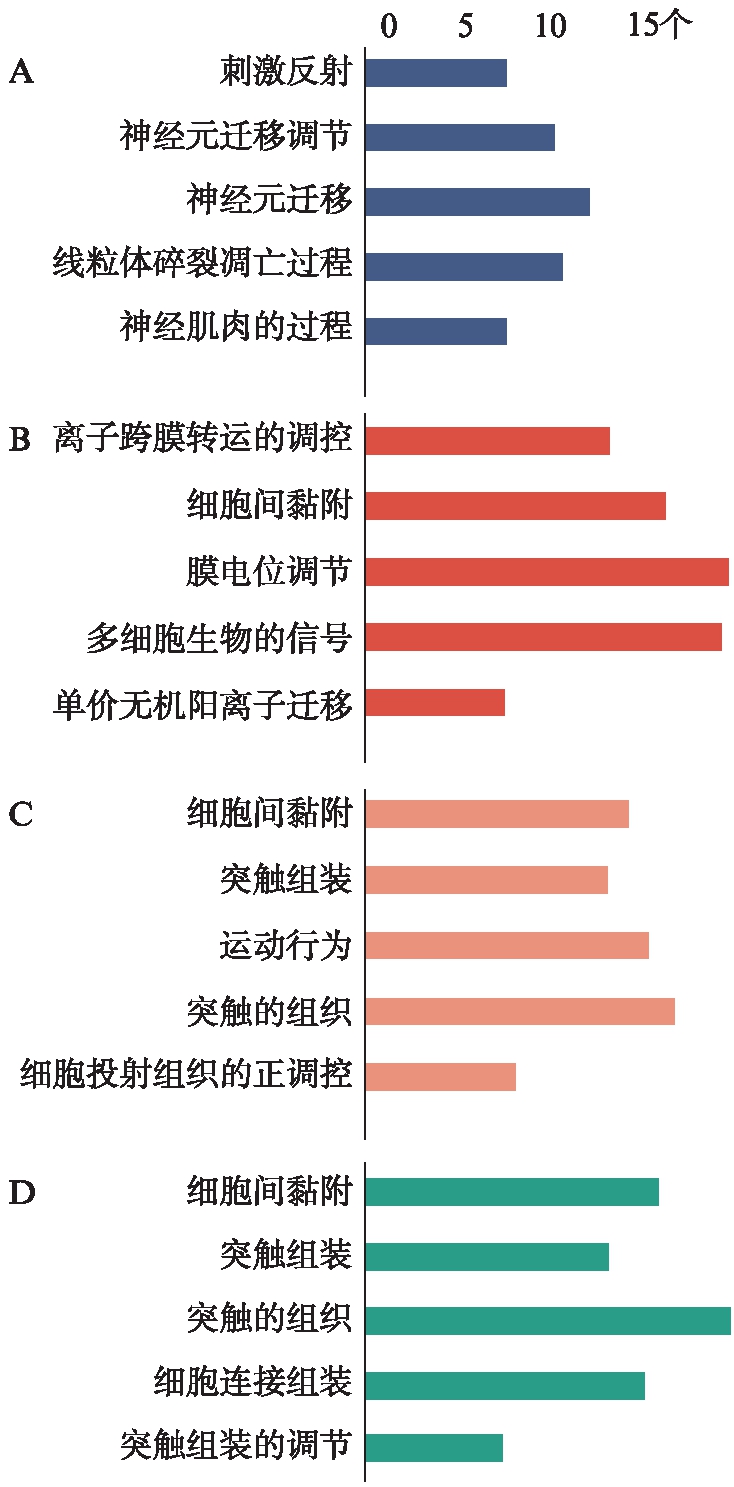
图6 各细胞类型下调基因GO分析结果
Fig.6 Go analysis(BP) results of down-regulated genes in main cell type
A: 神经细胞;B: 星形胶质细胞;C: 少突胶质细胞;D: 小胶质细胞

图7 下调基因的PPI网络图(星形胶质细胞)
Fig.7 PPI network map of down-regulated genes(astrocytes)
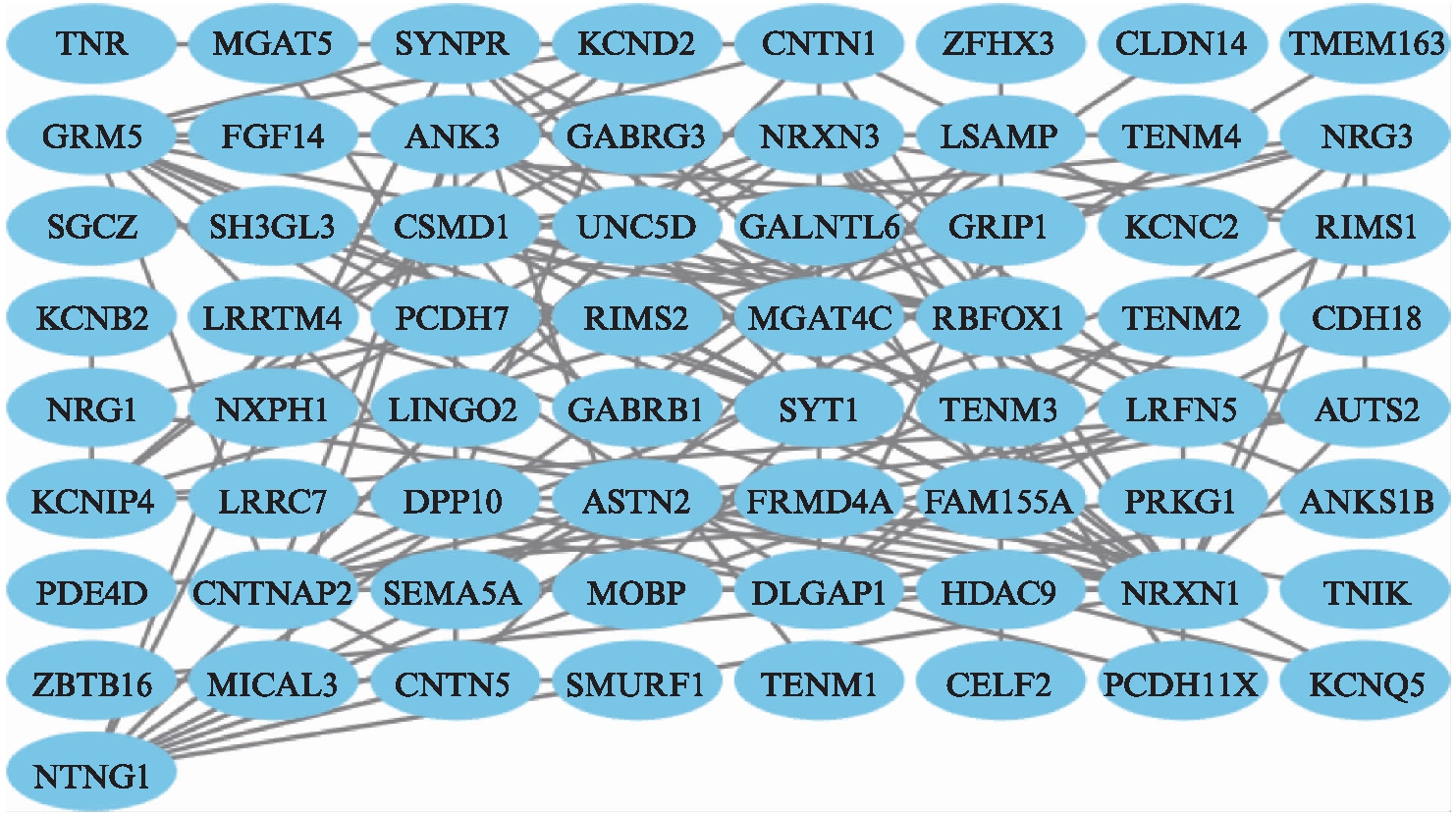
图8 下调基因的PPI网络图(少突胶质细胞)
Fig.8 PPI network map of down-regulated genes(oligodendrocytes)
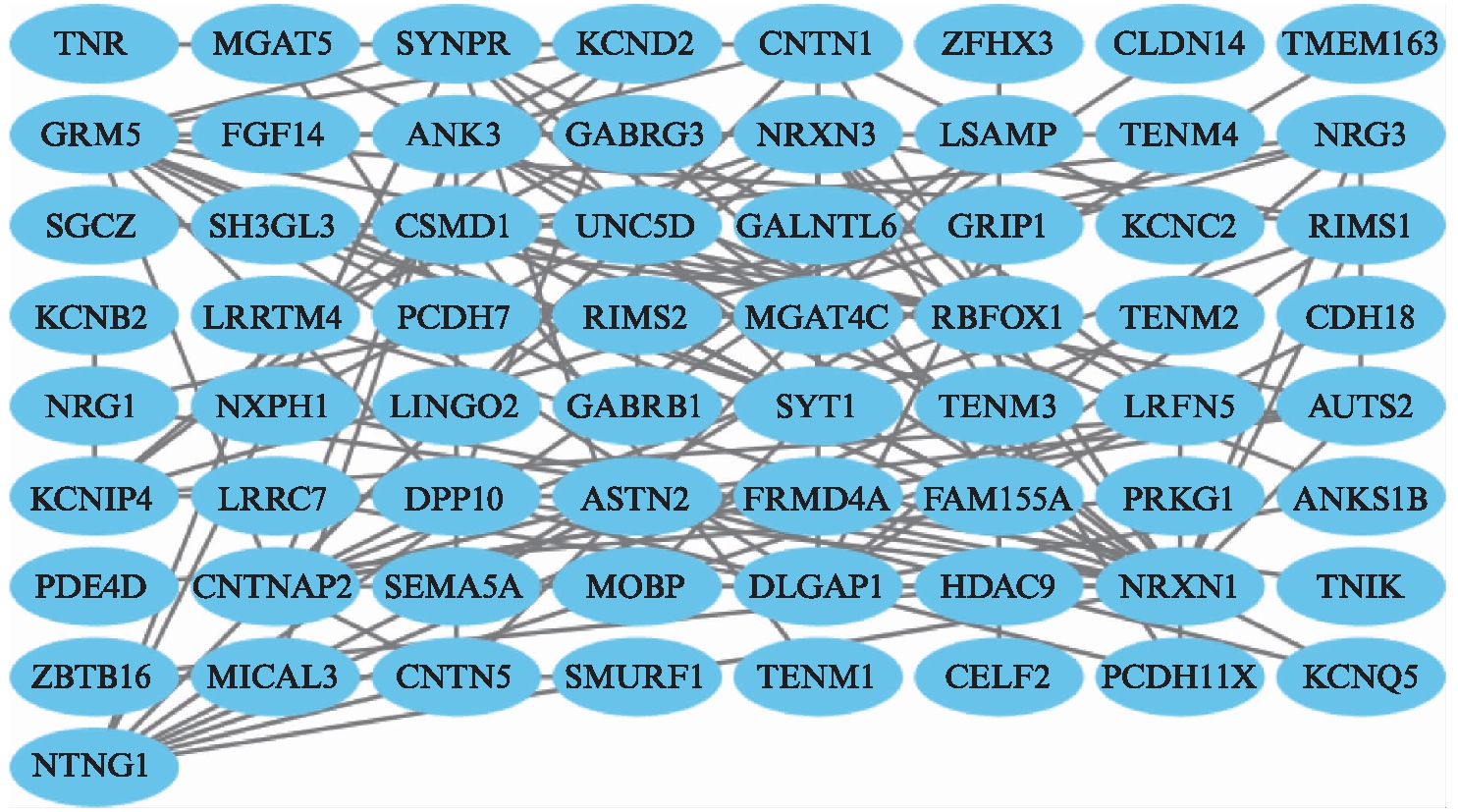
图9 下调基因的PPI网络图(小胶质细胞)
Fig.9 PPI network map of down-regulated genes(microglia)

图10 关键靶基因图
Fig.10 PPI network of hub gene
A: 星形胶质细胞;B: 少突胶质细胞;C: 小胶质细胞
3 讨 论
本研究通过分离S89G-DMP1小鼠与对照组小鼠的脑组织,制备单细胞悬液后上机测序得到单细胞转录组数据,利用Seurat对各细胞亚群进行差异基因分析,将具体细胞类型进行定义。诸多研究结果提示BBB功能的破坏与中枢神经系统(central nervous system, CNS)疾病密切相关,并且受到神经局部炎症微环境、星形胶质细胞、内皮细胞、周细胞、小胶质细胞以及神经元多方面的时序性调控,促炎剂脂多糖(lipopolysaccharide, LPS)激活的小胶质细胞能有效增加BBB内皮细胞的通透性[13],但同时也发现抑炎型小胶质细胞与缺血后恢复期间的长期神经血管重塑和神经功能改善有关[14],具有双重作用[15]。而在缺血区域,研究还发现周细胞能够表达小胶质细胞标记基因及干细胞标志物[16-17],并且与瘢痕组织形成相关[18]。针对少突胶质细胞,研究发现其增强BBB完整性的途径不是通过脑内皮细胞来源的PDGF-BB/PDGFRα信号通路,而是通过可溶性因子组成性地支持BBB的完整性[19]。本研究发现BBB的通透性可能受到星形胶质细胞、少突胶质细胞与小胶质细胞的共同调控,且PPI蛋白互作网络结果提示其关键靶基因表达具有一定的协同性。
Jing等[12]通过同源重组的方法,在C57BL/6J背景的小鼠体内敲入一段突变序列,将DMP1糖基化位点的丝氨酸错义突变为分子量更小的甘氨酸,构建出本研究中的S89G-DMP1小鼠模型。研究发现S89G-DMP1小鼠的星形胶质细胞出现皱缩,并且无法正确将终末足靶向定位到内皮细胞或周细胞上,进而丧失对BBB功能的维持作用;AQP4的低表达使星形胶质细胞对水通量的调节紊乱;另一方面,层粘连蛋白和ZO-1的表达量降低,使血管内皮细胞间的紧密连接松动,最终导致BBB功能障碍。为了进一步探究DMP1改变BBB通透性的作用机制,本研究应用单细胞转录组测序技术将S89G-DMP1与对照组小鼠大脑的单细胞转录组数据进行比较,发现S89G-DMP1小鼠与对照组小鼠的神经细胞基因表达较为接近,而在星形胶质细胞中与细胞黏附功能相关的基因显著下调,进一步证明了DMP1通过改变星形胶质细胞的黏附功能影响BBB的通透性。此外,除了星形胶质细胞,DMP1点突变还会影响小胶质细胞与少突胶质细胞的表达,与细胞黏附功能相关的基因也被同步下调。因此研究发现,DMP1点突变通过降低星形胶质细胞、小胶质细胞、少突胶质细胞的黏附性来增加BBB的通透性,进而造成BBB功能障碍。DMP1是BBB的关键分子调节剂。
研究证明BBB损伤可能是但不仅限于缺血性脑卒中的疾病进展因素而非疾病进展结果[20-24],因此BBB功能的保护可能是诸多CNS疾病的治疗新靶向,本文通过单细胞测序的方法揭示BBB通透性改变的分子机制,可能为CNS疾病提供一种新的治疗策略。
[1] ZHAO Z, NELSON A R, BETSHOLTZ C, et al. Establishment and dysfunction of the blood-brain barrier[J]. Cell, 2015,163(5): 1064-1078.
[2] ATTWELL D, BUCHAN A M, CHARPAK S, et al. Glial and neuronal control of brain blood flow[J]. Nature, 2010,468(7321): 232-243.
[3] KNOWLAND D, ARAC A, SEKIGUCHI K J, et al. Stepwise recruitment of transcellular and paracellular pathways underlies blood-brain barrier breakdown in stroke[J]. Neuron, 2014,82(3): 603-617.
[4] ARMULIK A, GENOVÉ G, M E M, et al. Pericytes regulate the blood-brain barrier[J]. Nature, 2010,468(7323): 557-561.
E M, et al. Pericytes regulate the blood-brain barrier[J]. Nature, 2010,468(7323): 557-561.
[5] DALKARA T, ALARCON-MARTINEZ L. Cerebral microvascular pericytes and neurogliovascular signaling in health and disease[J]. Brain Res, 2015,1623: 3-17.
[6] TANG M, RICH J N, CHEN S. Biomaterials and 3D bioprinting strategies to model glioblastoma and the blood-brain barrier[J]. Adv Mater, 2021,33(5): e2004776.
[7] PATABENDIGE A, SKINNER R A, ABBOTT N J. Establishment of a simplified in vitro porcine blood-brain barrier model with high transendothelial electrical resistance[J]. Brain Res, 2013,1521: 1-15.
[8] GEORGE A, SABSAY B, SIMONIAN P A, et al. Characterization of a novel dentin matrix acidic phosphoprotein. Implications for induction of biomineralization[J]. J Biol Chem, 1993,268(17): 12624-12630.
[9] GEORGE A, SILBERSTEIN R, VEIS A. In situ hybridization shows Dmp1(AG1) to be a developmentally regulated dentin-specific protein produced by mature odontoblasts[J]. Connect Tissue Res, 1995,33(1-3): 67-72.
[10] TERASAWA M, SHIMOKAWA R, TERASHIMA T, et al. Expression of dentin matrix protein 1(DMP1) in nonmineralized tissues[J]. J Bone Miner Metab, 2004,22(5): 430-438.
[11] YAO Y, CHEN Z L, NORRIS E H, et al. Astrocytic laminin regulates pericyte differentiation and maintains blood brain barrier integrity[J]. Nat Commun, 2014,5: 3413.
[12] JING B, ZHANG C, LIU X, et al. Glycosylation of dentin matrix protein 1 is a novel key element for astrocyte maturation and BBB integrity[J]. Protein Cell, 2018,9(3): 298-309.
[13] SUMI N, NISHIOKU T, TAKATA F, et al. Lipopolysaccharide-activated microglia induce dysfunction of the blood-brain barrier in rat microvascular endothelial cells co-cultured with microglia[J]. Cell Mol Neurobiol, 2010,30(2): 247-253.
[14] YANG Y R, SALAYANDIA V M, THOMPSON J F, et al. Attenuation of acute stroke injury in rat brain by minocycline promotes blood-brain barrier remodeling and alternative microglia/macrophage activation during recovery[J]. J Neuroinflammation, 2015,12: 26.
[15] HARUWAKA K, IKEGAMI A, TACHIBANA Y, et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation[J]. Nat Commun, 2019,10(1): 5816.
[16] ATTWELL D, MISHRA A, HALL C N, et al. What is a pericyte? [J]. J Cereb Blood Flow Metab, 2016,36(2): 451-455.
[17] SAKUMA R, KAWAHARA M, NAKANO-DOI A, et al. Brain pericytes serve as microglia-generating multipotent vascular stem cells following ischemic stroke[J]. J Neuroinflammation, 2016,13(1): 57.
[18] FERN NDEZ-KLETT F, POTAS J R, HILPERT D, et al. Early loss of pericytes and perivascular stromal cell-induced scar formation after stroke[J]. J Cereb Blood Flow Metab, 2013,33(3): 428-439.
NDEZ-KLETT F, POTAS J R, HILPERT D, et al. Early loss of pericytes and perivascular stromal cell-induced scar formation after stroke[J]. J Cereb Blood Flow Metab, 2013,33(3): 428-439.
[19] KIMURA I, DOHGU S, TAKATA F, et al. Oligodendrocytes upregulate blood-brain barrier function through mechanisms other than the PDGF-BB/PDGFRα pathway in the barrier-tightening effect of oligodendrocyte progenitor cells[J]. Neurosci Lett, 2020,715: 134594.
[20] KEEP R F, ZHOU N N, XIANG J M, et al. Vascular disruption and blood-brain barrier dysfunction in intracerebral hemorrhage[J]. Fluids Barriers CNS, 2014,11: 18.
[21] LIU H, WANG Y, XIAO Y Q, et al. Hydrogen sulfide attenuates tissue plasminogen activator-induced cerebral hemorrhage following experimental stroke[J]. Transl Stroke Res, 2016,7(3): 209-219.
[22] SHI Y J, ZHANG L L, PU H J, et al. Rapid endothelial cytoskeletal reorganization enables early blood-brain barrier disruption and long-term ischaemic reperfusion brain injury[J]. Nat Commun, 2016,7: 10523.
[23] NAGELHUS E A, OTTERSEN O P. Physiological roles of aquaporin-4 in brain[J]. Physiol Rev, 2013,93(4): 1543-1562.
[24] TOURDIAS T, MORI N, DRAGONU I, et al. Differential aquaporin 4 expression during edema build-up and resolution phases of brain inflammation[J]. J Neuroinflammation, 2011,8: 143.