肥胖是全球死亡率和慢性病发病率持续增高的重要因素之一,已作为重大公共卫生问题引起世界卫生组织的重点关注,而我国的肥胖发病率也呈现上升势态[1]。肥胖是诸多代谢性疾病的重要致病因素,其与非酒精性脂肪性肝病(non-alcoholic fatty liver diseases,NAFLD)的发生发展密切相关[2]。我国NAFLD的患病率已高达29.8%并仍保持持续增长态势,为疾病防控带来严峻挑战,因此也成为现今的一个研究热点[3]。但现今尚无有效治疗改善NAFLD肝脏脂肪变性的药物,治疗仍以控制减轻体质量为主[4]。现有多项研究[5-8]表明,胃袖状切除术(sleeve gastrectomy,SG)在改善肥胖合并NAFLD等代谢性疾病方面相较运动减肥、传统对症治疗等方式更具优势,但术后肝脏组织脂代谢功能恢复机制仍不明确,因此对其研究迫切且意义重大。既往研究[9-11]表明,SG可通过恢复肝脏组织内脂质从头合成(de novo lipogenesis,DNL)速率达到改善肝脏脂肪变性的目的。同时研究[12]表明,肝脏内DNL过程的重要转录因子——碳水化合物反应元件结合蛋白(carbohydrate responsive element binding protein,ChREBP)的含量与NAFLD等一系列肥胖相关的代谢性疾病密切相关。然而,在SG术后肝脏脂肪变性改善过程中ChREBP是否发挥作用尚未见报道。鉴于此,本研究旨在动物及细胞水平上验证SG对肝脏组织ChREBP表达的影响及其介导的细胞内脂肪蓄积的变化特点,为进一步揭示SG改善肝脏脂肪变性的机制提供新的研究思路。
1 材料与方法
1.1 实验动物及细胞
健康4周龄野生型雄性SPF级C57BL/6小鼠30只,体质量(11.36±1.16) g,购自上海杰思捷实验动物有限公司,生产许可证号码:SCXK(沪)2018—0004,用于构建健康对照小鼠及肥胖合并NAFLD小鼠模型。小鼠正常肝实质AML-12细胞株购自美国菌种保藏中心(American Type Culture Collection,ATCC)。
1.2 主要试剂
抗碳水化合物反应元件结合蛋白(carbohydrate responsive element binding protein,ChREBP)抗体、抗β-actin抗体购自美国Cell Signaling Technology公司;总胆固醇(total cholesterol,TC)测定试剂盒、总三酰甘油(total triglycerides,TG)测定试剂盒购自南京建成生物工程研究所;DMEM/f12、胎牛血清(fetal bovine serum,FBS)购自Gibco公司;胰岛素转铁蛋白硒混合物(insulin-transferrin-selenium,ITS)、双抗(100 U/mL青霉素、100 μg/mL链霉素)、嘌呤霉素(Puromycin)、地塞米松(Dexame-thasone)购自Invitrogen公司;油酸购自Sigma公司;包被小鼠碳水化合物反应元件结合蛋白(NCBI NM_000071.6)过表达质粒和短发夹RNA(short hairpin RNA,shRNA)慢病毒由汉恒生物科技(上海)有限公司合成。shRNA慢病毒载体为:pHBLV-U6-MCS-CMV-ZsGreen-PGK-PURO;序列信息如下:5′-GATCCGCGGAGCAGAAGAGGCGGTT-CAATATTTCAAGAGAATATTGAACCGCCTCTTCT-GCTCCGTTTTTTG-3′,3′-AATTCAAAAAACGGAG-CAGAAGAGGCGGTTCAATATTCTCTTGAAATATT-GAACCGCCTCTTCTGCTCCGCG-5′。
1.3 方法
1.3.1 动物模型与分组 所有动物适应性饲养1周后,随机将动物分为3组:胃袖状切除术(SG)组、假手术(sham)组及健康对照(control)组,每组各10只。SG组及sham组给予脂肪热卡百分比为40%的高糖高脂饲料(D09100301,Research Diet)喂养20周[13],同时control组给予脂肪热卡百分比为10%的普通饲料(上海交通大学医学院附属第九人民医院实验动物中心提供)。20周后检测SG组、sham组及control组小鼠体质量。排除sham组1只小鼠肥胖造模失败,control组小鼠体质量为(24.90±0.83) g,而SG组为(38.83±1.09) g,sham组为(37.18±1.97)g,分别超过control组体质量约55.94%及49.32%。随机选取3只小鼠,对其肝脏组织进行病理分析,脂质蓄积面积百分比control组为(3.06±0.07)%,而SG组为(49.53±2.39)%,sham组为(47.96±1.57)%;肥胖合并NAFLD模型的入选标准为体质量超过control组20%并同时满足肝脏脂肪变性33%以上[2,14]。SG组按标准手术方式进行操作[15]:术前16~24 h禁食,异氟醚(含2%~3%O2)进行麻醉,并固定于操作台上。取上腹正中切口约1 cm,充分暴露手术区域,使用动脉夹夹闭约80%的胃组织,切除胃食管交界处远端0.5 cm至幽门近端0.5 cm 处的胃组织,6-0可吸收线连续缝合。术后置于恒温加热垫复苏,并于术后12 h恢复流食(10%葡萄糖溶液),72 h逐步恢复正常饮食。sham组的麻醉、手术时间及术后恢复等与SG组保持一致,仅暴露手术视野,再行腹部切口缝合。于术后第4、8周分批处死动物并留取肝脏组织标本。所有动物实验均于上海交通大学医学院附属第九人民医院动物房内进行,并经动物伦理委员会批准(批件号:SH9H-2020-A715-1)。
1.3.2 细胞模型与分组 AML-12细胞完全培养基为10%FBS、1%ITS、40 ng/mL地塞米松、1%双抗、88%DMEM/f12。
构建ChREBP过表达的AML-12细胞,将AML-12以1×105/孔接种于24孔板内,置于37 ℃、5%CO2的细胞培养箱中进行培养,待细胞密度生长至2×105/孔时,更换为包被ChREBP过表达质粒的慢病毒(MOI=10)、5 μg/mL Polybrene的完全培养基培养24 h,弃上清液加入完全培养基培养48 h,之后加入2 μg/mL的嘌呤霉素筛选稳定转染细胞株。此时细胞分为3组:正常对照(AML-12)组、ChREBP过表达组及阴性对照(vehicle)组。
构建ChREBP敲低的AML-12细胞,将AML-12以1×105/孔接种于24孔板内,置于37 ℃、5%CO2的细胞培养箱中进行培养,待细胞密度生长至2×105/孔时,更换为包被ChREBP-shRNA的慢病毒(MOI=10)、5 μg/mL Polybrene的完全培养基培养24 h,弃上清液加入完全培养基培养48 h,之后加入2 μg/mL 的嘌呤霉素筛选稳定转染细胞株。根据Western印迹法结果,筛选并确认shRNA干扰效率高的序列。此时细胞分为3组:正常对照(AML-12)组、ChREBP沉默组及阴性对照(vehicle)组。
将各组细胞分别接种于6孔板内,完全贴壁后,更换为不含FBS的培养基,饥饿处理12 h后分别加入油酸(oleic acid,OA)1 mmol/L或PBS干预细胞12 h,进而诱导AML-12细胞内脂质蓄积[16-17]。
1.3.3 体质量变化 观察记录术前及术后各组小鼠的体质量变化,每2周1次。
1.3.4 肝脏病理变化 观察术后4、8周,颈椎脱臼法处死各组3只小鼠,迅速取肝,并使用PBS洗净表面血液分装保存。将其置于液氮中速冻,在本院病理科的协助下,完成油红O染色及H-E染色。光镜下以×200放大倍数进行观察评估。同时,采用Image J测定油红O染色组织学切片中脂质蓄积面积占总面积的百分比。
1.3.5 脂质蓄积定量分析 将完成OA脂质蓄积诱导的细胞置于4%多聚甲醛室温下固定10 min,之后60%的异丙醇增加细胞通透性1 min,随后使用油红工作液(60%异丙醇溶液配制)室温下孵育细胞10 min,PBS清洗3遍后在光镜下以×400放大倍数进行观察评估。同时,采用Image J测定细胞固定片中脂质蓄积面积占总面积的百分比。
1.3.6 脂质指标检测 根据TC、TG检测试剂盒实验说明书进行操作。肝脏及细胞样本使用无水乙醇进行匀浆并取上清,之后将其加入工作液混匀后,37 ℃ 孵育10 min,用酶标仪检测510 nm处的吸光度(A510)。计算公式如下:(样本OD值-空白OD值)/(校准OD值-空白OD值)×校准品浓度(mmol/L)/待测样品蛋白浓度(g/L),校准品浓度已知。
1.3.7 Western印迹法检测 提取肝脏组织及细胞蛋白后BCA法检测其蛋白浓度。20 μg总蛋白等质量上样,经8%SDS-PAGE电泳;转膜至PVDF膜上,5%脱脂奶粉室温封闭1 h,TBST洗膜3次,每次5 min;一抗4 ℃孵育过夜,TBST洗膜3次,每次5 min,室温下二抗孵育1 h;ECL发光显影。用Image J对条带的灰度值定量分析,以β-actin作为内参。
1.4 统计学处理
应用SPSS 23.0软件进行统计学分析。各组数据以![]() 表示,组间差异比较采用单因素方差分析(ANOVA检验),并进行Bonferroni事后检验。每组代表性实验进行3次生物学重复。P<0.05为差异有统计学意义。
表示,组间差异比较采用单因素方差分析(ANOVA检验),并进行Bonferroni事后检验。每组代表性实验进行3次生物学重复。P<0.05为差异有统计学意义。
2 结 果
2.1 SG术后体质量变化
术后各组小鼠体质量差异采用单因素方差分析,SG组小鼠在各时间点体质量较control组以及sham组差异均有统计学意义(P<0.05)。其中SG组于术后4周体质量达到最低值,之后体质量相对较为平稳并呈现缓慢上升趋势,与sham组及control组差异有统计学意义,见图1。

图1 高糖高脂饮食诱导及SG术后小鼠体质量变化图
Fig.1 Body weight of high-fat high-glucose diet induction and after SG in mice
A:高糖高脂饮食造模期间小鼠的体质量变化情况,SG组与control组相比,#P<0.05,sham组与control组相比,*P<0.05,n=10;B:各组小鼠术后体质量变化情况,SG组与control组相比,*P<0.05,SG组与sham组相比,ΔP<0.05,n=6 or 3
2.2 SG术后肝脏脂肪变性改变
术后4周和8周,SG组小鼠的肝脏脂肪变性程度呈现逐渐好转趋势。H-E切片提示,肝细胞体积减小,肿胀情况得到缓解,组织形态得以恢复;同时通过Image J对油红O染切片进行肝脏组织内脂质沉积面积定量分析,SG组术后4周和8周肝脏组织内脂质蓄积面积百分比分别为(38.61±3.28)%以及(13.48±3.12)%,与sham组比较改善显著。结果提示,在术后8周内,肝脏组织脂肪变性呈现持续改善趋势,见图2。
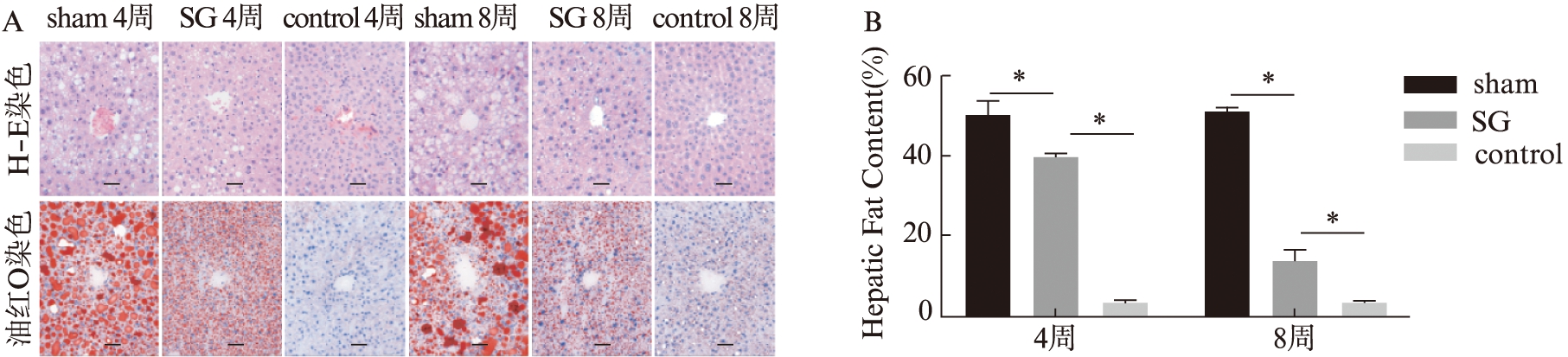
图2 SG术后肝脏病理组织改变
Fig.2 Histopathological changes in the liver after SG surgery
A:各组小鼠肝脏组织H-E染色及油红O染色切片,标尺大小为50 μm(×200);B:Image J对油红O染色的脂质蓄积面积进行定量评估,*P<0.05,n=3
为了进一步观察术后肝脏脂肪变性的变化情况,分别检测各组小鼠肝脏内的TC、TG含量。如图3A所示,SG组术后4周和8周肝脏组织中TC的含量分别为(0.31±0.03) g/L以及(0.22±0.02) g/L,含量显著优于sham组;SG组术后4周和8周肝脏组织中TG的含量分别为(0.22±0.01) g/L以及(0.18±0.01) g/L,显著优于sham组,见图3。结果提示,SG术后不仅可以改善脂质蓄积面积还可显著改善肝脏内包括TC、TG在内的脂代谢指标。
2.3 SG术后肝脏ChREBP表达变化
Western印迹法分别检测术后各组小鼠肝脏中ChREBP的蛋白水平表达情况。如图3所示,结果显示术后4周肝脏组织内ChREBP的表达量与sham组差异显著,同时与control组差异显著;而术后8周时,与sham组差异显著,但与control组不显著。提示,SG术后小鼠肝脏组织中ChREBP的表达呈持续下降趋势,差异有统计学意义(P<0.05),见图4。

图3 SG术后肝脏脂代谢指标及蛋白改变
Fig.3 Lipid metabolism index and protein changes in the liver after SG surgery
A:术后各组小鼠肝脏组织中TC及TG含量比较,n=3;B:术后各组小鼠肝脏组织中ChREBP蛋白水平表达;*P<0.05,n=3
2.4 细胞内ChREBP表达介导肝实质细胞内脂质沉积变化
为了进一步明确ChREBP与肝细胞脂代谢间的关系,通过慢病毒转染的方式,构建了ChREBP过表达以及沉默的AML-12细胞。经油酸诱导12 h后,ChREBP过表达组细胞内的脂质沉积面积显著高于正常对照组及阴性对照组;ChREBP沉默组细胞内脂质沉积相对较小且分散,显著低于正常对照组及阴性对照组。同时对各组细胞内的脂代谢指标TC、TG进行定量分析,结果显示ChREBP过表达组含量显著高于正常对照组及阴性对照组,而ChREBP沉默组含量显著低于正常对照组及阴性对照组,见图4、5。提示ChREBP参与肝细胞的脂代谢,且其表达量的高低与细胞内脂肪蓄积及TC、TG含量情况密切相关。
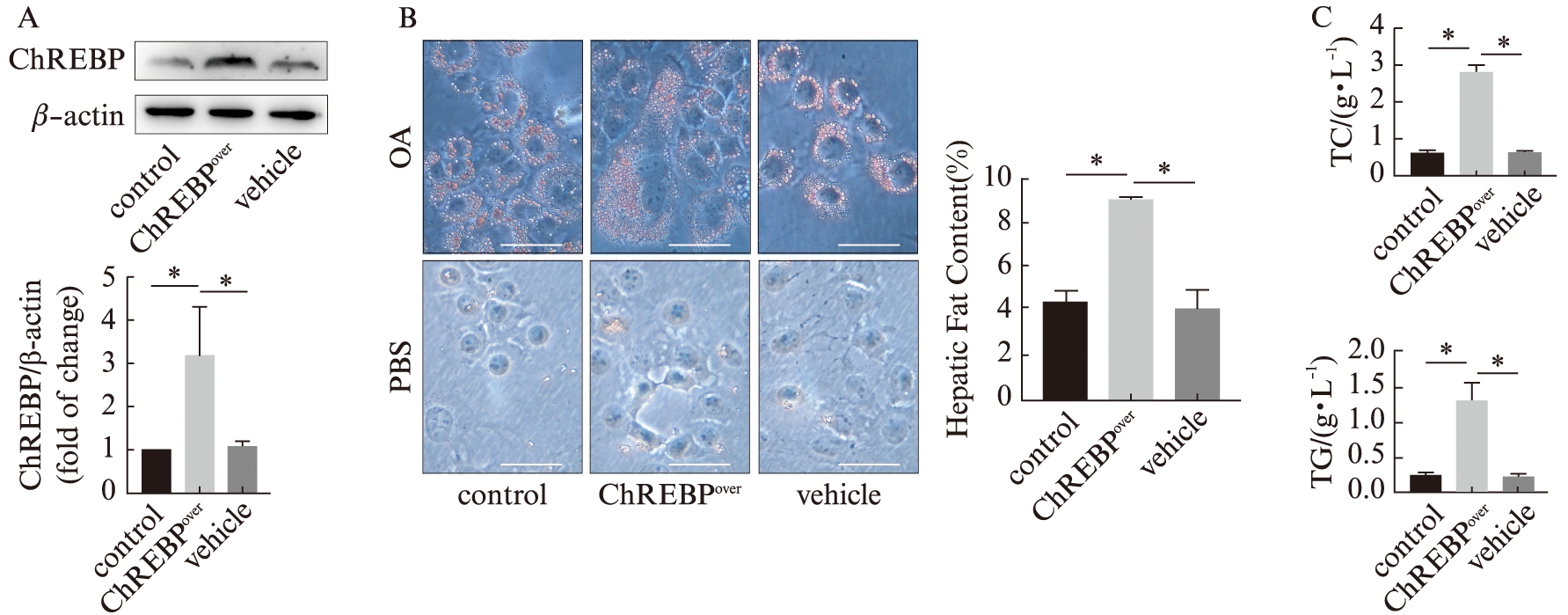
图4 脂质沉积实验检测过表达ChREBP对AML-12细胞脂代谢能力的影响
Fig.4 Lipid accumulation experiments to detect the over-expression of ChREBP on lipid metabolism in AML-12 cells
A:Western印迹法检测慢病毒转染效率;B:光学显微镜下观察各组细胞内脂质蓄积情况,并通过Image J定量分析,标尺大小为50 μm(×400);C:各组细胞内TC以及TG的含量检测;*P<0.05,n=3
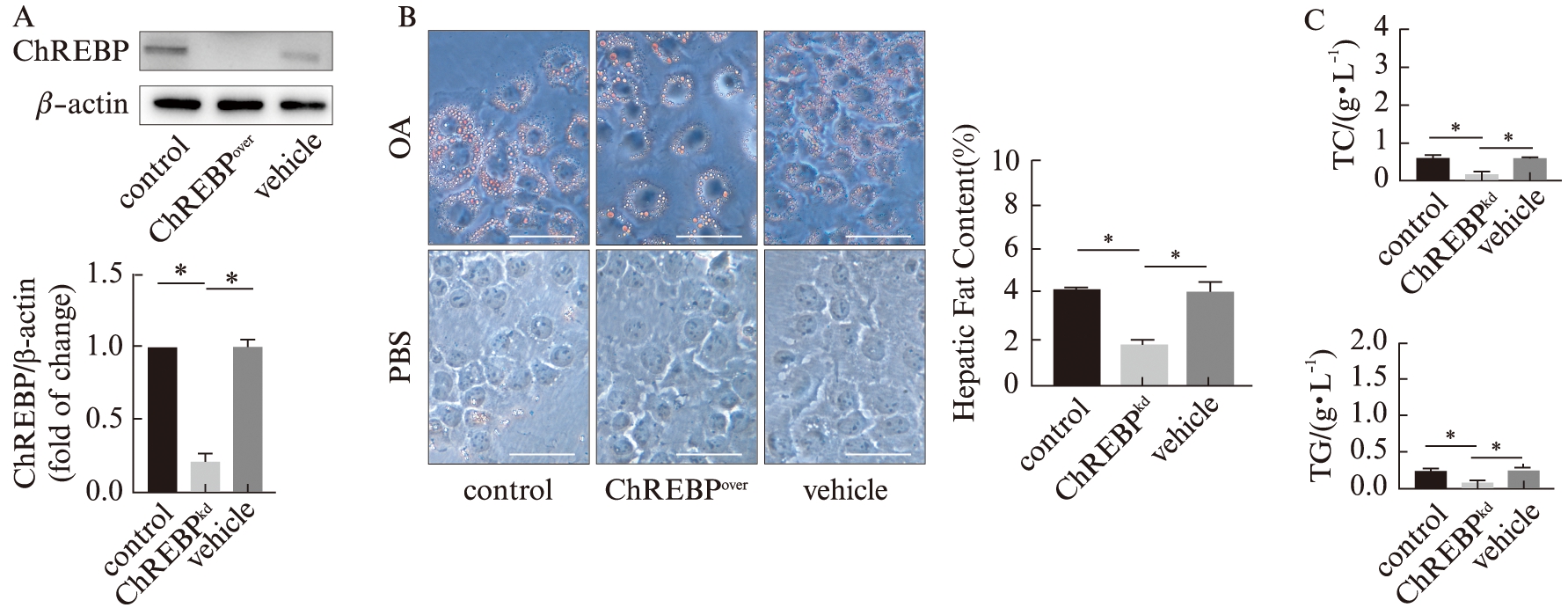
图5 脂质沉积实验检测沉默ChREBP对AML-12细胞脂代谢能力的影响
Fig.5 Lipid accumulation experiments to detect the knock-down of ChREBP on lipid metabolism in AML-12 cells
A:Western印迹法检测慢病毒转染效率;B:光学显微镜下观察各组细胞内脂质蓄积情况,并通过Image J定量分析,标尺大小为50 μm(×400);C:各组细胞内TC以及TG的含量检测;*P<0.05,n=3
3 讨 论
随着肥胖的发病率逐年增高,NAFLD已成为我国发病率最高的慢性肝病,同时也是健康体检肝脏生物化学指标异常的首要原因,严重危害人们的身体健康[18]。目前已开展多项基于治疗改善NAFLD脂肪变性的临床及基础研究,但均未被证实对50%以上的患者有效,因此其疗效仍有待进一步验证[19-22]。国内外各指南均将生活方式改善以及合理控制体质量作为NAFLD防治的首要原则[2,18,23]。然而一般的减重方式,均存在治疗周期长、维持难度大、易反弹等局限性,对于病态性肥胖症患者更是收效甚微。因此对于肥胖或伴有并发症的患者来说,减重代谢手术是首选治疗方案[24]。近年来,减重与代谢外科的迅猛发展,其所带来的诸多优势逐渐被人们所熟知。减重手术不仅可长期稳定控制体质量,还可显著改善肥胖相关的代谢性疾病,包括NAFLD、T2DM等[25-26]。据Lee等[27]的1篇纳入了32项研究的Meta分析报道,减重代谢手术对NAFLD患者肝脂肪变性疗效显著,但仍有12%患者术后出现了肝组织学恶化。随着减重代谢手术在治疗或缓解肥胖及其相关代谢性疾病的疗效获得广泛认可及推广,对其治疗机制的探究也成为近年来研究的热点,现已提出不少假说和科学依据,如糖脂代谢重平衡理论[28-29]、肠道微生物菌群改变理论[30]、胆汁酸代谢[31]、肠激素变化理论[32]等,但其均不能充分解释术后肝脏组织变化的特点及原因。因此,从术后肝脏组织脂代谢功能恢复的角度去阐释减重手术治疗改善肝脏脂肪变性的相关机制十分迫切且意义重大。
肝脏组织中脂质沉积主要是肝细胞内脂质合成增加、脂质分解以及脂质分泌减少的综合体现[4]。前期研究[12,33-35]已证明转录因子ChREBP被认为可通过调控肝脏脂质从头合成以及脂质分泌关键酶包括脂肪酸合成酶(fatty acid synthase,Fasn)、超长链脂肪酸连接酶6(elongation of very long chain fatty acids protein 6,Elovl6)、硬脂酰辅酶A去饱和酶1(stea-royl-CoA desaturase 1,Scd1)等,参与调控细胞内的脂质代谢情况,维持代谢稳态。Lizuka等[36]发现,ChREBP全身敲除小鼠肝脏脂质合成能力下降约60%,同时伴有Fasn、Elovl6、Scd1等基因mRNA表达下调。此外,Benhamed等[37]通过小鼠肝脏中腺病毒过表达ChREBP的方式证实了ChREBP的过表达可以促进上述基因表达上调,进而促进小鼠肝脏脂质累积。同时已有相关临床研究发现,肥胖合并NAFLD患者肝脏组织中ChREBP及下游脂质从头合成相关基因高表达,然而目前对ChREBP在减重手术术后肝脏脂肪变性好转过程中是否发挥作用尚未见报道。
本研究观察到:肥胖合并NAFLD小鼠施行SG手术后,小鼠在术后4周内体质量下降明显,之后缓慢增长;而肝脏脂质沉积面积、TC以及TG含量则呈现持续改善。在术后4~8周体质量逐渐增长的情况下,肝脏组织脂肪变性仍得到显著改善。同时还观察到肝脏中ChREBP的表达随着术后恢复时间的延长,呈现显著下降的趋势。在小鼠体质量相对稳定后,肝脏组织脂肪变性以及ChREBP含量依然得到持续改善,其结果提示,SG术后肝脏组织的脂代谢改善可能并不完全以体质量依赖的方式得以实现。既往研究也表明,减重手术在发挥改善机体代谢的功能时,可能并不完全以一种体质量依赖性的方式得以实现[29],这一观点与本研究结果一致。同时也有相似的临床研究报道,机体的代谢功能恢复先于体质量显著减轻[38],这与本研究的结果存在差异,推测小鼠在体质量显著减轻后,最先得到改变的是循环中的脂代谢指标,而肝脏脂肪变性的改善是一个相对较为缓慢的过程,需要足够的时间清除术前肝脏组织内蓄积的相关脂质物质,进而造成观察到的体质量相对较为稳定但肝脏脂肪变性持续改善的情况。
此外,为了进一步探究明确ChREBP的表达与肝细胞内脂质沉积情况的关系,构建了ChREBP过表达与沉默的细胞模型,发现相同浓度OA干预的情况下,ChREBP过表达组细胞内脂质沉积面积以及TC、TG含量均显著高于正常对照组及阴性对照组。ChREBP的表达下调可有效减慢肝细胞内的脂质从头合成速率,进而使得肝脏脂肪变性显著改善。已有报道称,胰岛素[39]、甲状腺素[40]等多因素可参与ChREBP的表达调控,且过程极为复杂,因此对减重手术下调肝脏组织中ChREBP的表达的具体原因仍有待后续工作进一步阐明。
综上所述,本研究通过动物及细胞模型,观察发现SG手术可显著改善肝脏脂肪变性,肝脏组织中ChREBP的表达下调发挥了重要作用。初步揭示SG术后肝脏脂代谢功能改善的分子基础,将为日后开发非手术治疗的靶向治疗药物提供理论基础和实验依据。
[1] BLÜHER M.Obesity:global epidemiology and pathogenesis[J].Nat Rev Endocrinol,2019,15(5):288-298.
[2] CHALASANI N,YOUNOSSI Z,LAVINE J E,et al.The diagnosis and management of nonalcoholic fatty liver disease:practice guidance from the American Association for the study of liver diseases[J].Hepatology,2018,67(1):328-357.
[3] FAN J G,KIM S U,WONG V W.New trends on obesity and NAFLD in Asia[J].J Hepatol,2017,67(4):862-873.
[4] FRIEDMAN S L,NEUSCHWANDER-TETRI B A,RINELLA M,et al.Mechanisms of NAFLD development and therapeutic strategies[J].Nat Med,2018,24(7):908-922.
[5] CABRÉ N,LUCIANO-MATEO F,FERN NDEZ-ARROYO S,et al.Laparoscopic sleeve gastrectomy reverses non-alcoholic fatty liver disease modulating oxidative stress and inflammation[J].Metabolism,2019,99:81-89.
NDEZ-ARROYO S,et al.Laparoscopic sleeve gastrectomy reverses non-alcoholic fatty liver disease modulating oxidative stress and inflammation[J].Metabolism,2019,99:81-89.
[6] MATTAR S G,VELCU L M,RABINOVITZ M,et al.Surgically-induced weight loss significantly improves nonalcoholic fatty liver disease and the metabolic syndrome[J].Ann Surg,2005,242(4):610-617.
[7] SALMAN A A,SULTAN A A E A,ABDALLAH A,et al.Effect of weight loss induced by laparoscopic sleeve gastrectomy on liver histology and serum adipokine levels[J].J Gastroenterol Hepatol,2020,35(10):1769-1773.
[8] ZHANG Y X,YANG L,YANG C C,et al.Correlation between obstructive sleep apnea and non-alcoholic fatty liver disease before and after metabolic bariatric surgery[J].Obes Surg,2020,30(10):3803-3812.
[9] CHELLA KRISHNAN K,FLOYD R R,SABIR S,et al.Liver pyruvate kinase promotes NAFLD/NASH in both mice and humans in a sex-specific manner[J].Cell Mol Gastroenterol Hepatol,2021,11(2):389-406.
[10] DEL R O-MORENO M,ALORS-PÉREZ E,GONZ
O-MORENO M,ALORS-PÉREZ E,GONZ -LEZ-RUBIO S,et al.Dysregulation of the splicing machinery is associated to the development of nonalcoholic fatty liver disease[J].J Clin Endocrinol Metab,2019,104(8):3389-3402.
-LEZ-RUBIO S,et al.Dysregulation of the splicing machinery is associated to the development of nonalcoholic fatty liver disease[J].J Clin Endocrinol Metab,2019,104(8):3389-3402.
[11] MARCHESINI G,PETTA S,DALLE GRAVE R.Diet,weight loss,and liver health in nonalcoholic fatty liver disease:Pathophysiology,evidence,and practice[J].Hepatology,2016,63(6):2032-2043.
[12] WANG Y H,VISCARRA J,KIM S J,et al.Transcriptional regulation of hepatic lipogenesis[J].Nat Rev Mol Cell Biol,2015,16(11):678-689.
[13] GUO L,ZHANG P,CHEN Z M,et al.Hepatic neuregulin 4 signaling defines an endocrine checkpoint for steatosis-to-NASH progression[J].J Clin Invest,2017,127(12):4449-4461.
[14] HARIRI N,THIBAULT L.High-fat diet-induced obesity in animal models[J].Nutr Res Rev,2010,23(2):270-299.
[15] FRIKKE-SCHMIDT H,ZAMARRON B F,O’ROU-RKE R W,et al.Weight loss independent changes in adipose tissue macrophage and T cell populations after sleeve gastrectomy in mice[J].Mol Metab,2017,6(4):317-326.
[16] KIM H Y,PARK S Y,LEE M H,et al.Hepatic STAMP2 alleviates high fat diet-induced hepatic steatosis and insulin resistance[J].J Hepatol,2015,63(2):477-485.
[17] 杨丹,孙波,崔振宇,等.磷脂酶D1促进非酒精性脂肪肝体外模型的脂肪生成[J].同济大学学报(医学版),2020,41(6):709-716.
[18] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.非酒精性脂肪性肝病防治指南(2018更新版)[J].实用肝脏病杂志,2018,21(2):30-39.
[19] KESSOKU T,IMAJO K,KOBAYASHI T,et al.Lubiprostone in patients with non-alcoholic fatty liver disease:a randomised,double-blind,placebo-controlled,phase 2a trial[J].Lancet Gastroenterol Hepatol,2020,5(11):996-1007.
[20] LOOMBA R,MORGAN E,WATTS L,et al.Novel antisense inhibition of diacylglycerol O-acyltransferase 2 for treatment of non-alcoholic fatty liver disease:a multicentre,double-blind,randomised,placebo-controlled phase 2 trial[J].Lancet Gastroenterol Hepatol,2020,5(9):829-838.
[21] YOUNOSSI Z M,RATZIU V,LOOMBA R,et al.Obeticholic acid for the treatment of non-alcoholic steatohepatitis:interim analysis from a multicentre,randomised,placebo-controlled phase 3 trial[J].Lancet,2019,394(10215):2184-2196.
[22] SMITH G I,SHANKARAN M,YOSHINO M,et al.Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease[J].J Clin Invest,2020,130(3):1453-1460.
[23] EUROPEAN ASSOCIATION FOR THE STUDY OF THE LIVER(E A S L),EUROPEAN ASSOCIATION FOR THE STUDY OF DIABETES(E A S D),EUROPEAN ASSOCIATION FOR THE STUDY OF OBESITY(E A S O).EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease[J].J Hepatol,2016,64(6):1388-1402.
[24] NGUYEN N T,VARELA J E.Bariatric surgery for obesity and metabolic disorders:state of the art[J].Nat Rev Gastroenterol Hepatol,2017,14(3):160-169.
[25] SAEIDI N,MEOLI L,NESTORIDI E,et al.Reprogramming of intestinal glucose metabolism and glycemic control in rats after gastric bypass[J].Science,2013,341(6144):406-410.
[26] MUMMADI R R,KASTURI K S,CHENNAREDDYGARI S,et al.Effect of bariatric surgery on nonalcoholic fatty liver disease:systematic review and meta-analysis[J].Clin Gastroenterol Hepatol,2008,6(12):1396-1402.
[27] LEE Y,DOUMOURAS A G,YU J,et al.Complete resolution of nonalcoholic fatty liver disease after bariatric surgery:asystematic review and meta-analysis[J].Clin Gastroenterol Hepatol,2019,17(6):1040-1060.
[28] LI M Y,LIU Z Y,QIAN B G,et al.“Dysfunctions”induced by Roux-en-Y gastric bypass surgery are concomitant with metabolic improvement independent of weight loss[J].Cell Discov,2020,6:4.
[29] BEN-ZVI D,MEOLI L,ABIDI W M,et al.Time-dependent molecular responses differ between gastric bypass and dieting but are conserved across species[J].Cell Metab,2018,28(2):310-323.
[30] LIU R,HONG J,XU X,et al.Gut microbiome and serum metabolome alterations in obesity and after weight-loss intervention[J].Nat Med,2017,23(7):859-868.
[31] BAUD G,DAOUDI M,HUBERT T,et al.Bile diversion in roux-en-Ygastric bypass modulates sodium-dependent glucose intestinal uptake[J].Cell Metab,2016,23(3):547-553.
[32] SINCLAIR P,BRENNAN D J,LE ROUX C W.Gut adaptation after metabolic surgery and its influences on the brain,liver and cancer[J].Nat Rev Gastroenterol Hepatol,2018,15(10):606-624.
[33] SANCHEZ-GURMACHES J,TANG Y F,JESPERSEN N Z,et al.Brown fat AKT2 is a cold-induced kinase that stimulates ChREBP-mediated de novo lipogenesis to optimize fuel storage and thermogenesis[J].Cell Metab,2018,27(1):195-209.e6.
[34] JIA H Y,LI Q Z,LV L F.HDAC5 inhibits hepatic lipogenic genes expression by attenuating the transcriptional activity of liver X receptor[J].Cell Physiol Biochem,2016,39(4):1561-1567.
[35] FILHOULAUD G,GUILMEAU S,DENTIN R,et al.Novel insights into ChREBP regulation and function[J].Trends Endocrinol Metab,2013,24(5):257-268.
[36] LIZUKA K,BRUICK R K,LIANG G S,et al.Deficiency of carbohydrate response element-binding protein(ChREBP) reduces lipogenesis as well as glycolysis[J].Proc Natl Acad Sci USA,2004,101(19):7281-7286.
[37] BENHAMED F,DENECHAUD P D,LEMOINE M,et al.The lipogenic transcription factor ChREBP dissociates hepatic steatosis from insulin resistance in mice and humans[J].J Clin Invest,2012,122(6):2176-2194.
[38] LAFERR RE B,REILLY D,ARIAS S,et al.Differential metabolic impact of gastric bypass surgery versus dietary intervention in obese diabetic subjects despite identical weight loss[J].Sci Transl Med,2011,3(80):80re2.
RE B,REILLY D,ARIAS S,et al.Differential metabolic impact of gastric bypass surgery versus dietary intervention in obese diabetic subjects despite identical weight loss[J].Sci Transl Med,2011,3(80):80re2.
[39] ZHANG S,GUO F L,YU M,et al.Reduced Nogo expression inhibits diet-induced metabolic disorders by regulating ChREBP and insulin activity[J].J Hepatol,2020,73(6):1482-1495.
[40] DUNTAS L H,BRENTA G.A renewed focus on the association between thyroid hormones and lipid metabolism[J].Front Endocrinol(Lausanne),2018,9:511.