乳腺癌是女性最常见的恶性肿瘤。2020年美国癌症学会公布的数据显示乳腺癌占女性新发肿瘤数的30%,高居第一位[1]。据报道,大约20%~40%的新诊断乳腺癌患者将经历明显的临床抑郁和心理困扰[2-4]。乳房切除术造成的乳房缺损经常给患者的生理和心理带来严重的创伤。乳房重建的实施则有助于帮助患者重塑身体外形,提高患者生存质量,缓解部分临床焦虑。乳房重建的方法主要包括假体植入和自体脂肪移植[5-7],但假体植入引起的并发症较多,诸如感染、血肿、积液、包膜挛缩、皮瓣坏死等[8-9];自体脂肪移植后脂肪细胞易液化、钙化和凋亡,效果不够稳定,且脂肪钙化会对术后定期影像学复查造成一定的误导[10-11]。
干细胞是具有多向分化能力的未分化细胞[12],其中脂肪干细胞因其来源充足、获取简便、产量高且增殖速度快等优点成为组织工程和再生医学主要的细胞来源[13-14]。脂肪干细胞已被广泛应用于乳房重建,在假体植入和自体脂肪移植中都是有益的[15]。Zuk等[16]首次从人脂肪组织中成功提取脂肪源干细胞(human adipose-derived stem cells,hADSCs)。后续的研究发现,hADSCs的成脂分化过程受一些调控因子和信号转导通路的调控,如C/EBPβ、PPARγ、Wnt/β-catenin和PI3K/Akt等[17-19]。近年的研究发现,高度保守的TRIB蛋白家族对脂肪的形成具有影响作用[20-21]。TRIB蛋白家族由3种相关的丝氨酸/苏氨酸激酶样蛋白TRIB1、TRIB2和TRIB3组成,其中TRIB2可以通过抑制Akt的活性,降解C/EBPβ,达到抑制脂肪生成的作用[22]。Andersen等[23]发现,在纳米支架表面涂覆小干扰RNA(siRNA)沉默间充质干细胞的TRIB2基因能够有效促进干细胞的成脂分化。然而,利用非病毒载体递送siRNA促进ADSC向脂肪分化的研究鲜有报道。本研究使用前期发现的生物可降解聚氨酯CPU作为非病毒基因递送载体[24],研究其介导TRIB2-siRNA进入hADSCs的转染活动,检测TRIB2基因的沉默效率及对干细胞成脂分化过程的影响,为TRIB2基因在促进脂肪分化的领域提供理论依据。
1 材料与方法
1.1 细胞株、主要试剂和仪器
人源脂肪干细胞ADSC购自美国ATCC公司;DMEM/F12培养基、胎牛血清(FBS)和青霉素-链霉素溶液(P/S)购自美国Gibco公司;Lipofecta-mineTM2000、Lyso-Tracker Green购自美国Invitrogen公司;DEPC水,TRIzol购自美国Ambion公司;氯仿、异丙醇、1,4-双(3-氨基丙基)哌嗪(BAP)、PrimeScriptTM RT Master Mix reagent Kit、TB GreenTM Premix Ex TaqTM(TliR-NaseH Plus) Reagent Kit购自日本TaKaRa公司;Hoechst33342购自江苏凯基生物技术股份有限公司;倒置荧光显微镜及照相系统购自日本Olympus公司;酶标仪购自美国Thermo Fisher Scientific公司;Viscoteck GPCmax型凝胶渗透色谱仪和纳米粒度及电位分析仪购自英国Malvern公司;激光共聚焦显微镜购自德国Leica公司;siRNA购自吉玛基因公司,TRIB2-siRNA序列:5′-GGACGAAGAGAGGACUCGGdTdT-3′,阴性对照NC-siRNA序列:5′-CCCUAUUCUCCUUCUUCGC-dTdT-3′。
1.2 阳离子聚氨酯材料CPU的合成及化学表征
根据文献[24]合成生物可降解的阳离子型CPU,即通过2,2′-二硫代二乙醇双对硝基苯基碳酸酯与1,4-双(3-氨基丙基)哌嗪缩聚反应,制备出CPU。通过凝胶渗透色谱仪测得CPU的数均分子量(Mn)为316 000,重均分子量(Mw)为50 000,分子量分散指数(Mw/Mn)为1.58。
使用Viscoteck GPC max型凝胶渗透色谱仪测试CPU的分子量及分散度。将CPU与siRNA按N/P为20∶1吹打混匀,室温25 ℃条件下孵育30 min 后,使用纳米粒度及电位分析仪测量复合物的粒径、分散度及表面电荷。
1.3 细胞培养
人源脂肪干细胞ADSC培养在含有10%胎牛血清、1%青霉素-链霉素以及10 ng/mL成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的DMEM/F12培养基中,于37 ℃、5%CO2恒温培养箱中培养,每2~3 d更换培养基。
1.4 实验分组及瞬时转染方法
将人工合成的TRIB2-siRNA和NC-siRNA溶于DEPC水中制成20 μmol/L贮存液,实验时用DEPC水稀释成所需浓度。实验分为:Blank组(未处理的细胞做空白对照),Lipo2000组(LipofectamineTM2000作为基因转染载体),CPU组(CPU作为基因转染载体),NC组(使用CPU转染NC-siRNA)。
细胞转染(以24孔板为例):将对数生长期的细胞以2×104个/孔的密度接种到24孔板中,接种24 h后观察细胞,待细胞融合至40%~50%进行瞬时转染。LipofectamineTM2000/siRNA比例为4/1,CPU/siRNA的N/P比为20∶1,每孔转染siRNA质量为0.5 μg。转染时将CPU与siRNA按质量比混匀后,轻柔地吹打5次后,室温下静置30 min。用无血清培养基转染细胞,1 h后更换成全培养基(含血清)完成转染过程。
1.5 成脂诱导方法
将细胞按1.4方法转染后,待细胞长至基本融合,换为成脂诱导分化培养基(A液:1 μmol/L地塞米松,10 μg/mL胰岛素,200 μmol/L吲哚美辛和0.5 mmol/L IBMX,含10%胎牛血清、1%双抗的基础培养基;B液:10 μg/mL胰岛素,10%胎牛血清,1%双抗的基础培养基)。小心吸走完全培养基后每孔加入0.5 mL诱导分化培养基A液,诱导3 d 后,更换B液;24 h后吸走B液,换回A液进行诱导。A液B液交替作用,根据实验需求分别诱导2、7、14和28 d。
1.6 Alamar Blue法检测CPU对细胞增殖的影响
将对数生长期细胞按每孔2×104细胞密度均匀的加入到24孔板中,加入TRIB2-siRNA/CPU复合物后将置于37 ℃培养箱中,培养24 h后用Alamar Blue检测细胞活力,每组3个平行复孔。细胞存活率的计算方法如下。
细胞存活率(%)=(Asample-A)/(Acontrol-A0)×100
Asample代表实验组吸光度值;A0代表1×Alamar Blue工作液吸光度值;Acontrol代表空白组吸光度值。
1.7 激光共聚焦显微镜下观察细胞摄取情况
将处于对数生长期的ADSC细胞5×104/皿接种于20 mm激光共聚焦专用皿上,置于恒温培养箱培养24 h,待细胞融合度至40%~50%时进行瞬时转染,将带有CY5标记的TRIB2-siRNA与CPU混合后无血清条件下转染2、4和8 h,后续分别用Hoechst33342和Lyso Tracker Green对细胞核和溶酶体进行染色,然后通过激光共聚焦显微镜观察ADSC细胞内荧光表达情况。细胞内红色荧光表示CY5-TRIB2-siRNA,蓝色荧光表示细胞核,绿色荧光代表溶酶体。
1.8 qPCR检测转染细胞后TRIB2 mRNA的表达
将处于对数生长期的ADSC细胞以2×104/孔的密度接种于24孔板中,实验分为空白对照组、Lipo2000组、CPU组、NC组。接种24 h后转染TRIB2-siRNA,分别于2、7、14和28 d分别收集各组细胞,利用传统TRIzol法抽提RNA,然后通过反转录试剂盒Prime ScriptTM RT Master Mix Reagent Kit将RNA反转录为cDNA,以反转录产物cDNA为模板,采用TB GreenTM Premix Ex TaqTM(TliRNaseH Plus) Reagent Kit进行qPCR反应。TRIB2以及内参GAPDH的引物序列见表1。
表1 引物序列
Tab.1 Primer sequence

基因名称正向引物反向引物GAPDH5′-GAAGGTGAAGGTC-GGAGTC-3′5′-GAAGATGGT-GATG-GGATTTC-3′TRIB25′-CATACACAGGTCT-ACCCCC-3′5′-TCCGCGGACCT-TA-TAGAC-3′
1.9 油红O染色及定量分析结果
将ADSC细胞接种于24孔板中,待细胞融合至40%~50%时转染TRIB2-siRNA(实验分组同1.8),之后成脂诱导并培养28 d。将各组细胞用4%多聚甲醛固定30 min,经PBS洗涤后每孔加入0.5 mL油红O工作液(油红O贮存液∶二次水=3∶ 2,混匀后用中性滤纸过滤即可)染色30 min,再次洗涤后置于倒置显微镜下观察成脂染色效果并拍照。使用异丙醇萃取脂滴中的油红O并测量518 nm处的吸光度(A518)值进行半定量分析。每个样本重复3次。
1.10 统计学处理
采用SPSS 23统计软件进行统计学处理。阳离子聚氨酯材料粒径及电位分析用![]() 表示,本研究中连续资料服从正态分布,因此两组间样本均数的比较采用t检验,多组间样本均数之间的差异比较采用单因素方差分析,P<0.05为差异具有统计学意义。
表示,本研究中连续资料服从正态分布,因此两组间样本均数的比较采用t检验,多组间样本均数之间的差异比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 阳离子型聚氨酯/siRNA复合物的表征
在Hepes缓冲溶液(pH=7.4)中,CPU/siRNA复合物在N/P为20∶1的条件下,粒径为(158.9±0.8) nm,粒径分散度较小(PDI=0.221),表面带有正电荷[(25.6±2.5) mV],见图1。
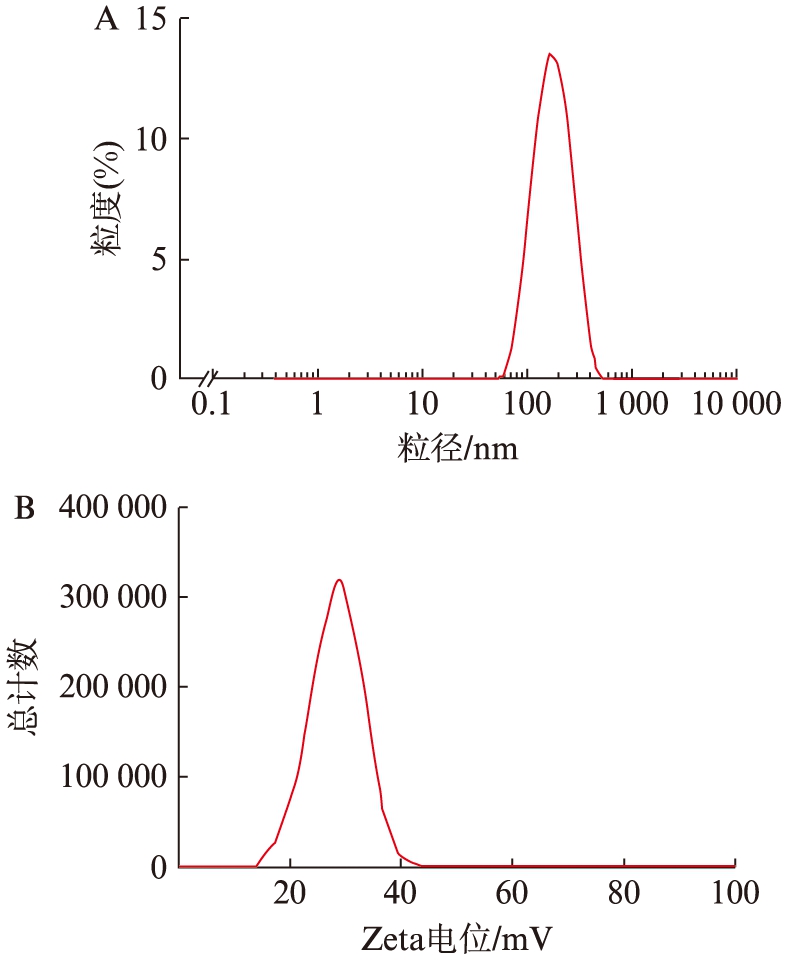
图1 CPU/siRNA复合物的粒径及表面Zeta电位
Fig.1 Particle size and zeta potential of CPU/siRNA complexes
A:CPU/siRNA复合物粒径;B:表面Zeta电位
2.2 CPU在ADSC中的转染效率和细胞毒性测定
qPCR法检测TRIB2-siRNA转染hADSCs的TRIB2 mRNA表达水平。CPU组TRIB2 mRNA的表达水平(0.291±0.038)较空白对照组显著下调,差异有统计学意义(P<0.000 1),并且低于Lipo2000组的TRIB2 mRNA的表达水平(0.515±0.056,P<0.000 1),见图2A。使用Alamar Blue检测细胞存活率表明,CPU组对hADSCs的细胞活性影响很小,细胞的存活率为(96.4±1.9)%,与空白组比较差异无统计学意义,见图2B。
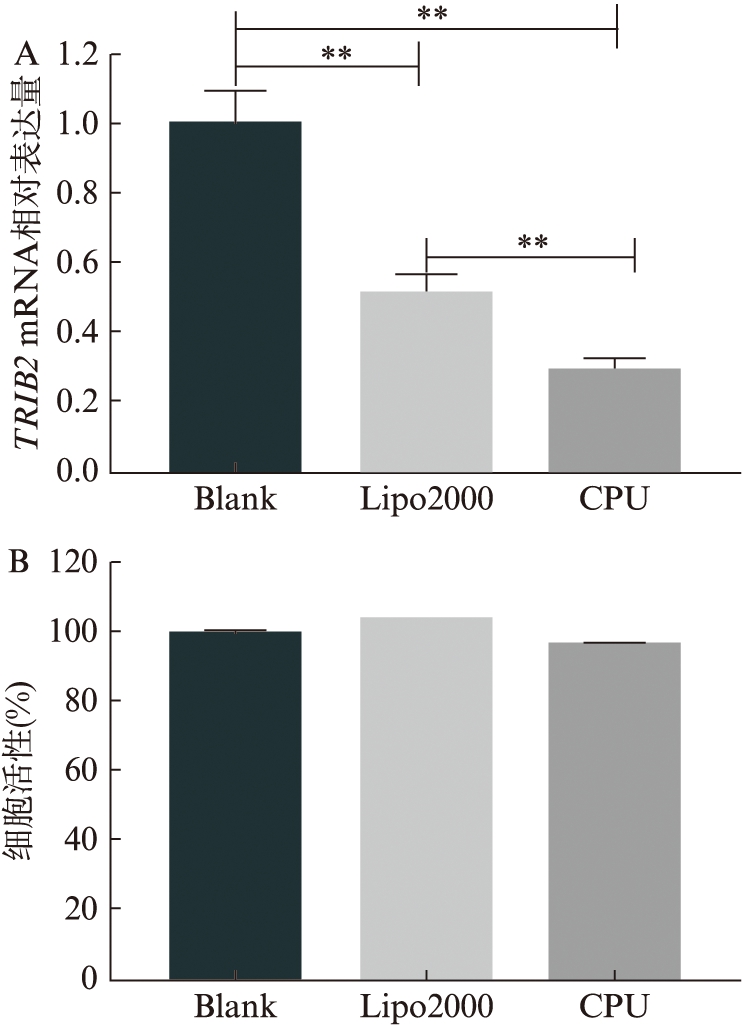
图2 TRIB2-siRNA转染hADSCs后TRIB2 mRNA的相对表达水平及细胞存活率
Fig.2 The relative expression of TRIB2 mRNA and cell survival rate of hADSCs after transfection with TRIB2-siRNA
A:TRIB2 mRNA相对表达水平;B:细胞存活率;多组之间的比较采用单因素方差分析,****P<0.000 1
2.3 siRNA在ADSCs中的摄取过程
使用CY5标记的siRNA转染hADSCs,并分别使用LysoTracker标记溶酶体,Hoechst33342标记细胞核,观察siRNA进入细胞的情况。转染2 h时,细胞体内的siRNA(红色)较少;当转染4 h时,部分siRNA位于酸性内含体/溶酶体(绿色)。但转染8 h时,红色与绿色重叠较少,说明siRNA逃逸至细胞胞质中,见图3。这说明CPU能够有效的介导siRNA进入细胞质中。
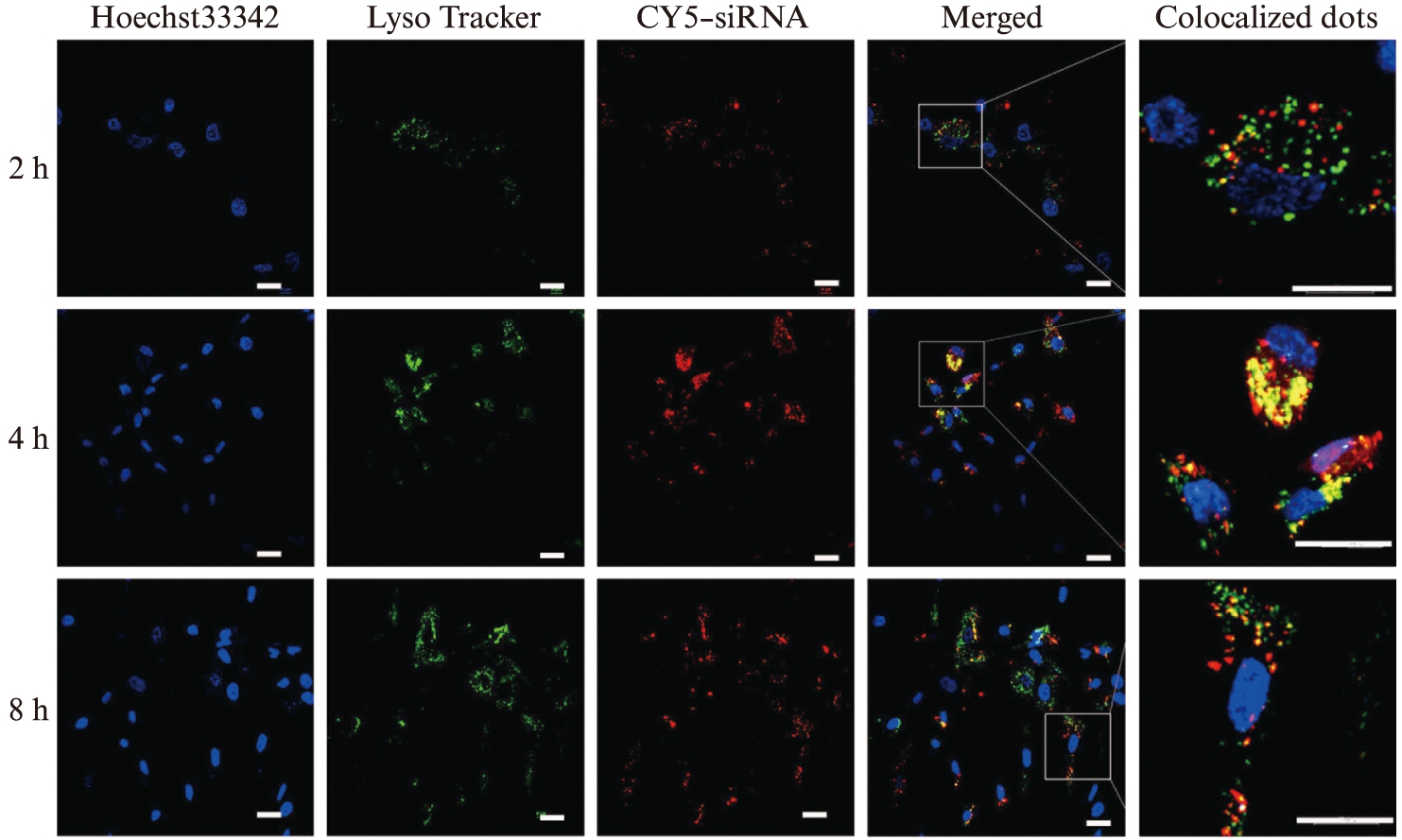
图3 激光共聚焦显微镜观察CPU/siRNA-CY5(红色)转染hADSCs后siRNA在hADSCs中的位置
Fig.3 Laser confocal microscope was used to observe the position of siRNA in hADSCs after CPU/siRNA-CY5(red)
LysoTracker和Hoechst33342染料分别标记溶酶体(绿色)和细胞核(蓝色);标尺大小为20 μm
2.4 体外培养2、7、14和28 d后ADSCs TRIB2 mRNA的表达水平
使用LipofectamineTM2000和CPU分别介导TRIB2-siRNA体外转染hADSCs后,体外成脂诱导分别培养2、7、14和28 d,通过qPCR检测细胞内TRIB2 mRNA的表达,见图4。转染2 d后,Lipo-2000组与CPU组两组之间TRIB2 mRNA的表达水平具有统计学意义(P<0.000 1)。随着时间的延长,细胞体内TRIB2 mRNA的表达水平逐渐回升,Lipo2000组和CPU组转染2、28 d的TRIB2 mRNA的表达水平差异有统计学意义(P<0.001)。
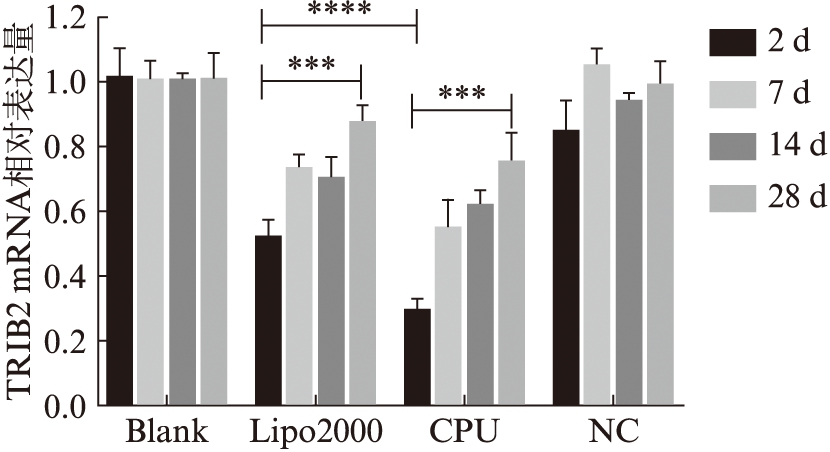
图4 qPCR分析TRIB2-siRNA转染hADSCs且成脂诱导后细胞TRIB2 mRNA的表达水平
Fig.4 The relative expression of TRIB2 mRNA of hADSCs after transfected with TRIB2-siRNA and differentiation was induced with adipogenic medium by qPCR
多组之间的差异比较采用单因素方差分析;***P<0.001,****P<0.000 1
2.5 成脂诱导28 d后ADSC细胞分化为脂肪细胞分析
使用CPU/TRIB2-siRNA转染hADSCs且成脂诱导28 d后,对细胞进行油红O染色,光学显微镜下观察脂滴形成情况。TRIB2组的脂滴数量明显较未处理的细胞(Blank组)多,且脂滴颜色较深,见图5A。用异丙醇将溶解在脂滴中的油红O萃取,测量510 nm处的吸光度值(A510),TRIB2组的吸光度值高于Blank组,见图5B。用两独立样本t检验进行统计学分析,TRIB2组和Blank组的吸光度值的差异具有统计学意义(P<0.001)。
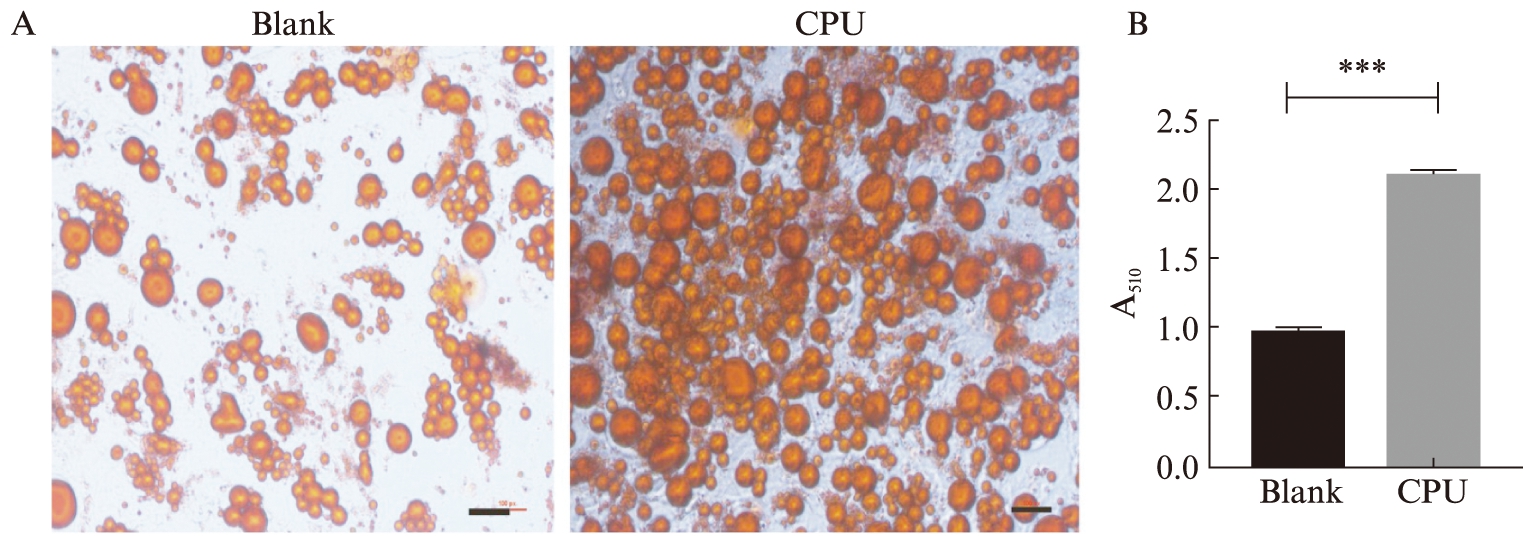
图5 CPU/TRIB2-siRNA转染hADSCs且成脂诱导分化28 d的光学显微镜照片
Fig.5 Optical micrograph of hADSCs stained with oil red O after transfected with TRIB2-siRNA and induced with adipogenic medium for 28 days
A:倒置显微镜下观察染色照片,标尺大小为100 μm;B:对油红O染色进行半定量分析;**P<0.001
3 讨 论
成体干细胞具有多向分化的潜能,是再生医学研究领域中重要的种子细胞源[25]。脂肪干细胞成脂肪分化是一个多因素、多因子调节的复杂过程[12]。TRIB蛋白家族由3种相关的丝氨酸/苏氨酸激酶样蛋白TRIB1、TRIB2及TRIB3组成,其在脂肪调控的过程中发挥作用[20-21]。Bezy等[26]发现TRIB3在3T3-L1细胞过表达抑制C/EBPβ的磷酸化和PPARγ的诱导,进而阻止3T3-L1的分化。TRIB2作为TRIB3的同源性基因,在脂肪形成过程中也发挥着类似的调节作用。Naiki等[22]的研究表明,TRIB2通过蛋白酶体依赖性机制与C/EBPβ同工型LAP结合抑制Akt活化与C/EBPβ的降解,从而抑制脂肪生成。
成功的递送siRNA进入脂肪干细胞依赖安全、有效的递送载体。目前常用的递送载体主要分为病毒载体和非病毒载体。病毒载体主要包括慢病毒和腺相关病毒,它具有转染效率高的特点,但存在较高的免疫原性和潜在的致癌性,而且制备复杂、技术门槛较高,限制了其在临床上的广泛应用。比较而言,非病毒载体毒副作用小、结构容易调控、易于制备,具有广阔的应用前景[27]。阳离子多聚物是一种非病毒载体[28]。Andersen等[23]利用可降解聚酯纳的纳米支架递送TRIB2-siRNA够促进脂肪干细胞向脂肪的分化。本研究采用课题组制备的含有二硫键的CPU作为载体,转运TRIB2-siRNA进入脂肪干细胞。本课题组前期研究证实,CPU具有生物可降解性、生物相容性和低毒性等特点[29],可作为DNA的递送载体。带正电荷的CPU能够通过静电作用将带负电的siRNA包裹、压缩以及最终形成带正电的纳米复合物。细胞膜特有的双分子层结构表面呈负电性。因此,该复合物所带的正电荷有助于复合物的细胞内吞。使用激光共聚焦显微镜观察到CPU能有效介导CY5标记的TRIB2-siRNA进入干细胞。本研究的数据表明,CPU组TRIB2 mRNA的表达量明显下降且细胞增殖率在95%以上,这说明CPU能高效的递送siRNA,且具有较低的细胞毒性。
综上,通过聚氨酯转运TRIB2-siRNA能有效转染脂肪干细胞并促进干细胞的成脂分化。在未来的乳房重建术中,利用CPU/TRIB2-siRNA转染脂肪干细胞为乳房重建提供了一种新的方案。
[1] SIEGEL R L,MILLER K D,JEMAL A.Cancer statistics,2020[J].CA Cancer J Clin,2020,70(1):7-30.
[2] DRINANE J J,PHAM T H,SCHALET G,et al.Depression is associated with worse outcomes among women undergoing breast reconstruction following mastectomy[J].J Plast Reconstr Aesthet Surg,2019,72(8):1292-1298.
[3] KADAN-LOTTICK N S,VANDERWERKER L C,BLOCK S D,et al.Psychiatric disorders and mental health service use in patients with advanced cancer:a report from the coping with cancer study[J].Cancer,2005,104(12):2872-2881.
[4] VALDERRAMA RIOS M C,S NCHEZ PEDRAZA R.Anxiety and depression disorders in relation to the quality of life of breast cancer patients with locally advanced or disseminated stage[J].Rev Colomb Psiquiatr(Engl Ed),2018,47(4):211-220.
NCHEZ PEDRAZA R.Anxiety and depression disorders in relation to the quality of life of breast cancer patients with locally advanced or disseminated stage[J].Rev Colomb Psiquiatr(Engl Ed),2018,47(4):211-220.
[5] DAVILA A A,MIOTON L M,CHOW G,et al.Immediate two-stage tissue expander breast reconstruction compared with one-stage permanent implant breast reconstruction:a multi-institutional comparison of short-term complications[J].J Plast Surg Hand Surg,2013,47(5):344-349.
[6] MIOTON L M,SMETONA J T,HANWRIGHT P J,et al.Comparing thirty-day outcomes in prosthetic and autologous breast reconstruction:a multivariate analysis of 13 082 patients?[J].J Plast Reconstr Aesthet Surg,2013,66(7):917-925.
[7] O’HALLORAN N,KHAN S,GILLIGAN K,et al.Oncological risk in autologous stem cell donation for novel tissue-engineering approaches to postmastectomy breast regeneration[J].Breast Cancer(Auckl),2019,13:1178223419864896.
[8] AVRAHAM T,WEICHMAN K E,WILSON S,et al.Postoperative expansion is not a primary cause of infection in immediate breast reconstruction with tissue expanders[J].Breast J,2015,21(5):501-507.
[9] NILSEN T J,DASGUPTA A,HUANG Y C,et al.Do processing methods make a difference in acellular dermal matrix properties?[J].Aesthet Surg J,2016,36(suppl 2):S7-S22.
[10] AGHA R A,FOWLER A J,HERLIN C,et al.Use of autologous fat grafting for breast reconstruction:a systematic review with meta-analysis of oncological outcomes[J].J Plast Reconstr Aesthet Surg,2015,68(2):143-161.
[11] AGHA R A,BORRELLI M R,DOWLUT N,et al.Use of autologous fat grafting in reconstruction following mastectomy and breast conserving surgery:an updated systematic review protocol[J].Int J Surg Protoc,2017,5:22-26.
[12] BAHMAD H F,DAOUK R,AZAR J,et al.Modeling adipogenesis:current and future perspective[J].Cells,2020,9(10):2326.
[13] O’HALLORAN N,COURTNEY D,KERIN M J,et al.Adipose-derived stem cells in novel approaches to breast reconstruction:their suitability for tissue engineering and oncological safety[J].Breast Cancer(Auckl),2017,11:1-18.
[14] BACAKOVA L,ZARUBOVA J,TRAVNICKOVA M,et al.Stem cells:their source,potency and use in regenerative therapies with focus on adipose-derived stem cells-a review[J].Biotechnol Adv,2018,36(4):1111-1126.
[15] TECHANUKUL T,LOHSIRIWAT V.Stem cell and tissue engineering in breast reconstruction[J].Gland Surg,2014,3(1):55-61.
[16] ZUK P A,ZHU M,MIZUNO H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[17] ROSS S E,HEMATI N,LONGO K A,et al.Inhibition of adipogenesis by Wnt signaling[J].Science,2000,289(5481):950-953.
[18] WHITE U A,STEPHENS J M.Transcriptional factors that promote formation of white adipose tissue[J].Mol Cell Endocrinol,2010,318(1-2):10-14.
[19] ROSEN E D,WALKEY C J,PUIGSERVER P,et al.Transcriptional regulation of adipogenesis[J].Genes Dev,2000,14(11):1293-1307.
[20] OSTERTAG A,JONES A,ROSE A J,et al.Control of adipose tissue inflammation through TRB1[J].Diabetes,2010,59(8):1991-2000.
[21] BI X P,TAN H W,XING S S,et al.Overexpression of TRB3 gene in adipose tissue of rats with high fructose-induced metabolic syndrome[J].Endocr J,2008,55(4):747-752.
[22] NAIKI T,SAIJOU E,MIYAOKA Y,et al.TRB2,a mouse Tribbles ortholog,suppresses adipocyte differentiation by inhibiting AKT and C/EBP beta[J].J Biol Chem,2007,282(33):24075-24082.
[23] ANDERSEN M Ø,NYGAARD J V,BURNS J S,et al.siRNA nanoparticle functionalization of nanostructured scaffolds enables controlled multilineage differentiation of stem cells[J].Mol Ther,2010,18(11):2018-2027.
[24] CHENG J,TANG X,ZHAO J,et al.Multifunctional cationic polyurethanes designed for non-viral cancer gene therapy[J].Acta Biomater,2016,30:155-167.
[25] 吴雅廷,刘海亮.柚皮素对脂肪间充质干细胞增殖的影响[J].同济大学学报(医学版),2021,42(1):3-10.
[26] BEZY O,VERNOCHET C,GESTA S,et al.TRB3 blocks adipocyte differentiation through the inhibition of C/EBPbeta transcriptional activity[J].Mol Cell Biol,2007,27(19):6818-6831.
[27] PANDEY A P,SAWANT K K.Polyethylenimine:a versatile,multifunctional non-viral vector for nucleic acid delivery[J].Mater Sci Eng C Mater Biol Appl,2016,68:904-918.
[28] WANG L P,ZHANG W H,ZHOU Q,et al.Establishing gene delivery systems based on small-sized chitosan nanoparticles[J].J Ocean Univ China,2018,17(5):1253-1260.
[29] PENG Q,HU C,CHENG J,et al.Influence of disulfide density and molecular weight on disulfide cross-linked polyethylenimine as gene vectors[J].Bioconjug Chem,2009,20(2):340-346.