哺乳动物免疫系统遭受蠕虫类寄生虫如日本血吸虫感染或经过敏原刺激后,其初始辅助Th细胞被激活并向Th2细胞分化。Th2细胞分泌的IL-4促进B细胞产生IgE,可使肥大细胞和嗜碱性粒细胞产生脱颗粒反应;分泌的IL-5可激活嗜酸性粒细胞;分泌的IL-13可刺激黏膜上皮细胞增生及分泌黏液增多。这些反应构成Th2型免疫应答,利于机体将寄生虫或过敏原排出体外,但也可能导致过敏性疾病及器官纤维化[1-3]。遍布全身的经典抗原提呈细胞—树突状细胞(dendritic cell,DC)在激活和极化Th2中起决定性作用[4-5]。此外,嗜碱性粒细胞通过持续大量产生IL-4也起着重要辅助作用[6-7]。嗜碱性粒细胞由骨髓干细胞在IL-3或胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)的作用下分化而成,但此过程是否受到IL-4调节尚不清楚。本研究通过比较IL-4缺陷小鼠和野生型小鼠骨髓细胞受IL-3诱导分化为嗜碱性粒细胞的情况,探究IL-4对嗜碱性粒细胞分化及维持的作用。
1 材料与方法
1.1 实验动物
野生型BALB/c小鼠,雌性,6~8周龄,由上海斯莱克实验动物有限责任公司和上海西普尔-必凯实验动物有限公司提供;IL-4基因缺陷小鼠(IL-4 knock out,IL-4 KO)(存储号:002496)购自美国杰克逊实验室。小鼠在同济大学实验动物中心SPF级动物房饲养。所有动物实验操作均经过同济大学动物实验伦理委员会批准。
1.2 试剂与仪器
细胞培养用胎牛血清、RPMI-1640液体培养基、青霉素/链霉素(P/S)购自美国Gibco公司;PBS购自维森特生物技术(南京)有限公司;重组小鼠细胞因子IL-3、IL-4购自美国Peprotech公司;Anti-IL-4(11B11)购自美国Biolegend公司。
流式细胞染色抗体及试剂:APC标记的抗小鼠FcεRIα(MAR-1)、PE以及FITC标记的抗小鼠ckit(2B8)、PE-cy7标记的抗小鼠CD49b(DX5)、BV421标记的抗小鼠CD11c(N418)、PE标记的抗小鼠Ki67(16A8)。以上抗体及相应的同型对照抗体均购自美国Biolegend公司。Permeabilization Buffer(10×)、Fixation/Permeabilization Diluent、Fixation/Permeab-ilization Concentrate均购自美国eBioscience公司。ELISA试剂:Purified抗小鼠IL-4(554434)与Biotin标记抗小鼠IL-4(554390)均购自美国BD公司;细胞因子IL-4标准品购自美国Peprotech公司;Avidin-HRP购自美国BioLegend公司;显色液TMB购自碧云天生物技术有限公司;包被液:将1.59 g碳酸钠及2.93 g碳酸氢钠溶于1 000 mL 水中,并将pH值调至9.6;洗涤液PBST:含有0.05% Tween-20的PBS;封闭液:含5%BSA的PBS溶液;终止液:1 mol/L硫酸溶液。
1.3 方法
1.3.1 骨髓来源的嗜碱性粒细胞培养 6~8周野生型或IL-4缺陷型雌性小鼠经异氟烷麻醉后脱颈处死,无菌环境下取出股骨及胫骨。冲洗出骨髓腔中骨髓细胞并重悬于RPMI-1640中,离心半径16.1 cm,1 500 r/min,离心5 min,弃上清液,细胞沉淀分散后重悬于2 mL红细胞裂解液中1 min,加入RPMI-1640培养基终止裂解。离心半径16.1 cm,1 500 r/min,离心5 min ,弃上清液,加入含10%FBS的RPMI-1640完全培养基重悬细胞并调整密度至1×106/mL。接种于24孔细胞培养板中,每孔1 mL,并加入终浓度为25 ng/mL的细胞因子IL-3;每隔3 d进行1次换液。培养过程中,于第3、6、9、12天进行流式细胞术检测。
1.3.2 细胞分选及其培养 经1.3培养的骨髓细胞,在所示天数收集细胞,离心半径16.1 cm,1 500 r/min ,离心5 min,RPMI-1640洗涤后,加入封闭血清和APC标记抗小鼠FcεRIα、PE标记抗小鼠ckit、PE-cy7标记抗小鼠CD49b。4 ℃避光孵育30 min。RPMI-1640重悬后离心,再重悬于RPMI-1640中,使用BD FCASAria Ⅲ细胞分选仪器分选FcεRIα+ckit-CD49b-单阳细胞群。分选后,调整细胞密度为1×106/mL,接种至24孔板中,分别在加入IL-3(30 ng/mL)后的第1、2、3天进行流式细胞术检测。
1.3.3 流式细胞染色 膜分子染色:将IL-3刺激培养后的细胞经计数后转移至流式管中,4 ℃,离心半径16.1 cm,1 500 r/min,离心5 min。弃上清液,加入0.8 mL预冷的FACS Buffer(含10%FBS和0.1%NaN3的PBS),混匀。再次离心后加入与抗体同体积的小鼠血清进行封闭,加入相应体积的APC标记的抗小鼠FcεRIα,PE或FITC标记的抗小鼠ckit,BV421标记的抗小鼠CD11c,PE-cy7标记的抗小鼠CD49b,4 ℃避光孵育30 min。加入0.8 mL FACS Buffer重悬后离心,细胞沉淀重悬于200 μL Fix Buffer(含1%多聚甲醛的FACS Buffer)重悬细胞,经200目尼龙筛网过滤后,BD FACS Verse仪器上检测,使用FlowJo 7.6软件进行分析。
胞内分子染色:膜分子染色完毕后,细胞重悬于200 μL Fixation/Permeabilization,4 ℃避光孵育45 min。离心,加入200 μL 1× Permeabilization Buffer工作液,重悬后离心。重复上一步操作后,加入1× Permeabilization Buffer工作液使总体积达100 μL。加入2 μL小鼠血清,室温避光孵育15 min。加入1 μL PE标记的抗小鼠Ki67抗体,室温避光孵育30 min。加入200 μL 1× Permeabilization Buffer工作液,混悬,离心弃上清液。重复上一步操作,加入200 μL Fix Buffer重悬细胞,经200目尼龙筛网过滤后,BD FACS Verse仪器上检测,使用FlowJo 7.6软件进行分析。
1.3.4 日本血吸虫感染模型的建立 选用6~8周雌性BALB/c 15只、雌性IL-4 KO小鼠15只,腹部皮肤脱毛,暴露于30条日本血吸虫尾蚴20 min。其中,日本血吸虫虫株为安徽贵池株,尾蚴由中国疾病预防控制中心寄生虫预防控制所提供。
感染后小鼠饲养于清洁级鼠房,待感染7周后各随机选取5只处死,流式细胞染色法检测骨髓中嗜碱性粒细胞(FcεRIα+ckit-CD49b+)。
1.3.5 IL-4细胞因子检测 使用ELISA包被液稀释Purified抗小鼠IL-4,100 μL每孔包被96孔酶标板,4 ℃过夜。PBST洗涤5次后,每孔加入200 μL含5%BSA封闭液,37 ℃放置1 h。PBST洗涤5次,使用1%BSA稀释IL-4标准品以及野生型小鼠骨髓细胞上清液后,每孔100 μL,设2个副孔,37 ℃放置2 h。PBST洗涤5次,加入Biotin标记抗小鼠IL-4,100 μL每孔,37 ℃放置1 h。PBST洗涤5次,加入100 μL的avidin-HRP,37 ℃放置30 min。PBST洗涤5次,加入100 μL TMB显色液,室温避光孵育15 min 后,加入50 μL 终止液终止显色。酶标仪测450 nm波长下的吸光度值(A450),根据曲线计算上清液的IL-4浓度。
1.4 统计学处理
所有获得数据每组实验包含至少3只小鼠。所有的计量资料性结果用![]() 表示。采用GraphPad Prism 8.2软件进行统计分析,组间差别的统计学意义采用非配对t检验分析,P<0.05为差异有统计学意义。
表示。采用GraphPad Prism 8.2软件进行统计分析,组间差别的统计学意义采用非配对t检验分析,P<0.05为差异有统计学意义。
2 结 果
2.1 IL-4缺陷小鼠骨髓细胞经IL-3诱导产生更多嗜碱性粒细胞
IL-3是诱导骨髓细胞分化为嗜碱性粒细胞的最主要细胞因子[8]。骨髓细胞在IL-3作用下,诱导出FcεRIα+ckit-CD49b+嗜碱性粒细胞和FcεRIα+ckit+CD49b-的肥大细胞,见图1A,其中FcεRIα是IgEFc段的高亲和力受体,该受体被交联后使嗜碱性粒细胞和肥大细胞激活而发生脱颗粒反应[9]。IL-3也可以诱导CD11c阳性的树突状细胞[10]。经IL-3培养的骨髓细胞,3~4 d后开始有嗜碱性粒细胞出现,至第9天达到高峰,以后开始下降。与野生型相比,IL-4缺陷型骨髓诱导出的嗜碱性粒细胞,无论是在细胞比例或数目上,还是细胞表达FcεRIα的平均荧光强度都有增加,尤以第4、12天显著,见图 1B~D。此外,与野生型相比,IL-4缺陷型骨髓细胞被IL-3诱导出的CD11c阳性的树突状细胞群的比例却显著降低,与FcεRIα阳性细胞的增加呈反向关系,见图1E。
为进一步明确在体IL-4对嗜碱性粒细胞产生的影响,本研究于稳态下检测了野生型小鼠及IL-4缺陷小鼠外周血及骨髓中嗜碱性粒细胞分布,如图1F所示,未感染状态下二者嗜碱性粒细胞无论是在骨髓抑或是外周血(数据未显示)差异均无统计学意义。进而,本研究选择了广泛使用的研究Th2免疫应答模型:日本血吸虫感染模型。感染7周后,流式细胞术检测小鼠骨髓中细胞群分布,发现与野生型小鼠相比,IL-4缺陷鼠嗜碱性粒细胞细胞群比例显著提高,见图1F。
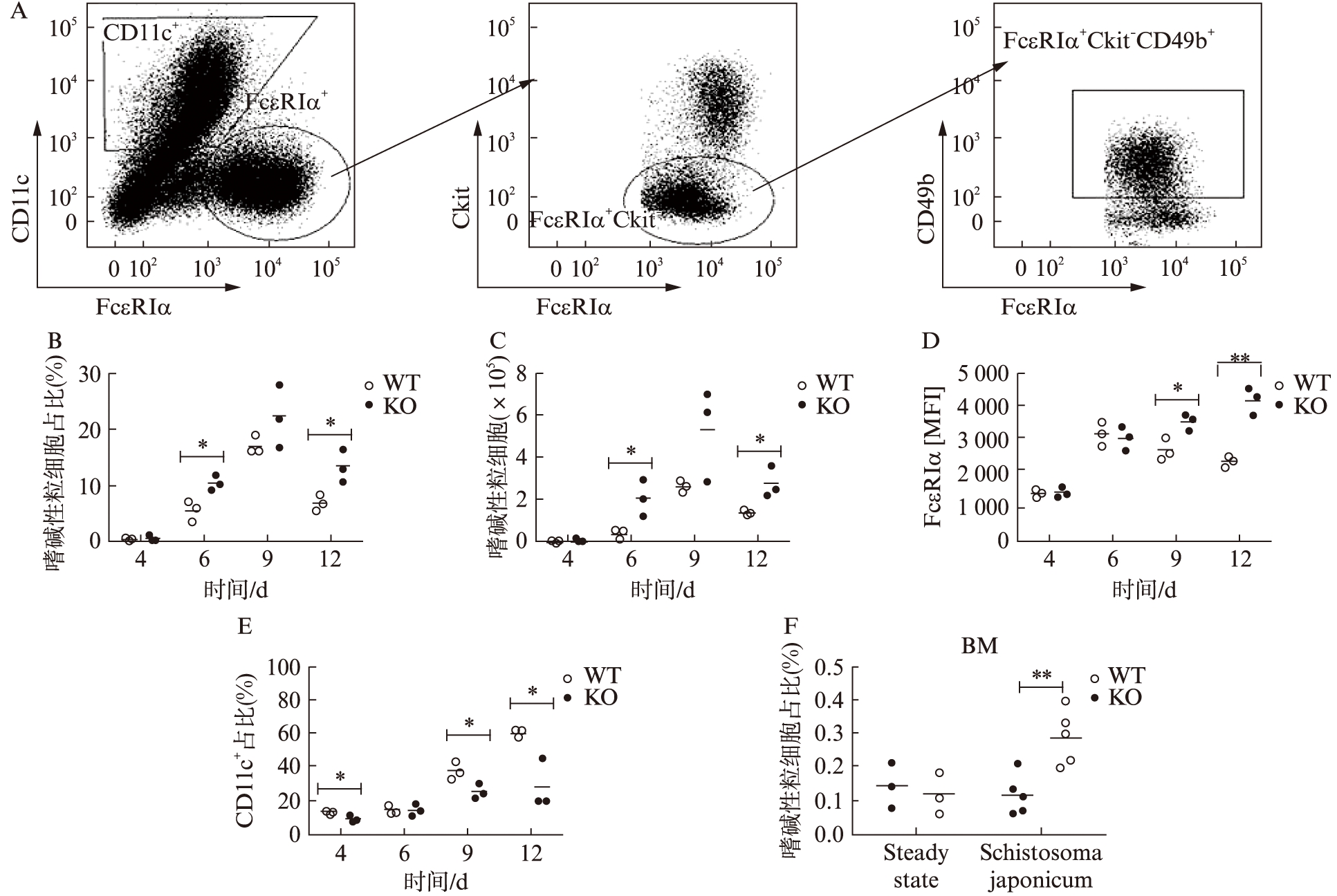
图1 IL-4敲除鼠骨髓细胞经IL-3诱导产生的嗜碱性粒细胞显著性增加
Fig.1 The production of basophils from BM of IL-4-/- mice was significantly increased with treatment of IL-3
A:代表性流式细胞术检测嗜碱性粒细胞设门过程(FcεRIα+ckit-CD49b+);B、C、D:3只鼠骨髓细胞刺激后不同时间点嗜碱性粒细胞比例、数目和FcεRIα的平均荧光强度;E:3只鼠骨髓细胞刺激后不同时间点CD11c阳性细胞比例;F:取未经感染的野生型及IL-4缺陷鼠(各3只)骨髓,破除红细胞后,流式细胞术检测稳态下骨髓中嗜碱性粒细胞比例;日本血吸虫尾蚴感染野生型及IL-4缺陷鼠(30条/只;各5只),感染7周后流式细胞术检测二者骨髓中嗜碱性细胞比例;非配对t检验分析,*P<0.05,**P<0.01;所有实验至少重复3次
2.2 IL-4具有下调IL-3诱导嗜碱性粒细胞产生的作用
与报道一致,经IL-3诱导分化出的嗜碱性粒细胞能够产生IL-4(数据未显示)。为明确IL-4缺陷鼠中表现出的嗜碱性粒细胞产生增加是否归因于IL-4,在IL-4缺陷型小鼠骨髓的IL-3诱导培养过程中加入重组IL-4。与对照组PBS相比,外源性IL-4使得IL-4缺陷型小鼠骨髓嗜碱性粒细胞生成和FcεRIα表达均被显著抑制,见图2A、B。在野生型小鼠骨髓IL-3诱导培养过程中,分别加入Anti-IL-4抗体并与同型抗体对照。加入Anti-IL-4使野生型小鼠骨髓诱导第9天后产生更多的嗜碱性粒细胞,且该细胞群的FcεRIα平均荧光强度也显著性增加,见图2C、D。本研究在野生型小鼠骨髓细胞培养体系上清液中检测出了细胞因子IL-4,且自始至终均存在于培养体系中,见图2E。因此,IL-3诱导骨髓细胞分化第9天即大量出现成熟嗜碱性粒细胞和肥大细胞时,有IL-4产生,且该IL-4具有控制嗜碱性粒细胞数量的作用。CD11c+细胞群形成与嗜碱性粒细胞群也呈反向关系。加入Anti-IL-4后,诱导产生的CD11c+细胞群比例显著性降低;然而加入外源性IL-4后,诱导产生的CD11c+细胞群比例显著性升高,见图2F、G。
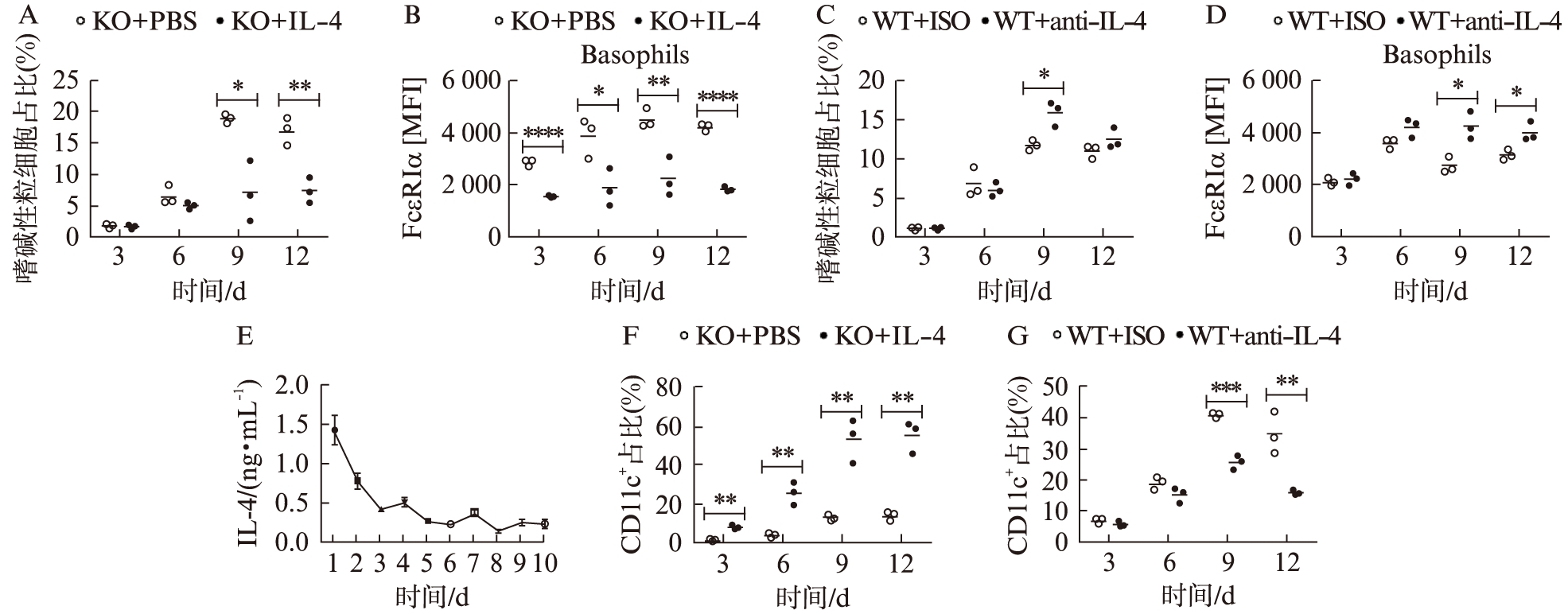
图2 IL-4下调IL-3诱导嗜碱性粒细胞的产生
Fig.2 IL-4 inhibits the production of basophils derived from IL-3 treated bone marrow cells
A~C:IL-3(25 ng/mL)联合IL-4(5 ng/mL)或PBS刺激IL-4缺陷型小鼠骨髓细胞;A:流 式细胞术检测FcεRIα+ckit-CD49b+细胞群比例;B:流式细胞术检测FcεRIα+ckit-CD49b+细胞群的FcεRIα平均荧光强度;C:流式细胞术检测FcεRIα+ckit-CD49b+细胞群比例;D~F:IL-3(25 ng/mL)联合Anti-IL-4(10 ng/mL)或同型对照抗体刺激野生型小鼠骨髓细胞;D:流式细胞术检测FcεRIα+ckit-CD49b+细胞群的FcεRIα平均荧光强度;E:IL-3(25 ng/mL)刺激野生型小鼠骨髓细胞,ELISA法检测细胞因子IL-4;F:流式细胞术检测CD11c+的比例;G:流式细胞术检测CD11c+细胞群比例;非配对t检验分析,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;实验重复2次
2.3 与野生型相比,IL-4缺陷小鼠嗜碱性粒细胞前体细胞的增殖增加
已有研究报道显示,从骨髓干细胞发育成嗜碱性粒细胞的定向干细胞或前体细胞包括嗜碱性粒细胞及肥大细胞共同前体细胞Pre-BMP(Lin-Sca1-ckit+CD34+CD16/32+FcεRIα+),以及稍晚的嗜碱性粒细胞前体细胞BaP(Lin-CD34+FcεRIα+ckit-)[11-12]。为探究IL-4缺陷鼠的嗜碱性粒细胞产生增加是否归因于这2种前体细胞的改变,本研究比较了野生型及IL-4缺陷小鼠骨髓细胞在IL-3诱导分化过程中Pre-BMP及BaP细胞群的比例,见图3A、B。与报道一致,这2类前体细胞群比例始终处于极低水平,不超过总细胞数的万分之一[11-13]。野生型对照组和IL-4缺陷组中Pre-BMP的比例均在IL-3诱导后第1天达到峰值,此后随时间推移而下降;BaP的比例则在诱导后第3天达到峰值,此后下降。野生型和IL-4缺陷组的Pre-BMP和BaP比例均仅在第9天有显著差异,但此时两组比例都极低(接近于0),且IL-4缺陷组的BaP比例是显著性低于野生型对照组的。兼之IL-4缺陷所导致的嗜碱性粒细胞比例显著性增高始于IL-3诱导后第6天,见图1。故可认为IL-4缺陷所导致的嗜碱性粒细胞增加并非是由已知的嗜碱性粒细胞前体增加所致。
进而利用Ki67染色,探究IL-4缺陷对分化出的相关细胞群增殖状态的影响。如图3C所示,野生型小鼠经骨髓分化而来的FcεRIα+ckit-CD49b+成熟嗜碱性粒细胞处于增殖状态的比例不超过15%,以诱导4~6 d最高,后随检测时间点逐渐下降。而IL-4缺陷鼠中处于增殖状态的成熟嗜碱性粒细胞的比例,在最高点即第9天明显高于野生型,且该显著增加的趋势一直维持到检测后期,见图3C。此外,本研究注意到一群接近全增殖状态的仅仅表达FcεRIα而ckit和CD49b为阴性的单阳细胞群。与野生型相比,IL-4缺陷小鼠单阳细胞群Ki67阳性率下降趋势显著放缓,且一直维持在较高水平,见图3D。
进一步研究发现,单阳细胞群在骨髓细胞里的比例远远超过目前已知的嗜碱性粒细胞前体细胞所占的比例,大概高100倍。和嗜碱性粒细胞一样,单阳性细胞比例亦随IL-3诱导而增加,并于第6天达到峰值,此后下降。并且,与嗜碱性粒细胞的变化一致,IL-4缺陷小鼠中单阳细胞比例也显著高于野生型鼠,见图3E。从表型上看(数据未显示),这群细胞不是肥大细胞或Pre-BMP细胞(无ckit),不是BaP细胞(无CD34),不是嗜酸性粒细胞(无siglec-F),但CD11b和Ly-6G阳性,属粒细胞系。更重要的是,流式分选出的单阳细胞群,经IL-3刺激培养,可继续分化成嗜碱性粒细胞和肥大细胞,见图3F,但其分化能力在野生型与IL-4缺陷型之间无差异(数据未显示)。上述结果提示,IL-4缺陷小鼠嗜碱性粒细胞产生增加可能是由于嗜碱性粒细胞增殖能力增加以及其单阳前体细胞数量和增殖能力增加所致。
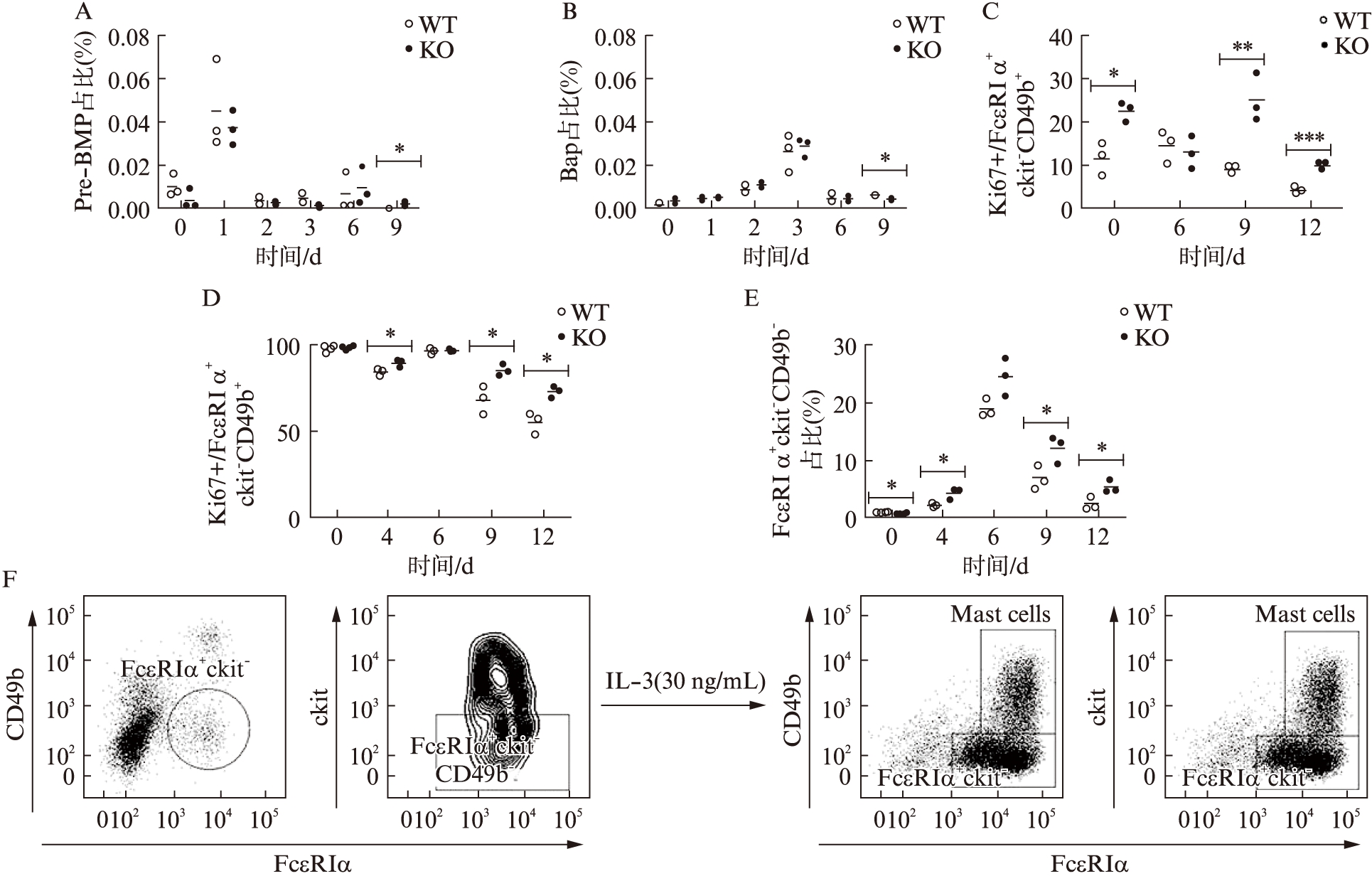
图3 IL-4缺陷鼠单阳细胞增殖增加
Fig.3 Basophils and FcεRIα single-positive precursor cells from IL-4 deficiency mice displayed more proliferation capacity
A、B:IL-3(25 ng/mL)刺激野生型及IL-4缺陷型小鼠骨髓细胞;A:流式细胞术检测Pre-BMP(Lin-Sca1-ckit+CD34+CD16/32+FcεRIα+)比例;B:流式细胞术检测BaP(Lin-CD34+FcεRIα+ckit-)比例;C、D:IL-3(25 ng/mL)刺激野生型及IL-4缺陷型小鼠骨髓细胞;C:流 式细胞术检测FcεRIα+ckit-CD49b+嗜碱性粒细胞的Ki67阳性率;D:流式细胞术检测FcεRIα+ckit-CD49b-单阳细胞群的Ki67阳性率;E:IL-3(25 ng/mL)刺激来自野生型及IL-4缺陷型各3只小鼠的骨髓细胞,于培养后0、4、6、9、12 d,流式细胞术检测FcεRIα+ckit-CD49b-单阳细胞群比例;F:IL-3(30 ng/mL)诱导培养骨髓细胞7 d后,代表性流式细胞分选单阳性细胞设门过程(FcεRIα+ckit-CD49b-);经IL-3(30 ng/mL)继续刺激培养后,流式细胞术检测该细胞群分化情况;非配对t检验分析,*P<0.05,**P<0.01
3 讨 论
尽管早在1879年Paul Ehrlich就发现一类容易被碱性染料着色而被命名为嗜碱性粒细胞的血细胞,但由于它在外周血中的比例极低(低于1%),研究手段有限,所以它的作用一直不清楚。直到1970年代,研究者发现人嗜碱性粒细胞和组织里的肥大细胞一样,表达IgE高亲和力受体,该受体也可被过敏原交联激活导致脱颗粒反应释放组胺和组织水解酶及炎症介质[14]。在小鼠中开展的研究工作发现,这类粒细胞在过敏和蠕虫感染时不仅数目增加,还可浸润组织,持续产生大量IL-4,与Ⅱ型固有淋巴细胞ILC2和Th2细胞一起,在过敏和抗蠕虫类寄生虫感染的Ⅱ型免疫应答中起着效应和调节作用[15]。但是与其他骨髓来源的外周血细胞相比,对调节其产生和维持的机制尚不十分清楚。
正常情况下,嗜碱性粒细胞由多能自我更新能力强的骨髓干细胞经自我更新能力弱的定向干细胞在骨髓中完成分化和成熟。在这个过程中,细胞因子IL-3和TSLP具有各自独立刺激前体细胞定向分化为嗜碱性粒细胞的能力[16],伴有骨髓细胞干性标志分子CD34转阴,肥大细胞标志分子ckit转阴,IgE高亲和力受体FcεRIα转阳及嗜碱性粒细胞成熟标志分子整合素CD49b转阳[17]。pre-BMP(Lin-Sca1-ckit+CD34+CD16/32+FcεRIα+)以及稍晚的前体BaP(Lin-CD34+FcεRIα+ckit-)是2种已经阐明的嗜碱性粒细胞的定向干细胞,IL-3通过激活STAT5启动核因子GATA2调控Pre-BMP和BaP的产生及进一步分化[12]。本研究发现,在IL-3诱导嗜碱性粒细胞定向分化过程中,存在FcεRIα+ckit-CD49b-的单阳细胞。重要的是,这类单阳细胞数目远远高于2类定向干细胞,且具有继续分化为成熟嗜碱性粒细胞的能力。日本血吸虫感染小鼠脾脏及肝脏中也发现,单阳细胞也和嗜碱性粒细胞一样具有浸润能力。因此,在定向干细胞之后至成熟之前,嗜碱性粒细胞经历了一个具有增殖能力但尚未完全成熟的过渡阶段,而IL-4通过抑制这些细胞的增殖而限制嗜碱性粒细胞的产生。
IL-3通过其异源二聚体受体复合物的信号级联反应促使定向干细胞向嗜碱性粒细胞分化,并维持嗜碱性粒细胞的生存和增殖。异源二聚体包括与IL-5和GM-CSF共用的负责传递信号的共有β链(βc),及与各自细胞因子特异性结合的α链。小鼠还有另一个β链叫βcIL-3,与共有β链具有91%相似性[18]。βc-JAK2-STAT5-GATA2的级联激活在嗜碱性粒细胞定向分化中起着决定性作用,而通过胞质内伴侣蛋白14-3-3招募介导及激活PI3K和AKT则在细胞生存(抗凋亡)和增殖中起着重要作用[19]。最近研究显示,IL-4和IL-3一样,通过PI3K,抑制成熟嗜碱性粒细胞凋亡[20],而本研究则发现IL-4 抑制了IL-3对成熟嗜碱性粒细胞和即将成熟的单阳细胞的促增殖作用,但对凋亡无影响(数据未显示)。不可否认,在IL-3诱导分化过程中产生的内源性IL-4可在多环节行使调节作用,但已报道的抗凋亡作用,无法解释本研究观察到的IL-4缺陷小鼠骨髓细胞能被IL-3诱导出更多的嗜碱性粒细胞的现象。已往的结果还发现IL-4抑制嗜碱性粒细胞中免疫细胞srk激酶家族分子lyn的激活,由于lyn可对IL-3活性起负调节作用[21],不能排除该作用可能参与介导IL-4缺陷小鼠中IL-3诱导增殖的活性增加。因此,本课题组将在本实验体系下检测IL-4缺陷型骨髓细胞经IL-3诱导后lyn磷酸化水平的变化。此外,为探究“单阳性细胞”及嗜碱性粒细胞增殖能力具体如何被IL-4影响,后续会将两细胞群进行RNA测序,以检测何种信号分子受到IL-4影响而致使增殖能力发生变化。
嗜碱性粒细胞的颗粒小体中,除含组胺及各种组织水解酶,含大量的IL-4,因而嗜碱性粒细胞也参与启动Th2适应性免疫应答[22]。本研究中IL-4通过下调成熟和将要成熟的嗜碱性粒细胞增殖而限制嗜碱性粒细胞的过度产生,对Th2应答及其主导的过敏反应起到了负反馈调节作用。本研究认为,在Th2应答的启动阶段,嗜碱性粒细胞作为IL-4的主要来源而通过IL-4-STAT6信号通路发挥重要作用;而在Th2应答的效应阶段,Th2细胞分泌产生大量的IL-4从而致使B细胞进行抗体类别转换分泌出IgE的同时,上调的IL-4水平能够抑制Ⅱ型免疫应答效应细胞嗜碱性粒细胞的产生。通过这些调节机制,机体从而能够将Th2应答控制在一定水平。因此仅仅干预IL-4的作用可能不是控制过敏性疾病的合理选择。
[1] GIESECKR L,WILSONM S,WYNNT A.Type 2 immunity in tissue repair and fibrosis[J].Nat Rev Immunol,2018,18(1):62-76.
[2] KUMAR S,JEONG Y,ASHRAF M U,et al.Dendritic cell-mediated Th2 immunity and immune disorders[J].Int J Mol Sci,2019,20(9):2159.
[3] GANDHI N A,BENNETT B L,GRAHAM N M,et al.Targeting key proximal drivers of type 2 inflammation in disease[J].Nat Rev Drug Discov,2016,15(1):35-50.
[4] WALKERJ A,MCKENZIEA N J.Th2 cell development and function[J].Nat Rev Immunol,2018,18(2):121-133.
[5] PHYTHIAN-ADAMSA T,COOKP C,LUNDIER J,et al.CD11c depletion severely disrupts Th2 induction and development in vivo[J].J Exp Med,2010,207(10):2089-2096.
[6] SOKOLC L,BARTONG M,FARRA G,et al.A mechanism for the initiation of allergen-induced T helper type 2 responses[J].Nat Immunol,2008,9(3):310-318.
[7] YOSHIMOTO T,YASUDA K,TANAKA H,et al.Basophils contribute to Th2-IgE responses in vivo via IL-4 production and presentation of peptide-MHC class Ⅱ complexes to CD4+ T cells[J].Nat Immunol,2009,10(7):706-712.
[8] SAITO H,HATAKE K,DVORAK A M,et al.Selective differentiation and proliferation of hematopoietic cells induced by recombinant human interleukins[J].PNAS,1988,85(7):2288-2292.
[9] KINET J P.The high-affinity IgE receptor(Fc Epsilon RI):from physiology to pathology[J].Annu Rev Immunol,1999,17:931-972.
[10] LUTZM B.IL-3 in dendritic cell development and function:a comparison with GM-CSF and IL-4[J].Immunobiology,2004,209(1-2):79-87.
[11] QI X,HONG J,CHAVES L,et al.Antagonistic regulation by the transcription factors C/EBPα and MITF specifies basophil and mast cell fates[J].Immunity,2013,39(1):97-110.
[12] LI Y P,QI X P,LIU B,et al.The STAT5-GATA2 pathway is critical in basophil and mast cell differentiation and maintenance[J].J Immunol,2015,194(9):4328-4338.
[13] ARINOBU Y,IWASAKI H,GURISHM F,et al.Developmental checkpoints of the basophil/mast cell lineages in adult murine hematopoiesis[J].PNAS,2005,102(50):18105-18110.
[14] ISHIZAKA T,DE BERNARDO R,TOMIOKA H,et al.Identification of basophil granulocytes as a site of allergic histamine release[J].J Immunol,1972,108(4):1000-1008.
[15] SCHWARTZ C,EBERLE JU,VOEHRINGER D.Basophils in inflammation[J].Eur J Pharmacol,2016,778:90-95.
[16] SIRACUSAM C,SAENZS A,HILLD A,et al.TSLP promotes interleukin-3-independent basophil haematopoiesis and type 2 inflammation[J].Nature,2011,477(7363):229-233.
[17] NISHIKADO H,MUKAI K,KAWANO Y,et al.NK cell-depleting anti-asialo GM1 antibody exhibits a lethal off-target effect on basophils in vivo[J].J Immunol,2011,186(10):5766-5771.
[18] DOUGAN M,DRANOFF G,DOUGAN S K.GM-CSF,IL-3,and IL-5 family of cytokines:regulators of inflammation[J].Immunity,2019,50(4):796-811.
[19] GUTHRIDGE M A,BARRY E F,FELQUER F A,et al.The phosphoserine-585-dependent pathway of the GM-CSF/IL-3/IL-5 receptors mediates hematopoietic cell survival through activation of NF-κB and induction of bcl-2[J].Blood,2004,103(3):820-827.
[20] REINHART R,KAUFMANN T.IL-4 enhances survival of in vitro-differentiated mouse basophils through transcription-independent signaling downstream of PI3K[J].Cell Death Dis,2018,9(7):713.
[21] SCAPINI P,PEREIRA S,ZHANG H,et al.Multiple roles of Lyn kinase in myeloid cell signaling and function[J].Immunol Rev,2009,228(1):23-40.
[22] BRUNNER T,HEUSSER C H,DAHINDEN C A.Human peripheral blood basophils primed by interleukin 3(IL-3) produce IL-4 in response to immunoglobulin Ereceptor stimulation[J].J Exp Med,1993,177(3):605-611.