多参数MRI(multiparametric MRI, Mp-MRI)是诊断前列腺癌(prostate cancer, PCa)的重要检查方法[1]。Mp-MRI包括高分辨T2加权成像(T2-weighted imaging, T2WI)、弥散加权成像(diffusion-weighted imaging, DWI)及相应表观弥散系数(apparent diffusion coefficient, ADC)图、动态对比增强(dynamic contrast enhanced, DCE)。高分辨T2WI能清晰地显示前列腺及病灶的位置、大小及形态,DWI及DCE作为功能成像有利于提高PCa检出的灵敏度和特异性。近年来,定量图像特征分析及人工智能诊断进一步促进了MR在PCa诊断中的应用[2]。MR定量特征中,PCa主要病灶的大小定量与其分级、治疗方案的选择和患者的预后密切相关,然而Mp-MRI各序列对PCa病灶体积评估的意义各文献报道不一。本研究拟通过比较Mp-MRI各序列PCa主要病灶体积及病理的关系,探讨各序列在评估PCa主要病灶体积中的价值。
1 资料与方法
1.1 病例选择
回顾性连续收集同济大学附属同济医院2017年1月—2018年6月收治的前列腺病例临床及MRI资料。纳入标准为: (1) 所有病例均进行了完整的Mp-MRI检查,包括T1加权成像(T1-weighted imaging, T1WI)、T2WI、DWI及ADC图、DCE;(2) 所 有病例均经根治病理证实,且根治手术在MRI检查后3个月内进行;(3) 患者在MRI检查之前无前列腺治疗史,如放射治疗,内分泌治疗等。排除标准: (1) MRI图像质量影响病灶体积测量;(2) 临 床资料或MRI扫描序列不全;(3) 主要病灶体积<0.5 cm3。
1.2 MRI检查
所有病例均采用Siemens Verio 3.0T MR扫描。成像序列主要包括快速自旋回波序列(turbo spin echo, TSE)横断位T1WI;横断位、矢状位高分辨T2WI,扫描参数: 重复时间(repetition time, TR)=4 290 ms,回波时间(echo time, TE)=96 ms,空间分辨率为0.7 mm×0.6 mm×3.0 mm;回波平面成像(echo planar imaging, EPI)序列横断位DWI及ADC图,扫描参数: TR=3 000 ms,TE=90 ms,空间分辨率为1.6 mm×1.2 mm×3.0 mm,b值包括50、800、1 400 s/mm2;VIBE(volume interpolated body exa-mination)序列横断位DCE,扫描参数: TR=4.8 ms,TE=1.7 ms,空间分辨率为0.8 mm×0.6 mm×2.0 mm,时间分辨率为7.8 s,持续约4.5 min,增强扫描对比剂采用钆喷酸葡胺(gadolinium-diethy-lenetriamine pentaacetic acid, Gd-DTPA),剂量为0.1 mmol/kg,流率为2.5 mL/s。所有患者扫描前嘱其排便、适量留尿,定位时线圈中心位于耻骨联合处,用束带固定以减少呼吸运动产生的伪影,未使用肌松类药物。
1.3 病理及MR图像分析
根治前列腺标本由足量10%的中性甲醛溶液固定24 h以后,自尖部向底部方向以3 mm层厚依次进行组织切片,常规脱水、透明、石蜡包埋,以4~5 μm 切片行H-E染色。选取每个3 mm层厚中,组织均匀、完整,无变形的病理玻片,由一位经验丰富的泌尿病理医师在200倍显微镜下对PCa最高格林森评分(gleason score, GS)的主要病灶进行边界勾画。如果存在多个最高GS病灶,选取体积最大的病灶。使用Matlab软件对各层勾画出的病灶进行面积测量。最终以3 mm为厚度,计算病灶的病理测量体积: 病灶体积=各层面病灶面积的总和×层厚(3 mm)。
所有MR图像先由一名不参与体积测定的高年资放射科医师与泌尿病理医师一起,依据病理结果对MR图像进行主要病灶标注,依据前列腺影像报告和数据系统第二版(prostate imaging reporting and data system V2, PI-RADS V2)判断DCE是否为阳性。依据DCE结果,将所有病例分为DCE阳性组和DCE阴性组。各序列图像上病灶主要病灶体积测定由另外二名具有前列腺MR诊断工作经验的高年资医师采用双盲法独立完成。DCE阳性组测量T2WI、ADC图以及DCE最大面积早期强化图上主要病灶的体积,DCE阴性组仅在T2WI、ADC图上测量,不同序列分次测量,最终结果取两名医师测量的平均值。病灶体积计算方法: 病灶体积=各层面病灶面积的总和×层厚,同时计算各序列与病理相比的病灶体积低估率。
1.4 统计学处理
实验数据采用SPSS 22.0软件进行统计学分析处理。所有测量数据采用![]() 表示。采用Pearson相关系数比较MRI各序列病灶体积与病理的相关性。采用单因素重复测量方差分析比较MRI各序列病灶体积与病理的关系以及各序列病灶体积低估率的差异,并采用Bonferroni检验作两两比较。采用Bland-Altman散点图显示MRI各序列病灶体积低估率的差异。P<0.05表示差异有统计学意义。
表示。采用Pearson相关系数比较MRI各序列病灶体积与病理的相关性。采用单因素重复测量方差分析比较MRI各序列病灶体积与病理的关系以及各序列病灶体积低估率的差异,并采用Bonferroni检验作两两比较。采用Bland-Altman散点图显示MRI各序列病灶体积低估率的差异。P<0.05表示差异有统计学意义。
2 结 果
2.1 病例资料
依据病例选择原则,共计56例PCa病例纳入研究,年龄为45~85岁,平均(61.5±20.3)岁,平均PSA值为(20.3±15.5)ng/mL,位于外周带(peripheral zone, PZ)39例,位于移行带(transitional zone, TZ)17例;GS 6分7例,GS 7a分18例,GS 7b 分17例,GS 8分9例,GS 9分5例;DCE阳性组40例,其中位于PZ 28例,CZ 12例,DCE阴性组16例,其中位于PZ 11例,CZ 5例。
2.2 DCE阳性组病灶测量体积比较
DCE阳性组PCa主要病灶测量如图1所示,测量结果见表1。T2WI、ADC、DCE以及病理平均测量体积分别为(1.81±1.57)、(1.51±1.29)、(2.82±2.59)、(3.38±2.96)cm3,T2WI、ADC、DCE病灶测量体积与病理均呈正相关。MR各序列与病理病灶测量体积总体差异存在统计学意义(单因素重复方差分析F值为29.494,P<0.001),Bonferroni法分析显示,T2WI、ADC、DCE测量体积与病理两两比较,差异也均存在统计学意义(P<0.01);T2WI与ADC、DCE与病理病灶测量体积差异有统计学意义(P=0.003),DCE与T2WI、ADC测量体积差异有统计学意义(P<0.001),病理与T2WI、ADC测量体积差异也具有统计学意义(P<0.001)。T2WI、ADC、DCE测量体积与病理比较,病灶体积低估百分比分别为(41.65±16.66)%、(50.05±15.81)%、(16.00%±14.50)%(图2),各序列低估百分比总体差异有统计学意义(单因素重复方差分析F值为142.501,P<0.001),Bonferroni法分析显示各序列低估百分比两两比较差异也均存在统计学意义(P<0.001),DCE的低估百分比低于T2WI及ADC。
表1 DCE阳性组Mp-MRI各序列PCa病灶体积测定与病理对照
Tab.1 Volume measurement of PCa in different sequences of Mp-MRI and comparison with pathology in DCE positive group (n=40)
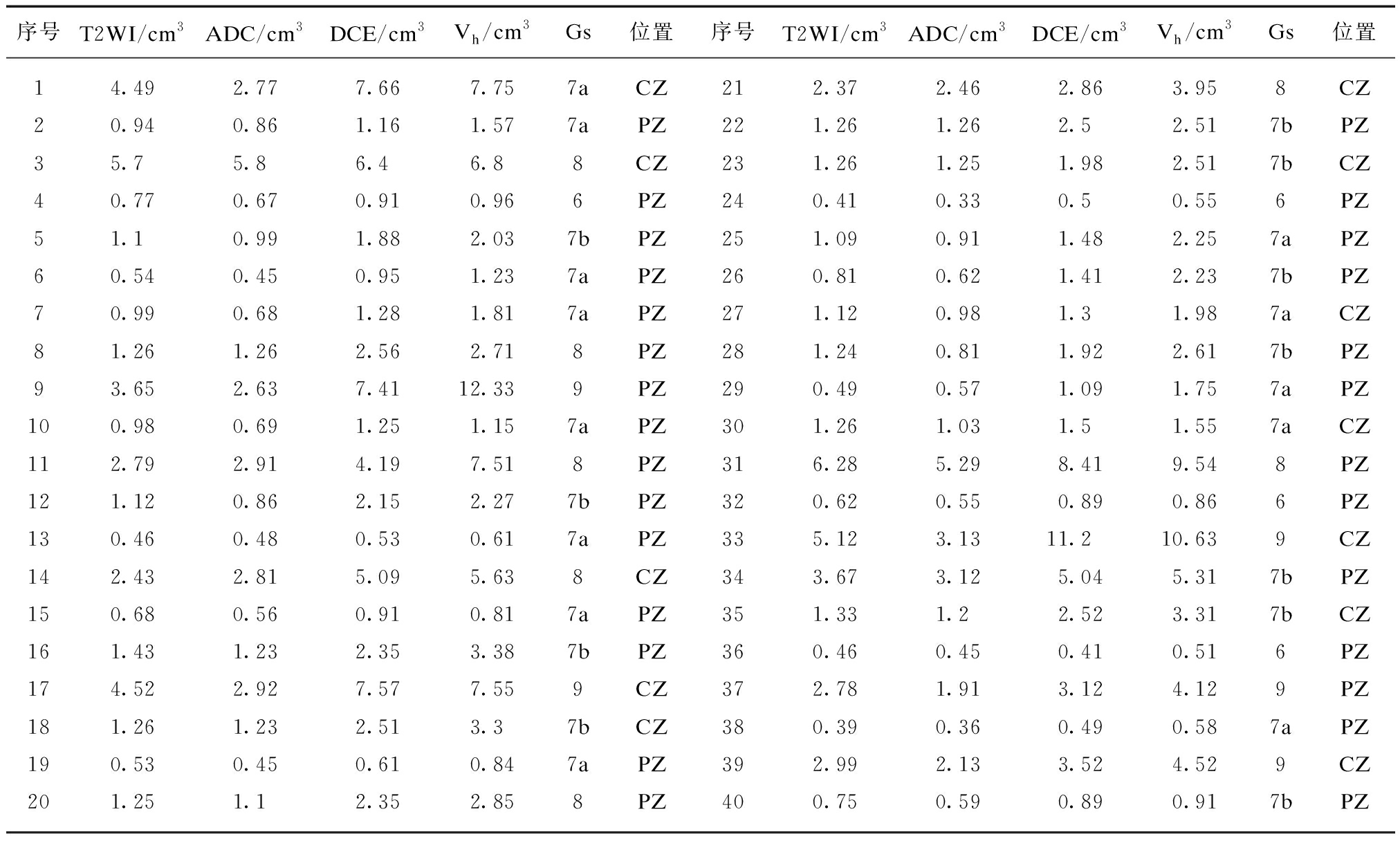
序号T2WI/cm3ADC/cm3DCE/cm3Vh/cm3Gs位置序号T2WI/cm3ADC/cm3DCE/cm3Vh/cm3Gs位置14.492.777.667.757aCZ212.372.462.863.958CZ20.940.861.161.577aPZ221.261.262.52.517bPZ35.75.86.46.88CZ231.261.251.982.517bCZ40.770.670.910.966PZ240.410.330.50.556PZ51.10.991.882.037bPZ251.090.911.482.257aPZ60.540.450.951.237aPZ260.810.621.412.237bPZ70.990.681.281.817aPZ271.120.981.31.987aCZ81.261.262.562.718PZ281.240.811.922.617bPZ93.652.637.4112.339PZ290.490.571.091.757aPZ100.980.691.251.157aPZ301.261.031.51.557aCZ112.792.914.197.518PZ316.285.298.419.548PZ121.120.862.152.277bPZ320.620.550.890.866PZ130.460.480.530.617aPZ335.123.1311.210.639CZ142.432.815.095.638CZ343.673.125.045.317bPZ150.680.560.910.817aPZ351.331.22.523.317bCZ161.431.232.353.387bPZ360.460.450.410.516PZ174.522.927.577.559CZ372.781.913.124.129PZ181.261.232.513.37bCZ380.390.360.490.587aPZ190.530.450.610.847aPZ392.992.133.524.529CZ201.251.12.352.858PZ400.750.590.890.917bPZ
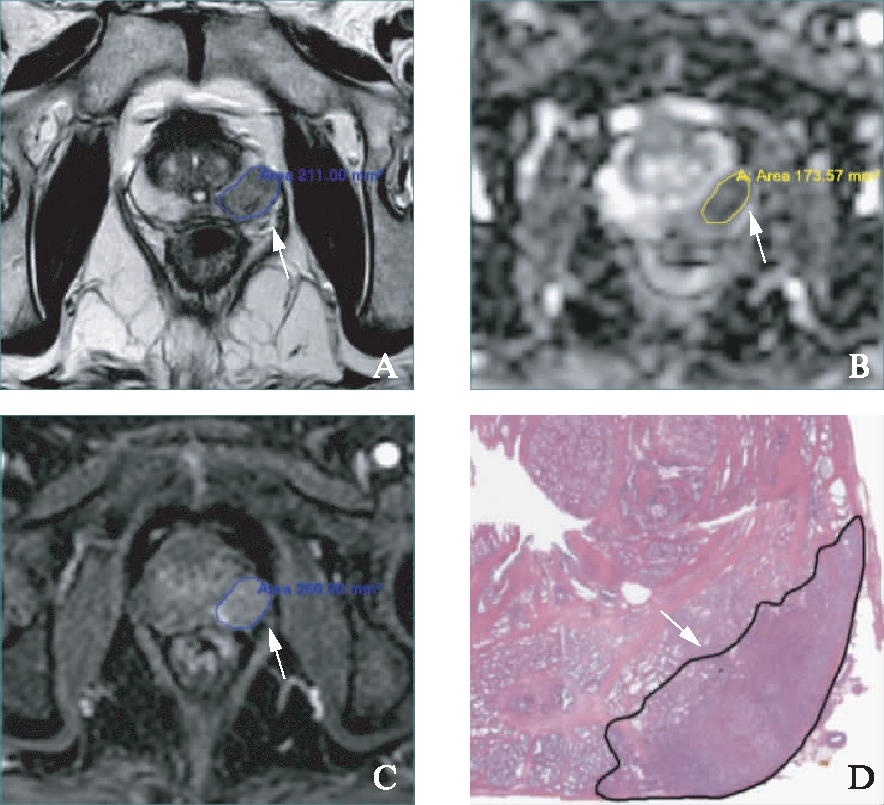
图1 MR各序列及病理主要病灶体积的测量
Fig.1 Measurement of the volume of index lesions in MR sequences and pathology
患者,男,71岁,PSA 20.3 ng/mL,根治病理证实为左侧外周带PCa,GS为7b(4+3);DCE阳性患者测量每层T2WI(A)、ADC图(B)以及DCE最大面积早期强化图(C)上主要病灶的面积。主要病灶体积=各层面病灶面积的总和×层厚;病理切片图(D)测量主要病灶体积2.03 cm3(H-E染色)
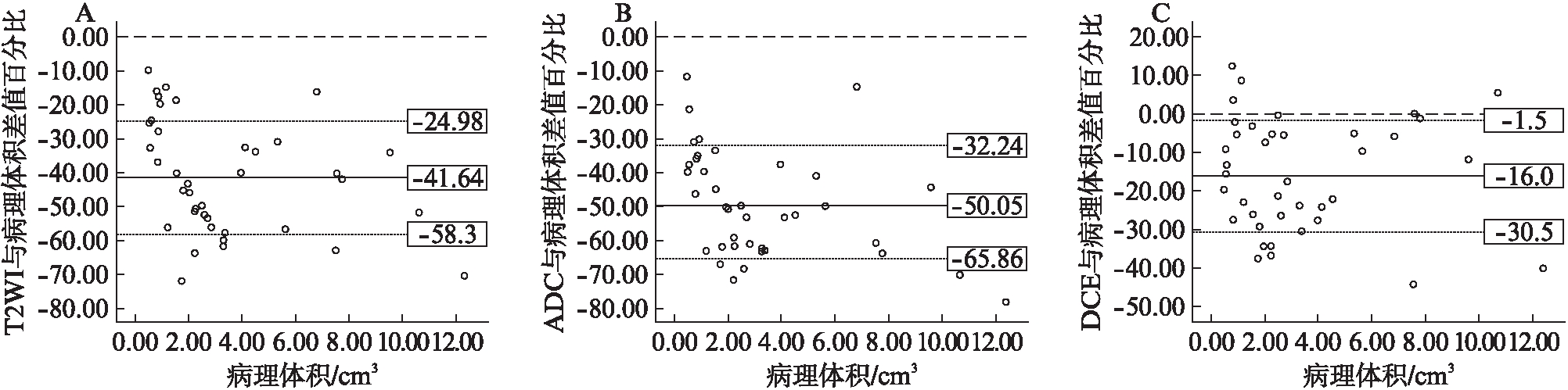
图2 Bland-Altman散点图显示MRI各序列与病理比较,病灶体积低估百分比的差异
Fig.2 Bland Altman scatter plot shows the difference in the percentage of underestimation of lesion volume between MRI sequences and pathology
Bland-Altman散点图显示DCE阳性组,T2WI(A)、ADC(B)及DCE(C)与病理比较,各序列均低估了病灶体积,其中DCE低估百分比明显低于T2WI及ADC图(P<0.001)
2.3 DCE阴性组病灶测量体积比较
DCE阴性组测量结果见表2。PCa主要病灶T2WI、ADC、病理平均测量体积分别为(2.60±1.87)、(2.11±1.70)、(4.24±3.00) cm3,T2WI、ADC病灶测量体积与病理均呈正相关。T2WI、ADC与病理病灶测量体积总体差异存在统计学意义(单因素重复方差分析F值为24.209,P<0.001),Bonferroni法分析显示T2WI、ADC与病理测量体积两两比较差异也存在统计学意义(P<0.01),T2WI与ADC、T2WI与病理、ADC与病理测量体积差异均有统计学意义(P=0.005,P=0.001,P<0.001)。T2WI、ADC测量体积与病理比较,病灶低估百分比分别为(36.25±14.07)%、(49.87±13.73)%,两者低估百分比存在统计学差异(单因素重复方差分析F值为25.366,P<0.001),T2WI低估百分比低于ADC图。
表2 DCE阴性组多参数MR各序列前列腺癌病灶体积测定与病理对照
Tab.2 Volume measurement of PCa in different sequences of Mp-MRI and comparison with pathology in DCE negative group(n=16)
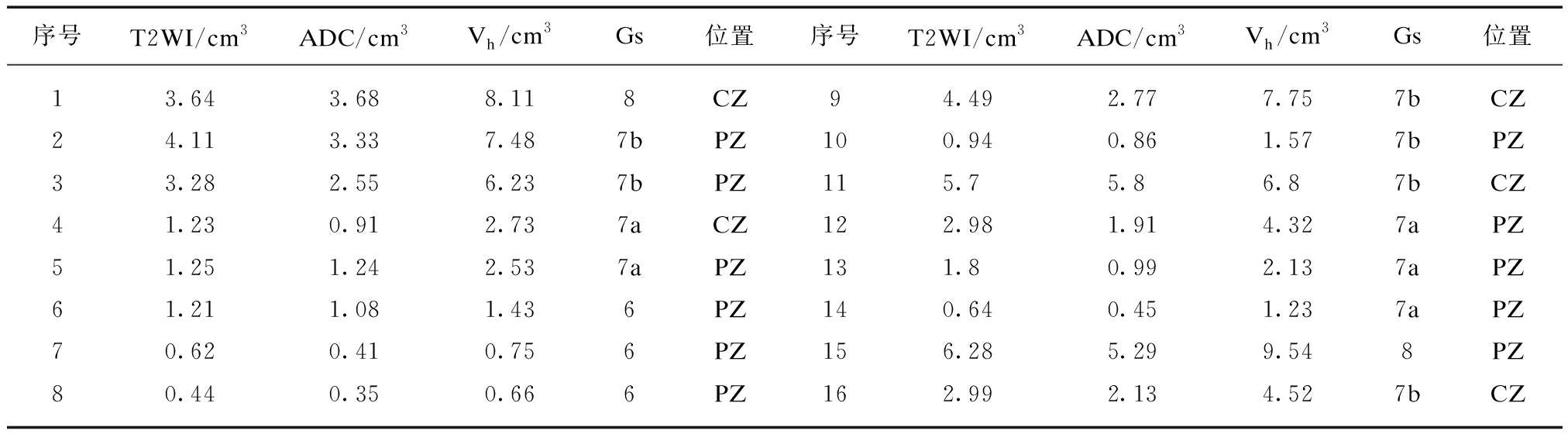
序号T2WI/cm3ADC/cm3Vh/cm3Gs位置序号T2WI/cm3ADC/cm3Vh/cm3Gs位置13.643.688.118CZ94.492.777.757bCZ24.113.337.487bPZ100.940.861.577bPZ33.282.556.237bPZ115.75.86.87bCZ41.230.912.737aCZ122.981.914.327aPZ51.251.242.537aPZ131.80.992.137aPZ61.211.081.436PZ140.640.451.237aPZ70.620.410.756PZ156.285.299.548PZ80.440.350.666PZ162.992.134.527bCZ
3 讨 论
PCa主要病灶的大小与其诊断、治疗及预后密切相关,Mp-MRI能准确评价PCa病灶的体积,然而各序列评估的价值不同[3-6]。欧洲泌尿放射协会发布的PI-RADS V2认为,在目前的技术条件下,Mp-MRI与病理比较,各序列均低估了病灶体积及范围,尤其是针对GS 3的病灶,而最适合测量病灶大小的序列和图像方位各文献报道不一,不同MR序列评估PCa病灶大小的临床意义需进一步研究[7-8]。本研究依据DCE-MRI表现,将PCa病灶分为DCE阳性组和阴性组,比较Mp-MRI各序列PCa主要病灶体积及病理的关系,探讨各序列在评估PCa主要病灶体积中的意义,结果显示,两组各序列病灶体积与病理均具有较好的正相关性,且均低估了病灶体积。DCE阳性组中,DCE的低估百分比低于T2WI及ADC,DCE评价PCa主要病灶体积优于T2WI及ADC;DCE阴性组中,T2WI低估百分比低于ADC图,T2WI评价PCa主要病灶体积优于ADC。
Le Nobin等[9]评估了37例PCa根治患者术前Mp-MRI图像,采用软件辅助校准并计算T2WI、ADC及根治标本图像上病灶体积,结果表明: 在50个肿瘤病灶中,T2WI、ADC低估病灶体积分别达32%、47%,ADC低估肿瘤病灶体积较T2WI更为明显,GS≥7分或者PI-RADS评分为4分或5分的病灶,体积低估率更明显,但该研究未对DCE图像病灶体积进行分析。
Harvey等[10]通过比较41例PCa Mp-MRI图像与病理体积,结果显示T2WI、DWI以及DCE-MRI评估病灶体积各不相同(P<10-8),T2WI阅片者一致性、与病理比较的一致性均优于DWI和DCE,DWI与DCE均低估了病灶体积,尤以DCE-MIR更为明显,因此Harvey等[10]认为T2WI更适合用于PCa放射治疗计划大体肿瘤体积的勾画。然而,Harvey等[10]在病例选择中,未对DCE阴性病例进行单独分组分析,也未予以剔除,这可能是导致DCE明显低估PCa病灶的主要原因。
Sun等[11]以根治病理标本为最终标准,选取T2WI、DWI及DCE均为阳性的PCa主要病灶共计40例,对比分析病灶T2WI、DWI及DCE的测量体积,结果发现T2WI(P=0.000 002)、DWI(P=0.000 003)及DCE(P=0.004 412)均低估了病灶体积,其中T2WI(54.98%±22.60%)、DWI(58.59%±18.58%)低估率明显高于DCE(18.33%±30.11%),DCE评估PCa主要病灶体积优于T2WI、DWI。本研究DCE阳性组与Sun等报道结果一致,而Sun等未对DCE阴性病例做进一步研究,不符合临床实际应用情况。
Bratan等[12]回顾性分析了202例前列腺根治手术前患者Mp-MRI影像资料,比较所有真阳性病例T2WI、ADC、DCE图像以及三者中最大病灶体积(Vmax)与病理的关系,结果显示T2WI、ADC、DCE均低估了病灶体积,Vmax能较好地评估病灶体积,两名阅片者平均Vmax准确性分别达0.92、0.95,同时,两名阅片者中,Vmax来源于T2WI、ADC、DCE图像比例分别为20.0%、12.9%、73.0%和18.4%、25.3%、59.9%,Vmax主要决定于DCE图像。该研究间接表明,Mp-MRI有利于弥补单一参数评价PCa病灶体积的不足,而且DCE比T2WI、ADC更有利于评估主要病灶的体积,尤其是针对DCE阳性病例。
各序列对PCa主要病灶体积评估的差异可能与各自成像基础不同有关。T2WI、高b值DWI及其相应ADC图主要与组织腺腔密度有关,肿瘤组织缺乏正常腺腔结构,腺体成分明显减少,T2WI信号降低,ADC值降低[13]。DWI及定量ADC还与组织的细胞密度相关,肿瘤组织细胞密集,细胞密度大,细胞外间隙水分子活动受限,ADC值降低。DCE是评价肿瘤血管最常用的功能成像方法,高时间分辨率的DCE-MRI能快速、直接地反映肿瘤血管药物代谢特征,包括组织的微血管灌注、血管渗透性、血管外细胞外间隙,肿瘤组织由于血管渗透性增加,可表现为早期快速强化[14]。各序列不同的成像基础导致其检测PCa的灵敏度、特异性不同,从而影响其病灶体积的测量。
各序列对PCa主要病灶体积测量的不同也可能与PCa的位置、大小以及GS有关。PCa是一种高度多样性的恶性肿瘤,无论是临床表现、发病部位、形态特征,还是分子基因、病理组织结构、瘤内或瘤间异质性等各方面均具有复杂的不均匀性[15]。外周带PCa组织形态结构特征与移行带存在差异,外周带PCa常表现为类圆形,而在移行带则表现为“凸透镜”或水滴形,边缘模糊[16]。Lemaitre等[17]研究了27例经根治病理证实的前部PCa病灶的形态学特征,包括肿瘤的边缘、最大表面积及体积,通过与病理对照,发现DCE与病理位置、形态特征及体积评估有较好的一致性,而89%的病灶T2WI边界不清。另外,Mp-MRI对PCa的检测与病灶的大小密切相关,DCE有利于提高小病灶检测的灵敏度[8],说明小PCa病灶,T2WI、DWI更容易被低估。
PCa的GS评分一定程度上反映了组织内的不均匀,GS 3分所占的比例直接影响各序列对主要病灶的体积评估。PCa的GS评分与ADC值呈线性相关,GS 3分PCa可能更多的表现为PI-RADS评分DWI 3分病灶[18]。Taghipour等[19]以前列腺根治病理为标准,回顾性分析了209例外周带PCa,结果显示DWI 3分病灶有45例,约占21.5%,其中DCE阳性29例,真阳性21例,阴性16例,真阴性10例,DCE对于DWI 3分csPCa的诊断准确性为68.9%,DCE有利于DWI 3分PCa的诊断。Greer等[20]以前列腺根治全切病理为标准,对比分析了420例外周带病灶,结果显示对于DWI 3分病灶,DCE阳性对PCa检出率为67.8%,对csPCa检出率为54.0%,DCE+DWI与单纯DWI相比,对外周带PCa检出率提高了16.0%。前期研究结果也表明,针对于PSA小于10 ng/mL的患者,DCE有利于提高PCa的诊断灵敏度[21]。DCE有利于GS 3分PCa的显示可能是DCE评价PCa主要病灶体积优于T2WI及ADC的重要原因之一,同时也说明PCa体积被低估可能主要发生在GS 3分的病灶,或者DCE阴性的部分。
总之,本研究比较分析了Mp-MRI各序列PCa主要病灶体积及病理的相互关系,结果显示,各序列病灶体积与病理均具有较好的正相关性,且均低估了病灶体积。如果病灶DCE阳性,DCE更有利于评价PCa主要病灶的体积,而DCE阴性时,T2WI优于DWI。
[1] 张配配, 王良.PI-RADS相关的前列腺癌热点问题研究现状[J].影像诊断与介入放射学,2017,26(6): 496-503.
[2] 王为刚,张国凯,李军衡,等.3.0T磁共振图像计算机特征鉴别诊断前列腺良恶性病变的价值[J].同济大学学报(医学版),2019,40(2): 201-206.
[3] KNOEDLER J J, KARNES R J, THOMPSON R H, et al. The association of tumor volume with mortality following radical prostatectomy[J]. Prostate Cancer Prostatic Dis, 2014,17(2): 144-148.
[4] SUGANO D, SIDANA A, JAIN A L, et al. Index tumor volume on MRI as a predictor of clinical and pathologic outcomes following radical prostatectomy[J]. Int Urol Nephrol, 2019,51(8): 1349-1355.
[5] MARTORANA E, PIROLA G M, SCIALPI M, et al. Lesion volume predicts prostate cancer risk and aggressiveness: validation of its value alone and matched with prostate imaging reporting and data system score[J]. BJU Int, 2017,120(1): 92-103.
[6] TURKBEY B, MANI H, ARAS O, et al. Correlation of magnetic resonance imaging tumor volume with histopathology[J]. J Urol, 2012,188(4): 1157-1163.
[7] WEINREB J C, BARENTSZ J O, CHOYKE P L, et al. PI-RADS prostate imaging-reporting and data system: 2015, version 2[J]. Eur Urol, 2016,69(1): 16-40.
[8] TURKBEY B, ROSENKRANTZ A B, HAIDER M A, et al. Prostate imaging reporting and data system version 2.1: 2019 update of prostate imaging reporting and data system version 2[J]. Eur Urol, 2019,76(3): 340-351.
[9] LE NOBIN J, ORCZYK C, DENG F M, et al. Prostate tumour volumes: evaluation of the agreement between magnetic resonance imaging and histology using novel co-registration software[J]. BJU Int, 2014,114(6b): E105-E112.
[10] HARVEY H, ORTON M R, MORGAN V A, et al. Volumetry of the dominant intraprostatic tumour lesion: intersequence and interobserver differences on multiparametric MRI[J]. Br J Radiol, 2017,90(1071): 20160416.
[11] SUN C P, CHATTERJEE A, YOUSUF A, et al. Comparison of T2-weighted imaging, DWI, and dynamic contrast-enhanced MRI for calculation of prostate cancer index lesion volume: correlation with whole-mount pathology[J]. AJR Am J Roentgenol, 2019,212(2): 351-356.
[12] BRATAN F, MELODELIMA C, SOUCHON R, et al. How accurate ismultiparametric MR imaging in evaluation of prostate cancer volume?[J]. Radiology, 2015,275(1): 144-154.
[13] KWAK J T, SANKINENI S, XU S, et al. Prostate cancer: a correlative study of multiparametric MR imaging and digital histopathology[J]. Radiology, 2017,285(1): 147-156.
[14] HARRY V N. Novel imaging techniques as response biomarkers in cervical cancer[J]. Gynecol Oncol, 2010,116(2): 253-261.
[15] TOLKACH Y, KRISTIANSEN G. The heterogeneity of prostate cancer: a practical approach[J]. Pathobiology, 2018,85(1-2): 108-116.
[16] BARENTSZ J O, RICHENBERG J, CLEMENTS R, et al. ESUR prostate MR guidelines 2012[J]. Eur Radiol, 2012,22(4): 746-757.
[17] LEMAITRE L, PUECH P, PONCELET E, et al. Dynamic contrast-enhanced MRI of anterior prostate cancer: morphometric assessment and correlation with radical prostatectomy findings[J].Eur Radiol, 2009,19(2): 470-480.
[18] JOHNSTON E W, BONET-CARNE E, FERIZI U, et al. VERDICT MRI for prostate cancer: intracellular volume fraction versus apparent diffusion coefficient[J]. Radiology, 2019,291(2): 391-397.
[19] TAGHIPOUR M, ZIAEI A, ALESSANDRINO F, et al. Investigating the role of DCE-MRI, over T2 and DWI, in accurate PI-RADS v2 assessment of clinically significant peripheral zone prostate lesions as defined at radical prostatectomy[J].Abdom Radiol(NY), 2019,44(4): 1520-1527.
[20] GREER M D, SHIH J H, LAY N, et al. Validation of the dominant sequence paradigm and role of dynamic contrast-enhanced imaging in PI-RADS version 2[J]. Radiology, 2017,285(3): 859-869.
[21] 邵志红,王伟,刘卫英,等.双参数与多参数MRI对不同PSA水平前列腺癌诊断的对比研究[J].同济大学学报(医学版),2020,41(4): 437-442.