目前,乙肝病毒感染引起的慢性乙型肝炎(chronic hepatitis B, CHB)仍导致沉重的负担: 有传染性、需长期治疗、难以治愈。如果没有及时有效的治疗,疾病将缓慢进展,最终发展为肝硬化、肝衰竭或肝细胞癌的风险为15%~40%,是世界性的公共健康威胁。Marshallpo[1]于1998年正式提出了“肠-肝轴”的概念。肝脏和肠道在解剖和生物学功能上存在密不可分的联系,肠道菌群代谢物进入体循环,影响宿主肝脏的功能。基于对CHB功能性治愈的迫切需要和对肠-肝轴认识的深入,本研究应用16s rDNA扩增子测序技术对CHB患者肠道菌群的多样性进行分析,旨在比较CHB患者和健康人肠道菌群的差异,探讨肠道菌群对CHB患者疾病的影响及可能的作用机制。
1 资料与方法
1.1 研究对象
收集2017年1月—2018年12月在同济大学附属同济医院感染科及消化科就诊的CHB患者60例粪便样本,另外收集健康对照者30例粪便样本。
入选标准: 年龄18~65岁,参照中华医学会肝病学分会及中华医学会感染病学分会《慢性乙型肝炎防治指南》(2015年更新版)[2],符合CHB临床诊断标准,处于免疫清除期(immune clearance phase)和再活动期(reactivation phase)CHB患者60例,其中HBeAg阳性慢乙肝34例,HBeAg阴性慢乙肝26例,不伴肝纤维化或肝硬化、肝癌等并发症,同时根据患者血清ALT、HBVDNA水平和肝脏疾病严重程度,结合其年龄、家族史等因素,综合评估患者疾病进展风险,达到抗病毒治疗标准,予以入选。
排除标准: (1) 孕妇及哺乳期妇女;(2) 精神病患者;(3) 肿瘤患者;(4) 肝硬化患者;(5) 合并其它肝病及传染病患者;(6) 合并心、肺、肾、中枢神经系统等严重疾病者;(7) 合并胃肠道疾病;(8) 入组前曾应用或正在应用乙肝抗病毒药物者;(9) 入组前1个月有使用抗生素及微生态药物者;(10) 因各种原因依从性差、不能严格配合治疗及按时随访者。
健康对照组入选要求: 年龄18~65岁,健康体检正常,排除病毒携带者,入组前1个月未应用抗生素及微生态药物者。
1.2 研究方法
用FloraPrepTM样品采集管(苏州艾达康医疗科技有限公司)进行粪便采样,置于4 ℃暂存,2周内尽快送检。应用16s rDNA扩增子测序技术检测样本菌群多样性,实验流程包括: 对粪便样本进行DNA的提取与质检、16s rDNA可变区PCR扩增、产物纯化、文库制备与检测、高通量测序等多个步骤。严格质控,按照目标数据量调整文库体积,将多个文库混合后进行Illumina MiSeq测序。
1.3 统计学处理
研究慢性CHB患者和健康人肠道菌群的差异,探讨肠道菌群对慢性CHB患者疾病的影响。应用SPSS 20.0统计软件进行数据分析,两组性别比较采用χ2检验;两组年龄比较采用成组t检验;计量资料符合正态分布,用![]() 表示;应用Chao1和Shannon指数分析肠道菌群的丰富度和多样性;应用Metastats差异分析肠道菌群的组间差异。P<0.05为差异有统计学意义。
表示;应用Chao1和Shannon指数分析肠道菌群的丰富度和多样性;应用Metastats差异分析肠道菌群的组间差异。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
研究纳入CHB患者60例,其中男性35例,女性25例,年龄(42.35±11.04)岁;健康对照组30例,其中男性15例、女性12例,年龄(41.70±11.46)岁。CHB患者组与健康对照组性别(χ2=0.023,P=0.880)、年龄(t=0.260,P=0.795)差异无统计学意义。
2.2 CHB患者与健康对照者肠道菌群OTU
对测序得到的每一条序列的原始数据进行去接头和低质量过滤处理后,去除嵌合体序列,得到有效序列后再进行聚类分析,每一个聚类称为一个OTU。根据OTU聚类分析结果,CHB组与健康对照组共有644个OTU,CHB组(Z)独有375个OTU,健康对照组(C)独有66个OTU,韦恩图(Venn)见图1。
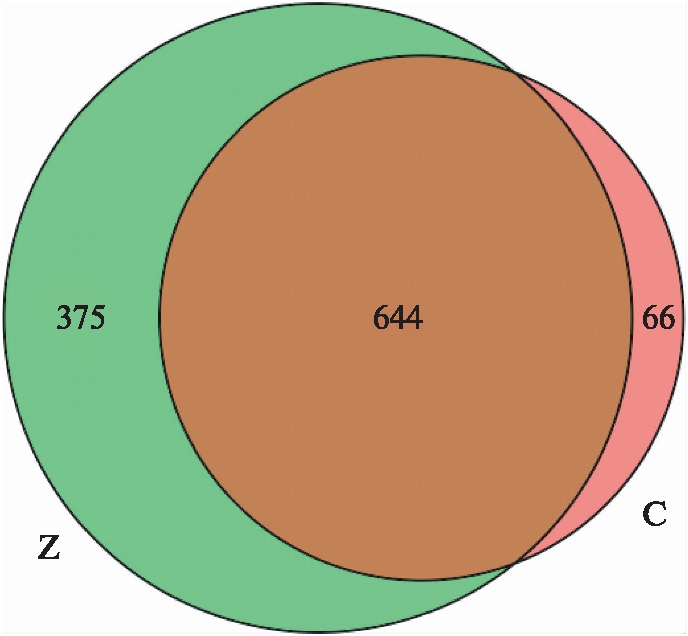
图1 基于OTU的Venn图
Fig.1 Venn diagram of OTU in different groups
健康对照组独有的前10位OTU根据丰度由高到低有: OTU133(p_Bacteroidetes; c_Bacteroidia; o_Bacteroidales; f_Prevotellaceae; g_Alloprevotella)、OTU431(p_Firmicutes; c_Erysipelotrichia; o_Erysi-pelotrichales; f_Erysipelotrichaceae)、OTU485(p_Pro-teobacteria; c_Betaproteobacteria; o_ Burkho-lderiales; f_Alcaligenaceae; g_Sutterella)、OTU284(p_Proteo-bacteria; c_Alphaproteobacteria; o_Rhodospirillales; f_Rhodospirillaceae)、OTU337(p_Bacteroidetes; c_Bacteroidia; o_Bacteroidales; f_Bacteroidaceae; g_Bacteroides)、OTU487(p_Bacteroidetes; c_Bacteroidia; o_Bacteroidales; f_Prevotellaceae; g_Alloprevotella)、OTU396(p_Firmicutes; c_Negativicutes; o_Seleno-monadales; f_Veillonellaceae; g_Mitsuokella)、OTU346(p_Cyanobacteria; c_Melainabacteria; o_Gastra-naerophilales)、OTU286(p_Cyanobacteria;c_Mela-inabacteria;o_Gastranaerophilales)、OTU260(p_Firmi-cutes; c_Clostridia; o_Clostridiales; f_ Clostridiales vadinBB60 group)。
CHB组独有的前10位OTU根据丰度由高到低有: OTU1120(p_Bacteroidetes; c_Bacteroidia; o_Bacteroidales; f_Bacteroidaceae; g_Bacteroides)、OTU592(p_Firmicutes; c_Clostridia; o_Clostri-diales; f_Ruminococcaceae; g_Ruminococcus)、OTU766(p_Bacteroidetes; c_Bacteroidia; o_Bacter-oidales; f_Bacteroidaceae; g_Bacteroides)、OTU658(p_Firmicutes; c_Clostridia; o_Clostridiales; f_Ruminococcaceae; g_Faecalibacterium)、OTU972(p_Bacteroidetes; c_Bacteroidia; o_Bacteroidales; f_Pre-votellaceae; g_Prevotella 9)、OTU801(p_Firmicutes; c_Negativicutes; o_Selenomonadales; f_Veillonellaceae; g_Megamonas)、OTU560(p_Firmicutes; c_Clostridia; o_Clostridiales; f_Lachnospiraceae; g_Blautia)、OTU516(p_Bacteroidetes; c_Bacteroidia; o_Bac-teroidales; f_ Rikenellaceae; g_Rikenellaceae RC9 gut group)、OTU651(p_Actinobacteria; c_Actinobacteria; o_Bifidobacteriales; f_Bifidobacteriaceae; g_Bif-idobacterium)、OTU559(p_Firmicutes; c_Clostridia; o_Clostridiales; f_Lachnospiraceae; g_[Eubacterium] rectale group)。
CHB组OTU数量为(203.00±68.59)个,健康对照组为(230±57.08)个,提示健康对照组物种更丰富,但经独立样本非参数检验分析,差异无统计学意义(P=0.332)。
2.3 CHB患者与健康对照者肠道菌群的丰度
各样本Top的物种分布,分别在 phylum(门)(图2)、class(纲)(图3)、order(目)(图4)、family(科)(图5)、genus(属)(图6)和 species(种)(图7)不同水平上进行分类,统计各样本的相对丰度值,绘制成柱状图。
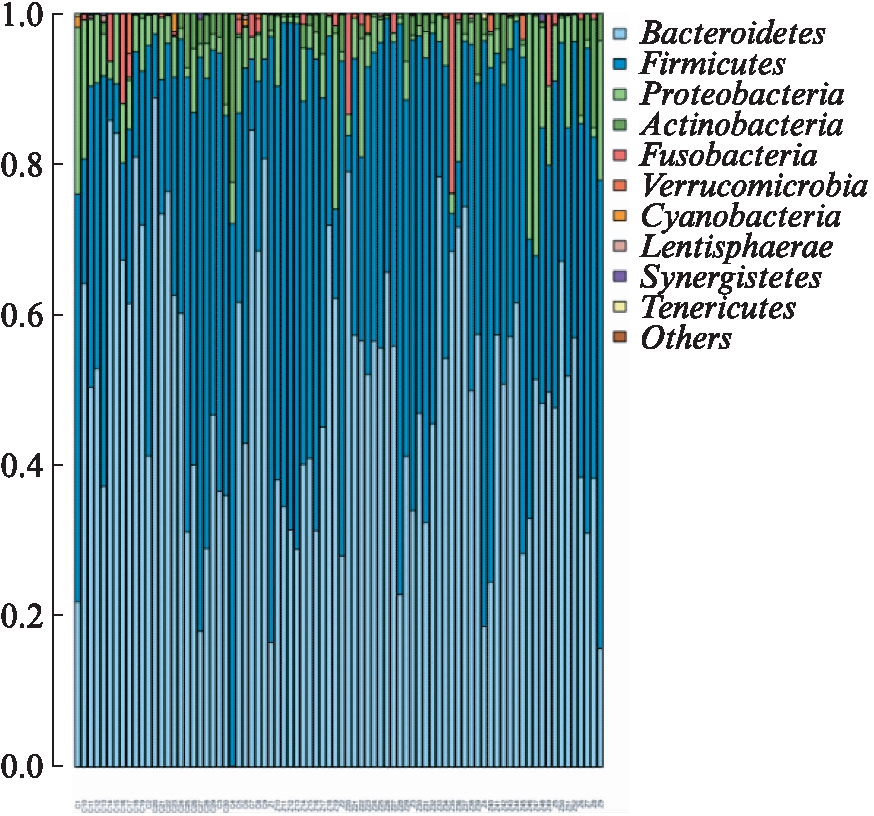
图2 在门水平各样本丰度前10位的肠道菌
Fig.2 At phylum level top 10 species with high abundance in different samples
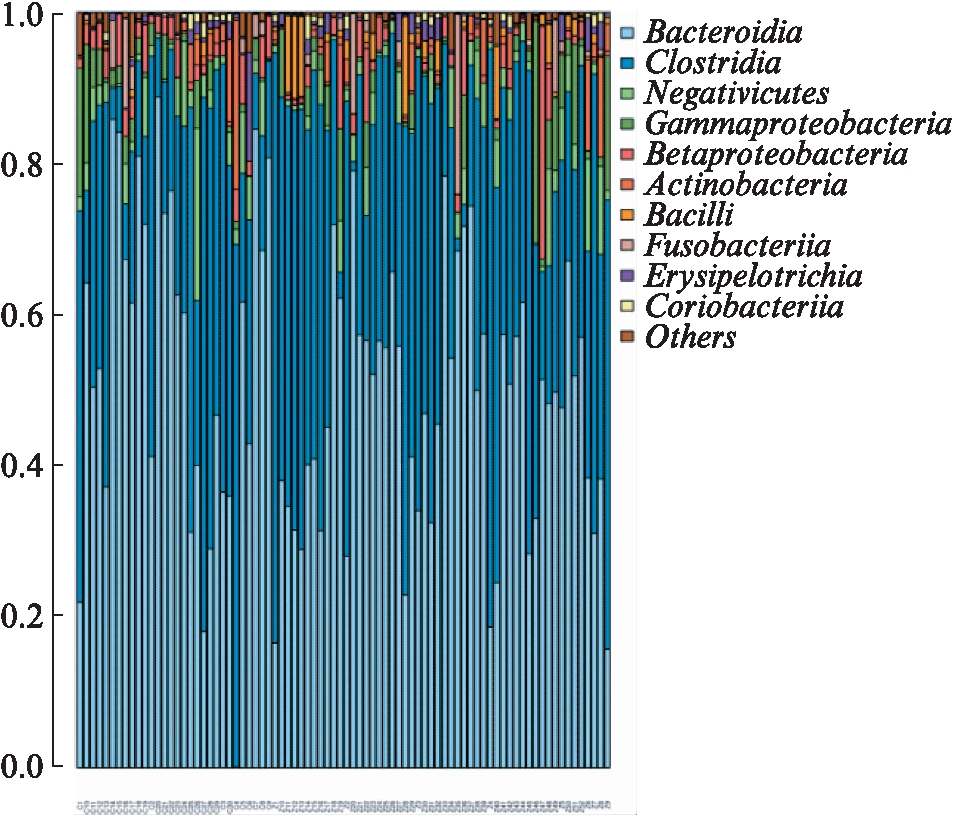
图3 在纲水平各样本丰度前10位的肠道菌
Fig.3 At class level top 10 species with high abundance in different samples

图4 在目水平各样本丰度前10位的肠道菌
Fig.4 At order level top 10 species with high abundance in different samples
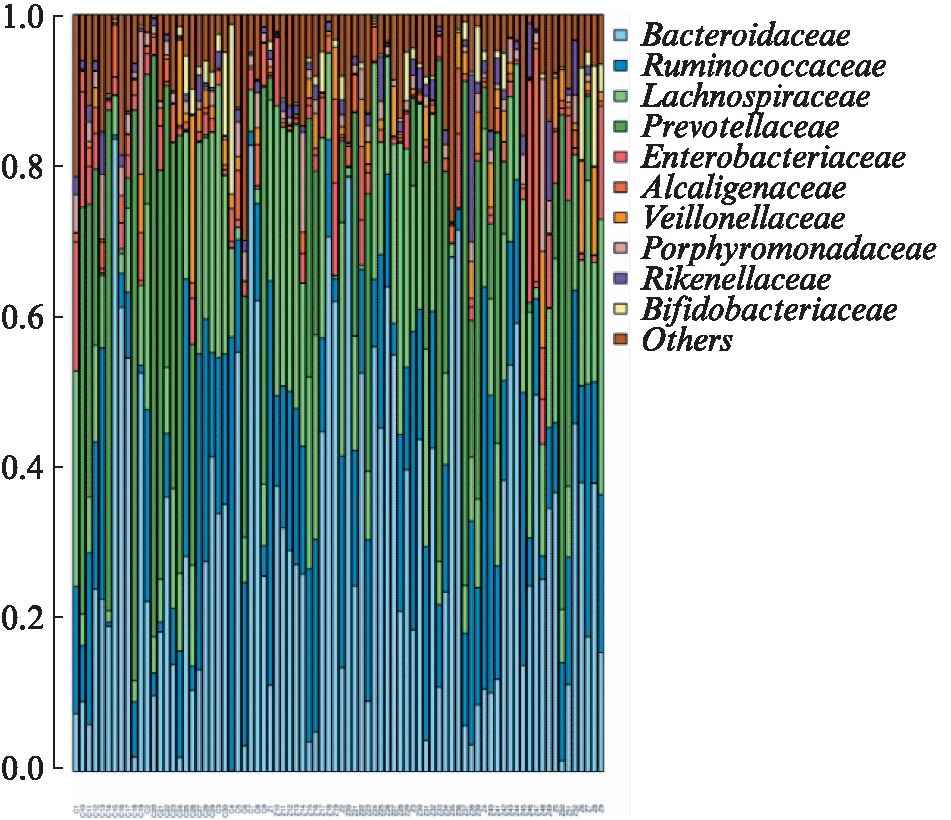
图5 在科水平各样本丰度前10位的肠道菌
Fig.5 At family level top 10 species with high abundance in different samples

图6 在属水平各样本丰度前10位的肠道菌
Fig.6 At genus level top 10 species with high abundance in different samples
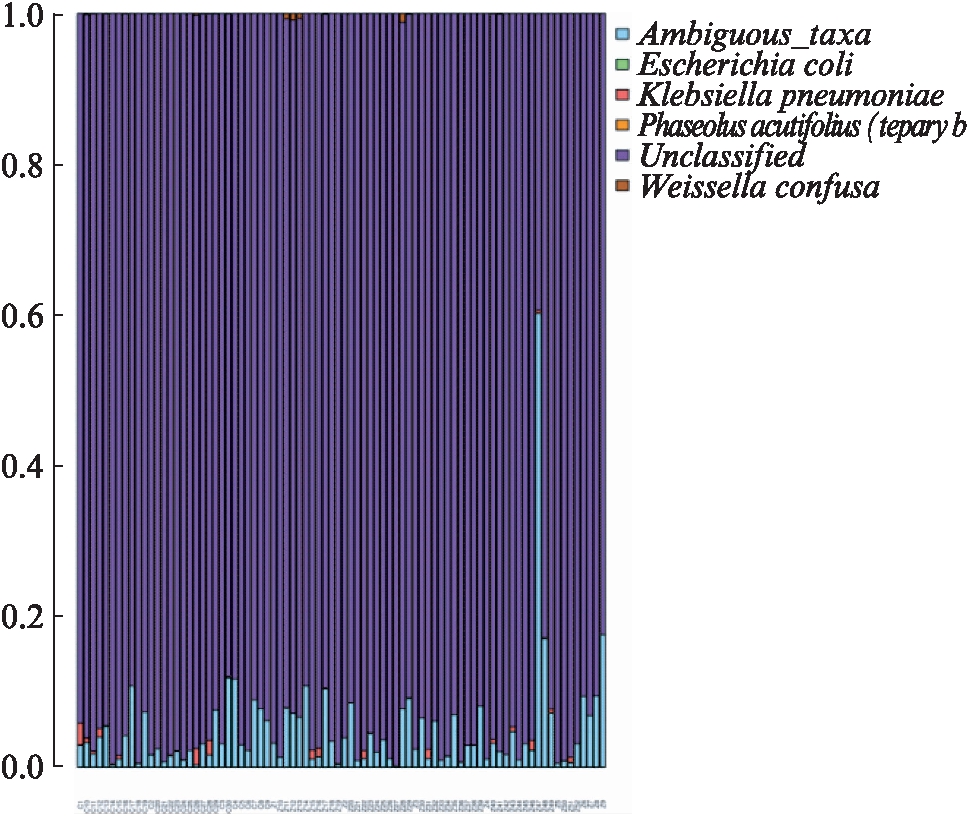
图7 在种水平各样本丰度前6位的肠道菌
Fig.7 At species level top 6 species with high abundance in different samples
2.4 CHB患者与健康对照者肠道菌群α多样性指数分析
α多样性关注单样本的多样性分析,通过统计学指数的分析来估计物种丰富度和多样性。以Chao1和Shannon指数为例,组间差异分析的箱线图分别见图8~9。
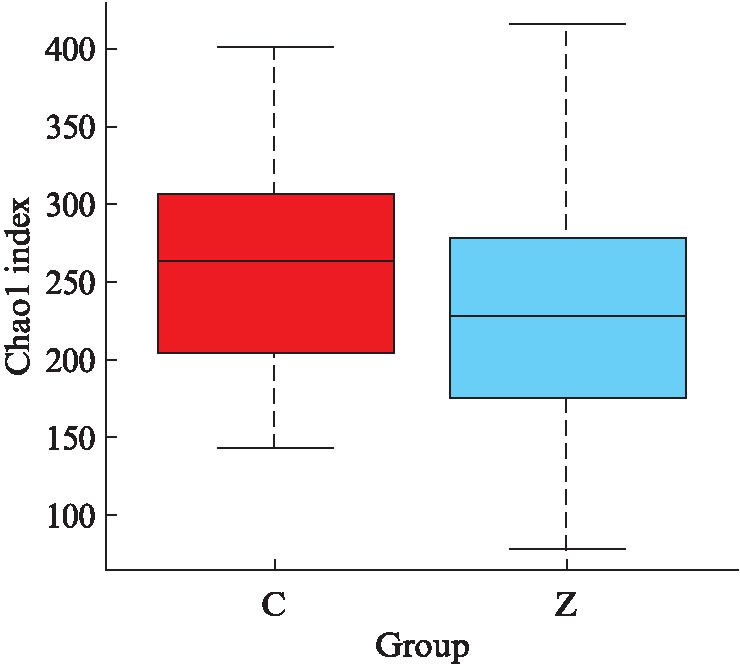
图8 Chao1指数分析肠道菌群组间差异
Fig.8 Chao1 index analysis of intestinal flora in different groups
CHB组(Z)的Chao1指数中位数为228.5,健康对照组(C)的Chao1指数中位数为263.6,表明健康对照组肠道菌群的丰富度更高,见图8。
CHB组(Z)的Shannon指数中位数为4.70,健康对照组(C)的Shannon指数中位数为4.72,表明健康对照组菌群的多样性更丰富,见图9。
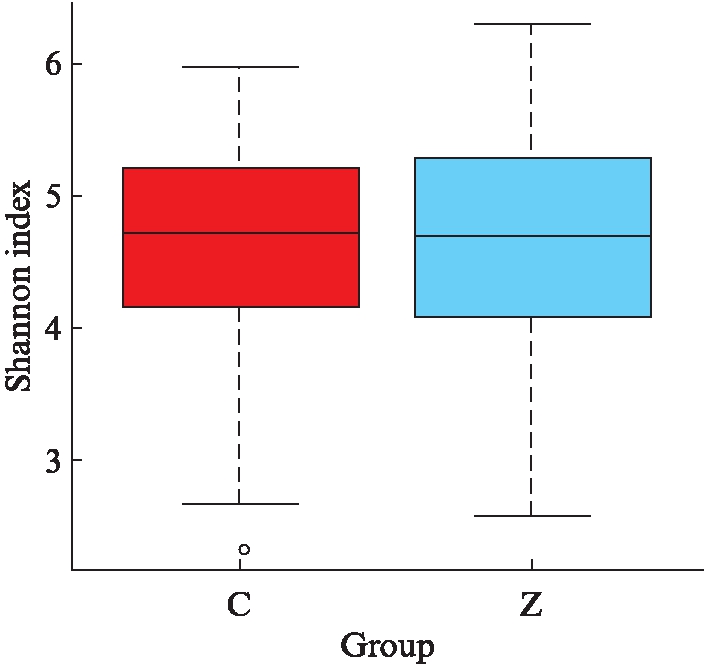
图9 Shannon指数分析肠道菌群组间差异
Fig.9 Shannon index analysis of intestinal flora in different groups
2.5 CHB患者与健康对照者肠道菌群多样性分析Rank-abundance曲线
两组Rank-abundance曲线见图10。在横轴分布上看,健康对照组比CHB组相对较宽,提示健康对照组物种分布较为丰富;从纵轴分布上看,健康对照组曲线分布较CHB组平坦,提示健康对照组物种组成的均匀度相对较高。

图10 不同样本肠道菌群Rank-abundance曲线
Fig.10 Rank-abundance curve of intestinal flora in different samples
2.6 不同分类水平CHB患者与健康对照者肠道菌种分布
在门水平,两组样本菌群均以厚壁菌门(Firmi-cutes)和拟杆菌门(Bacteroidetes)为主;健康对照组出现了独有的浮霉菌门(Planctomycetes);梭杆菌门(Fusobacteria)在CHB患者中有出现且均较健康人体内的数量多,但差异无统计学意义(P=0.875 125)。
在纲水平,CHB组梭菌纲(Clostridia)多于健康对照组,但差异无统计学意义(P=0.078 921);CHB组芽孢杆菌纲(Bacilli)多于健康对照组,且差异有统计学意义(P=0.000 999);健康对照组独有Melainabacteria和OM190,CHB组没有检测到。
在目水平,放线菌目(Actinomycetales)、假单胞菌目(Pseudomonadales)在CHB组中独有,Gastra-naerophilales在健康对照组独有;CHB组乳酸菌目(Lactobacillales)多于健康对照组,且差异有统计学意义(P=0.000 999);CHB组柄杆菌目(Caulo-bacterales)、脱硫弧菌目(Desulfovibrionales)、根瘤菌目(Rhizobiales)少于健康对照组,且差异有统计学意义(依次P=0.000 999、0.045 954、0.000 003 57)。
在科水平,放线菌科(Actinomycetaceae)、丛毛单胞菌科(Comamonadaceae)、莫拉氏菌科(Mora-xellaceae)在CHB组中独有;CHB组叶杆菌科(Phyllobacteriaceae)、柄杆菌科(Caulobacteraceae)、氨基酸球菌科(Acidaminococcaceae)少于健康对照组,且差异有统计学意义(依次P=0.000 003 57、0.000 999、0.039 96);CHB组Defluviitaleaceae、链球菌科(Streptococcaceae)、毛螺菌科(Lachno-spiraceae)多于健康对照组,且差异有统计学意义(依次P=0.000 067 3、0.000 999、0.018 981)。
在属水平,CHB组和健康对照组中都含有较多的拟杆菌属(Bacteroides)、粪杆菌属(Faeca-libacterium)、普氏菌9(Prevotella 9)和罗斯氏菌(Roseburia),但差异无统计学意义(依次P=0.576 424、0.189 81、0.183 816、0.080 919);CHB组独有的属有理研菌属(Rikene-llaceae RC9 gut group)、Intestinibacter、活泼瘤胃球菌属(Ruminococcus gnavus group)、不动杆菌属(Acinetobacter)、Rumi-nococcus gauvreauii group、Flavonifractor、嗜木聚糖真杆菌属(Eubacterium xylanophilum group)、放线菌属(Actinomyces)、代尔夫特菌属(Delftia)、Cateni-sphaera、微单胞菌属(Parvimonas)、韦荣球菌UCG-007(Erysipelotri-chaceae UCG-007);健康对照组独有的属有微生长单胞菌属(Dysgonomonas)、韦荣球菌UCG-004(Erysipelotrichaceae UCG-004)、短真杆菌(Eubacte-rium brachy group)、Faecalicoccus、邻单胞菌属(Plesi-omonas);CHB组毛螺旋菌属UCG-010(Lachnospiraceae UCG-010)、中慢生根瘤菌属(Mesorhizobium)少于健康对照组,且差异有统计学意义(依次P=0.033 966、0.000 003 57);CHB组瘤胃球菌属1(Ruminococcus 1)、伊格尔兹氏菌属(Eggerthella)、毛螺旋菌属NC2004(Lachnosp-iraceae NC2004 group)、毛螺旋菌属FCS020(Lac-hnospiraceae FCS020 group)、梭菌属(Clostridium innocuum group)、Defluviitaleaceae UCG-011、颤杆菌克属(Oscillibacter)、Blautia多于健康对照组,差异有统计学意义(依次P=0.009 99、0.004 995、0.030 969、0.0119 88、0.027 972、0.000 067 3、0.000 969、0.019 98)。
2.7 CHB患者与健康对照者肠道菌群聚类分析
使用非加权配对算术平均法(UPGMA)聚类法,基于Brary-Curtis距离矩阵,构建进化树,进行PCoA(Principal Co-ordinates Analysis)分析,结果显示;样本各自聚集,区分良好,两组间仅少数样本交叉,但CHB组有8个样本偏离较大,独自聚集,菌群离散度与健康对照组相比更大。提示CHB患者总体菌群结构与健康对照组有显著差异,不同个体间肠道菌群离散程度显著,菌群结构个体差异大,而健康对照组菌群结构个体差异较小,见图11。

图11 不同样本肠道菌群PcoA分析
Fig.11 PCoA analysis of intestinal flora in different samples
2.8 CHB患者与健康对照者肠道菌群组间差异分析
两组Metastats差异分析见图12: 目水平差异最大且具有统计学意义的5个菌种是Rhizobiales、Caulobacterales、Gastranaerophilales、Lactobacillales、Actinomycetales(依次P=0.000 003 57、0.000 999 001、0.000 999 001、0.000 999 001、0.007 992 008),见图12。
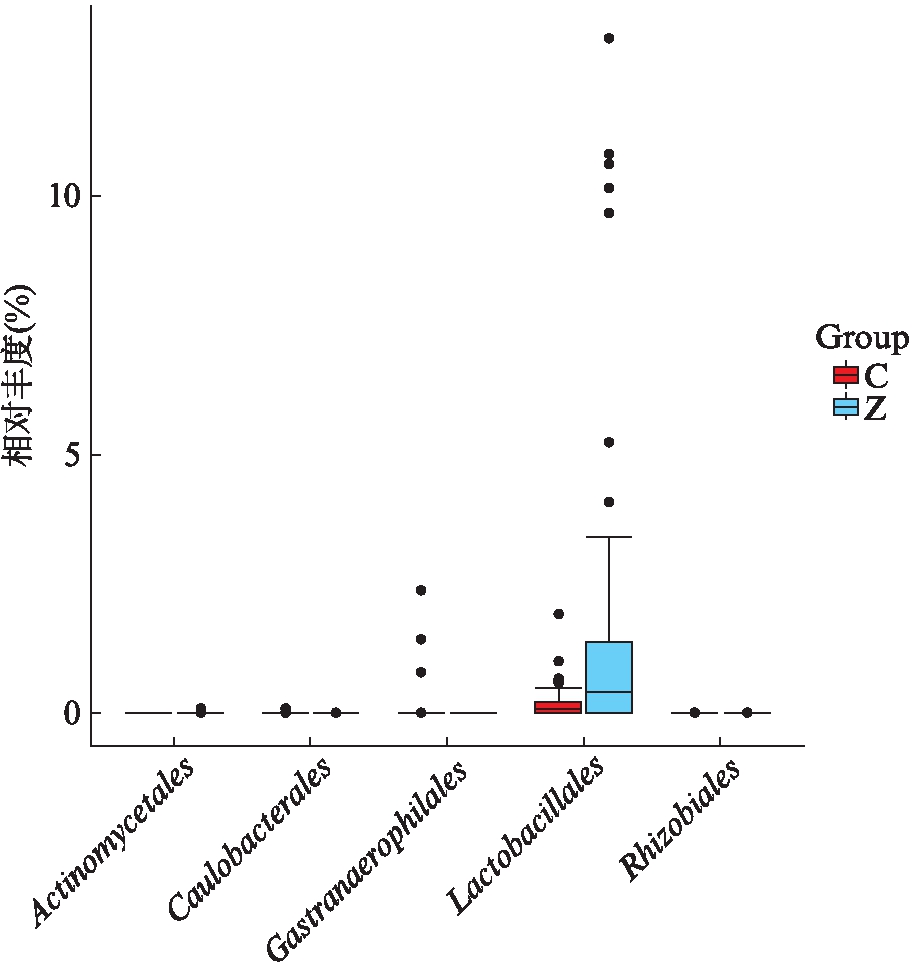
图12 Metastats分析肠道菌群组间差异
Fig.12 Metastats analysis of intestinal flora in different groups
3 讨 论
据估计全世界有3.5亿慢性乙肝病毒携带者[3],CHB是全球最常见的传染病之一。HBV感染者不同的临床结局是病毒、宿主及环境相互作用所致。宿主因素包括感染病毒时的年龄、性别、个人行为、宿主遗传因素及肠道微生态等[4]。
肠道和肝脏有共同的胚胎起源——前肠,肠道淋巴细胞起源于发育中的肝脏,成熟后通过门静脉和胆道系统相互关联。肝脏和肠道在解剖和生物学功能上存在密不可分的联系。肠道微生物群在宿主代谢和免疫调节中发挥着重要作用。肠道微生态与疾病的关系正受到越来越多的关注[5-6]。
研究[7-19]表明,CHB与肠道微生物群的失调有关,并将焦点集中于肠-肝轴,认为肠道微生物群的结构变化、细菌易位和免疫损伤会影响肝脏炎症的发生发展。肠道菌群失调会导致肝功能异常、肝脂肪变性和结缔组织重塑等慢性肝病进展,其中有炎症介质、细胞因子、氧化应激、线粒体功能紊乱等参与[20]。
有研究[21]入组85名低Child-Pugh scores CHB患者及20名健康对照,发现与对照组比较,CHB组菌群有以下变化: 5个OTU增加,包括Actinomyces、Clostridium sensu stricto、unclassified Lachnospiraceae和Megamonas;27个OTU减少,包括Alistipes、Asacc-harobacter、Bacteroides、Butyricimonas、Clostridium IV、Escherichia/Shigella、Parabacteroides、Ruminococcus、unclassified Bacteria、unclassified Clostridiales、Unc-lassified Coriobacteriaceae、unclassified Enterobacte-riaceae、unclassified Lachnospiraceae和unclassified Ruminococcaceae等。另有研究[22]表明,柔嫩梭菌、粪肠球菌、肠杆菌、双歧杆菌和乳酸菌,在乙肝后肝硬化患者肠道中有明显变异。双歧杆菌和肠杆菌科B/E值,从健康对照组(1.15±0.11)、无症状携带者(0.99±0.09),CHB患者(0.76±0.08)、肝硬化失代偿患者(0.64±0.09),依次显著降低(P<0.01)。
传统的微生物鉴定方法常难以鉴定众多习性复杂的微生物。16s rDNA扩增子测序技术通过特异性引物扩增样本中原核生物16s rDNA的可变区特征性核苷酸序列,构建高通量测序文库并对16s rDNA可变区序列进行分析,从而鉴定样本中细菌的多样性与丰度。本研究应用16s rDNA扩增子测序技术,对CHB患者和健康对照者粪便样本进行DNA提取与质检、PCR扩增、产物纯化、文库制备与检测、高通量测序,比较CHB患者和健康人肠道菌群的差异。
本研究结果显示: 在门水平,两组样本菌群均以Firmicutes和Bacteroidetes为主;健康对照组出现了独有的Planctomycetes。在纲水平,健康对照组独有Melainabacteria和OM190;Bacilli在CHB组较健康对照组多(P<0.05)。在目水平,Actinomyce-tales、Pseudomonadales在CHB组中独有;Gastran-aerophilales在健康对照组独有; Lactobacillales在CHB组多于健康对照组(P<0.05);Caulobac-terales、Desulfovibrionales、Rhizobiales在CHB组少于健康对照组(P<0.05)。在科水平,Actinomyceta-ceae、Comamonadaceae、Moraxellaceae在CHB组中独有;Phyllobacteriaceae、Caulobacteraceae、Acidami-nococcaceae在CHB组少于健康对照组(P<0.05);Defluviitaleaceae、Streptococcaceae、Lachnospiraceae在CHB组多于健康对照组(P<0.05)。在属水平,CHB组独有12个属,健康对照组独有5个属; CHB组Lachnospiraceae UCG-010、Mesorhizobium少于健康对照组(P<0.05);CHB组Ruminococcus 1、Egg-erthella、Lachnospiraceae NC2004 group、Lachnospir-aceae FCS020 group、Clostridium innocuum group、Deflu-viitaleaceae UCG-011、Oscillibacter、Blautia多于健康对照组(P<0.05)。本研究结果说明,与健康对照比较,CHB肠道菌群的丰富度、多样性、均匀度均下降;CHB肠道菌群个体差异大,健康对照组个体差异较小;在不同分类水平,CHB组和健康对照组有各自独有的肠道菌种和差异菌。
CHB病毒导致感染以及肝硬化和肝癌的机制尚未完全明确。越来越多研究表明[23],肠道菌群能调节免疫,保护机体免受肝炎病毒感染。肠道菌群的潜在免疫作用为乙肝病毒感染的发病机制提供了新的研究方向。研究慢乙肝患者肠道菌群的改变,可能为慢乙肝的功能性治愈提供潜在有效的靶向治疗手段。但肠道微生态纷繁复杂,临床研究需要投入大量时间和精力,影响因素较多,数据分析繁琐,要进一步阐明其作用机制和管理策略,尚需深入研究和大样本的随机对照临床研究。
[1] MARSHALL J C. The gut as a potential trigger of exercise-induced inflammatory responses[J]. Can J Physiol Pharmacol, 1998,76(5): 479-484.
[2] 中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2015年更新版)[J].临床肝胆病杂志,2015,31(12): 1941-1960.
[3] KANG Y, CAI Y. Gut microbiota and hepatitis-B-virus-induced chronic liver disease: implications for faecal microbiota transplantation therapy[J]. J Hosp Infect, 2017,96(4): 342-348.
[4] 邢卉春.影响慢性乙型肝炎病毒感染临床结局的宿主因素[J] . 中华肝脏病杂志,2017,25(7): 495-499.
[5] 余超,王贞.肠黏膜屏障与慢性肾脏病关系的研究进展[J].同济大学学报(医学版),2018,39(6): 124-128.
[6] KOH J C, LOO W M, GOH K L, et al. Asian consensus on the relationship between obesity and gastrointestinal and liver diseases[J]. J Gastroenterol Hepatol, 2016,31(8): 1405-1413.
[7] FU Z D, CUI J Y. Remote sensing between liver and intestine: importance of microbial metabolites[J]. Curr Pharmacol Rep, 2017,3(3): 101-113.
[8] DEROVS A, LAIVACUMA S, KRUMINA A. Targeting microbiota: what do we know about it at present?[J]. Medicina(Kaunas), 2019,55(8): E459.
[9] MILOSEVIC I, VUJOVIC A, BARAC A, et al. Gut-liver axis, gut microbiota, and its modulation in the management of liver diseases: a review of the literature[J]. Int J Mol Sci, 2019,20(2): E395.
[10] YANG R L, XU Y, DAI Z F, et al. The immunologic role of gut microbiota in patients with chronic HBV infection[J]. J Immunol Res, 2018,2018: 2361963.
[11] HOU X, HAO X L, ZHENG M J, et al. CD205-TLR9-IL-12 axis contributes to CpG-induced oversensitive liver injury in HBsAg transgenic mice by promoting the interaction of NKT cells with Kupffer cells[J]. Cell Mol Immunol, 2017,14(8): 675-684.
[12] TSAI K N, KUO C F, OU J J. Mechanisms of hepatitis B virus persistence[J]. Trends Microbiol, 2018,26(1): 33-42.
[13] CABALLERO S, PAMER E G. Microbiota-mediated inflammation and antimicrobial defense in the intestine[J].Annu Rev Immunol, 2015,33: 227-256.
[14] EGRESI A, LENGYEL G, SOMOGYI A, et al. Various pathways leading to the progression of chronic liver diseases[J]. Orv Hetil, 2016,157(8): 290-297.
[15] MILOSEVIC I, VUJOVIC A, BARAC A, et al. Gut-liver axis, gut microbiota, and its modulation in the management of liver diseases: a review of the literature[J]. Int J Mol Sci, 2019, 20(2): E395.
[16] HAGYM SI K, BACS
SI K, BACS RDI A, EGRESI A, et al. The role of gut microbiota in chronic liver diseases, and treatment possibilities[J]. Orv Hetil, 2018,159(36): 1465-1474.
RDI A, EGRESI A, et al. The role of gut microbiota in chronic liver diseases, and treatment possibilities[J]. Orv Hetil, 2018,159(36): 1465-1474.
[17] WOODHOUSE C A, PATEL V C, SINGANAYAGAM A, et al. Review article: the gut microbiome as a therapeutic target in the pathogenesis and treatment of chronic liver disease[J]. Aliment Pharmacol Ther, 2018,47(2): 192-202.
[18] YANG R L, XU Y, DAI Z F, et al. The immunologic role of gut microbiota in patients with chronic HBV infection[J]. J Immunol Res, 2018,2018: 2361963.
[19] DEROVS A, LAIVACUMA S, KRUMINA A. Targeting microbiota: what do we know about it at present?[J]. Medicina(Kaunas), 2019,55(8): E459.
[20] EGRESI A, LENGYEL G, SOMOGYI A, et al. Various pathways leading to the progression of chronic liver diseases[J]. Orv Hetil, 2016,157(8): 290-297.
[21] WANG J, WANG Y, ZHANG X, et al. Gut microbial dysbiosis is associated with altered hepatic functions and serum metabolites in chronic hepatitis B patients[J]. Front Microbiol, 2017,8: 2222. DOI: 10.3389/fmicb.2017.02222.
[22] LU H, WU Z, XU W, et al. Intestinal microbiota was assessed in cirrhotic patients with hepatitis B virus infection. Intestinal microbiota of HBV cirrhotic patients[J]. Microb Ecol, 2011,61(3): 693-703.
[23] XU D, HUANG Y, WANG J. Gut microbiota modulate the immune effect against hepatitis B virus infection[J]. Eur J Clin Microbiol Infect Dis, 2015,34(11): 2139-2147.