甘草是东西方最古老、最常用的草本植物之一[1]。世界分布着30种甘草,亚洲是其中的中心区域[2]。它广泛分布在伊朗、印度、哈萨克斯坦、俄罗斯、阿富汗、塔吉克斯坦、西班牙和吉尔吉斯斯坦[3]。目前,从甘草属植物中分离得到的化合物有数百种,包括三萜皂苷、黄酮类、香豆素、生物碱等,具有保肝、抗炎、解毒等多种生物活性[4-5]。
个体衰老是一个复杂的过程,在这一过程中衰老细胞在组织中逐渐积累,继而导致组织功能受损[6]。细胞衰老在多种生物学过程中发挥了重要的作用,是研究衰老的非常重要的切入点。许多研究表明,成体干细胞在维持机体健康和预防年龄相关疾病方面发挥着关键作用,但是它们的年代性退化导致其再生能力受损[7]。人脂肪间充质干细胞(human adipose-derived stem cells, hADSCs)是一种成人间充质干细胞,具有与高度复制的骨髓源性干细胞(bone marrow-derived stem cells, BMSCs)相似的分化特性[8-9]。在研究和治疗应用方面,hADSCs比其他干细胞具有多种优势。首先,hADSCs易于从皮下脂肪组织中分离,产量高,体外培养容易膨胀。其次,随着年龄的增长,hADSCs的浓度和增殖率始终保持不变[10]。但其仍有一些不足之处,如干细胞自身具有局限性,随着年龄增长,ADSCs的增殖和分化活力可能有所下降[11],这就限制了hADSCs的实际应用。本研究使用体外试验来探究乌拉尔甘草、光果甘草和胀果甘草中的共有活性物质甘草酸(GA)、甘草苷(LQ)、异甘草苷(ILQ)、芹糖甘草苷(LA)和芹糖异甘草苷(ILA)的抗衰老作用。
1 材料与方法
1.1 材料与仪器
DMEM/F-12、胎牛血清、非必需氨基酸(NEAA)购自Gbico公司;倒置荧光显微镜购自尼康公司;细胞计数板购自Hausser Scientific公司;多功能酶标仪购自Molecular Devices公司;各种细胞培养器皿购自Corning公司;甘草酸、甘草苷、异甘草苷、芹糖甘草苷、芹糖异甘草苷购自同田生物公司;细胞周期与细胞凋亡检测试剂盒、细胞衰老β-半乳糖苷酶染色试剂盒购自碧云天公司;DNA提取试剂盒购自天根公司;成骨诱导分化培养基试剂盒、成脂诱导分化培养基试剂盒购自Cyagen公司;细胞ROS检测试剂盒购自Sigma公司;CCK-8试剂盒购自日本同仁公司;hADSCs来自本实验室。
1.2 CCK8法和Ki67染色检测甘草中活性物质对hADSCs增殖的影响
将hADSCs消化处理后制成细胞悬液,计数,调整细胞密度为5×104个/mL,在透明96孔板中加入100 μL细胞悬液;在CO2培养箱中孵育过夜,使细胞贴壁;吸弃原培养基,并加入不同浓度梯度药物培养基,以正常培养基作为对照组,每组设有6个复孔,CO2培养箱孵育24 h;吸弃药物培养基,加入含10% CCK8的培养基;CO2培养箱孵育1~2 h,测定450 nm处D450值,计算细胞活力=(实验孔-空白孔)/(对照孔-空白孔) × 100%。
将hADSCs接种在24孔板里,贴壁后去除原培养基,加入药物培养基培养一段时间;之后吸弃培养基,多聚甲醛固定液进行固定,并进行Ki67和DAPI染色。利用Image J进行统计,计算Ki67阳性细胞百分比。
1.3 RNA提取以及p16INK4a、p21、p53基因表达量检测
将hADSCs种在6孔板里,贴壁后去除原培养基,加入药物培养基培养一段时间;之后吸弃培养基,用PBS清洗3~4次,加入700 μL TRIzol,放在摇晃机上缓慢摇5 min;加入200 μL氯仿,振荡混匀,室温放置10 min,4 ℃,12 000×g,离心10 min,吸取上清液至另1离心管;加300 μL异丙醇,混匀,-20 ℃ 放置30 min,4 ℃,12 000×g,离心30 min,弃上清液;用75%乙醇清洗2~3次,吹干。反转成cDNA,检测p16、p21、p53的表达,以β-actin为内参,引物序列见表1。PCR反应体系及程序如下。
表1 人p16、p21、p53、β-actin引物序列
Tab.1 Primers of human p16, p21, p53 and β-actin

基因上游引物下游引物p16INK4a5'-ACCAGAGGCAG-TAACCATGC-3'5'-CCTGTAGGACC-TTCGGTGAC-3'p215'-GCAGACCAGCA-TGACAGATTT-3'5'-GGATTAGGGCT-TCCTCTTGGA-3'p535'-CCGCAGTCAGA-TCCTAGCG-3'5'-AATCATCCATT-GCTTGGGACG-3'β-actin5'-AGAAAATCTGG-CACCACACC-3'5'-GGGGTGTTGAA-GGTCTCAAA-3'
qRT-PCR体系: 在10 μL体系中,加入cDNA 1 μL,10×上下游引物各0.25 μL,2×SYBR Green 5 μL,最后加水3.5 μL。qRT-PCR程序同文献[12]。
1.4 ROS检测
将hADSCs消化处理后制成细胞悬液,计数;调整细胞密度为5×104个/mL,在不透明96孔板中加入100 μL细胞悬液;在CO2培养箱中孵育过夜,使细胞贴壁;吸弃原培养基,加入适宜浓度的药物培养基,等待24 h;将ROS培养基提前拿出,从-20 ℃恢复至室温,配制mix,将药物培养基吸弃,配好的mix在96孔板中加入100 μL,在CO2培养箱中培养0.5~1 h;使用酶标仪测荧光量(λex=640/λem=675 nm)。
1.5 RNA测序
对每个样本进行独立且一致的RNA测序。在6孔板培养细胞,并加以活性物质处理,24 h后吸弃培养基,用PBS冲洗2~3次,加700 μL TRIzol提取总RNA,并进行测序。使用bowtie-2将Clean reads与内参基因序列比对,计算每个样本的基因表达水平。DEGseq法进行差异基因表达检测。统计结果以ma-plot法为基础。随机抽取样本中获得的特定基因reads数,根据正态分布计算p值,并修正为q值。为提高差异基因表达检测的准确性,筛选差异倍数在2倍以上且q值≤0.001的基因,定义为差异表达显著的基因。测序数据可以根据需要联系通讯作者,予以提供。
1.6 统计学处理
本研究统计学方法均采用软件Graphpad Prism 5.0,数据由![]() 表示。两组之间采用t检验分析处理数据。P<0.05为差异有统计学意义。
表示。两组之间采用t检验分析处理数据。P<0.05为差异有统计学意义。
2 结 果
2.1 5种活性物质对hADSCs增殖的影响
利用CCK8法并设置10个不同浓度来研究不同物质作用于hADSCs增殖的最佳浓度。甘草酸、甘草苷、异甘草苷、芹糖甘草苷、芹糖异甘草苷在ROS以及端粒相对长度的测定等实验中的所使用浓度分别是3.125、3.125、3.125、3.125、6.25 μmol/L,见图1。

图1 不同浓度下活性物质对hADSCs的影响
Fig.1 Effects of active substances at different concentrations on hADSCs
A: 甘草酸;B: 甘草苷;C: 异甘草苷;D: 芹糖甘草苷; E: 芹糖异甘草苷;A、B、C、D、E中横坐标浓度为μmol/L
采用上述物质相对应的适宜浓度对hADSCs进行培养,并进行Ki67染色,结果显示,甘草酸处理后Ki67阳性细胞极显著增加(P<0.001);甘草苷和芹糖异甘草苷处理后Ki67阳性细胞显著增加(P<0.01);异甘草苷和芹糖甘草苷处理后Ki67阳性细胞显著增加(P<0.05),见图2。
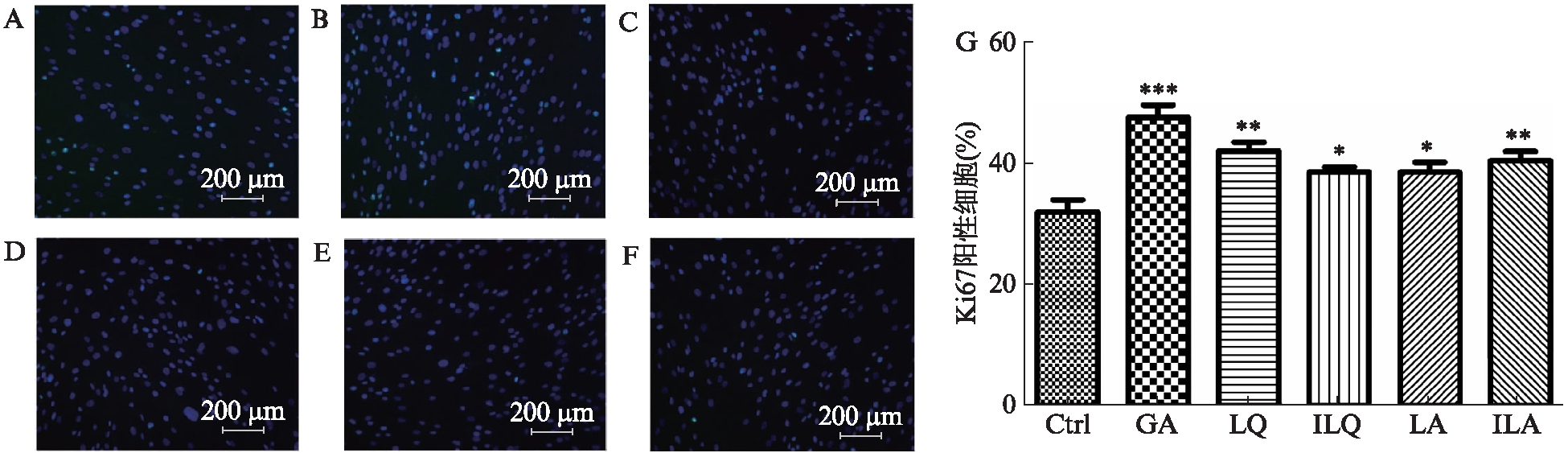
图2 活性物质处理对hADSCs中Ki67阳性细胞数目的影响
Fig.2 Effect of active substance treatment on the number of Ki67-positive hADSCs
A-F: Ki67染色图;A: 甘草酸;B: 甘草苷;C: 异甘草苷;D: 芹糖甘草苷; E: 芹糖异甘草苷;G: Ki67阳性细胞数目统计
2.2 5种活性物质对hADSCs中β-半乳糖苷酶的影响
衰老细胞通常体积变大,并表达在pH=6.0时有高酶活性的β-半乳糖苷酶。细胞衰老也被认为是生物体抑制肿瘤的一种方式,同时也是生物体老化的一种潜在原因。甘草酸等5种化合物可显著降低衰老细胞比例(P<0.001),药物处理使衰老细胞比例由17%下降至10%及10%以下。其中甘草酸、甘草苷、异甘草苷和芹糖异甘草苷的抗衰老能力更强,见图3。
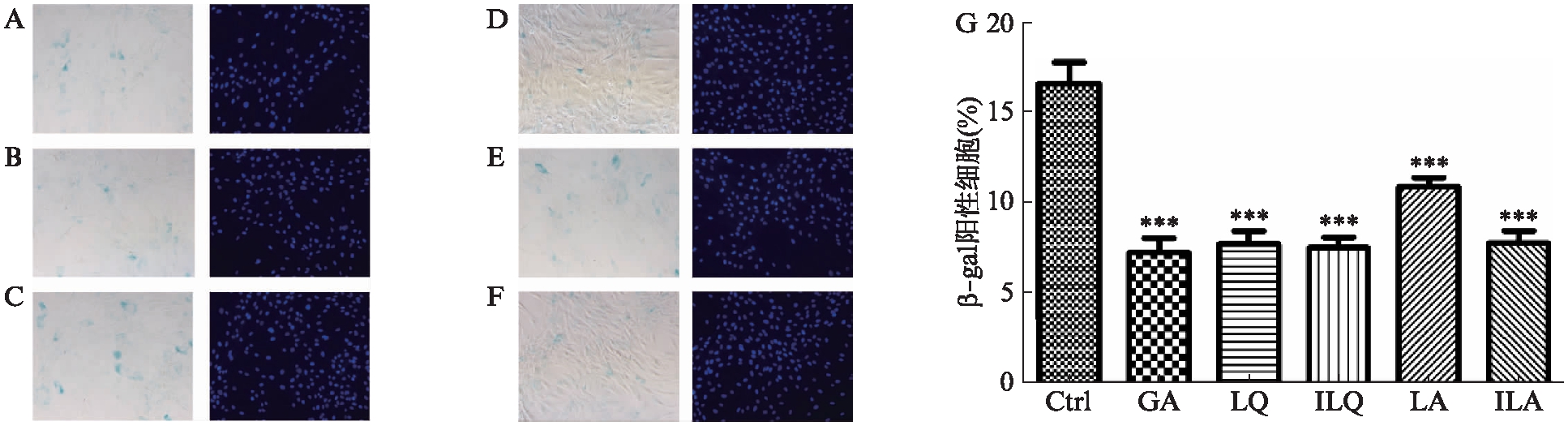
图3 活性物质处理对hADSCs细胞β-半乳糖苷酶阳性细胞数目的影响
Fig.3 Effect of active substance treatment on the number of β-galactosidase positivehADSCs
A~F: β-半乳糖苷酶染色图;A: 对照;B: 甘草酸;C: 甘草苷;D: 异甘草苷;E: 芹糖甘草苷; F: 芹糖异甘草苷;G: β-半乳糖苷酶阳性细胞数目柱状统计图
2.3 5种活性物质对hADSCs内ROS产生的影响
线粒体作为细胞呼吸、物质氧化的重要场所,细胞内约90% ATP来源于线粒体[13];线粒体也是细胞内ROS生成的主要场所,而ROS是影响干细胞衰老的重要因素[14]。利用ROS试剂盒检测hADSCs内ROS水平,经芹糖甘草苷处理后细胞内ROS水平差异无统计学意义(P>0.05),异甘草苷处理后细胞内ROS水平显著下降(P<0.01),甘草酸、甘草苷以及芹糖异甘草苷处理后细胞内ROS水平极显著下降(P<0.001),见图4。
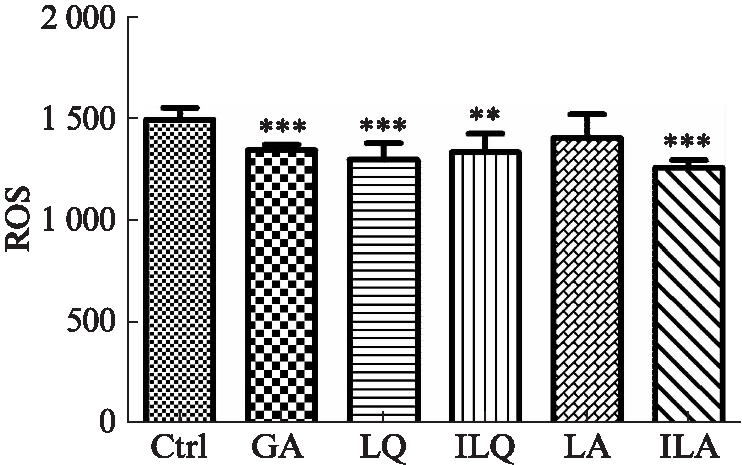
图4 活性物质处理对hADSCs内ROS的影响
Fig.4 Effect of active substance treatment on reactive oxygen species in hADSCs
2.4 5种活性物质对hADSCs细胞周期的影响
分裂活跃的细胞中S和G2的比例很高,而G1期细胞则相对比较小。在经化合物处理24 h后,细胞周期结果显示,甘草酸、异甘草苷和芹糖甘草苷处理下,对细胞周期无影响(P>0.05)。芹糖异甘草苷能使处在G1期的细胞比例减少(P<0.05),但其并未使处于S期和G2期的细胞比例增加(P>0.05)。甘草苷能使G1期比例有减少趋势,但差异不存在统计学意义,并能使S期增加,但G2期细胞与对照无差异,但从S+G2期来看,甘草苷能使处在S和G2期细胞比例略微增加,但同样不存在差异性(P>0.05),见图5。
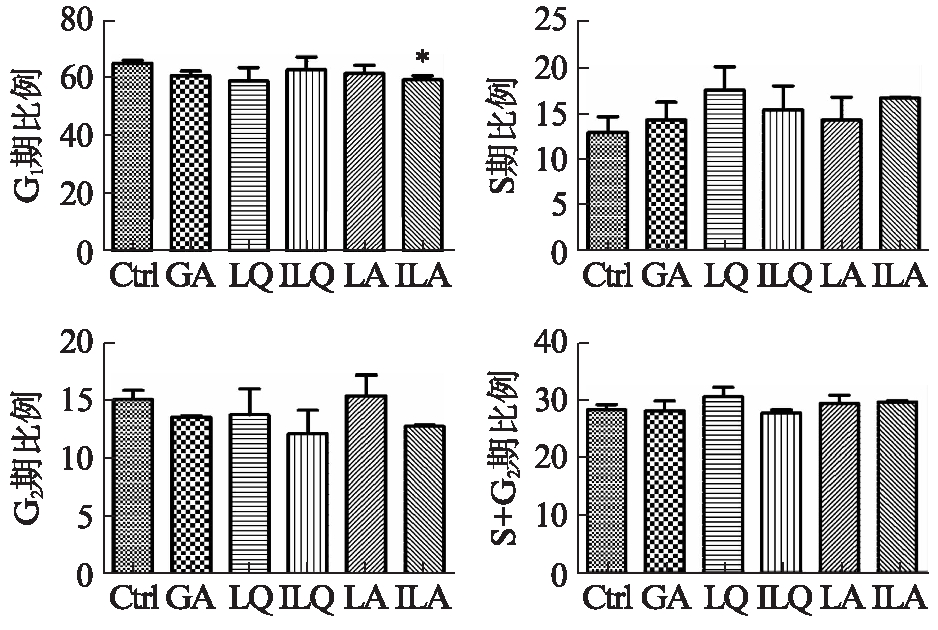
图5 活性物质处理对hADSCs细胞周期的影响
Fig.5 Effect of active substance treatment on cell cycle of hADSCs
2.5 5种活性物质对hADSCs内p16INK4a、p21、p53基因表达的影响
p16INK4a和p21是细胞周期蛋白激酶抑制剂家族的成员之一,它可以抑制CDK复合物的形成,从而导致细胞周期阻滞和凋亡[15]。5种化合物处理后测定hADSCs内p16INK4a、p21、p53基因的表达量。5种化合物处理1天时甘草酸、甘草苷以及芹糖异甘草苷能使p16INK4a基因表达量降低(分别为P<0.05、P<0.01、P<0.05)。然而5种化合物处理对p21、p53基因表达量无显著性差异(P>0.05),见图6。
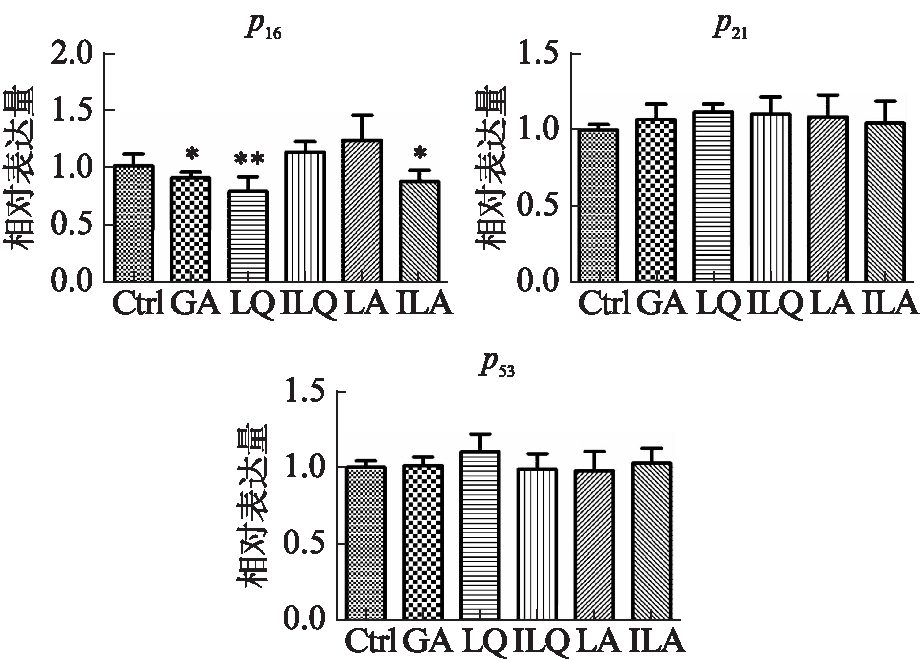
图6 活性物质处理对hADSCs内p16、p21、p53基因表达量的影响
Fig.6 Effect of active substance treatment on the expression of p16, p21 and p53 genes in hADSCs
2.6 5种活性物质对hADSCs端粒相对长度的影响
大多数人类细胞的端粒在体内衰老过程中也会缩短,这表明端粒长度可能是衰老和与年龄相关的发病率的生物标志物[16]。在经化合物处理24 h后,测量hADSCs端粒长度变化。甘草苷和异甘草苷处理后端粒相对长度与对照相比极显著增加(P<0.001),甘草酸处理后端粒长度与对照相比显著增加(P<0.01),见图7。
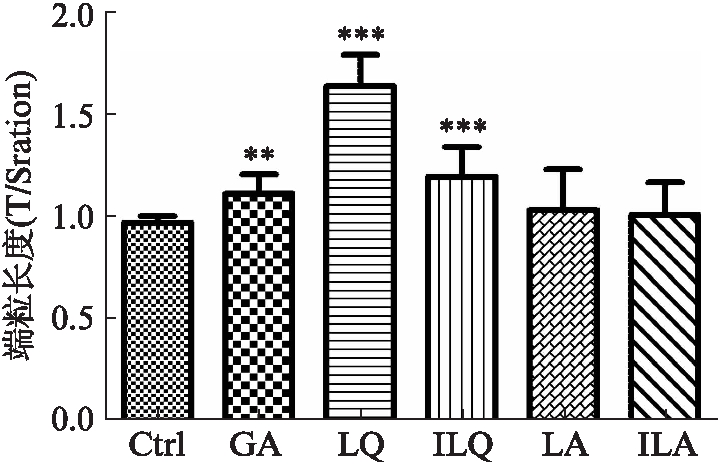
图7 活性物质处理对hADSCs端粒相对长度的影响
Fig.7 Effect of active substance treatment on relative telomere length of hADSCs
2.7 甘草酸、甘草苷以及芹糖异甘草苷对hADSCs定向分化的影响
以上实验基础上,挑选了甘草酸、甘草苷及芹糖异甘草苷等3种化合物进行hADSCs的定向分化。在hADSCs的成脂分化中,发现3种化合物都能使成脂率降低(P<0.001),见图8A。在hADSCs的成骨分化中,茜素红染色后发现甘草酸和芹糖异甘草苷能促进成骨分化的能力,见图8C、 图8E;而甘草苷则对成骨分化没有明显变化,见图8D。

图8 活性物质处理对hADSCs成脂成骨分化的影响
Fig.8 Effect of active substance treatment on adipogenic and osteogenic differentiation of hADSCs
A~E为成脂分化诱导示意图及统计柱状图(B: 对照;C: GA;D: LQ;E: ILA);F~I为成骨分化诱导染色图(F: 对照;G: GA;H: LQ;I: ILA)
2.8 甘草酸、甘草苷以及芹糖异甘草苷处理hADSCs后测序结果
在以上实验基础上,挑选了甘草酸、甘草苷以及芹糖异甘草苷三种化合物处理后的细胞进行测序。
在RNA-seq分析中,甘草酸处理后与对照相比有317个差异基因,其中上调基因有153个,下调基因有164个。对差异基因进行了KEGG通路富集气泡分析,发现差异基因通路富集在抗原加工提呈、人类巨细胞病毒感染以及原发性免疫缺陷等。并对抗原加工提呈中的差异基因进行热图分析,发现甘草酸处理后hADSCs中CD8a的表达量增加,见图9。
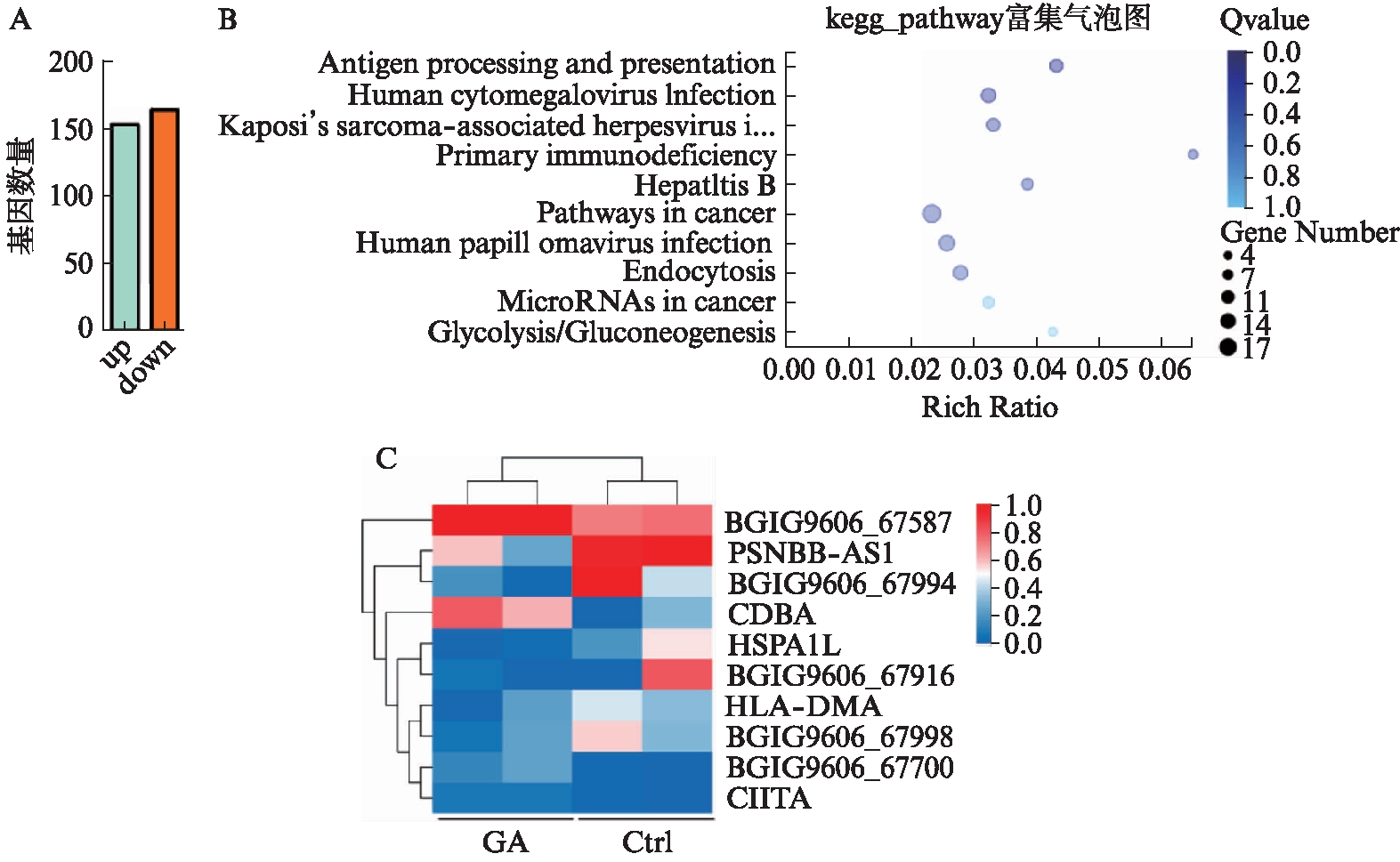
图9 甘草酸测序结果分析
Fig.9 The RNA-seq results of GA and control hADSCs
A: 差异基因数目;B: KEGG通路富集分析气泡图;C: 抗原加工提呈热图分析
在甘草苷处理hADSCs后与对照相比差异基因共有322个,其中上调基因有155个,下调基因有167个。对差异基因进行了KEGG通路富集气泡分析,发现这些基因与疟疾及一些生物合成相关,见图10。在这些通路中,还看到甘草苷处理可影响糖酵解和MAPK信号通路。
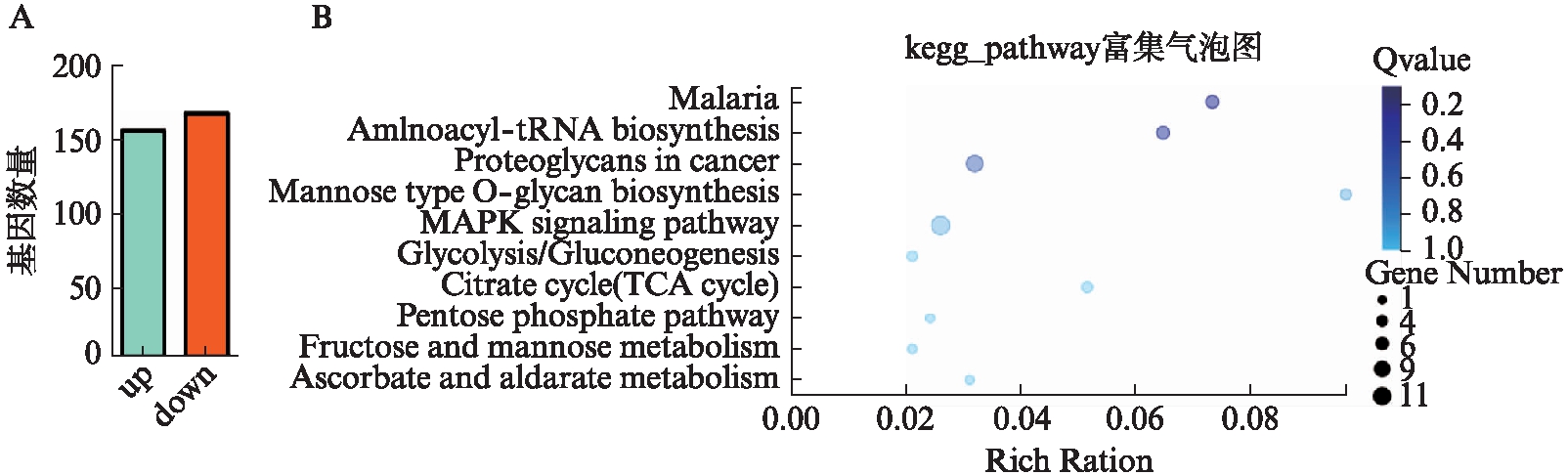
图10 甘草苷测序结果分析
Fig.10 The RNA-seq results of LQ and control hADSCs
在芹糖异甘草苷处理后与对照相比的321个差异基因中,上调基因有135个,下调基因有186个,对这些差异基因进行了KEGG通路富集气泡图分析,发现与抗原加工提呈相关性最大,并对其中的差异基因进行热图分析,发现芹糖异甘草苷处理可抑制了CD8a的表达量,见图11。
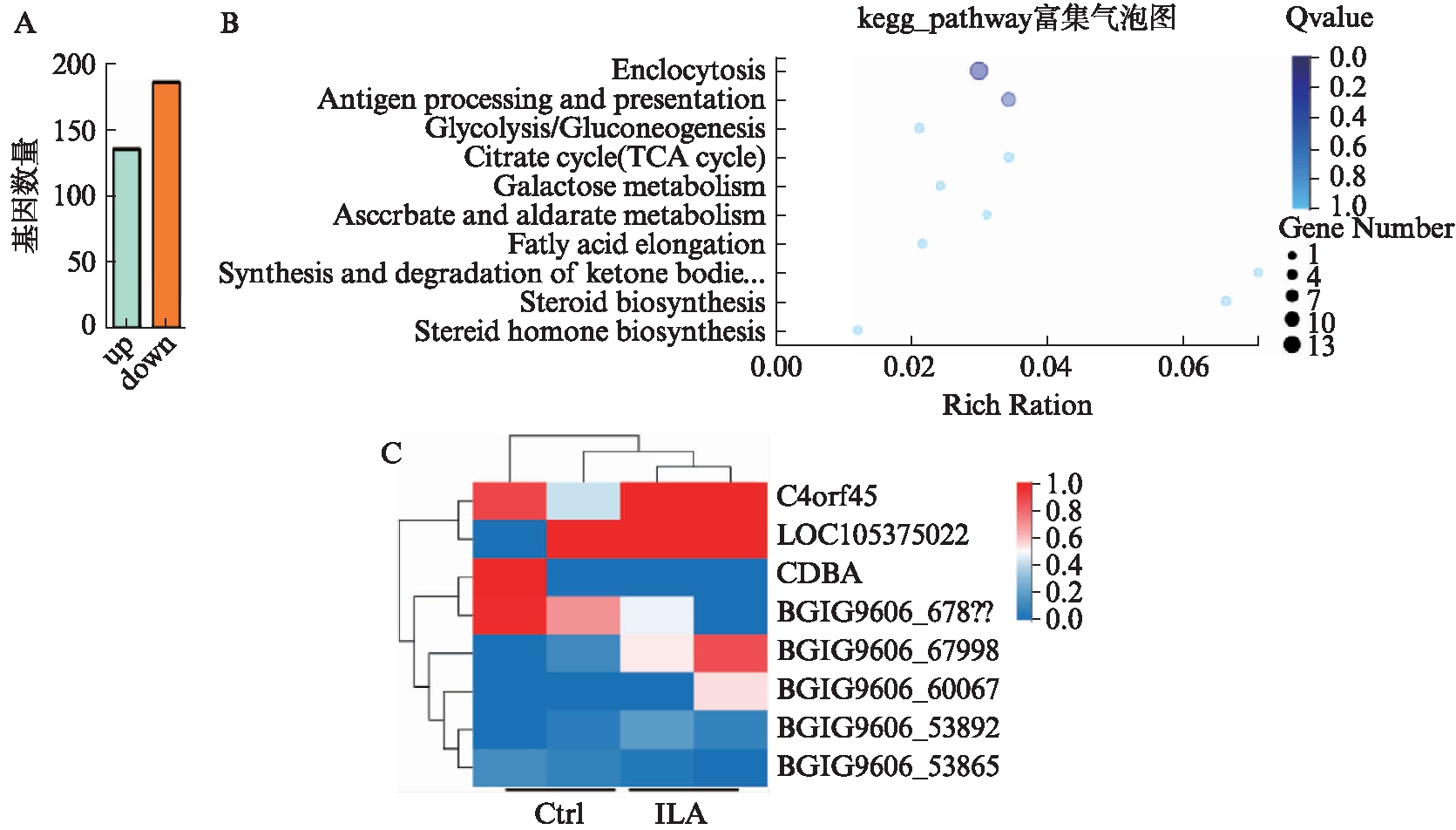
图11 芹糖异甘草苷测序结果分析
Fig.11 The RNA-seq results of ILA and control hADSCs
A: 差异基因数目;B: KEGG通路富集分析气泡图;C: 抗原加工提呈热图分析
3 讨 论
本研究通过选取甘草内5种活性物质,利用CCK-8法测得了这些物质作用于hADSCs的最佳浓度,并在此基础上利用Ki67染色、β-半乳糖苷酶原位染色、细胞内ROS、细胞周期等实验研究了它们的抗衰老作用。发现这5种化合物在体外都有不同程度的抗衰老作用,并且5种活性物质中,甘草酸的抗衰老效果最佳,其次是甘草苷和芹糖异甘草苷。在以往对甘草活性物质的研究中,对芹糖甘草苷和芹糖异甘草苷的研究较少,本实验首先在细胞层次上研究了它们与抗衰老的联系。
细胞衰老过程中,氧化应激的增加是导致细胞和细胞外基质的损失的唯一最有害老化因素[17]。当ROS水平超过防御机制时,细胞就被认为处于氧化应激状态。在环境胁迫下,增强ROS的产生会对细胞造成威胁,导致脂质过氧化、蛋白质氧化和核酸损伤,最终导致细胞死亡。处理过量的ROS可以改善细胞代谢,从而延长寿命 [18-19]。本实验观察到甘草酸、甘草苷、异甘草苷以及芹糖异甘草苷都能使细胞内ROS水平降低,这一结果显示这4种活性物质可能通过氧化应激途径来延缓细胞衰老,并且此结果预示着这4种药物可能在体内具有很好的抗衰老作用。在以前的体内实验中,已发现甘草酸能清除ROS[20],甘草苷具有抗氧化和抗凋亡作用[21],这些均证明了甘草酸和甘草苷等具有重要研究意义。本研究在细胞实验中观察到芹糖异甘草苷具有抗衰老作用,这揭示其有着更大的研究意义。
RNA测序结果显示,甘草酸、甘草苷和芹糖异甘草它们与人类疾病之间具有密切相关性。其中甘草酸增加了CD8a的表达量,本研究在体内实验中发现了甘草酸能增加体内T细胞数目,这一结果与细胞实验结果一致。另外,有研究发现,甘草酸还能促进调节T细胞的增殖[22],这与本研究结果相似。甘草酸提高免疫细胞数目具有何作用,并通过什么途径起作用需要进一步进行研究。本研究测序结果发现芹糖异甘草苷能抑制CD8a表达,那么其在体内是否具有其他的功效,如是否有抑制肿瘤作用,则需要进一步研究。
衰老对脂肪细胞和脂肪组织稳态的影响尚不清楚,但年龄相关的脂肪功能障碍是众多代谢和其他紊乱的重要原因,这一点已被广泛接受[8]。在这些情况下,找到一种能够对抗干细胞衰老并恢复其再生潜力的天然产物,可能对衰老相关疾病的干预和维持干细胞功能[23]产生巨大影响。本研究首次观察了在体外甘草中物质对hADSCs衰老的作用,结果提示甘草酸等可通过保护线粒体功能和调节胞内免疫对抗hADSCs衰老。本研究为从线粒体和免疫角度探寻阻止hADSCs衰老的有效方法提供了有价值的数据。
[1] RAMILOWSKI J A, SAWAI S, SEKI H, et al. Glycyrrhiza uralensis transcriptome landscape and study of phytochemicals[J]. Plant Cell Physiol, 2013,54(5): 697-710.
[2] WANG C, CHEN L, XU C, et al. Acomprehensive review for phytochemical, pharmacological, and biosynthesis studies on Glycyrrhiza spp[J]. Am J Chin Med, 2020,48(1): 17-45.
[3] YANG R, WANGL Q, YUAN B C, et al. The pharmacological activities of licorice[J]. Planta Med, 2015,81(18): 1654-1669.
[4] TANG Z H, LI T, TONG Y G, et al. A systematic review of the anticancer properties of compounds isolated from licorice(Gancao)[J]. Planta Med, 2015,81(18): 1670-1687.
[5] WANG L, YANG R, YUAN B, et al. The antiviral and antimicrobial activities of licorice, a widely-used Chinese herb[J]. Acta Pharm Sin B, 2015,5(4): 310-315.
[6] SIGNER R A, MORRISON S J. Mechanisms that regulate stem cell aging and life span[J]. Cell Stem Cell, 2013,12(2): 152-165.
[7] OH J, LEE Y D, WAGERS A J. Stem cell aging: mechanisms, regulators and therapeutic opportunities[J]. Nat Med, 2014,20(8): 870-880.
[8] LINDROOS B, SUURONEN R, MIETTINEN S. The potential of adipose stem cells in regenerative medicine[J]. Stem Cell Rev Rep, 2011,7(2): 269-291.
[9] ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002,13(12): 4279-4295.
[10] DEVITT S M, CARTER C M, DIEROV R, et al. Successful isolation of viable adipose-derived stem cells from human adipose tissue subject to long-term cryopreservation: positive implications for adult stem cell-based therapeutics in patients of advanced age[J]. Stem Cells Int, 2015,2015: 146421.
[11] KORNICKA K, MARYCZ K, TOMASZEWSKI K A, et al. The effect of age on osteogenic and adipogenic differentiation potential of human adipose derived stromal stem cells(hASCs) and the impact of stress factors in the course of the differentiation process[J]. Oxidative Med Cell Longev, 2015,2015: 1-20.
[12] 孟必成,朱小奇,李琛,等.微RNA对脊髓损伤小鼠恢复的影响[J].同济大学学报(医学版),2017,38(6): 1-5.
[13] SAHIN E, DEPINHO R A. Linking functional decline of telomeres, mitochondria and stem cells during ageing[J]. Nature, 2010,464(7288): 520-528.
[14] ZHANG D Y, PAN Y, ZHANG C, et al. Wnt/β-catenin signaling induces the aging of mesenchymal stem cells through promoting the ROS production[J]. Mol Cell Biochem, 2013,374(1/2): 13-20.
[15] LI Q, ZHANG Y, FU J X, et al. FOXA1 mediates p16(INK4a) activation during cellular senescence[J]. EMBO J, 2013,32(6): 858-873.
[16] VON ZGLINICKI T, MARTIN-RUIZ C M. Telomeres as biomarkers for ageing and age-related diseases[J]. Curr Mol Med, 2005,5(2): 197-203.
[17] GODIC A. The role of stem cells in anti-aging medicine[J]. Clin Dermatol, 2019,37(4): 320-325.
[18] MARYCZ K, TOMASZEWSKI K A, KORNICKA K, et al. Metformin decreases reactive oxygen species, enhances osteogenic properties of adipose-derived multipotent mesenchymal stem cells in vitro, and increases bone density in vivo[J]. Oxid Med Cell Longev, 2016,2016: 9785890.
[19] CRUCIANI S, SANTANIELLO S, FADDA A, et al. Extracts frommyrtle liqueur processing waste modulate stem cells pluripotency under stressing conditions[J]. Biomed Res Int, 2019,2019: 5641034.
[20] KIMURA M, MORO T, MOTEGI H, et al.In vivo glycyrrhizin accelerates liver regeneration and rapidly lowers serum transaminase activities in 70% partially hepatectomized rats[J]. Eur J Pharmacol, 2008,579(1-3): 357-364.
[21] SUN Y X, TANG Y, WU A L, et al. Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusion in mice via its antioxidant and antiapoptosis properties[J]. J Asian Nat Prod Res, 2010,12(12): 1051-1060.
[22] GAO M X, LI X L, HE L L, et al. Diammonium glycyrrhizinate mitigates liver injury via inhibiting proliferation of NKT cells and promoting proliferation of tregs[J]. Drug Des Devel Ther, 2019,13: 3579-3589.
[23] 柳幸子,全红,刘君君,等.不同浓度人脂肪干细胞与脂肪颗粒混合种植对裸鼠脂肪细胞增长的影响[J].同济大学学报(医学版),2019,40(1): 16-21.