目前,极具潜力的干细胞治疗已经广泛应用于各种临床疾病中,成为医学研究最前沿和最热门的研究方向之一[1]。1967年,Friedenstein教授首次从骨髓中发现并分离出一种具有自我更新能力的贴壁细胞,由于这些细胞能分化为中胚层来源的间质细胞,因此称之为间充质干细胞(mesenchymal stem cells, MSCs)[2]。而后,从骨髓[3]、牙髓[4]、脐带[5]以及脂肪[6]等各种广泛组织中都分离得到大量的MSCs。其中人脐带来源的MSCs(umbilical cord-derived mese-nchymal stem cells, UCMSCs)作为围产期组织来源的细胞,因具有更多的原始表型、更长的端粒酶和活性、更高的产量、更短的倍增时间、取材方便、伦理学争议小等优点,已经逐步应用于临床前和临床研究[7-8]。
磁性二氧化硅纳米微球(magnetic silica nano-spheres, MSNPs)具有特有的超顺磁性、磁靶向性和生物相容性等特点[9],近些年来在生物医学领域具有很好的应用潜能。例如,在肿瘤治疗研究领域,通过MSNPs标记细胞药物,可利用基于其超顺磁性的磁共振成像,实现细胞药物的体内示踪,并在外加磁场下增强药物在肿瘤部位的富集,提升杀伤肿瘤细胞的效果[10];另外,经抗体、引物表面修饰后的MSNPs能高效地从复杂生物样品中分离蛋白质、核酸等目标成分,以用于下一步研究。除此之外,用于治疗心肌梗死、中风等疾病的干细胞,由于移植到体内后存活率很低,严重影响治疗效果,而MSNPs可通过材料本身或负载活性物质(如自由基清除剂、小分子药物等)来改善干细胞活性、增强干细胞的旁分泌等功能,进而提高干细胞的治疗效果[11]。另外,MSNPs也可以作为一种标记干细胞的探针,示踪干细胞移植后在体内的命运[12]。MSNPs不仅有望成为MSCs体内移植的示踪标记物,而且还能介导MSCs活性来提升对疾病治疗效果。基于此,本研究旨在探究MSNPs对UCMSCs体外增殖、迁移等生物学活性的影响,为进一步研究MSNPs标记UCMSCs的体内移植治疗提供理论依据。
1 材料与方法
1.1 材料
本研究中脐带组织的供者均签署知情同意书,并经过同济大学附属东方医院伦理委员会批准: 【2017】体临审第(001)号修正2。
α-MEM培养基和胎牛血清购自美国Gibco公司;CCK-8试剂盒、三系分化试剂等购自碧云天生物技术有限公司;流式抗体CD34、CD45、CD73、CD90购自Cell Signaling Technology公司。
1.2 UCMSCs的分离和原代培养过程
1.2.1 UCMSCs的分离 本实验UCMSCs原代培养采用的是组织块培养法。首先将获得的脐带组织放入含有双抗的生理盐水中,4 ℃条件下运输到GMP实验室。在超净工作台中弃去脐带保存液,在75%乙醇中振荡浸泡2 min,然后用生理盐水不断冲洗脐带。接着将脐带组织放置于10 cm培养皿中,将其剪碎为2~3 cm的节段并洗去脐带中残留的血液。最后用无菌镊剔除脐带中的脐静脉和脐动脉(1根脐静脉、2根脐动脉)并分离出华通胶,将其剪碎为1 cm2左右的组织块。
1.2.2 UCMSCs的原代培养 挑取上述组织块平铺于T75的细胞培养瓶中,置于37 ℃、5%CO2的培养箱中培养4~6 h。组织块铺板后,每5 d更换1次α-MEM完全培养基,同时显微镜观察组织块周边,约2周后组织块周边可爬出长梭形UCMSCs。待原代UCMSCs生长接近汇合80%,用胰酶消化3~5 min至UCMSCs回缩,收集UCMSCs,500×g,离心5 min,去上清液,以1∶2/1∶4比例接种至新的培养瓶中,并标记为第1代。平均每2~3 d换液,至UCMSCs融合80%传代,以此类推。
1.2.3 UCMSCs的制备流程 流程包括取材、分离、剪切、接种、培养,见图1。

图1 原代培养UCMSCs的制备流程
Fig.1 The preparation process of primary cultured UCMSCs
1.3 UCMSCs的细胞鉴定方法
1.3.1 UCMSCs的表面标志物鉴定 取第4~5代UCMSCs,PBS清洗,用胰酶在37 ℃ 条件下消化3~5 min至UCMSCs回缩,立即加入α-MEM完全培养基终止消化,收集UCMSCs,500×g,离心5 min,去上清液。用PBS清洗UCMSCs 1~2次,500×g,离心5 min。然后用PBS重悬UCMSCs,加入不同的流式管中。分别加入抗人的CD34/CD45、CD73/CD90抗体,每个样本加5 μL抗体,设立空白对照组。混匀样本放置于4 ℃,避光孵育30 min。在UCMSCs中加入PBS重悬,500×g,离心5 min,去除未结合到UCMSCs的抗体。将PBS加入UCMSCs重悬,采用流式细胞技术检测UCMSCs表面标志物。流式结果用Flow Jo软件分析。
1.3.2 UCMSCs的三系分化鉴定 取4.5×105个UCMSCs接种到6孔板中,放于37 ℃、5%CO2的培养箱中,培养至UCMSCs贴壁。待UCMSCs扩增至接近融合,将6孔板中换为成骨或成脂诱导分化培养基。每2~3 d更换成骨或成脂诱导分化培养基1次,倒置显微镜下观察UCMSCs的形态。
1.3.3 UCMSCs的茜素红染色和成骨分化UCMSCs培养3周后,用4%多聚甲醛固定液固定30 min,PBS清洗后,将茜素红染液加入UCMSCs中,染色30 min。然后吸去茜素红溶液,PBS清洗后,通过倒置显微镜观察和拍摄UCMSCs成骨诱导分化的结果。
1.3.4 UCMSCs的油红O染色和成脂分化 油红O染液配制: 油红O粉末完全溶于无水乙醇为储存液。将油红O储存液与蒸馏水按3∶2混匀,用中性滤纸过滤即为工作液。UCMSCs培养3周后,用4%多聚甲醛固定液固定30 min,PBS清洗后,将油红O工作液加入UCMSCs中,染色30 min。而后吸去油红O工作液,PBS清洗后,通过倒置显微镜观察和拍摄UCMSCs成脂诱导分化的结果。
1.3.5 UCMSCs的阿利新蓝染色和成软骨分化取5×107个UCMSCs悬液(用α-MEM完全培养基重悬)滴于24孔板的中央,形成细胞微团,放于37 ℃、5%CO2的培养箱中培养。待24 h后向24孔板中滴加成软骨诱导分化培养基。UCMSCs微团大约每2~3 d换成软骨诱导分化培养基1次,倒置显微镜下观察UCMSCs形态。UCMSCs微团培养3周后,用4%多聚甲醛固定液固定30 min,PBS清洗后,将阿利新蓝染液加入UCMSCs微团中,染色30 min。而后吸去阿利新蓝溶液,PBS清洗后,通过倒置显微镜观察和拍摄UCMSCs成软骨诱导分化的结果。
1.4 MSNPs的制备与表征
根据文献报道的溶剂热法和Stöber方法[13]制备MSNPs,流程如下: 在磁搅拌下将2.56 g乙酸钠和0.81 g FeCl3·6H2O溶解在30 mL乙二醇中,转至高压釜中200 ℃下加热10 h,混合物用乙醇和离子水各洗涤3次,将上述产物分散在70%乙醇中,转移至250 mL反应瓶,用NH4Cl调节pH至9.5,在剧烈搅拌下加入100 μL TEOS,反应12 h后,用乙醇和去离子水各洗涤3次,烘干获得MSNPs粉末,4 ℃ 保存备用。
其中,若往反应体系中添加的是罗丹明B异硫氰酸酯,则产物是红色荧光的MSNPs;如果不需要荧光标记,则这反应过程中不添加荧光染料。
采用透射电子显微镜(TEM)和扫描电子显微镜(SEM)对MSNPs的尺寸和形貌进行表征。红色荧光标记MSNPs的情况将通过荧光显微镜目视检查。同时,使用马尔文电位仪可测量MSNPs在pH=7 条件下的微球表面电位。
1.5 MSNPs标记UCMSCs
先取一定量MSNPs粉末配制成2 mg/mL的溶液。每次使用前,须经超声分散后,用PBS分别稀释配制成1、10、50、100、200 μg/mL浓度梯度的MSNPs溶液。然后,往等细胞量的UCMSCs悬液中加入不同浓度的MSNPs,在冰浴下共孵育30 min,再在磁力架上进行磁分离,用PBS洗涤2次,去除未被标记的UCMSCs,收集剩余的细胞即获得MSNPs标记的UCMSCs。采用荧光倒置显微成像和流式细胞技术分别检测MSNPs对UCMSCs的细胞形态和表面干性标志物的影响。
1.6 细胞增殖实验
采用CCK-8法评价UCMSCs的增殖能力。将带有不同质量浓度(1、10、50、100、200 μg/mL)MSNPs的UCMSCs以1×104个/孔种植于96孔板中(对照组为UCMSCs),培养24 h后,按照试剂说明书,以10 μL CCK-8溶液添加进每个孔中,放入37 ℃、5%CO2的培养箱中培养1~2 h。用酶标仪读取每个孔在450 nm下的光密度值(D450)。
1.7 细胞划痕实验
细胞划痕实验方法[14]: 将含有不同质量浓度(1、10、50、100、200 μg/mL)MSNPs的UCMSCs以1×106个/孔种植于6孔板中(对照组为UCMSCs),而后37 ℃、5%CO2的培养箱中培养至细胞汇合80%,用灭菌过的10 μL枪头垂直于细胞进行划痕,划一条干净的直线边缘。然后分别在培养后0、6、12、24 h将6孔板放置于显微镜下,取划痕周围6个视野观察UCMSCs的迁移情况。
1.8 统计学分析
实验所有数据用![]() 表示,每个实验重复3次。采用GraphPad Prism 8.0软件进行分析,并绘制相应的统计图表。不同组间的差异比较使用了非配对t检验。P<0.05为差异有统计学意义。
表示,每个实验重复3次。采用GraphPad Prism 8.0软件进行分析,并绘制相应的统计图表。不同组间的差异比较使用了非配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 原代培养的UCMSCs的细胞形态观察
供者的脐带组织通过组织块培养法进行分离和铺板,约2周后组织块周边可爬出UCMSCs,继续培养约1周,UCMSCs数量明显增多。而后待UCMSCs达到80%汇合后进行消化和传代。倒置显微镜下观察,可见原代培养的UCMSCs贴壁生长,细胞形态呈长梭形,见图2A。
2.2 原代培养UCMSCs的干细胞特性鉴定
UCMSCs经成脂诱导培养基培养3周,可见细胞核缩小或偏向细胞一侧,通过油红O染色,低倍镜下可见细胞内出现大小不一、数量不等的橙红色空泡样脂滴,见图2B。UCMSCs经过成骨诱导培养基培养3周,可见细胞呈立方形或不规则形态,通过茜素红染色,低倍镜下可见细胞表面大量片状橘红色钙化结节斑块,见图2C。UCMSCs经过成软骨诱导培养基培养3周,可见细胞呈球形,通过阿利新蓝染色,圆球着蓝色,见图2D。
UCMSCs经胰酶消化获得悬浮细胞,而后与相应的抗体结合。流式细胞术检测结果显示,UCMSCs的表面标志物CD90和CD73表达为阳性,UCMSCs的表面标志物CD34和CD45表达为阴性,见图2E。
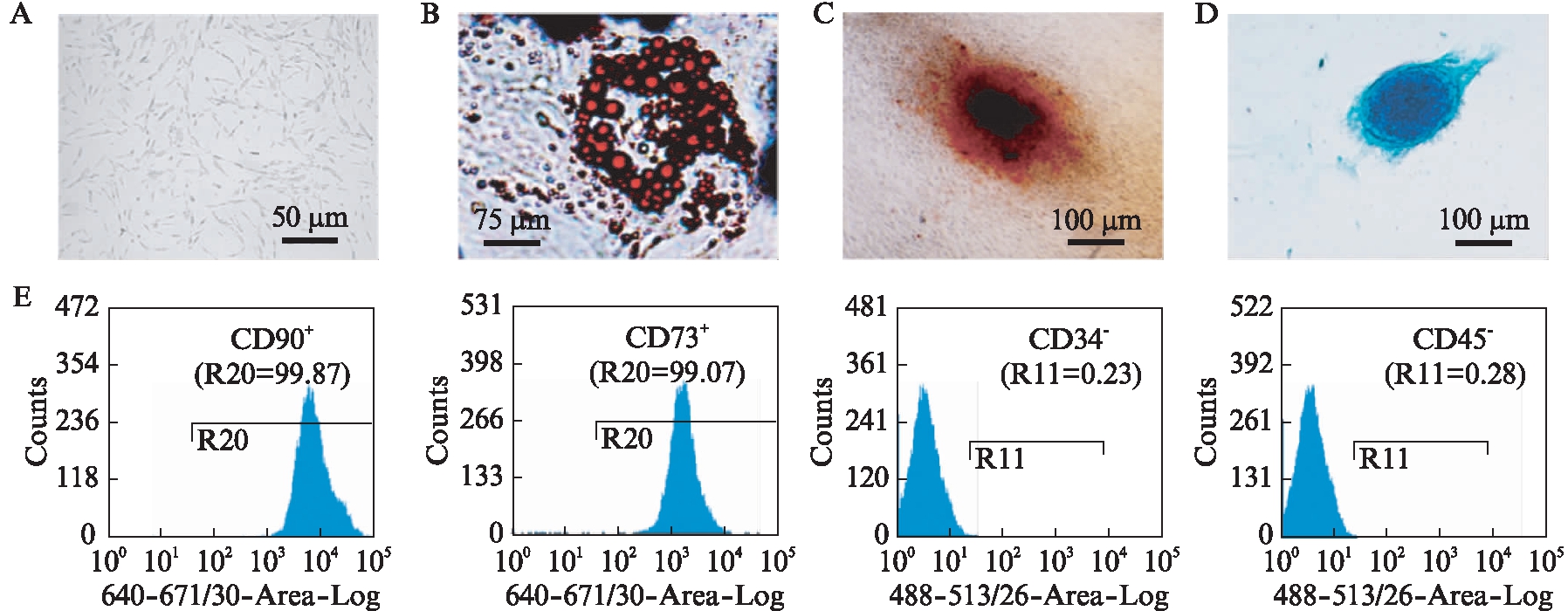
图2 原代培养UCMSCs的干细胞特性鉴定
Fig.2 Characterization of stem cells of primary cultured UCMSCs
A: 倒置显微镜下UCMSCs细胞形态;B: UCMSCs成脂分化;C: UCMSCs成骨分化;D: UCMSCs成软骨分化;E: 流式细胞术检测UCMSCs表面标志物
2.3 MSNPs的制备与表征
MSNPs的包硅修饰是改善磁性纳米材料生物相容性的关键步骤。为了获得生物相容性好和包裹均匀的MSNPs,本研究精确调控硅烷化试剂(如TEOS)在碱性溶液中水解的速率。如果水解过快,则容易产生单纯的二氧化硅微球;如果水解过慢,则会出现磁性材料相互粘连,不利于获得分散性高、粒径均匀的MSNPs。本研究通过TEM和SEM,监控了反应过程中二氧化硅修饰的进展。通过优化物料配比,本研究获得的MSNPs粒径为200~300 nm,见图3A、3B。同时,使用马尔文电位分析仪测试MSNPs的表面电荷情况,结果表明MSNPs的平均电位为(-27±2) mV,且它们都能均匀地分散在水或缓冲液中,可稳定存放12个月而不结团块,同时还保持良好的分散性能。
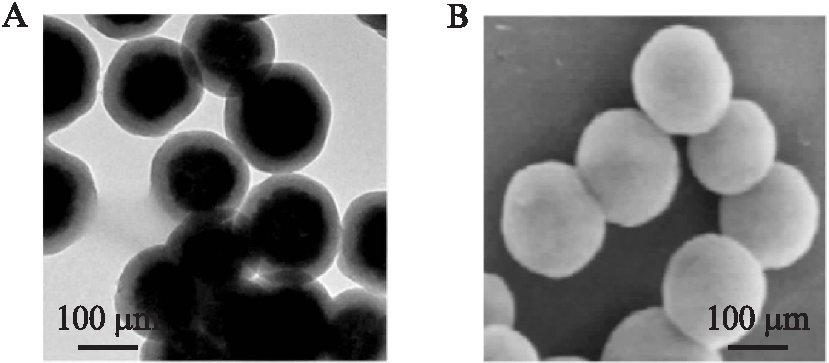
图3 磁性二氧化硅纳米微球的表征
Fig.3 Characterization of magnetic silica nanospheres
A: MSNPs的透射电镜图;B: MSNPs的扫描电镜图
2.4 MSNPs标记UCMSCs对细胞形态的影响
不同质量浓度(1、10、50、100、200 μg/mL)MSNPs与UCMSCs共孵育,通过磁分离获得标记的细胞,再放入37 ℃、5%CO2的培养箱中培养至细胞贴壁后,通过倒置显微镜观察可见不同浓度MSNPs标记UCMSCs对其细胞形态没有明显影响,标记的UCMSCs依然保持长梭形生长,增大微球质量浓度至200 μg/mL也没有观察到细胞皱缩,变形等异常形态变化,见图4A。
同时,采用活细胞标记染料Hoechst 33342(0.2 μg/mL,C1029,碧云天公司)与MSNPs标记的UCMSCs共孵育30 min,让细胞核被标记蓝色。在荧光显微镜下,可见红色荧光MSNPs成功吸附在蓝色细胞核标记的UCMSCs上,见图4B。

图4 MSNPs标记UCMSCs对细胞形态的影响
Fig.4 The effect of MSNPs on cell morphology of the labeled UCMSCs
A: 倒置显微镜下,不同浓度MSNPs-UCMSCs细胞形态的典型图像;B: 荧光显微镜下,10 μg/mL MSNPs-UCMSCs细胞形态的典型图像
2.5 MSNPs标记UCMSCs对细胞表面干性标志物的影响
将质量浓度为10 μg/mL的MSNPs标记在UCMSCs上,放入37 ℃、5%CO2的培养箱中进行培养。当培养至第4~5代时,将标记的干细胞用胰酶消化获得干细胞悬浮液,而后与相应的干细胞标志物抗体孵育结合,洗涤去干扰后进行流式细胞技术检测,结果见图5。MSNPs标记的UCMSCs细胞表面的干性标志物CD90和CD73表达依然呈阳性,同时,表面标志物CD34和CD45表达也保持阴性,则与对照组中未经标记的UCMSCs的流式细胞检测结果一致,说明一定剂量下的MSNPs标记对UCMSCs表面干性标志物的表达无明显干扰。

图5 MSNPs标记UCMSCs后对其细胞表面标志物的表达影响
Fig.5 MSNPs affects the expression of cell surface markers of labeled UCMSCs
2.6 MSNPs标记UCMSCs对细胞增殖和迁移的影响
将不同质量浓度(1、10、50、100、200 μg/mL)MSNPs标记在UCMSCs上后,放入37 ℃、5%CO2的培养箱中进行培养24 h。CCK-8细胞增殖结果表明: MSNPs在质量浓度为1 μg/mL时能够促进UCMSCs的增殖,然而随着质量浓度(10、50、100、200 μg/mL)的增大,MSNPs对UCMSCs的增殖存在抑制作用,且抑制作用随着微球剂量增大而增强,见图6A。
另外,在本研究中选择10 μg/mL MSNPs作为代表浓度,考察了其标记UCMSCs对细胞迁移能力的影响。同上述流程一样,依次经过共孵育和磁分离,获得该浓度剂量标记的UCMSCs,然后,转移至37 ℃、5%CO2的培养箱中进行培养。待细胞汇合80%,用灭菌过的10 μL枪头垂直于细胞进行划痕,再放入培养箱中继续培养。然后分别在0、6、12、24 h将6孔板放置于显微镜下,取划痕周围6个视野观察UCMSCs的迁移情况。通过细胞迁移实验可以观察到不同培养时间下MSNPs标记对UCMSCs的迁移能力的干扰情况,相关结果见图6B。实验数据显示在10 μg/mL质量浓度下MSNPs标记UCMSCs没有对其细胞迁移能力造成明显干扰。

图6 MSNPs标记UCMSCs对其增殖和迁移的影响
Fig.6 The effect of MSNPs on cell proliferation and migration of labeled UCMSCs
A: 不同浓度的MSNPs-UCMSCs的细胞增殖结果,UCMSCs为对照组;B: 10 μg/mL MSNPs-UCMSCs的细胞迁移结果
3 讨 论
研究报道,作为前沿的MSCs治疗具有归巢到损伤部位组织,发挥促炎或抗炎等免疫调控,刺激血管新生等生物学作用,从而用于治疗各种临床疾病,如血液病、移植物抗宿主病、糖尿病、炎症性疾病、心血管疾病、骨和软骨疾病、神经系统疾病和自身免疫性疾病等[15-16]。骨髓来源的MSCs(bone marrow mesenchymal stem cells, BMMSCs)被最先和最广泛应用于临床前和临床研究中,而后脂肪来源的干细胞(adipose tissue derived mesenchymal stem cells, ATMSCs)和UCMSCs也进入了临床前和临床研究中。BMMSCs虽然作为目前在临床治疗中应用最多的MSCs类型,但它仍具有一些局限性。首先,患者自身来源的BMMSCs必须通过骨髓抽取这种有创操作来获取,这可能会导致一些并发症。对健康志愿者通过有创性骨髓抽取活检来获得同种异体来源的BMMSCs也面临伦理问题。其次,骨髓抽取出的BMMSCs的最初细胞含量很低,需要通过扩增到很多代才能达到细胞治疗数量。而长时间的体外扩增过程,可能使BMMSCs的功能和质量下降[17]。
UCMSCs的来源是脐带,而脐带作为分娩的医疗废物,不需要活检等有创性操作,其伦理性问题争议也相对较小。2006年,国际细胞治疗学会(the Interna-tional Society for Cellular Therapy, ISCT)提出鉴定MSCs最低的3个标准: (1) 在体外培养中,长梭形的MSCs呈贴壁生长;(2) MSCs表面标志物CD73、CD105、CD90、CD29等表达阳性,表面标志物CD11b,CD34、CD45、CD79α、HLA-DR等几乎不表达;(3) 具有成骨、成脂、成软骨的三系分化潜能[18]。
MSNPs主要用于生物样本的分离纯化、细胞的标记和成像等。有研究报道磁性纳米微球可以标记MSCs中实现核磁成像[19]。超顺磁性氧化铁纳米微球可以经过表面修饰降低其生物毒性[20]。此外,磁性纳米微球是一种生物相容性较好的MRI造影剂,可对干细胞在体内的分布和代谢评估,为干细胞移植治疗的可视化控制提供新的思路。因此,探究磁性二氧化硅纳米微球对UCMSCs的表面干性标志物表达、细胞增殖、迁移等活性影响,对发展稳定的UCMSCs标记物具有重要意义。
本研究首先通过组织块培养法成功分离和原代培养出人UCMSCs,接着依次采用显微镜观察、流式细胞术检测和三系分化等技术手段鉴定原代培养的上述细胞是否具有干细胞的基本特性。其次,将不同质量浓度的MSNPs溶液与UCMSCs共孵育与磁分离,获得MSNPs标记的UCMSCs。最后,通过荧光倒置显微镜成像、流式细胞技术、细胞增殖试剂盒和细胞划痕实验等技术手段评估了MSNPs标记对UCMSCs的细胞形态、表面干性标志物表达、细胞增殖和迁移能力等干扰情况。
综上所述,磁性二氧化硅纳米微球有望成为UCMSCs的纳米标记物,然而其在体内模型中评估其对UCMSCs的分布、迁移、归巢、疗效等生物学特性影响尚需深入研究。
[1] SQUILLAROT, PELUSOG, GALDERISIU. Clinical trials with mesenchymal stem cells: an update[J]. Cell Transplant, 2016,25(5): 829-848.
[2] FRIEDENSTEINA J, PETRAKOVAK V, KUROLESO-VAA I, et al. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues[J]. Transplantation, 1968,6(2): 230-247.
[3] CAPLANA I. Mesenchymal stem cells[J]. J Orthop Res, 1991,9(5): 641-650.
[4] GRONTHOS S, BRAHIM J, LI W, et al. Stem cell properties of human dental pulp stem cells[J]. J Dent Res, 2002,81(8): 531-535.
[5] WANGH S, HUNGS C, PENGS T, et al. Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord[J]. Stem Cells, 2004,22(7): 1330-1337.
[6] ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002,13(12): 4279-4295.
[7] MENG F P, XU R N, WANG S Y, et al. Human umbilical cord-derived mesenchymal stem cell therapy in patients with COVID-19: a phase 1 clinical trial[J]. Signal Transduct Target Ther, 2020,5(1): 172.
[8] 石凯燕,张春雪,王艺静,等.人源脐带间充质干细胞对脑缺血再灌注小鼠神经功能及神经炎症的影响[J].同济大学学报(医学版),2020, 41(5): 537-545.
[9] LEE N, YOO D, LING D S, et al. Iron oxide based nanoparticles for multimodal imaging and magnetoresponsivetherapy[J]. Chem Rev, 2015,115(19): 10637-10689.
[10] WANG J, MEI T X, LIU Y, et al. Dual-targeted and MRI-guided photothermal therapy via iron-based nanoparticles-incorporated neutrophils[J]. Biomater Sci, 2021. DOI: 10.1039/d1bm00127b.
[11] ZHANG B B, YAN W, ZHUY J, et al. Nanomaterials in neural-stem-cell-mediated regenerative medicine: imaging and treatment of neurological diseases[J]. Adv Mater, 2018,30(17): e1705694.
[12] SUN Y T, LU Y X, YIN L, etal. The roles of nanoparticles in stem cell-based therapy for cardiovascular disease[J]. Front Bioeng Biotechnol, 2020,8: 947.
[13] CHEN B D, LEW J, WANG Y L, et al. Targeting negative surface charges of cancer cells by multifunctional nanoprobes[J]. Theranostics, 2016,6(11): 1887-1898.
[14] CORY G. Scratch-wound assay[J]. Methods Mol Biol, 2011,769: 25-30.
[15] DIMMELER S, LERI A. Aging and disease as modifiers of efficacy of cell therapy[J]. Circ Res, 2008,102(11): 1319-1330.
[16] SQUILLARO T, PELUSO G, GALDERISI U. Clinical trials with mesenchymal stem cells: an update[J]. Cell Transplant, 2016,25(5): 829-848.
[17] LI Y, WU Q, WANG Y J, et al. Senescence of mesenchymal stem cells (Review)[J]. Int J Mol Med, 2017,39(4): 775-782.
[18] DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006,8(4): 315-317.
[19] ZHENG B, VON SEE M P, YU E, et al. Quantitative magnetic particle imaging monitors the transplantation, biodistribution, and clearance of stem cells in vivo[J]. Theranostics, 2016,6(3): 291-301.
[20] XU C J, MIRANDA-NIEVES D, ANKRUM J A, et al. Tracking mesenchymal stem cells with iron oxide nanoparticle loaded poly(lactide-co-glycolide) microparticles[J]. Nano Lett, 2012,12(8): 4131-4139.