消化系统由消化道和消化腺两部分组成,包括口腔、咽、食管、胃、小肠(十二指肠、空肠、回肠)及大肠(盲肠、结肠、直肠)、唾液腺、肝脏、胆胰等。消化系统恶性肿瘤是目前尚未攻克的难治疾病,发病率位居我国癌症发病率的前列,由于其临床发病较为复杂隐匿,早期多无明显的临床体征和症状,常被忽视,发现时已经处于疾病进展期,同时有效的治疗方法十分有限,故死亡率较高[1-2]。
外泌体(exosome)作为一种细胞外囊泡,具有脂质双层膜结构,可以通过转运其来源细胞的活性物质,发挥调控靶细胞的作用[3]。外泌体蛋白质介导的肿瘤细胞间的信号转导在肿瘤的早期发生和其发展中起重要的作用[4]。随着蛋白质组学技术的普及,更多的外泌体蛋白质的组成和功能相继被揭示。多项研究表明外泌体携带的蛋白质在不同肿瘤中存在差异性表达,检测这些特征性外泌体蛋白质可能对各种肿瘤的诊断和治疗有非常重要的价值。本文针对外泌体蛋白质在消化系统恶性肿瘤中的相关文献进行总结归纳,对其在生物学特征、作用、机制、诊断及治疗中的应用价值进行综述。
1 外泌体蛋白质的基本生物学特性
外泌体蛋白质,总的可以分为两大类:非特异性和特异性。非特异性蛋白质是细胞内普遍存在的蛋白质,包括酶类,如甘油醛3-磷酸脱氢酶、过氧化氢酶;信号转导相关蛋白质,如蛋白质激酶、14-3-3蛋白、β-连环蛋白;膜转运相关蛋白质,如CD9、CD35、CD63、CD81、浮舰蛋白;分子伴侣,如热休克蛋白(heat shock protein,HSP);融合相关蛋白质,如膜联蛋白、Rabs蛋白;细胞黏附相关蛋白质,如整合素、乳凝素;多泡体生成相关蛋白质等。特异性蛋白质与细胞特殊功能有关,成分与细胞来源密切相关[5],例如:结肠上皮细胞来源的外泌体常常携带多种特异性抗原和代谢酶外泌体蛋白质;而肿瘤来源的外泌体常常携带肿瘤抗原和肿瘤坏死因子相关凋亡诱导配体、死亡诱导因子配体、转化生长因子-β等外泌体蛋白质。
2 外泌体蛋白质在消化系统恶性肿瘤中的作用及机制
外泌体蛋白质是细胞间交换物质、传递信息的特别重要的信使,能影响正常的生理过程,在肿瘤等多种疾病发生发展中起到非常关键的作用[6]。肿瘤的发生发展依赖于肿瘤微环境(tumor microenvi-ronment,TME)。TME是癌细胞和周围基质细胞的集合,外泌体的含量明显增多,特别富含P53、磷酸酶和HSP等蛋白质[7],具有组织缺氧、间质高压形成、产生细胞趋化因子和生长因子等,从而具有激发免疫炎性反应等特点[8]。适宜的TME可直接或间接地影响肿瘤细胞的生长,其机制包括促进肿瘤血管生成、改变肿瘤的生物学表型等。如外泌体蛋白质在消化系统恶性肿瘤中的作用及机制见表1。
表1 外泌体蛋白质在消化系统恶性肿瘤中的作用及机制
Tab.1 The role and mechanism of exosomal proteins in malignant tumors of the digestive system
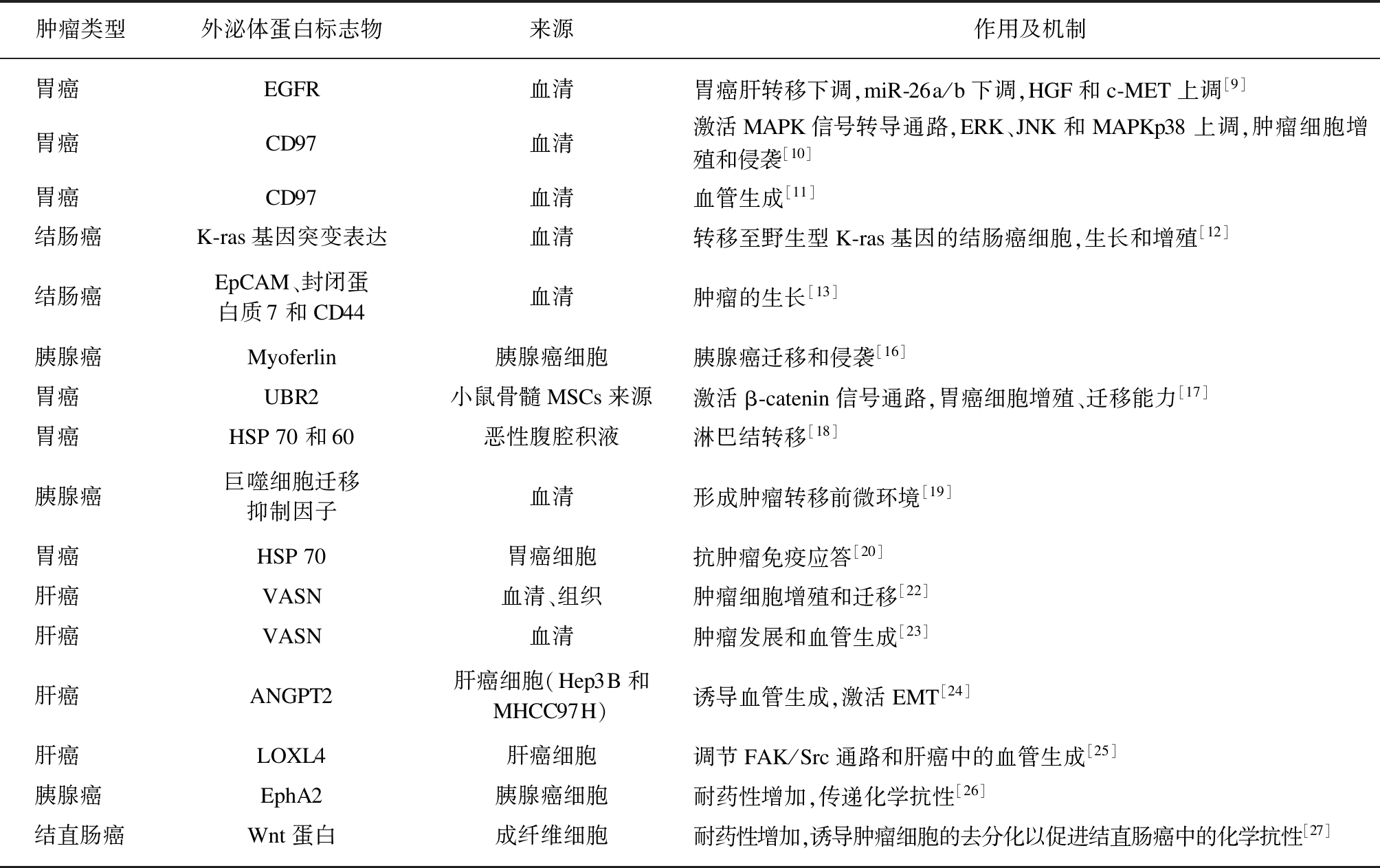
肿瘤类型外泌体蛋白标志物来源作用及机制胃癌EGFR血清胃癌肝转移下调,miR-26a/b下调,HGF和c-MET上调[9]胃癌CD97血清激活MAPK信号转导通路,ERK、JNK和MAPKp38上调,肿瘤细胞增殖和侵袭[10]胃癌CD97血清血管生成[11]结肠癌K-ras基因突变表达血清转移至野生型K-ras基因的结肠癌细胞,生长和增殖[12]结肠癌EpCAM、封闭蛋白质7和CD44血清肿瘤的生长[13]胰腺癌Myoferlin胰腺癌细胞胰腺癌迁移和侵袭[16]胃癌UBR2小鼠骨髓MSCs来源激活β-catenin信号通路,胃癌细胞增殖、迁移能力[17]胃癌HSP70和60恶性腹腔积液淋巴结转移[18]胰腺癌巨噬细胞迁移抑制因子血清形成肿瘤转移前微环境[19]胃癌HSP70胃癌细胞抗肿瘤免疫应答[20]肝癌VASN血清、组织肿瘤细胞增殖和迁移[22]肝癌VASN血清肿瘤发展和血管生成[23]肝癌ANGPT2肝癌细胞(Hep3B和MHCC97H)诱导血管生成,激活EMT[24]肝癌LOXL4肝癌细胞调节FAK/Src通路和肝癌中的血管生成[25]胰腺癌EphA2胰腺癌细胞耐药性增加,传递化学抗性[26]结直肠癌Wnt蛋白成纤维细胞耐药性增加,诱导肿瘤细胞的去分化以促进结直肠癌中的化学抗性[27]
2.1 外泌体蛋白质与肿瘤生长
外泌体蛋白质能够诱导肿瘤的生长,是通过将与肿瘤发生相关的信息传递给正常组织或细胞实现的。
Zhang等[9]的研究发现,表皮生长因子受体(epidermal growth factor receptor,EGFR),是胃癌细胞来源的外泌体蛋白质,可以促进转移性肝癌生长,通过将EGFR递送至肝脏,并整合至肝基质细胞的质膜上,来激活肝细胞生长因子(human growth factor,HGF),上调的HGF与位于胃癌细胞c-MET受体结合来实现。Li等[10]分别采用胃癌细胞来源的不同浓度外泌体蛋白CD97处理胃癌细胞,经检测发现高表达的CD97可作用于激活丝裂原活化蛋白质激酶(mitogen-activated protein kinase,MAPK)信号转导通路,实现了上调细胞外信号调节激酶(extracellular sigal-regulated protein kinase,ERK),c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和MAPKp38,进而有效促进胃癌细胞增殖和侵袭。Liu等[11]的研究发现,外泌体蛋白CD97在胃癌中的表达增强与明显的恶性程度相关,CD97高表达的胃癌组织来源的外泌体可发挥促血管生成作用而使胃癌细胞增殖能力提高20%。
Demory等[12]研究发现,由K-ras基因突变的结肠癌细胞分泌的外泌体中含有K-ras基因突变表达的外泌体蛋白质,可以转移至具有野生型K-ras基因的结肠癌细胞,促进其生长,加速肿瘤细胞的增殖。此外,Tauro等[13]发现,结肠癌细胞分泌的外泌体含有上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)、封闭蛋白7和CD44,这些外泌体蛋白质与肿瘤的生长十分相关。
2.2 外泌体蛋白质与肿瘤侵袭转移
肿瘤来源的外泌体蛋白质中富含血管相关生长因子,可诱导血管生长相关因子基因高表达,促进内皮细胞的增殖、迁移和出芽[14],从而有利于肿瘤进展。外泌体蛋白质可通过激活肿瘤上皮细胞间质转化(epithelial-mesenchymal transition,EMT)[15],来获得更强的迁移和侵袭能力的间质表型,与此同时,外泌体蛋白质参与肿瘤细胞对宿主免疫的逃避、调控对宿主细胞与血管的重塑等促进肿瘤侵袭转移的生物学过程。
Blomme等[16]的研究首次发现来自胰腺癌细胞系的BxPC-3细胞外泌体蛋白——肌铁蛋白(myoferlin)明显高表达,myoferlin的缺失可显著降低外泌体与人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的融合,进而抑制HUVEC的增殖和迁移。
Mao等[17]发现在p53基因缺失的小鼠骨髓MSCs来源的外泌体中大量富集外泌体蛋白(ubiquitin protein ligase E3 component n-recogin,UBR2)。将p53基因缺失小鼠骨髓MSCs来源的外泌体作用于小鼠MFC胃癌细胞后,可通过激活β-catenin信号通路,促进胃癌细胞增殖、迁移能力。
Zhong等[18]发现来自胃癌患者热处理过的恶性腹腔积液的外泌体在体外能够促进树突细胞(dendritic cell,DC)成熟并诱导肿瘤特异性细胞毒性T淋巴细胞反应。根据检测结果,与未经热处理的胃癌患者腹水制备的外泌体相比,这些过程与外泌体中存在更高水平的HSP70和HSP60蛋白有关。研究发现,胃癌细胞经过热激处理后,可以获得高表达外泌体蛋白HSP70,可以致敏DC,促进抗肿瘤免疫应答,为外泌体蛋白介导肿瘤逃避免疫提供证据[19-20]。
COSTA-SILVA等[21]提出,胰腺癌外泌体中含有明显高表达的巨噬细胞迁移抑制因子(macro-phage migration inhibitory factor,MIF),MIF可与肝脏Kupffer细胞结合,诱导这些细胞产生转化生长因子-β(transforming growth factor-β,TGF-β)。TGF-β随后激活肝星状细胞,上调纤连蛋白(fibronection,FN)。骨髓源性细胞(即巨噬细胞)与富含FN的肝脏部位结合,最终导致肝转移前生态位的形成,从而支持肿瘤细胞转移。
研究发现,通过消减EMSA-SELEX筛选,外泌体血管蛋白VASN在肝癌的血清和组织样本中高表达,并证实VASN能促进细胞增殖和迁移[22]。进一步研究发现,VASN是Ⅰ型跨膜蛋白,在肿瘤的发展和血管生成中起重要作用并证实VASN可能是肿瘤细胞与内皮细胞之间沟通的关键介质[23]。XIE等[24]研究发现肝癌细胞(Hep3B和MHCC97H)来源的外泌体高表达血管生成素2重组蛋白(recombinant angiopoitetin 2,ANGPT2),并可通过外泌体内吞作用将其传递到HUVECs,这种传递通过Tie2显著增加血管生成。此外,CRISPR-Cas系统敲除ANGPT2后显著抑制肝癌细胞(hepatocellular carcinoma,HCC)外泌体蛋白ANGPT2诱导的血管生成,并能明显抑制HCC中EMT的激活。研究发现LOXL4升高与肿瘤分化程度、血管浸润和肿瘤淋巴结转移(TNM)分期有关,并证实LOXL4在HCC中表达异常,LOXL4通过调节FAK/Src通路和肝癌中HUVECs的增殖、迁移等,从而促进肿瘤转移。
2.3 外泌体蛋白质与肿瘤耐药
由于遗传或表型变化(内在抗性),肿瘤细胞内可能产生治疗抗性,或者它可能是与肿瘤微环境相互作用(外在抗性)的结果。在肿瘤细胞和TME相互作用下导致肿瘤耐药。
Fan等[26]研究发现,耐药的胰腺癌肿瘤细胞外泌体相比于吉西他滨敏感细胞外泌体携带明显高表达的EphA2蛋白,且EphA2蛋白高表达可诱导吉西他滨敏感性胰腺癌细胞化疗耐药,但目前具体机制并不清楚。
研究发现,来自成纤维细胞的外泌体Wnt蛋白可以诱导结肠癌细胞的去分化以促进结直肠癌的化疗耐药,干扰基质细胞外泌体Wnt蛋白转移可以有助于改善结肠癌化疗耐药性和治疗效果不佳的问题[27-28]。
3 外泌体蛋白质在消化系统恶性肿瘤中的应用价值
3.1 诊断和预后
临床上对于消化系统恶性肿瘤诊断,通常依靠组织活检技术,取材要求高,操作难度大。来自体液的外泌体会选择性富集癌症病变的特征性蛋白质,选择检测这些外泌体蛋白质可能辅助癌症等的疾病诊断,因此液体活检可作为一种当前全新的技术,避免了手术开刀或穿刺对患者造成的创伤,方便,容易实施,安全,可选取血液、唾液、胸腹水、尿液等体液[29]。而外泌体蛋白质具有调节受体细胞生命活动的功能,并可以释放到外周血循环系统中,故外泌体蛋白质可作为一种新的无创诊断和评价疗效的潜在生物标志物[30]。Guo等[31]开发出纸基等速电泳技术,能够快速选择与目标外体相关的蛋白质生物标志物,代表了将肿瘤衍生的外泌体的检测转化为医疗保健的重要步骤。外泌体蛋白质在消化系统恶性肿瘤中的判断和预后见表2。
表2 外泌体蛋白质与消化系统恶性肿瘤的诊断和预后
Tab.2 Diagnosis and prognosis of exosomal protein in digestive system malignant tumors

肿瘤类型外泌体蛋白标志物来源检测方法胃癌GRN血清iTRAQ联合液相色谱串联质谱分析[32]胃癌TRIM3血清液相色谱串联质谱法[33]胃癌GKN1血清蛋白质微阵列分析法[35]胰腺癌GPC1血清流式细胞仪[36]胰腺癌EGFR血清质谱和免疫印迹[37]结肠癌ECM1血清质谱和免疫印迹[38]胃肠道间质瘤KIT、SPRY4血清高通量蛋白质组学[39]大肠癌GPC1血浆ExoCapTMExosome分离富集[40]
Loei等[32]研究发现将胃癌细胞来源的外泌体蛋白质谱经相对和绝对定量放射性核素标记技术(isobaric tags for relative and absolute quantitation,iTRAQ)联合二维液相色谱-串联质谱分析后,外泌体蛋白血清颗粒体蛋白(granulin,GRN)在胃肿瘤组织尤其是早期胃癌中的表达水平显著高于正常胃组织,故将血清GRN作为诊断胃癌的生物学标记物。相关研究[33-34]通过液相色谱-串联质谱法检测胃癌患者血清中外泌体蛋白质组学特征,发现胃癌患者血清血中外泌体蛋白TRIM3的水平明显低于健康人,TRIM3可以作为胃癌诊断的生物标志物。Yoon等[35]发现,胃癌患者中外泌体蛋白胃动蛋白1(gastro-kine 1,GKN1)的表达水平显著低于正常对照人群,晚期胃癌患者中GKN1的表达水平低于早期胃癌患者,在正常对照、萎缩性胃炎、萎缩性胃炎伴肠化生和胃癌患者中呈逐渐降低的趋势,提示GKN1可以较好地区分正常和胃良恶性疾病;并且GKN1可鉴别胃癌与结肠癌和肝癌。这一研究提示,外泌体蛋白GKN1可能是胃癌早期诊断和鉴别诊断的潜在指标。
Melo等[36]发现硫酸乙酰肝素蛋白多糖家庭的一种细胞表面蛋白(glypican-1,GPC1)在胰腺来源的外泌体富集,GPC1能够区分不同程度的胰腺疾病患者,如健康受试者、良性胰腺疾病患者及早、晚期胰腺癌患者,特别如果结合影像学检查,可以及时的对早期胰腺癌患者进行手术治疗,是治疗的检测指标和预后指标。Adamczyk等[37]发现,胰腺癌细胞分泌不同形式的EGFR,不同形式的外泌体蛋白EGFR在体内可能承担着不同的功能,可以作为血清生物标志物辅助诊断和治疗靶点。
Santasusagna等[38]发现,结肠癌患者外周血中的外泌体蛋白细胞外基质(extracelluar matrix 1,ECM1)的高表达与结肠癌复发、肝转移有关。
Atay等[39]对胃肠道间质瘤(gastrointestinal stromal tumors,GIST)衍生的外泌体首次高通量蛋白质组学研究,鉴定了构成其核心蛋白质组的1060 种蛋白如KIT、SPRY4,提供了对GIST衍生的癌体蛋白质组的首次见解,并进一步了解其促癌作用和耐药性的致癌成分胃肠道间质肿瘤衍生的外来体蛋白质组的见解揭示了新的潜在诊断生物标志物。
Li等[40]研究发现大肠癌患者手术前肿瘤组织和血浆中GPC1+外泌体的百分率和GPC1蛋白表达均明显高于正常对照组,血浆外泌体蛋白GPC1升高是大肠癌诊断的特异性标志物,也是大肠癌治疗的靶点。
随着快速大规模生产、纯化、提取和筛选外泌体内容物的发展,可以探索外泌体蛋白质的应用,以用于早期癌症诊断,监测和预后评估[41]。
3.2 治疗价值
外泌体蛋白质可介导肿瘤发生、生长、转移等,因此干预外泌体蛋白质的发生、释放、细胞摄取等生物学过程的干预有助于肿瘤治疗。外泌体蛋白质在消化系统恶性肿瘤中的治疗见表3。
表3 外泌体蛋白质与消化系统恶性肿瘤的治疗
Tab.3 Exosomal protein in the treatment of malignant tumors of the digestive system
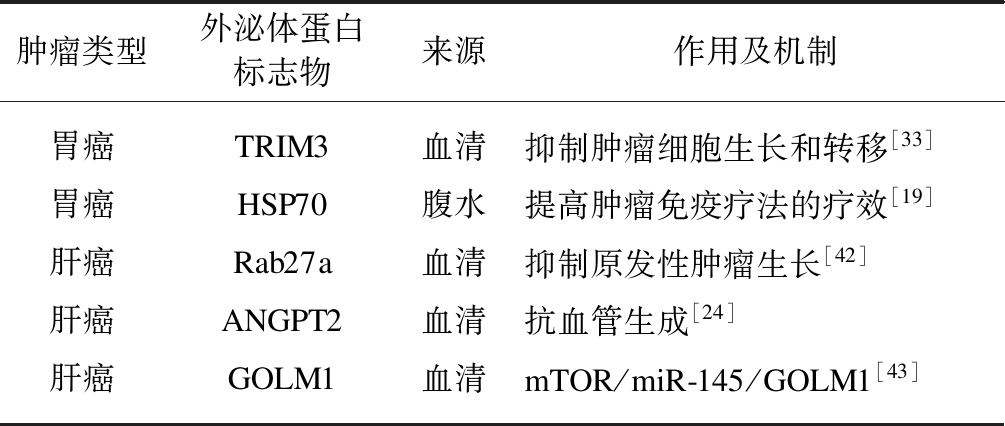
肿瘤类型外泌体蛋白标志物来源作用及机制胃癌TRIM3血清抑制肿瘤细胞生长和转移[33]胃癌HSP70腹水提高肿瘤免疫疗法的疗效[19]肝癌Rab27a血清抑制原发性肿瘤生长[42]肝癌ANGPT2血清抗血管生成[24]肝癌GOLM1血清mTOR/miR-145/GOLM1[43]
Fu等[33]发现将携带丰富TRIM3蛋白的外泌体作用于胃癌细胞,具有抑制胃癌生长和转移的效果,表明采用外泌体转运抑癌蛋白质是一种潜在的胃癌生物治疗方法。
Gobbo等[19]提出,抑制肿瘤源性外泌体表面的热休克蛋白质70活性可提高肿瘤免疫疗法的疗效。
Chen等[42]在小鼠肝癌模型中阻断外泌体蛋白质Rab27a,可减少外泌体的分泌,继而减少外泌体中多泡体生成相关蛋白,抑制原发性肿瘤生长。
Xie等[24]研究发现,由HCC细胞分泌的外泌体蛋白血管生成素样蛋白2(angiopoietin like protein 2,ANGPT2)诱导的肿瘤血管生成的新途径,不同于经典的ANGPT2/Tie2途径。这种方式可能是抗血管生成治疗的潜在治疗靶标。
Gai等[43]研究发现,高尔基体膜蛋白1(Golgi membrane protein 1,GOLM1)是HCC的血清标志物,而miR-145通过靶向GOLM1基因的编码序列抑制GOLM1表达。富含GOLM1的肝癌细胞外泌体可激活受体细胞的GSK-3β/MMPs信号轴,加速细胞增殖和迁移。因此靶向mTOR/miR-145/GOLM1信号通路可用于HCC治疗。
肿瘤细胞分泌的外泌体蛋白质既能够促进肿瘤细胞的增殖、侵袭与转移等生物学过程,抑制机体的免疫反应,还可以增加肿瘤细胞对化疗药物的耐药性,因而对肿瘤的治疗有重要价值,可能成为攻克肿瘤耐药的重要靶点[44]。
3.3 外泌体载药系统
外泌体可作为基因治疗药物的载体或基因治疗药物载体。有研究表明,发现最优的树突供体细胞是构建有效外泌体药物递送的重要前提,特别是未成熟树突供体细胞很可能是外泌体的一个理想供体细胞[44]。
Zhong等[18]将分离获得的胃癌患者的恶性腹腔积液细胞,经热处理后提取外泌体携载更多热休克蛋白,免疫原性增强,从而促进树突状细胞成熟和功能有关,提示热应激条件下恶性腹腔积液来源的外泌体热休克蛋白具有作为新型肿瘤疫苗的潜能。
生物工程外泌体已被用于以细胞特异性方式向癌细胞输送抗癌药物。通过外来体靶向肿瘤干细胞是开发癌症疗法的有前途的方法之一。为了制造修饰的外泌体,对供体细胞进行改造,使其在外泌体的膜上产生特定的蛋白质,例如外泌体蛋白质CD44、CD24、CD133和CD200,用作外泌体的靶标[45]。
4 展 望
外泌体蛋白质参与了消化系统肿瘤的发生、发展和转移,为消化系统肿瘤的诊治提供了新的线索。外泌体起着细胞间通信的作用,它们广泛存在于细胞外环境中,并具有独特的功能[6]。在像肿瘤这样的异常状态下,外泌体蛋白质参与了消化系统肿瘤的耐药,可通过抗凋亡信号,增加DNA修复或将ABC转运蛋白传递到药物敏感性细胞来转移治疗耐药性,同时可促进环境介导的治疗耐药性,可利用其传递功能用于抗癌治疗。
外泌体蛋白质可作为消化系统肿瘤新的生物标志物,可用于开发基于液体的活检,对消化系统肿瘤的诊断及治疗效果进行监测[29]。由于外泌体蛋白质的结构独特,在机体内部具有良好的生物稳定性、低毒性,其用于生物标志物研究的潜力巨大。
但是由于缺乏分析平台和可用的技术,外泌体蛋白质异质性的起源和生物学的意义在很大的程度上仍不清楚,对外泌体蛋白质参与消化系统肿瘤机制的研究还不够深入。另外,现在对外泌体分离蛋白质提取技术质量和安全性要求极高,是一个需要长期攻克的生物学难题。
随着对外泌体蛋白质作为生物标志物的深入探索和研究,期待发现越来越多的特异、灵敏外泌体蛋白标志物,利用这些外泌体蛋白质较好的细胞生物化学相容性、稳定性与生物靶向性,应用于载药系统或接种无细胞恶性肿瘤疫苗,有助于提高肿瘤的临床诊疗水平。
[1] FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-E386.
[2] 吴建国,罗蓓,朱忠政,等.顺铂腹腔化疗联合微波热疗治疗消化系统癌性腹水的临床疗效[J].同济大学学报(医学版),2020,41(5):650-653.
[3] TKACH M,THÉRY C.Communication by extracellular vesicles:where we are and where we need to go[J].Cell,2016,164(6):1226-1232.
[4] MASHOURI L,YOUSEFI H,AREF A R,et al.Exosomes:composition,biogenesis,and mechanisms in cancer metastasis and drug resistance[J].Mol Cancer,2019,18(1):1-14.
[5] BORIACHEK K,ISLAM M N,MÖLLER A,et al.Biological functions and current advances in isolation and detection strategies for exosome nanovesicles[J].Small,2018,14(6).
[6] RUIVO C F,ADEM B,SILVA M,et al.The biology of cancer exosomes:insights and new perspectives[J].Cancer Res,2017,77(23):6480-6488.
[7] YU D D,WU Y,SHEN H Y,et al.Exosomes in development,metastasis and drug resistance of breast cancer[J].Cancer Sci,2015,106(8):959-964.
[8] PINK R C,ELMUSRATI A A,LAMBERT D,et al.Royal Society Scientific Meeting:Extracellular vesicles in the tumour microenvironment[J].Philos Trans R Soc Lond B Biol Sci,2018,373(1737):20170066.
[9] ZHANG H,DENG T,LIU R,et al.Exosome-delivered EGFR regulates liver microenvironment to promote gastric cancer liver metastasis[J].Nat Commun,2017,8:15016.
[10] LI C,LIU D R,LI G G,et al.CD97 promotes gastric cancer cell proliferation and invasion through exosome-mediated MAPK signaling pathway[J].World J Gastroenterol,2015,21(20):6215-6228.
[11] LIU D R,LI C,TROJANOWICZ B,et al.CD97 promotion of gastric carcinoma lymphatic metastasis is exosome dependent[J].Gastric Cancer,2016,19(3):754-766.
[12] DEMORY BECKLER M,HIGGINBOTHAM J N,FRANKLIN J L,et al.Proteomic analysis of exosomes from mutant KRAS colon cancer cells identifies intercellular transfer of mutant KRAS[J].Mol Cell Proteomics,2013,12(2):343-355.
[13] TAURO B J,GREENING D W,MATHIAS R A,et al.Two distinct populations of exosomes are released from LIM1863 colon carcinoma cell-derived organoids[J].Mol Cell Proteomics,2013,12(3):587-598.
[14] NAZARENKO I,RANA S,BAUMANN A,et al.Cell surface tetraspanin Tspan8 contributes to molecular pathways of exosome-induced endothelial cell activation[J].Cancer Res,2010,70(4):1668-1678.
[15] TIAN X D,ZHOU D J,CHEN L,et al.Polo-like kinase 4 mediates epithelial-mesenchymal transition in neuroblastoma via PI3K/Akt signaling pathway[J].Cell Death Dis,2018,9(2):54.
[16] BLOMME A,FAHMY K,PEULEN O,et al.Myoferlin is a novel exosomal protein and functional regulator of cancer-derived exosomes[J].Oncotarget,2016,7(50):83669-83683.
[17] MAO J H,LIANG Z F,ZHANG B,et al.UBR2 enriched in p53 deficient mouse bone marrow mesenchymal stem cell-exosome promoted gastric cancer progression via wnt/β-catenin pathway[J].Stem Cells,2017,35(11):2267-2279.
[18] ZHONG H J,YANG Y S,MA S L,et al.Induction of a tumour-specific CTL response by exosomes isolated from heat-treated malignant ascites of gastric cancer patients[J].Int J Hyperthermia,2011,27(6):604-611.
[19] GOBBO J,MARCION G,CORDONNIER M,et al.Restoring anticancer immune response by targeting tumor-derived exosomes with a HSP70 peptide aptamer[J].J Natl Cancer Inst,2016,108(3):3.
[20] 杨云山,蔡志坚,钟海均.热激胃癌细胞外泌体致敏DC诱导显著的抗肿瘤免疫反应[J].中国肿瘤生物治疗杂志,2016,23(2):188-194.
[21] COSTA-SILVA B,AIELLO N M,OCEAN A J,et al.Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver[J].Nat Cell Biol,2015,17(6):816-826.
[22] LI S H,LI H,YANG X Q,et al.Vasorin is a potential serum biomarker and drug target of hepatocarcinoma screened by subtractive-EMSA-SELEX to clinic patient serum[J].Oncotarget,2015,6(12):10045-10059.
[23] HUANG A X,DONG J,LI S H,et al.Exosomal transfer of vasorin expressed in hepatocellular carcinoma cells promotes migration of human umbilical vein endothelial cells[J].Int J Biol Sci,2015,11(8):961-969.
[24] XIE J Y,WEI J X,LV L H,et al.Angiopoietin-2 induces angiogenesis via exosomes in human hepatocellular carcinoma[J].Cell Commun Signal,2020,18(1):46.
[25] LI R K,WANG Y H,ZHANG X X,et al.Exosome-mediated secretion of LOXL4 promotes hepatocellular carcinoma cell invasion and metastasis[J].Mol Cancer,2019,18(1):18.
[26] FAN J,WEI Q,KOAY E J,et al.Chemoresistance transmission via exosome-mediated EphA2 transfer in pancreatic cancer[J].Theranostics,2018,8(21):5986-5994.
[27] HU Y B,YAN C,MU L,et al.Exosomal Wnt-induced dedifferentiation of colorectal cancer cells contributes to chemotherapy resistance[J].Oncogene,2019,38(11):1951-1965.
[28] HU J L,WANG W,LAN X L,et al.CAFs secreted exosomes promote metastasis and chemotherapy resistance by enhancing cell stemness and epithelial-mesenchymal transition in colorectal cancer[J].Mol Cancer,2019,18(1):91.
[29] SIRAVEGNA G,MARSONI S,SIENA S,et al.Integrating liquid biopsies into the management of cancer[J].Nat Rev Clin Oncol,2017,14(9):531-548.
[30] FU M,GU J M,JIANG P C,et al.Exosomes in gastric cancer:roles,mechanisms,and applications[J].Mol Cancer,2019,18(1):41.
[31] GUO S,XU J,ESTELL A P,et al.Paper-based ITP technology:an application to specific cancer-derived exosome detection and analysis[J].Biosens Bioelectron,2020,164:112292.
[32] LOEI H,TAN H T,LIM T K,et al.Mining the gastric cancer secretome:identification of GRN as a potential diagnostic marker for early gastric cancer[J].J Proteome Res,2012,11(3):1759-1772.
[33] FU H L,YANG H,ZHANG X,et al.Exosomal TRIM3 is a novel marker and therapy target for gastric cancer[J].J Exp Clin Cancer Res,2018,37(1):162.
[34] 李鑫,王震,邓雅,等.外泌体在体外对胃癌耐药信息传递作用的研究[J].微创医学,2018,13(1):5-8.
[35] YOON J H,HAM I H,KIM O,et al.Gastrokine 1 protein is a potential theragnostic target for gastric cancer[J].Gastric Cancer,2018,21(6):956-967.
[36] MELO S A,LUECKE L B,KAHLERT C,et al.Glypican-1 identifies cancer exosomes and detects early pancreatic cancer[J].Nature,2015,523(7559):177-182.
[37] ADAMCZYK K A,KLEIN-SCORY S,TEHRANI M M,et al.Characterization of soluble and exosomal forms of the EGFR released from pancreatic cancer cells[J].Life Sci,2011,89(9-10):304-312.
[38] SANTASUSAGNA S,MORENO I,NAVARRO A,et al.Proteomic analysis of liquid biopsy from tumor-draining vein indicates that high expression of exosomal ECM1 is associated with relapse in stage I-III colon cancer[J].Transl Oncol,2018,11(3):715-721.
[39] ATAY S,WILKEY D W,MILHEM M,et al.Insights into theproteome of gastrointestinal stromal tumors-derived exosomes reveals new potential diagnostic biomarkers[J].Mol Cell Proteomics,2018,17(3):495-515.
[40] LI J,CHEN Y X,GUO X,et al.GPC1 exosome and its regulatory miRNAs are specific markers for the detection and target therapy of colorectal cancer[J].J Cell Mol Med,2017,21(5):838-847.
[41] LI W,LI C,ZHOU T,et al.Role of exosomal proteins in cancer diagnosis[J].Mol Cancer,2017,16(1):145.
[42] CHEN L,GUO P,HE Y C,et al.HCC-derived exosomes elicit HCC progression and recurrence by epithelial-mesenchymal transition through MAPK/ERK signalling pathway[J].Cell Death Dis,2018,9(5):513.
[43] GAI X C,TANG B F,LIU F M,et al.mTOR/miR-145-regulated exosomal GOLM1 promotes hepatocellular carcinoma through augmented GSK-3β/MMPs[J].J Genet Genomics,2019,46(5):235-245.
[44] BACH D H,HONG J Y,PARK H J,et al.The role of exosomes and miRNAs in drug-resistance of cancer cells[J].Int J Cancer,2017,141(2):220-230.
[45] TAN A,RAJADAS J,SEIFALIAN A M.Exosomes as nano-theranostic delivery platforms for gene therapy[J].Adv Drug Deliv Rev,2013,65(3):357-367.