糖尿病是一种常见的代谢性疾病,随着其病程的延长,出现糖尿病肾脏疾病的概率也逐渐增高,在2型糖尿病中仅次于大血管并发症的发生,是引起终末期肾病(end-stage renal disease,ESRD)的主要病因[1]。现今,在发达国家导致ESRD的首要原因是糖尿病肾脏疾病病(diabetic kidney disease,DKD)[2],而我国ESRD患者中约有40%的病因是糖尿病肾脏疾病[3],随着其患病率的急剧攀升,同时也增加心血管疾病的患病率和死亡率[4]。由糖尿病肾脏疾病所导致的全身各脏器的多种并发症给患者、家属和社会带来巨大的经济负担。由此可见,DKD的早期筛查和诊断非常重要,改善全球肾脏病预后组织指南推荐以尿白蛋白/肌酐比值(urine albumin creatinine ratio,ACR)作为DKD的筛查和早期诊断指标[5]。本研究旨在分析影响2型糖尿病患者ACR水平的相关临床危险因素,以利及时在临床环节开展早期干预,达到延缓糖尿病肾脏疾病的发生和进展。
1 资料与方法
1.1 研究对象
收集2012年1月—2020年5月至上海交通大学附属新华医院内分泌科住院就诊的2型糖尿病患者共1998例。纳入标准根据世界卫生组织1999年制定的2型糖尿病的诊断标准。糖尿病肾病诊断标准参照2014版《中国糖尿病肾病防治专家共识》。ACR为30~300mg/g可诊断为微量尿蛋白,ACR≥300mg/g 则可诊断为大量尿蛋白。将本研究分为3组患者:单纯糖尿病组、糖尿病微量尿蛋白组、糖尿病大量尿蛋白组,以上3组患者均已排除肾结石、肾囊肿、肾脏积液、尿路感染等影响肾功能及尿蛋白情况的因素。
1.2 研究方法
采集所有研究对象的基线和随访信息,包括患者性别、年龄、糖尿病病程、糖尿病家族史、吸烟、饮酒、合并症,同时记录患者空腹血糖、空腹C肽、空腹胰岛素、糖化血红蛋白(hemoglobin A1c,HbA1c)、胆固醇(cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白(low-density lipoprotein,LDL)、高密度脂蛋白(high-density lipoprotein,HDL)、血清肌酐(serum creatinine,Scr)、尿酸、ACR、肾小球滤过率等生化指标。所有患者均行腹部超声、颈动脉及下肢动脉超声检查并记录。按标准方法测量身高、体重、腰围、臀围和血压,并计算体重指数(body mass index,BMI)和腰臀比(waist-to-hip ratio,WHR)。依据肾脏病饮食改良(modification of diet in renal disease,MDRD)公式计算估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)[6]:eGFR=175×(Scr/88.4)-1.234×年龄-0.179[×0.79(女)]。使用生化分析仪(7104型,Hitachi公司,日本)检测血生化指标,采用高效液相色谱法(HPLC)检测HbA1c(HA-8150,Arkray公司,日本)。
1.3 统计学处理
使用SPSS 22.0软件进行统计学分析。正态分布的定量资料用![]() 表示,非正态分布数据用M(P25,P75)表示。定性资料用n(%)表示。不同尿蛋白组之间的定量资料比较采用单因素方差分析或多独立样本的秩和检验,计数资料采用χ2检验。同时,双变量正态采用Pearson相关分析,非正态采用Spearman相关分析,多因素Logistic回归模型进行有无尿蛋白相关因素的分析,以是否发生尿蛋白为因变量,将组间差异有统计学意义和/或有临床意义的变量作为自变量分析尿蛋白的危险因素,同时采用多重模型校正相关混杂因素。P<0.05为差异有统计学意义。
表示,非正态分布数据用M(P25,P75)表示。定性资料用n(%)表示。不同尿蛋白组之间的定量资料比较采用单因素方差分析或多独立样本的秩和检验,计数资料采用χ2检验。同时,双变量正态采用Pearson相关分析,非正态采用Spearman相关分析,多因素Logistic回归模型进行有无尿蛋白相关因素的分析,以是否发生尿蛋白为因变量,将组间差异有统计学意义和/或有临床意义的变量作为自变量分析尿蛋白的危险因素,同时采用多重模型校正相关混杂因素。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
共纳入1998例糖尿病患者,分析随访资料,其中无尿蛋白患者1257例,有微量尿蛋白患者542例,大量尿蛋白患者199例。大量尿蛋白组患者血清尿酸、肌酐、病程显著高于微量尿蛋白组及无尿蛋白组,eGFR值显著低于微量尿蛋白组及无尿蛋白组(P<0.05)。且大量尿蛋白组患者高血压的患病率要高于无尿蛋白组及微量尿蛋白组(P<0.05),其余指标差异均无统计学意义(P>0.05),见表1。
表1 基线T2DM患者的临床特征
Tab.1 The baseline characteristics of T2DM patients![]()
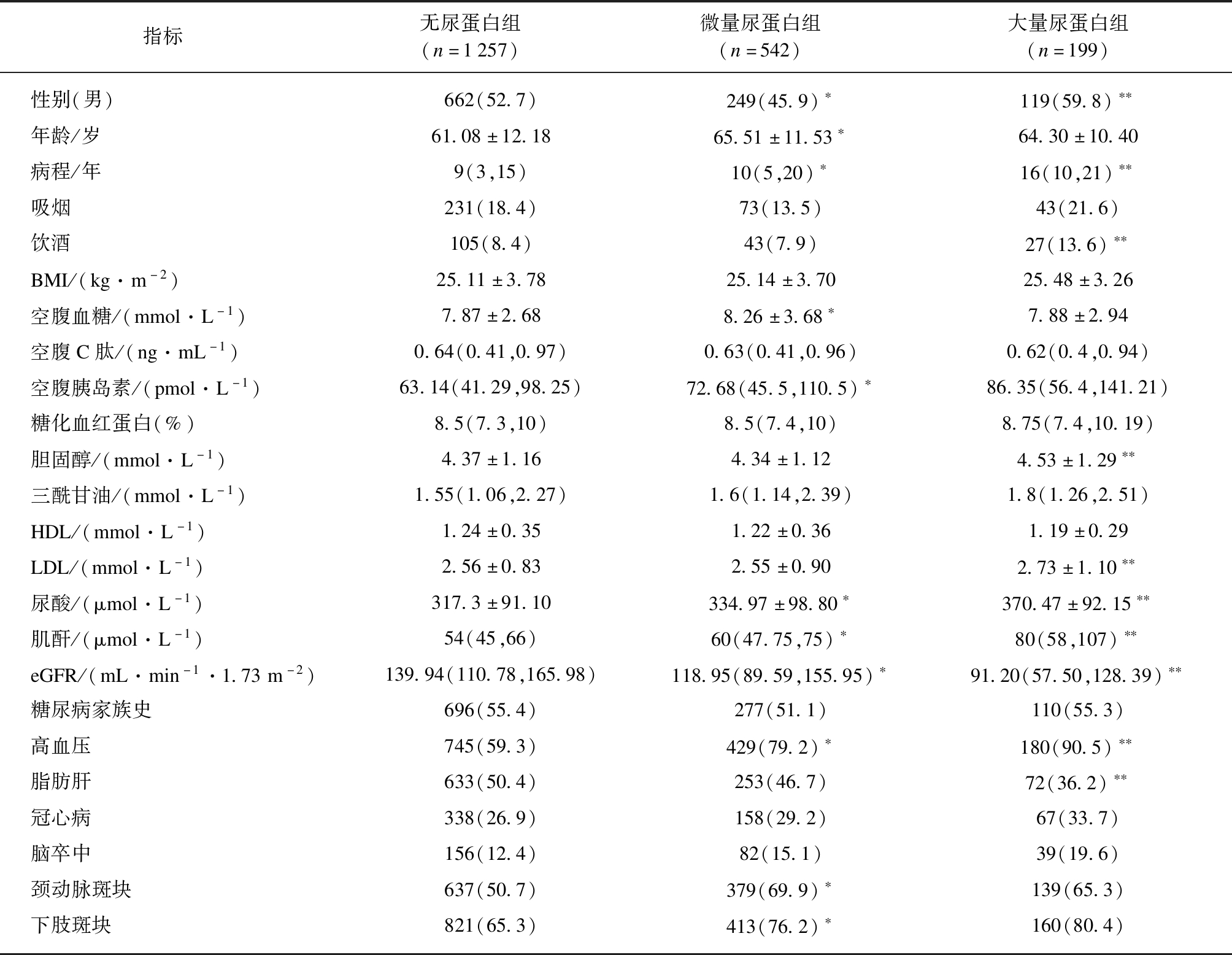
指标无尿蛋白组(n=1257)微量尿蛋白组(n=542)大量尿蛋白组(n=199)性别(男)662(52.7)249(45.9)∗119(59.8)∗∗年龄/岁61.08±12.1865.51±11.53∗64.30±10.40病程/年9(3,15)10(5,20)∗16(10,21)∗∗吸烟231(18.4)73(13.5)43(21.6)饮酒105(8.4)43(7.9)27(13.6)∗∗BMI/(kg·m-2)25.11±3.7825.14±3.7025.48±3.26空腹血糖/(mmol·L-1)7.87±2.688.26±3.68∗7.88±2.94空腹C肽/(ng·mL-1)0.64(0.41,0.97)0.63(0.41,0.96)0.62(0.4,0.94)空腹胰岛素/(pmol·L-1)63.14(41.29,98.25)72.68(45.5,110.5)∗86.35(56.4,141.21)糖化血红蛋白(%)8.5(7.3,10)8.5(7.4,10)8.75(7.4,10.19)胆固醇/(mmol·L-1)4.37±1.164.34±1.124.53±1.29∗∗三酰甘油/(mmol·L-1)1.55(1.06,2.27)1.6(1.14,2.39)1.8(1.26,2.51)HDL/(mmol·L-1)1.24±0.351.22±0.361.19±0.29LDL/(mmol·L-1)2.56±0.832.55±0.902.73±1.10∗∗尿酸/(μmol·L-1)317.3±91.10334.97±98.80∗370.47±92.15∗∗肌酐/(μmol·L-1)54(45,66)60(47.75,75)∗80(58,107)∗∗eGFR/(mL·min-1·1.73m-2)139.94(110.78,165.98)118.95(89.59,155.95)∗91.20(57.50,128.39)∗∗糖尿病家族史696(55.4)277(51.1)110(55.3)高血压745(59.3)429(79.2)∗180(90.5)∗∗脂肪肝633(50.4)253(46.7)72(36.2)∗∗冠心病338(26.9)158(29.2)67(33.7)脑卒中156(12.4)82(15.1)39(19.6)颈动脉斑块637(50.7)379(69.9)∗139(65.3)下肢斑块821(65.3)413(76.2)∗160(80.4)
无尿蛋白组与微量尿蛋白组相比,*P<0.05;微量尿蛋白组与大量尿蛋白组相比,**P<0.05
2.2 相关临床指标与血尿酸水平的关系
尿酸水平与其他临床因素的相关分析,符合双变量正态的采用Pearson相关分析,非正态采用Spearman相关分析,尿酸与BMI、三酰甘油、LDL、肌酐、ACR呈正相关(r=0.195、0.288、0.046、0.155,P=0.000、0.000、0.040、0.000、0.000),与HbA1c、HD、eGFR呈负相关(r=-0.149、-0.242、-0.410,P=0.000、0.000、0.000),尿酸水平与胆固醇无相关性(r=0.007,P=0.742)。
2.3 血尿酸水平与尿蛋白的回归分析
采用Logistic回归模型来评估血清尿酸水平是否为尿蛋白的独立预测因素,将影响尿蛋白的潜在的混杂因素纳入回归模型中,包括年龄、性别、病程、体重指数、糖化血红蛋白、高血压、尿酸、eGFR、胆固醇、LDL、三酰甘油、颈部动脉斑块、下肢动脉斑块,结果见表2。在不同的模型中,校正了混杂因素后,血清尿酸水平与尿蛋白均呈显著的正相关,是尿蛋白的独立危险因素。
表2 尿酸与尿蛋白的回归分析
Tab.2 Logistic regression analysis of uric acid and urine protein

模型OR95%CIP模型11.0021.001~1.0030.002模型21.0021.001~1.0030.006模型31.0021.001~1.0030.005模型41.0011.000~1.0030.017
模型1:校正性别、年龄、病程、BMI、尿酸、eGFR;模型2:校正性别、年龄、病程、BMI、尿酸、eGFR、胆固醇、甘油三脂、LDL;模型3:校正性别、年龄、病程、BMI、尿酸、eGFR、胆固醇、甘油三脂、LDL、HBA1C、颈动脉斑块、下肢动脉斑块;模型4:校正性别、年龄、病程、BMI、尿酸、eGFR、胆固醇、甘油三脂、LDL、HBA1C、颈动脉斑块、下肢动脉斑块、高血压
2.4 降压药物的使用对血尿酸水平的影响
比较患者使用降压药物对血尿酸水平的影响,将服用降压药物的患者分为高尿酸血症组及正常组,高尿酸水平的临床诊断标准以血尿酸大于420μmol/L 为诊断标准[7],结果见表3。服用降压药物治疗对2型糖尿病患者血尿酸水平的影响基本无显著差异。
表3 使用降压药物治疗的T2DM患者对血尿酸水平的影响
Tab.3 The blood uric acid levels of T2DM patients treated with antihypertensive drugs
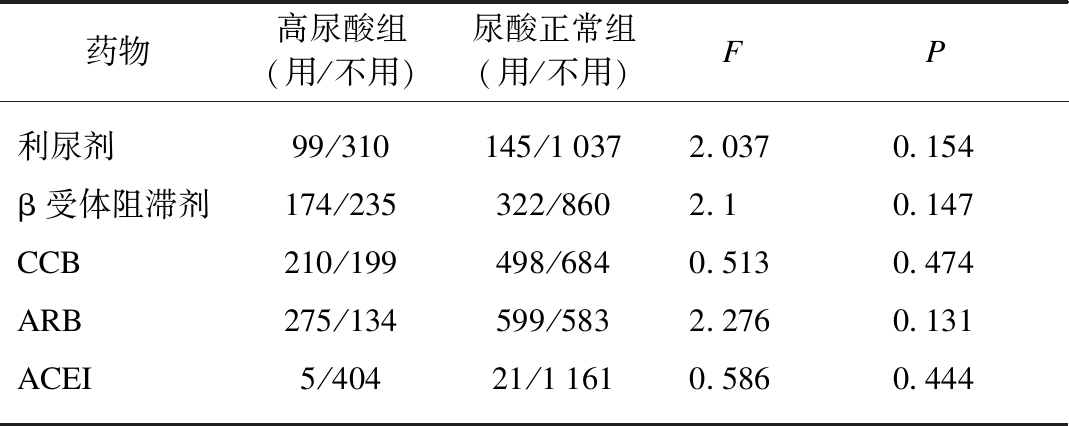
药物高尿酸组(用/不用)尿酸正常组(用/不用)FP利尿剂99/310145/10372.0370.154β受体阻滞剂174/235322/8602.10.147CCB210/199498/6840.5130.474ARB275/134599/5832.2760.131ACEI5/40421/11610.5860.444
3 讨 论
糖尿病是常见的慢性代谢性疾病之一,近30年来其患病率呈逐年上升趋势,中国疾控中心最新的流行病学调查研究显示,中国成人糖尿病患病率约为10.9%[8]。糖尿病肾脏疾病是指由糖尿病所致的慢性肾脏疾病(chronickidney disease,CKD),是糖尿病主要的微血管并发症之一。2型糖尿病病程超过5年,大多会有肾脏并发症的发生。目前我国尚缺乏全国性DKD流行病学研究资料,文献报道国内2型糖尿病患者DKD患病率为10%~40%[9]。如此庞大的DKD人群,给健康和社会经济带来严重影响,将使未来的卫生系统不堪重负。
近年来,许多大型观察性队列研究已证实血尿酸升高及尿蛋白与DKD的发生、发展密切相关,血尿酸和尿蛋白水平可作为糖尿病患者评判肾脏损伤严重程度的指标[10-11]。一项北京居民的横断面研究显示,随着血尿酸水平增加,男、女性人群尿蛋白异常的比例逐渐增加,血尿酸升高是尿蛋白的危险因素[12]。Kamei等[13]观察了165847例已发生DKD的患者,发现尿酸升高可能预测其尿蛋白和肾功能的发展。本研究通过分析2型糖尿病患者尿蛋白水平及其影响因素发现,大量尿蛋白组患者血清尿酸、肌酐显著高于微量尿蛋白组及无尿蛋白组,eGFR值显著低于微量尿蛋白组及无尿蛋白组,差异有统计学意义。Logistic回归分析进一步发现,矫正了性别、年龄、病程、BMI、尿酸、eGFR、胆固醇、三酰甘油、LDL、HBA1C、颈动脉斑块、下肢动脉斑块、高血压等可能影响尿蛋白水平的混杂因素后,血清尿酸水平与尿蛋白呈显著的正相关,是糖尿病患者尿蛋白的独立危险因素。在本研究中,Pearson相关分析也显示,2型糖尿病患者的血尿酸水平与肾小球滤过率呈负相关、与尿ACR呈正相关,与国内外的研究结果相一致[14-15]。高尿酸血症作为代谢性因素可能参与了尿蛋白及DKD的发生及发展过程,而肾功能受损亦有可能加重高尿酸血症。国内的一项横断面研究结果表明在没有使用利尿药、促尿酸排泄药物以及乙醇使用的2型糖尿病患者中的高尿酸血症和异常尿蛋白有关联[16],另外一项2型糖尿病患者的前瞻性队列研究中,eGFR<60mL/(min·1.73m2)的发生率随着血尿酸水平的增加而增加[17]。肾功能损伤被认为是高尿酸血症的一个重要后果,反之高尿酸血症可能会影响肾实质和肾小球前动脉[18-20]。随着血尿酸水平升高,析出尿酸盐结晶,沉积在肾组织堵塞肾小管,导致肾损伤,还可以通过可溶性尿酸造成肾功能下降,导致尿蛋白排泄率增高[21]。高尿酸血症可产生过量的活性氧、导致线粒体功能紊乱、使抗氧化系统受损,所致氧化应激反应在DKD中起到一定的作用[22]。研究认为尿酸诱发的炎症反应是以单钠尿酸盐(mono-sodium urate,MSU)存在,经TOLL样受体识别、激活炎性小体引起IL-18、IL-1β的增加[23]。高浓度的血尿酸水平还可以通过增强eNOS信号通路,抑制一氧化氮合成,诱导内皮细胞功能障碍,导致肾血流灌注减少和肾小球滤过率下降,促使尿蛋白和DKD的发生和进展[24-25]。故在临床应早期采取积极手段,控制糖尿病患者尿酸水平,可延缓尿蛋白和DKD的发生和进展。在今后的的研究中将继续随访患者肾功能情况,对高尿酸导致的肾小球滤过率下降速率做进一步研究。
肾脏在维持稳定血糖浓度中起着至关重要的作用。正常情况下,循环中的血尿酸,血糖可通过肾小球过滤,在近曲小管被重吸收[26]。有研究表明当葡萄糖和尿酸在近曲小管重吸收时,葡萄糖可能影响肾脏尿酸排泄及尿酸重吸收的调节[27]。临床研究结果显示严格血糖控制能够延缓2型糖尿病微量尿蛋白的进展,后续将进一步研究尿酸是否与血糖存在交互作用,在尿蛋白变化中是否起到作用。
在本次研究中还发现尿蛋白组的糖尿病患者合并颈动脉粥样硬化的比例要明显高于无尿蛋白组,既往也有研究报道指出合并尿蛋白的糖尿病患者,其颈动脉内中膜厚度(cartoid intima-media thickness,CIMT)明显增加[28],提示糖尿病大血管病变与尿蛋白亦相关。而在糖尿病人群中,血尿酸水平升高也是促进动脉粥样硬化的形成的原因之一。高尿酸水平可通过氧化应激和慢性炎症反应等多种途径引起动脉粥样硬化。Pacifico等[29]对170例青少年血尿酸水平与CIMT关系进行研究发现,血尿酸水平升高与CIMT具有显著相关性。故为延缓糖尿病大血管病变的发生,有必要密切关注糖尿病患者尿蛋白及血尿酸水平。
本研究存在一定的局限性:数据来源于患者的临床病例资料与相关实验室检查,是小样本回顾性病例对照研究,其中存在一定的混杂因素及偏倚,如糖尿病患者缺乏正常人群对照,仅有单次测量的生化结果,未将血压控制达标率、血糖控制达标率、糖尿病视网膜病变等因素考虑在内。有关2型糖尿病尿蛋白水平的相关临床研究尚需要进一步的大样本、多中心、前瞻性研究。
综上所述,在2型糖尿病患者中,尿酸为影响尿蛋白水平的独立危险因素,且随着尿酸水平的升高可增加动脉粥样硬化的风险,故临床上应加强对糖尿病患者血尿酸水平的监测,更好地控制血尿酸水平,有望延缓糖尿病肾脏疾病的发生和发展。
[1] DURAN-SALGADO M B,RUBIO-GUERRA A F.Diabetic nephropathy and inflammation[J].World J Diabetes,2014,5(3):393-398.
[2] SERAFINCEANU C,NECULAESCU C,CIMPONERIU D,et al.Impact of gender and dialysis modality on early mortality risk in diabetic ESRD patients:data from a large single center cohort[J].Int Urol Nephrol,2014,46(3):607-614.
[3] 张路霞,王海燕.从流行病学的角度探讨我国糖尿病肾病的发病趋势及对策[J].中华内科杂志,2010,49(9):804-805.
[4] JIA W,XU A,CHEN A,et al.Chronic vascular complications in diabetes[J].J Diabetes Res,2013,2013:858746.
[5] RADHAKRISHNAN J,CATTRAN D C.The KDIGO practice guideline on glomerulonephritis:reading between the (guide)lines:application to the individual patient[J].Kidney Int,2012,82(8):840-856.
[6] MA Y C,ZUO L,CHEN J H,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease[J].J Am Soc Nephrol,2006,17(10):2937-2944.
[7] 中华医学会内分泌学分会.中国高尿酸血症与痛风诊疗指南[J].中华内分泌代谢杂志,2020,36(1):1-13.
[8] WANG L M,GAO P,ZHANG M,et al.Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J].JAMA,2017,317(24):2515-2523.
[9] 中华医学会糖尿病学分会微血管并发症学组.中国糖尿病肾脏疾病防治临床指南[J].中华糖尿病杂志,2019,11(1):15-28.
[10] 孔令斯,陶敏,施映枫,等.2型糖尿病患者血清尿酸水平与缺血性脑卒中的相关性研究[J].同济大学学报(医学版),2019,40(2):190-195.
[11] ZHAO X,ZHANG X M,YUAN N,et al.Associations of bone mineral density and bone metabolism indices with urine albumin to creatinine ratio in Chinese patients with type 2 diabetes[J].Exp Clin Endocrinol Diabetes,2019,127(1):50-55.
[12] 樊晓红,蔡建芳,高碧霞,等.普通人群尿白蛋白排泄率与血尿酸的关系[J].中华内科杂志,2011,50(7):550-554.
[13] KAMEI K,KONTA T,HIRAYAMA A,et al.A slight increase within the normal range of serum uric acid and the decline in renal function:associations in a community-based population[J].Nephrol Dial Transplant,2014,29(12):2286-2292.
[14] 王玫,任安,叶山东.2型糖尿病患者血尿酸水平与尿白蛋白/肌酐的相关性研究[J].中国临床保健杂志,2012,15(4):341-344.
[15] BONAKDARAN S,HAMI M,SHAKERI M T.Hyperuricemia and albuminuria in patients with type 2 diabetes mellitus[J].Iran J Kidney Dis,2011,5(1):21-24.
[16] FU C C,WU D A,WANG J H,et al.Association of C-reactive protein and hyperuricemia with diabetic nephropathy in Chinese type 2 diabetic patients[J].Acta Diabetol,2009,46(2):127-134.
[17] DE COSMO S,VIAZZI F,PACILLI A,et al.Serum uric acid and risk of CKD in type 2 diabetes[J].Clin J Am Soc Nephrol,2015,10(11):1921-1929.
[18] DEHGHAN A,VAN HOEK M,SIJBRANDS E J G,et al.High serum uric acid as a novel risk factor for type 2 diabetes[J].Diabetes Care,2008,31(2):361-362.
[19] BORGHI C,ROSEI E A,BARDIN T,et al.Serum uric acid and the risk of cardiovascular and renal disease[J].J Hypertens,2015,33(9):1729-1741.
[20] KOHAGURA K,KOCHI M,MIYAGI T,et al.An association between uric acid levels and renal arteriolopathy in chronic kidney disease:a biopsy-based study[J].Hypertens Res,2013,36(1):43-49.
[21] S NCHEZ-LOZADA L G,TAPIA E,SANTAM-AR
NCHEZ-LOZADA L G,TAPIA E,SANTAM-AR A J,et al.Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats[J].Kidney Int,2005,67(1):237-247.
A J,et al.Mild hyperuricemia induces vasoconstriction and maintains glomerular hypertension in normal and remnant kidney rats[J].Kidney Int,2005,67(1):237-247.
[22] S NCHEZ-LOZADA L G,LANASPA M A,CRIS-T
NCHEZ-LOZADA L G,LANASPA M A,CRIS-T BAL-GARC
BAL-GARC A M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-e78.
A M,et al.Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Exp Nephrol,2012,121(3-4):e71-e78.
[23] JIN M,YANG F,YANG I,et al.Uric acid,hyperuricemia and vascular diseases[J].Front Biosci (Landmark Ed),2012,17:656-669.
[24] LI P,ZHANG L,ZHANG M,et al.Uric acid enhances PKC-dependentENOS phosphorylation and mediates cellular ER stress:a mechanism for uric acid-induced endothelial dysfunction[J].Int J Mol Med,2016,37(4):989-997.
[25] NAKAGAWA T,TANABE K,CROKER B P,et al.Endothelial dysfunction as a potential contributor in diabetic nephropathy[J].Nat Rev Nephrol,2011,7(1):36-44.
[26] BERGENSTAL R M,KLONOFF D C,GARG S K,et al.Threshold-based insulin-pump interruption for reduction of hypoglycemia[J].N Engl J Med,2013,369(3):224-232.
[27] GUERCI B,FLORIOT M,BÖHME P,et al.Clinical performance of CGMS in type 1 diabetic patients treated by continuous subcutaneous insulin infusion using insulin analogs[J].Diabetes Care,2003,26(3):582-589.
[28] 张若兰.糖尿病患者尿白蛋白排泄率/肌酐比值与大血管损害的相关性研究[J].中国医学前沿杂志(电子版),2014,(2):42-44.
[29] PACIFICO L,CANTISANI V,ANANIA C,et al.Serum uric acid and its association with metabolic syndrome and carotid atherosclerosis in obese children[J].Eur J Endocrinol,2009,160(1):45-52.