获得性再生障碍性贫血(aplastic anemia,AA,简称再障)由多种病因引起的机体造血功能障碍,以骨髓造血干细胞数量减少、骨髓造血组织脂肪化和外周血全血细胞减少为特征的血液系统疾病。其发病机制目前尚未十分清楚,近年来多数学者认为获得性AA的主要发病机制为机体中T细胞免疫异常活化导致骨髓造血功能衰竭,可能原因与机体T淋巴细胞功能异常激活,产生抑制性造血细胞因子如IL-2、IFN-γ等抑制骨髓造血干细胞的增殖分化[1]。人体T细胞亚群如TH1,TH2,Treg等分泌各种细胞因子,IL-2、IFN-γ、IL-4等调节机体免疫平衡,抑制性的细胞因子表达增加可抑制机体的造血功能。
目前国内外学者较为关注调节TH1、TH2细胞平衡的转录因子T-bet及GATA3。Solomou等[2]研究发现在获得性AA患儿外周T淋巴细胞中T-bet表达上调。而在获得性AA患儿骨髓T-bet,GATA3的表达尚未见相关报道。本研究检测获得性AA患儿骨髓组织中促使Th细胞分化为TH1、TH2细胞的调节因子T-bet,GATA3蛋白的表达变化,同时分析其外周血细胞因子水平,进一步阐明获得性AA的免疫病理机制,为获得性AA科学研究以及临床医师治疗获得性AA决策提供客观依据。
1 资料与方法
1.1 研究对象
收集同济大学附属同济医院儿科2005年8月—2018年8月保存完整的获得性AA患儿骨髓活检石蜡标本49例,该标本均为既往满足临床诊断后剩余的科学保存的石蜡标本。获得性AA患儿诊断与临床分型参考中华医学会的诊疗建议[3],临床表现为外周血细胞减少,骨髓涂片和活检等显示造血功能降低,且除外低增生性白血病和骨髓异常增生综合征等其他可导致外周血三系下降的疾病。重型为中性粒细胞<0.5×109/L、网织红细胞<20×109/L、血小板<20×109/L,上述3项中满足2项;若中性粒细胞<0.2×109/L则为极重型。非重型组25例,重型和极重型组24例。男性患儿27例,女性患儿22例,中位年龄8岁(4~10岁)。本研究获得上海市同济医院伦理委员会批准(KYSB-2015-35)。
1.2 主要试剂
T-bet单克隆抗体与GATA3单克隆抗体由美国ABCAM公司生产,组化试剂盒DAB显色剂由丹麦DAKO公司生产。
1.3 免疫组织化学染色
(1) 石蜡切片脱蜡至水;(2) 抗原修复;(3) 阻断内源性过氧化物酶;(4) 血清封闭;(5) 加入一抗:在切片上滴加PBS按一定比例(预实验约为1∶200)配好的一抗,切片平放于湿盒内,4℃孵育过夜;(6) 加入二抗:圈内滴加二抗(HRP标记)覆盖组织,室温孵育;(7) DAB显色:玻片置于PBS(pH=7.4)中在脱色摇床上晃动洗涤3次。切片稍甩干后在圈内滴加新鲜配制的DAB显色液;(8) 复染细胞核:Harris苏木精复染,盐酸乙醇分化,自来水冲洗,氨水返蓝;(9) 脱水封片;(10) 切片扫描录入,图像采集分析。
1.4 平均光密度值(average optical density,AOD)测定
切片使用数字切片全景扫描仪器进行扫描录入,随机选取切片全景图3处,进行放大400倍后采集图像,T-bet,GATA3阳性表达图片显示为棕黄色。使用图像分析软件IPP6.0对所采集图像进行平均光密度AOD值的测定,AOD值与T-bet,GATA3表达正相关,3次测定结果取平均值。
1.5 患儿外周血细胞因子水平测定
采取无发热的获得性AA患儿清晨空腹外周血,离心(离心半径12.5cm,3000r/min,10min),采用酶联免疫吸附试验测定IL-2、IL-4、IFN-γ水平,测定时严格按照试剂盒说明书操作,试剂盒由上海瓦兰生物有限公司提供。
1.6 统计学处理
数据采用SPSS 22.0软件进行统计学分析。患儿血红蛋白、红细胞计数、GATA3 AOD值符合正态性检验用![]() 表示,采用t检验。患儿年龄、骨髓病理活检报告造血组织与脂肪比值、白细胞计数、中性粒细胞计数、网织红细胞百分比、血小板计数、T-bet AOD不符合正态性检验用中位数(P25,P75)表示,采取秩和检验。血清中IL-2,IL-4,IFN-γ水平符合正态分布t检验,不符合正态分布用秩和检验。性别等分类变量,采取χ2检验。P<0.05为差异有统计学意义。
表示,采用t检验。患儿年龄、骨髓病理活检报告造血组织与脂肪比值、白细胞计数、中性粒细胞计数、网织红细胞百分比、血小板计数、T-bet AOD不符合正态性检验用中位数(P25,P75)表示,采取秩和检验。血清中IL-2,IL-4,IFN-γ水平符合正态分布t检验,不符合正态分布用秩和检验。性别等分类变量,采取χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组获得性AA患儿基线情况
两组患儿年龄、性别、外周血白细胞、中性粒细胞、血红蛋白、红细胞、网织红细胞、血小板情况如表1所示。
表1 两组获得性AA患儿基线情况与单因素分析
Tab.1 Baseline and univariate analysis of two groups of children with aplastic anemia![]()
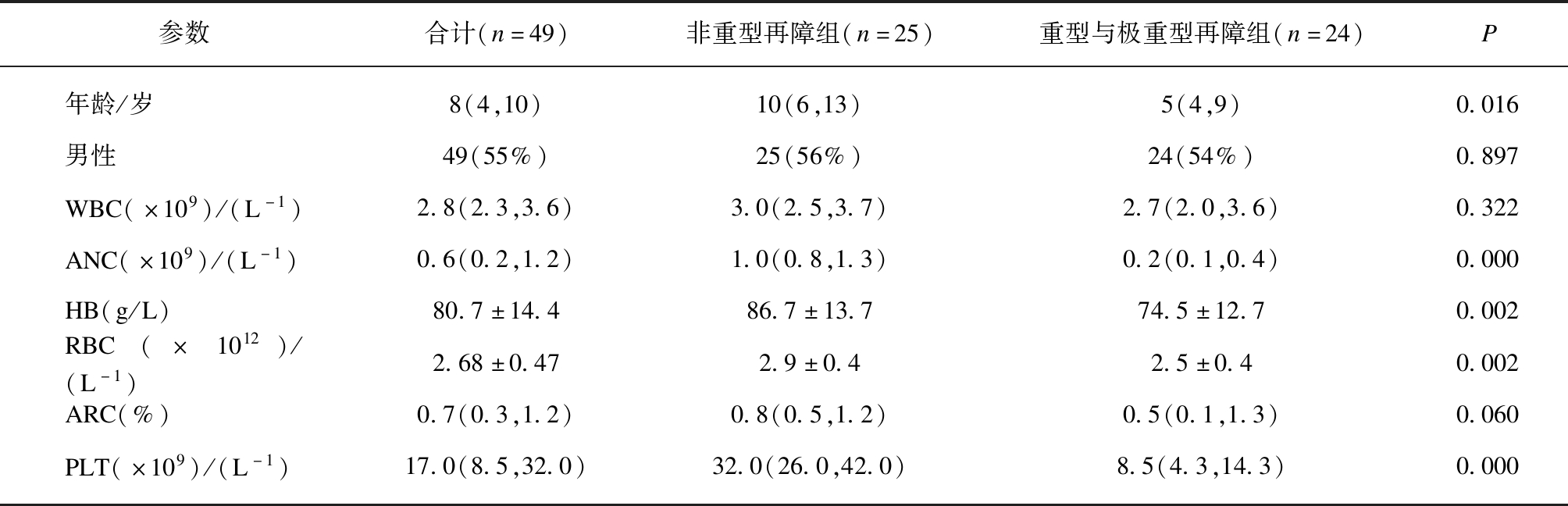
参数合计(n=49)非重型再障组(n=25)重型与极重型再障组(n=24)P年龄/岁8(4,10)10(6,13)5(4,9)0.016男性49(55%)25(56%)24(54%)0.897WBC(×109)/(L-1)2.8(2.3,3.6)3.0(2.5,3.7)2.7(2.0,3.6)0.322ANC(×109)/(L-1)0.6(0.2,1.2)1.0(0.8,1.3)0.2(0.1,0.4)0.000HB(g/L)80.7±14.486.7±13.774.5±12.70.002RBC(×1012)/(L-1)2.68±0.472.9±0.42.5±0.40.002ARC(%)0.7(0.3,1.2)0.8(0.5,1.2)0.5(0.1,1.3)0.060PLT(×109)/(L-1)17.0(8.5,32.0)32.0(26.0,42.0)8.5(4.3,14.3)0.000
WBC:白细胞;ANC:中性粒细胞;HB:血红蛋白;RBC:红细胞;ARC:网织红细胞;PLT:血小板
2.2 两组患儿骨髓病理表现
相较与非重型获得性AA患儿,在重型获得性AA患儿骨髓的H-E染色中造血细胞下降更明显,脂肪组织等非造血组织形成空泡更多,见图1。
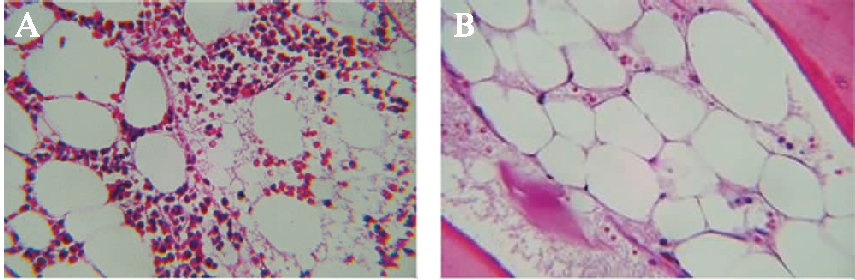
图1 不同程度获得性AA患儿骨髓H-E染色(×200)
Fig.1 H-E staining of bone marrow in children with different degrees of acquired aplastic anemia(×200)
A:非重型获得性AA患儿骨髓H-E染色;B:重型获得性AA患儿骨髓H-E染色
2.3 T-bet、GATA3蛋白在获得性AA患儿骨髓表达
T-bet蛋白在获得性AA患儿骨髓中多呈棕黄色阳性表达,T-bet在重型与极重型组较非重型组阳性表达显著增多,见图2A、B。GATA3在两组获得性AA患儿未见明显阳性表达,见图2C、D和表2。
表2 获得性AA患儿骨髓T-bet、GATA3蛋白表达比较
Tab.2 Comparison of T-bet and GATA3 protein expression in bone marrow of children with aplastic anemia![]()

蛋白Total(n=49)非重型组(n=25)重型与极重型组(n=24)PGATA3AOD0.0053±0.00100.0052±0.00090.0053±0.00100.846T-BetAOD0.0077(0.0058,0.0170)0.0060(0.0051,0.0064)0.0170(0.0140,0.0210)0.000
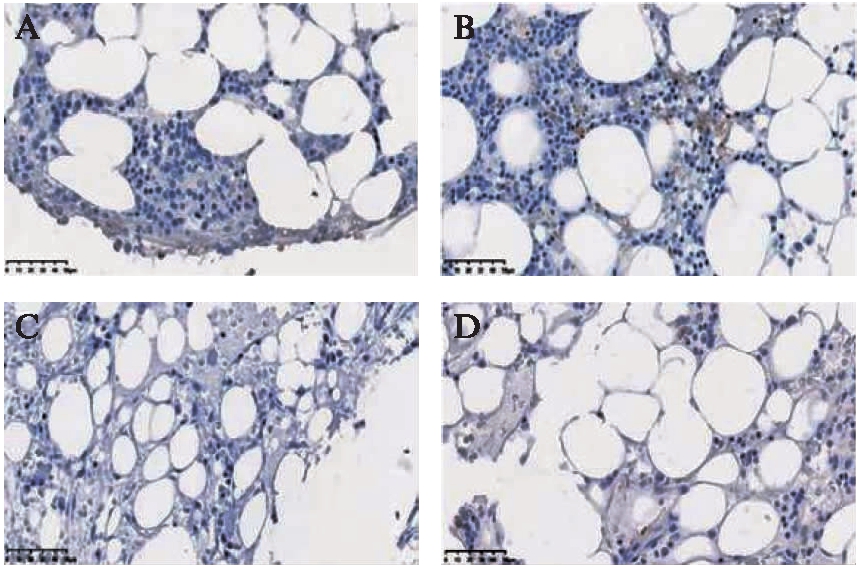
图2 T-bet、GATA3蛋白在不同程度获得性AA患儿骨髓表达
Fig.2 Expression of T-bet and GATA3 protein in bone marrow of children with different degrees of acquired aplastic anemia
A:非重型获得性AA患儿骨髓T-bet表达(×400);B:重型获得性AA患儿骨髓T-bet表达(×400);C:非重型获得性AA患儿骨髓GATA3表达(×400);D:重型获得性AA患儿骨髓GATA3表达(×400)
2.4 两组获得性AA患儿治疗前外周血细胞因子水平比较
不同程度病情获得性AA患儿IL-2,IL-4,IFN-γ表达比较,IL-2及IFN-γ在重型与极重型组显著高于非重型组(P=0.000,P=0.007),IL-4两组比较差异无统计学意义(P=0.289),见表3。
表3 两组获得性AA患儿治疗前细胞因子水平比较
Tab.3 Comparison of cytokine levels between two groups of children with AA before treatment

细胞因子非重型组(n=23)重型与极重型组(n=21)统计值PIL-2/(pg·mL-1)6.49±8.4127.4±25.8z=-3.5610.000IL-4/(pg·mL-1)14.3±10.311.1±13.0t=1.0800.289IFN-γ/(pg·mL-1)371.0±117.2466.3±145.0t=2.8780.007
3 讨 论
我国属于获得性AA高发地区,年发病率为7.4/100万[4-5]。获得性AA的自然病程长、治疗周期长,预计我国儿童获得性AA的现患率并不低于白血病,且多为重型获得性AA[6]。获得性AA严重威胁我国儿童的生命健康,重型获得性AA常因外周血下降导致严重感染或颅内出血而引起死亡。应用免疫抑制治疗获得性AA可使部分患儿病情缓解,免疫抑制治疗的有效性也进一步提示获得性AA的发病机制主要为机体免疫异常所致。
获得性AA涉及免疫紊乱可能为人体T淋巴细胞的异常激活,导致人体骨髓造血微环境的紊乱,进而影响造血干细胞增殖与分化[6-7]。获得性AA主要发病机制涉及Th1/Th2细胞比例失衡。Th1及Th2细胞分化阶段受不同抗原-抗原受体、共刺激信号分子等多种因素共同作用,而T-bet、GATA3蛋白在T细胞亚群分化过程中具有重要的调节功能[8-9]。
T-bet蛋白是Th1分化的特异性转录因子,T-bet功能结构域有与IFN-γ等造血抑制性细胞因子结合的能力。机体的T-bet不仅表达在Th1细胞,IFN-γ诱导下也可使NK细胞、树突状细胞、巨噬细胞等表达[10]。Solomou等[2]发现获得性AA患儿Itk激酶表达水平增加可刺激机体T-bet表达上调,进而促使IFN-γ基因的主动转录。IFN-γ等抑制性细胞因子通过Fas通路、半胱天冬酶和相关促凋亡基因的上调降低造血基因的表达,上调IFN-γ基因增强小鼠凋亡基因表达及活化细胞毒性T细胞,增加造血干细胞和祖细胞破坏[11-12]。既往研究显示可通过免疫调节剂OCH调节NKT细胞改善免疫机制介导骨髓衰竭模型小鼠Th1/Th2的失衡,促使Th1细胞向Th2细胞分化而改善骨髓衰竭,同时检测到骨髓中T-bet表达的改变[13]。
与T-bet相对的GATA3是GATA家族成员中的一种锌指蛋白[14]。在外界环境刺激或外源性IL-4等诱导分化体系中能通过STAT通路促使Th细胞向着Th2方向分化且检测到Th细胞胞内GATA3的mRNA表达水平明显增加[15]。Ouyang等[16]发现利用反转录病毒将GATA3的DNA转入Th细胞,Th细胞可在不受外界诱导环境下分化为Th2细胞,甚至将GATA3转入已经进行早期Th1诱导环境中的T细胞后,可促使Th1细胞分化被逆转为Th2细胞且分泌IL-4、IL-5、IL-6、IL-13等由Th2细胞分泌的相关免疫因子。近年来促炎细胞因子受到广泛关注,如罗斌等[17]分析促炎因子IL-6与患者临床结局之间的关系,发现IL-6有效地判断患儿的疾病危重程度及预测患儿的临床结局。本研究中显示Th1细胞相关的细胞因子IL-2与IFN-γ在重型和极重型再障组明显高于非重型再障组,说明T-bet相关的Th1的异常活化在获得性AA的发病中可能起着一定作用。
国内有研究通过流式细胞术与RT-PCR检测获得性AA与正常人外周血Th1、Th2、外周单个核细胞转录因子T-bet和GATA-3 mRNA基因表达,与正常人群相比,重型再障组T-bet明显升高,GATA3相比正常对照显著降低[18]。检测获得性AA患儿骨髓T-bet和GATA3的表达水平或可更直接反映骨髓Th1、Th2细胞分化水平,进一步揭示再障疾病的免疫病理机制。本研究显示重型与极重型再障患儿T-bet蛋白表达较轻型表达显著高,T-bet可能加重获得性AA患儿骨髓细胞Th1/Th2失衡而加重获得性AA的发生。本研究未检测到GATA3蛋白在不同程度获得性AA患儿骨髓病理切片表达差异,仅检测出T-bet的差异,提示T-bet在判断获得性AA病情轻重方面优于GATA3蛋白表达。目前获得性AA疾病严重程度临床诊断主要依靠于外周血常规,由于外周血常规计数受到输血制品及感染等情况的影响,临床指标并不一定能及时有效提示疾病严重程度,但机体骨髓在一定时间保持稳定状态,T-bet的表达高低一定程度上或可反映了机体免疫损伤的程度。儿童获得性AA病因复杂,通过T-bet蛋白的检测或可识别出免疫损伤因素导致的再障,排除先天性骨髓衰竭,以选择免疫抑制治疗,避免先天性骨髓衰竭患儿盲目使用免疫抑制治疗,错过了移植治疗的最佳时机。
本研究涉及的骨髓活检标本部分存放时间偏长,可能对实验结果有一定影响;进一步研究还需要与先天性骨髓衰竭或其他疾病进行对比研究;该疾病为罕见病,需多中心进一步扩大临床样本进行分析;或结合患儿的预后情况进行相关分析,为获得性AA患儿的精准治疗方案的选择提供一定的实验室依据。
[1] SCHOETTLER M L,NATHAN D G.The pathophysiology of acquired aplastic anemia:current concepts revisited[J].Hematol Oncol Clin North Am,2018,32(4):581-594.
[2] SOLOMOU E E,KEYVANFAR K,YOUNG N S.T-bet,a Th1 transcription factor,is up-regulated in T cells from patients with aplastic anemia[J].Blood,2006,107(10):3983-3991.
[3] 中华医学会儿科学分会血液学组,《中华儿科杂志》编辑委员会.儿童获得性再生障碍性贫血诊疗建议[J].中华儿科杂志,2014,52(2):103-106.
[4] 付蓉,刘春燕.再生障碍性贫血诊断与治疗中国专家共识(2017版)解读[J].临床血液学杂志,2017,30(6):821-825.
[5] MIANO M,DUFOUR C.The diagnosis and treatment of aplastic anemia:a review[J].Int J Hematol,2015,101(6):527-535.
[6] 谢晓恬.《儿童获得性再生障碍性贫血诊疗建议》的理解与实践[J].中国小儿血液与肿瘤杂志,2015,20(4):215-217.
[7] YOUNG N S.AplasticAnemia[J].N Engl J Med,2018,379(17):1643-1656.
[8] ZHANG Y,ZHANG Y,GU W,et al.TH1/TH2 cell differentiation and molecular signals[J].Adv Exp Med Biol,2014,841:15-44.
[9] HOYLER T,CONNOR C A,KISS E A,et al.T-bet and Gata3 in controlling type 1 and type 2 immunity mediated by innate lymphoid cells[J].Curr Opin Immunol,2013,25(2):139-147.
[10] SZABO S J,KIM S T,COSTA G L,et al.A novel transcription factor,T-bet,directs Th1 lineage commitment[J].Cell,2000,100(6):655-669.
[11] CHEN J C,FENG X M,DESIERTO M J,et al.IFN-γ-mediated hematopoietic cell destruction in murine models of immune-mediated bone marrow failure[J].Blood,2015,126(24):2621-2631.
[12] 王海丽,魏武.再生障碍性贫血中T-bet的表达及其对CD4+T细胞极化的调控[J].中国实验血液学杂志,2011,19(2):546-549.
[13] QIAO X H,XIE X T,SHI W,et al.OCH ameliorates bone marrow failure in mice via downregulation of T-bet expression[J].J Immunol Res,2014,2014:928743.
[14] KO L J,YAMAMOTO M,LEONARD M W,et al.Murine and human T-lymphocyte GATA-3 factors mediate transcription through a Cis-regulatory element within the human T-cell receptor delta gene enhancer[J].Mol Cell Biol,1991,11(5):2778-2784.
[15] ZHENG W,FLAVELL R A.The transcription factor GATA-3 is necessary and sufficient for Th2 cytokine gene expression in CD4 T cells[J].Cell,1997,89(4):587-596.
[16] OUYANG W J,RANGANATH S H,WEINDEL K,et al.Inhibition of Th1 development mediated by GATA-3 through an IL-4-independent mechanism[J].Immunity,1998,9(5):745-755.
[17] 罗斌,戴国兴,陈莹,等.EICU患者APACHEⅡ评分及促炎因子水平与临床结局的相关性[J].同济大学学报(医学版),2018,39(4):78-81.
[18] 杨晓红,唐旭东,许勇钢,等.转录因子T-bet和GATA-3对再生障碍性贫血免疫失衡的作用[J].广东医学,2010,31(3):290-292.