对于终末期肾病(end-stage renal disease,ESRD)患者,肾移植仍是目前唯一治愈方法。但由于缺乏合适供体,仍有不少ESRD患者长期依赖血液透析作为替代治疗。而自体动静脉瘘(autogenous arteriovenous fistula,AVF)使用时间长、感染率低,是目前血液透析患者的主要血管通路[1]。1966年Brescia等[2]首次记载了通过手术在血液透析患者建立AVF作为血管通路的方法,而近年来的指南更是强调了AVF作为血液透析患者首选血管通路并积极维持的重要性[3-4]。然而,AVF常因各种原因发生狭窄而失去功能[5]。有研究所述,AVF的1年和2年通畅率分别为60%和51%[6-7]。1989年,Schwab等[8]最先报道了经皮腔内血管成形术(percu-taneous transluminal angioplasty,PTA)可延长AVF的通畅时间。PTA具相对创伤小、安全高、恢复快,可保留现有血管资源等优点[9-10]。近年来,超声引导下PTA在临床上得到一定应用,改变了侵入性血管造影(digital subtraction angiography,DSA)的手术方式。本研究通过对ESRD患者AVF狭窄的范围和原因进行分型,分析超声引导下PTA治疗不同类型AVF狭窄的短期疗效,并对其临床意义进行探讨。
1 资料与方法
1.1 一般资料
选取2018年1月1日—2020年5月31日期间在复旦大学附属华山医院血透中心因AVF狭窄无法完成血透而入院治疗的ESRD患者47例为研究对象。
纳入标准:(1) 达到《慢性肾脏病及透析的临床实践指南》(K/DOQI指南)中终末期肾病的诊断标准;(2) 均为前臂或上臂AVF,造瘘时间1个月以上;(3) 因触诊震颤消失或瘘管流量低于 200mL/min无法完成血透,超声明确诊断为AVF狭窄;(4) 意识清晰,病情相对稳定,无严重的心、肺、脑并发症。
排除标准:(1) 非上肢AVF的患者或使用人造血管(arteriovenous graft,AVG)的患者;(2) 造瘘时间小于1个月;(3) 伴有AVF严重感染、凝血障碍或患有严重心肺功能不全、脑卒中、中心静脉回流障碍的患者;(4) 其它原因无法配合者。
1.2 仪器与方法
本研究AVF评估的超声仪器均使用日本HITACHI ALOKA公司生产的HI VISION Preirus彩色多普勒超声诊断仪,应用线阵探头(频率5~13MHz)。术前应用二维灰阶超声观察流入动脉、动静脉瘘口及引流静脉管壁、内膜、血栓,斑块并测量相关数据,明确AVF狭窄部位后多切面着重观察狭窄的范围、形态,明确原因后进行超声分型。彩色多普勒超声观察记录肱动脉、流入动脉及引流静脉的血流方向、波形、流速,血流量。术中超声引导则为美国GE公司的LOGIQ E便携式多普勒彩超诊断仪,应用线阵探头(频率5~10MHz)。术中行常规消毒铺巾,局部麻醉后超声引导下穿刺,引导鞘管、导丝及球囊的置入。累及输入动脉的狭窄使用普通球囊扩张,其余狭窄使用高压球囊,促成熟患者根据血管内径使用直径4~6mm球囊,非促成熟患者使用直径6mm球囊。球囊扩张压力为8~18个大气压(1标准大气压=101.325kPa),球囊扩张持续时间1~3min。术中为避免血液凝固和血栓再形成保持肝素化,术后一般不再使用抗凝药物。球囊扩张后观察原狭窄部位改善情况、血流动力学变化、流量恢复及是否有血栓的出现。术后超声再次评估原狭窄,观察狭窄的范围、形态,同样观察记录肱动脉、流入动脉及引流静脉的血流方向、波形、流速及流量。测量流量时患者应处于静息状态下,选择点横截面尽可能为圆形,频谱形态较规则,取样门基本覆盖整个血管。
1.3 分型和评价方法
术前根据所在部位对AVF狭窄分为4型,动脉、吻合口型(Ⅰ型)狭窄范围包括输入动脉和(或)吻合口的狭窄,静脉近吻合口型(Ⅱ型)狭窄的范围包括距离吻合口5cm以内的引流静脉段,静脉型(Ⅲ型)狭窄范围为超过吻合口5cm以外的引流静脉,复合型(Ⅳ型)狭窄为引流静脉狭窄基础上同时累及吻合口和(或)输入动脉。根据AVF狭窄原因同样分为4型,包括内膜增生型(A型)、机械缩窄型(B型)、复杂型(C型)和单纯血栓型(D型)。其中A型为因血管内膜增生引起的AVF狭窄,B型为局部单纯机械性缩窄引起的狭窄,C型为在内膜增生基础上伴有机械缩窄或出现钙化斑,D型为仅出现血栓而无其他原因的狭窄,A、B、C型均可同时伴有血栓形成,见图1。术后进行超声评估,非促成熟患者以术后触诊震颤满意并能至少成功血液透析1次、且透析显示血流量达到200mL/min以上视为技术成功,促成熟患者以短期(1个月)内随访肱动脉流量不低于300mL/min为技术成功。PTA技术成功但持续血透时间少于3个月者,为短期再狭窄,再狭窄的分型方法与术前一致。
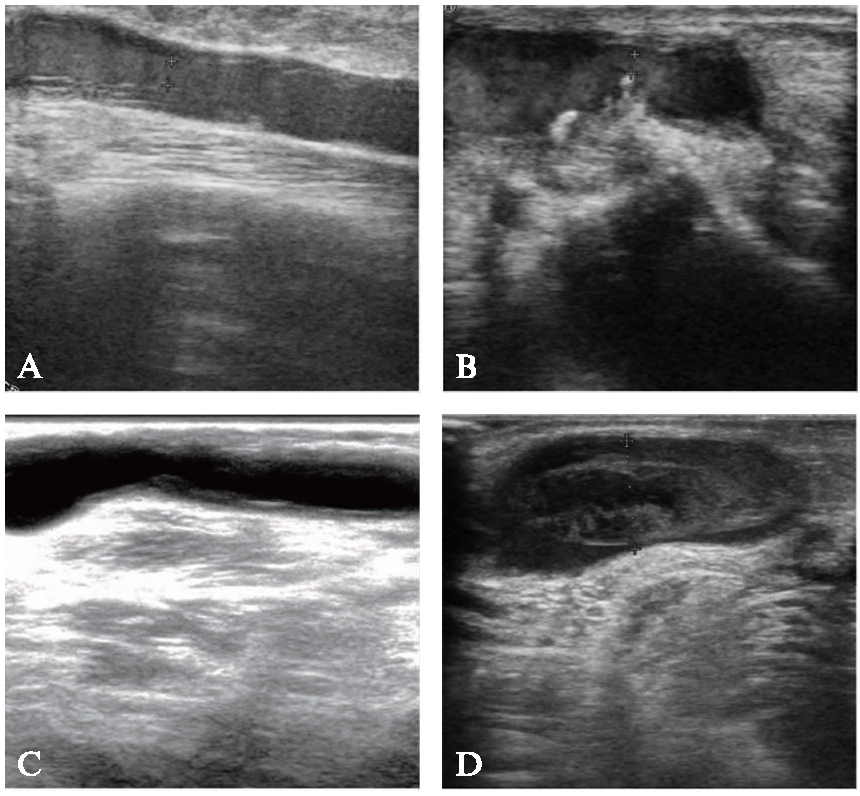
图1 根据不同原因分型的AVF狭窄超声图像
Fig.1 Ultrasonic image of stenosis of AVF typed according to different reasons
A:内膜增生型;B:机械缩窄型;C:复杂型;D:单纯血栓型
1.4 统计学处理
采用SPSS 23统计学分析软件对数据进行分析,计量资料用![]() 表示,计量资料之间比较根据方差齐性采用t或t′检验,各型狭窄发生率及复发率的比较采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
表示,计量资料之间比较根据方差齐性采用t或t′检验,各型狭窄发生率及复发率的比较采用χ2检验或Fisher精确检验,P<0.05为差异有统计学意义。
2 结 果
2.1 临床资料与分型
本组47例患者中男性22例,女性25例,平均年龄(61.5±11.5)岁,AVF建立时间1~156个月,平均(34.2±39.8)个月。38例为前臂桡动脉头静脉吻合,此外尺动脉贵要静脉吻合3例,肱动脉头静脉吻合、肱动脉贵要静脉吻合、肱动脉肘正中静脉吻合各2例。47例AVF狭窄按狭窄部位分为Ⅰ型2例(4.3%),Ⅱ型33例(70.2%),Ⅲ型5例(10.6%),Ⅳ型7例(14.9%),按狭窄原因分为A型18例(38.3%)、B型7例(14.9%)、C型18例(38.3%)和D型4例(8.5%)。统计显示Ⅱ型明显多于Ⅰ、Ⅲ和Ⅳ型(P<0.01),出现内膜增生的A型、C型分别多于B型和D型(P=0.019,P<0.01)。
2.2 疗效及复发率
47例患者PTA技术成功率91.5%(43/47),其中6例于3个月内再次发生短期再狭窄(6/43,14.0%)。PTA治疗后肱动脉、输入动脉和静脉流量明显高于治疗前流量(P<0.01),见表1。A型术后引流静脉流量提高不如B、C、D型(P<0.01)。未达到技术成功的4例均为 Ⅱ A型,PTA术后3个月内狭窄复发的6例中4例为 Ⅱ A型,另两例为ⅠC型、ⅡC型,ⅡA型的短期再狭窄率高于非 Ⅱ A型(P=0.012)。围手术期出现2例穿刺点出血外未出现血管破裂、感染等其他并发症,予以持续压迫止血后痊愈。
表1 47例患者PTA术前后流量比较
Tab.1 Comparison of PTA flow before and after in 47 patients
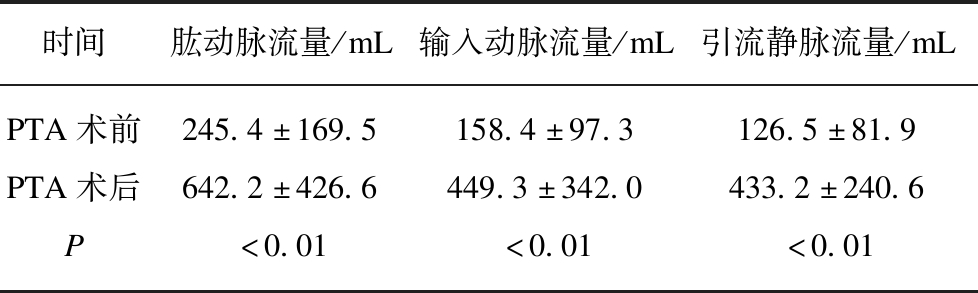
时间肱动脉流量/mL输入动脉流量/mL引流静脉流量/mLPTA术前245.4±169.5158.4±97.3126.5±81.9PTA术后642.2±426.6449.3±342.0433.2±240.6P<0.01<0.01<0.01
2.3 组织病理染色
其中1位63岁男性患者经前臂桡动脉头静脉吻合术后57个月出现ⅡA型狭窄,经PTA治疗后再次短期内出现同类型狭窄,后行瘘管切除合并高位重建术,切除的引流静脉近吻合口近段、中段、远段的标本经H-E、Masson和茜素红染色,显示狭窄部分全段内膜出现显著增生,胶原纤维在位于接近吻合口的引流静脉内膜或中膜的大量沉积,见图2。
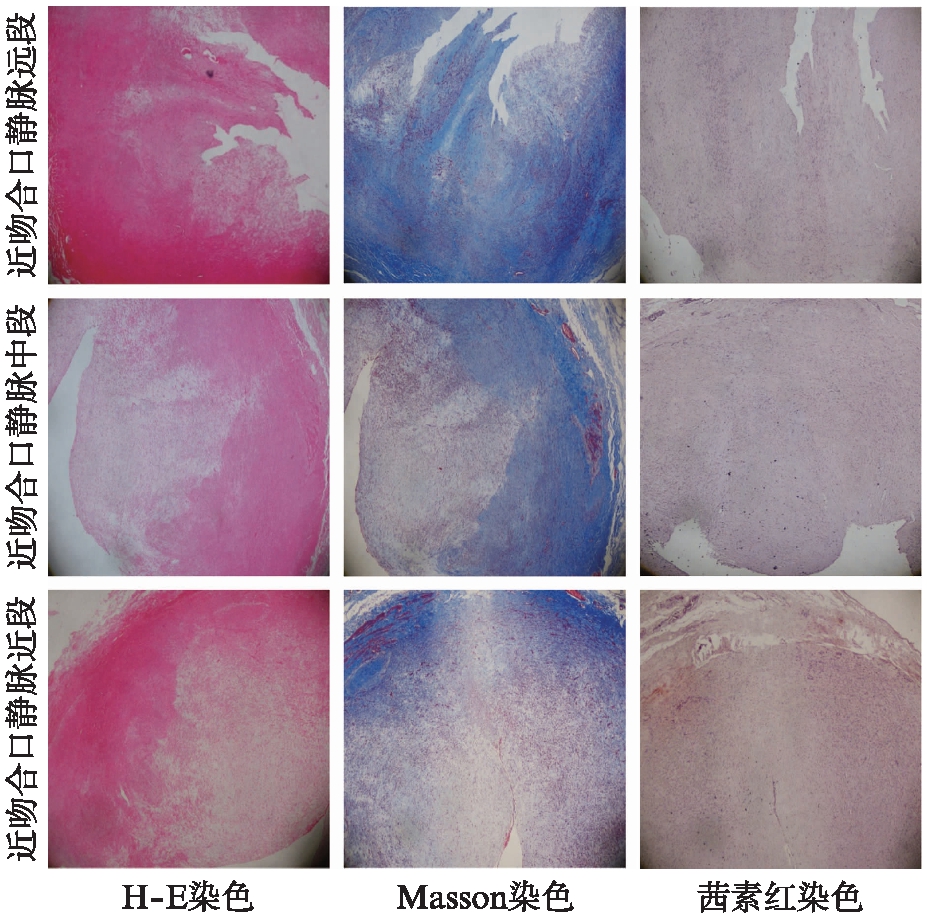
图2 AVF ⅡA型狭窄复发患者瘘管切除引流静脉近吻合口近段、中段、远端的标本经H-E、Masson和茜素红染色染色后的镜下图像(×40)
Fig.2 Microscopical images of a patient with recurrent AVF stenosis of type ⅡA who resected the proximal anastomotic segment,middle segment and distal segment of the drainage vein by H-E,Masson and alizarin red staining(×40)
3 讨 论
血液透析是目前ESRD患者的主要治疗方法之一,AVF作为目前血液透析最常用血管通路与患者生存期密切相关。本研究中根据AVF狭窄部位和原因分型,Ⅱ型狭窄即距离吻合口5cm以内的静脉段狭窄多于Ⅰ型和Ⅲ型狭窄。而PTA未达到技术成功的4例均为ⅡA型,术后3个月内狭窄复发的6例中4例为ⅡA型。组织病理染色显示狭窄部分内膜增生,胶原纤维在位于接近吻合口的引流静脉的内中膜沉积。血流动力学的变化是内膜增生这一AVF狭窄主要病因的促成因素。由于自体动静脉瘘建立后原有的血流压力梯度发生变化,而影响最大的是剪切力(wall shear stress,WSS)的变化,不稳定的剪切力是引起内膜增生和内皮细胞的损伤主要原因。低和不稳定的血管壁剪切力所出现的位置恰好是AVF狭窄的好发部位,常见于吻合口起始端静脉和引流静脉弯曲之后的内壁[11]。血管的血流动力学随着机体代谢和需要而随时发生变化,相对于这种变化,血管壁的结构是相对稳定的,但在某些情况下,血管急性改变血管张力的同时还能慢性地改变结构。由于AVF建立后WSS等因素的影响,血流动力学发生变化形成了一个高顺应性,低阻力的环境,血管结构和功能相适应的这种变化被称为血管重构[12-15]。血管重构决定了AVF能否发育成为可用的血管通路,良性的血管重构可以促成AVF成熟,恶性的血管重构则会直接导致AVF的失功。激发血管重构后促使血管细胞活化后释放各种生长因子,细胞因子、蛋白水解酶和基质成分作为应答,使AVF扩张,同时肌成纤维细胞的迁移增加,内膜增生;而同时内皮祖细胞激活,修复受损内皮,抑制内膜增生[16]。血管扩张和内膜增生同时发生,当血管扩张良好,内膜增生抑制,内皮及时修复时为良性血管重构;而血管扩张不良,内膜增生剧烈,内皮修复不良时为恶性血管重构,血管重构占优势的类型决定了AVF是否成熟或狭窄,以及狭窄的程度。此外Kokubo等[17]发现,由于血管平滑肌的增殖和迁移,慢性肾病的小鼠AVF吻合术后内膜增生程度是正常肾功能小鼠的2倍。超声引导下PTA虽能在短期内恢复AVF的血流量,但无法消除内膜增生型AVF狭窄的根本原因,无法抑制和逆转恶性血管重构,因此短期复发率高于其他类型。此外PTA可能对血管壁造成一定程度的损伤,从而加重内膜增生引起狭窄。PTA治疗也存在出现血栓、血肿和管壁夹层等并发症的可能性,并发症是PTA是否达到技术成功的重要因素。此外抗凝药物的使用、术后瘘管的护理和合理的功能锻炼均是术后是否复发的影响因素。
此外,本研究认为血管壁的机械缩窄和局部血栓的形成是AVF狭窄另两个重要原因。管壁机械缩窄常发生于吻合口或穿刺点附近,可能与血管损伤后的的修复或陈旧性血肿压迫有关,可同时伴有内膜增厚,存在这种狭窄的类型PTA治疗效果较好。血栓形成的主要病因是静脉壁损伤、血流动力学改变、高凝状态以及肾功能不全导致的凝血功能障碍以及止血药物的使用,单纯由血栓引起的狭窄发生率较低,本研究中为8.8%(3/34),治疗后短期内均未复发。目前对于ESRD患者的AVF狭窄,目前的主要治疗方法有PTA和开放手术,PTA治疗AVF狭窄的成功率大于90%[18]。开放手术是在切除狭窄或闭塞段AVF的基础上重新吻合,长期通畅率高,费用与PTA相似。但开放手术的创伤较大,且无法为患者保留有限的的自体血管资源,因此两种方法的选择时机很重要。本研究中A型狭窄PTA术后流量提高不如B、C型,ⅡA型PTA治疗后易复发,此时须考虑开放手术。另外,目前DSA仍是诊断血管病变的金标准,但超声除了具有经济性、简便性等其他检查没有的优势外,在术前可更清晰地显示血管管壁结构、血流情况,更准确地判断AVF狭窄的确切位置、范围、程度和真正的原因,确定狭窄类型,为全面评估AVF狭窄提供了详细的信息,更利于合理有效地选择干预方法,使AVF患者能在短时间内恢复瘘管功能血透[19-20]。此外,术中超声能引导穿刺置管,实时评估血流情况和PTA效果,减少手术风险和时间,降低术中并发症发生的可能性。
超声引导下PTA是治疗ESRD患者AVF狭窄的有效手段,近吻合口的引流静脉是狭窄好发部位,随访时须重点观察,且多为内膜增生或在该基础上伴其他原因引起的狭窄,采用PTA治疗易复发,必要时可考虑开放手术或重新评估后造瘘。
[1] VORWERK D,SCHURMANN K,MÜLLER-LEISSE C,et al.Hydrodynamic thrombectomy of haemodialysis grafts and fistulae:results of 51 procedures[J].Nephrol Dial Transplant,1996,11(6):1058-1064.
[2] BRESCIA M J,CIMINO J E,APPEL K,et al.Chronic hemodialysis using venipuncture and a surgically created arteriovenous fistula[J].N Engl J Med,1966,275(20):1089-1092.
[3] Vascular Access 2006 Work Group.Clinical practice guidelines for vascular access[J].Am J Kidney Dis,2006,48(Suppl 1):S176-S247.
[4] National Kidney Foundation.KDOQI Clinical practice guidelines and clinical practice recommendations for 2006 updates:hemo-dialysis adequacy,peritoneal dialysis adequacy and vascular access[J].Am J Kidney Dis,2006,47(5 Suppl 3):S1-S122.
[5] SHO E,NANJO H,SHO M,et al.Arterial enlargement,tortuosity,and intimal thickening in response to sequential exposure to high and low wall shear stress[J].J Vasc Surg,2004,39(3):601-612.
[6] Vascular Access Work Group.Clinical practice guidelines for vascular access[J].Am J Kidney Dis,2006,48(Suppl 1):S248-S273.
[7] AL-JAISHI A A,OLIVER M J,THOMAS S M,et al.Patency rates of the arteriovenous fistula for hemodialysis:a systematic review and meta-analysis[J].Am J Kidney Dis,2014,63(3):464-478
[8] SCHWAB S J,RAYMOND J R,SAEED M,et al.Prevention of hemodialysis fistula thrombosis.Early detection of venous stenoses[J].Kidney Int,1989,36(4):707-711.
[9] PERERA G B,MUELLER M P,KUBASKA S M,et al.Superiority of autogenous arteriovenous hemodialysis access:maintenance of function with fewer secondary interventions[J].Ann Vasc Surg,2004,18(1):66-73.
[10] 何勍,余波,史伟浩,等.高压球囊与普通外周球囊治疗前臂自体动静脉瘘狭窄长期通畅率的对照研究[J].同济大学学报(医学版),2017,38(1):44-47.
[11] ENE-IORDACHE B,REMUZZI A.Disturbed flow in radial-cephalic arteriovenous fistulae for haemodialysis:low and oscillating shear stress locates the sites of stenosis[J].Nephrol Dial Transplant,2012,27(1):358-368.
[12] ROY-CHAUDHURY P,SPERGEL L M,BESARAB A,et al.Biology of arteriovenous fistula failure[J].J Nephrol,2007,20(2):150-163.
[13] DIXON B S.Why don’t fistulas mature?[J].Kidney Int,2006,70(8):1413-1422.
[14] CARROLL G T,MCGLOUGHLIN T M,BURKE P E,et al.Wall shear stresses remain elevated in mature arteriovenous fistulas:a case study[J].J Biomech Eng,2011,133(2):021003.
[15] BALLERMANN B J,DARDIK A,ENG E,et al.Shear stress and the endothelium[J].Kidney Int Suppl,1998,67:S100-S108.
[16] TEICHMANN J,MORGENSTERN A,SEEBACH J,et al.The control of endothelial cell adhesion and migration by shear stress and matrix-substrate anchorage[J].Biomaterials,2012,33(7):1959-1969.
[17] KOKUBO T,ISHIKAWA N,UCHIDA H,et al.CKD accelerates development of neointimal hyperplasia in arteriovenous fistulas[J].J Am Soc Nephrol,2009,20(6):1236-1245.
[18] SINGER-JORDAN J,PAPURA S.Cutting balloon angioplasty for primary treatment of hemodialysis fistula venous stenoses:preliminary results[J].J Vasc Interv Radiol,2005,16(1):25-29.
[19] DA FONSECA JUNIOR J H,PITTA G B,MIRANDA J NIOR F.Accuracy of Doppler ultrasonography in the evaluation of hemodialysis arteriovenous fistula maturity[J].Rev Col Bras Cir,2015,42(3):138-142.
NIOR F.Accuracy of Doppler ultrasonography in the evaluation of hemodialysis arteriovenous fistula maturity[J].Rev Col Bras Cir,2015,42(3):138-142.
[20] TURMEL-RODRIGUES L A,BOURQUELOT P,PENGLOAN J.Hemodialysis arteriovenous fistula maturity:US evaluation[J].Radiology,2003,227(3):906-907.