年龄相关性黄斑变性(age-related macular degeneration,AMD)是一种后天性黄斑疾病,是主要致盲眼病之一。经国内外诸多调查研究发现,吸烟、二手烟雾是AMD的重要危险因素[1]。父母吸烟也会增加后代女子患AMD的风险[2-3]。背后机制涉及视网膜色素上皮(retinal pigment epithelium,RPE)细胞的线粒体膜电位升高,超氧化物的生成,4- 羟基-2-壬烯醛、血管内皮生长因子、血红素加氧酶-1的表达升高等。近些年又有研究发现,香烟中的尼古丁通过刺激α-肾上腺素能受体促进血管收缩引起血管痉挛来影响视网膜细胞的正常功能[4-6]。目前,除尼古丁、一氧化氮外,鲜有报道香烟烟雾中的其他物质与AMD的发生有关。本研究通过对构建的香烟暴露大鼠进行代谢组学分析,探索香烟烟雾中导致AMD发生的其他潜在毒物。
1 材料与方法
1.1 香烟暴露大鼠和萘诱导大鼠模型的建立方法与染毒标准
选取健康SD大鼠体重约为280g(购自上海斯莱克公司)。遵守同济大学医学院/同济大学生命科学与技术学院《实验动物使用和管理》规定并符合美国视觉与眼科学研究学会眼科研究领域中使用动物的要求。经适应性饲养后,随机将大鼠分为正常对照组(control group,CTL)、香烟暴露组(cigarette exposure group,CE)和萘诱导组(nap-hthalene induced group,NA)。对照组大鼠不做任何处理,自由呼吸室内空气。对香烟暴露组大鼠每周5d,每天分4次(共6h)进行暴露。每只大鼠按照每周10支84mm“红双喜牌”香烟(焦油量:11mg;烟气烟碱量:1mg;烟气一氧化碳量:13mg)的标准进行暴露。以每天1mg/kg剂量,连续2个月对SD大鼠经口灌喂萘,作为萘诱导组体内研究模型。
1.2 液相质谱(liquid chromatography mass spectro-metry,LC-MS/ MS)相关的实验动物组织的收集与处理
1.2.1 血浆提取 将大鼠按照每500g体重注射 1mL 2%戊巴比妥钠的剂量进行腹腔注射麻醉,使用心脏取血法将血液收集在肝素抗凝管中。4℃离心(离心半径13.5cm,1500r/min,15min),收集上层血浆于干净的离心管,分装后放入液氮速冻后,于-80℃保存。
1.2.2 眼组织提取 将大鼠麻醉后脱颈处死。使用灭菌的眼科解剖器械取出眼球后,用预冷的无菌1×PBS洗净。使用“前房穿刺法”收集房水,进而取出视网膜。将6只大鼠眼球的房水、视网膜、玻璃体收集于同一离心管中,制成混合样本后放入液氮速冻后,于-80℃保存。
1.2.3 动物组织的实验前处理方法 每10mg固体组织加入提前添加0.2%(体积分数)冰醋酸的乙腈100μL。每10μL液体样本加入提前添加0.2%(体积分数)冰醋酸的流动相20μL。记录稀释倍数后于4℃下匀浆组织。而在4℃离心(离心半径13.5cm,12000r/min,15min),将上清液按1∶2的比例加入流动相进行稀释,以进一步降低基质效应。最后添加终浓度为0.4μg/L的醋酸胺后快速进样分析。
1.3 香烟暴露大鼠代谢产物分析
按照1.2的方法收集大鼠血浆、房水和视网膜,送至上海百趣生物医学科技有限公司进行实验检测。
使用岛津®高性能三重四极杆液质谱联用仪TM,安捷伦®SB-C18柱为实验色谱柱,进样分析时控制柱温在45℃。单针进样体积为5μL,流速为0.2mL/min。
1-萘酚使用负离子模式,监测离子为143-99(m/z),Q1为27V,CE为8V,Q3为10V。2-萘酚使用负离子模式,监测离子为143-99(m/z),Q1为16V,CE为9V,Q3为23V。1,2-二羟基萘使用负离子模式,监测离子为159-115(m/z),Q1为10V,CE为21V,Q3为13V。1,2-萘醌使用正离子模式,监测离子为159-131(m/z),Q1为-19V,CE为-19V,Q3为-22V。
对1-萘酚、2-萘酚、1,2-萘醌使用10%、50%、90%的乙腈进行梯度洗脱。对1,2-二羟基萘使用80%乙腈进行洗脱。进流动相冲洗色谱柱后,待柱压稳定在9~12MPa后进样分析。
1.4 丙二醛(malondialdehyde,MDA)水平及总抗氧化能力(total antioxidant capacity,T-AOC)测定
将大鼠麻醉后脱颈处死,取出眼球,在体视显微镜下快速分离视网膜。每10mg视网膜组织加入提前添加苯甲基磺酰氟(PMSF)与蛋白酶抑制剂的蛋白裂解液100μL,4℃匀浆组织后于冰上放置15min,中途振荡2~3次。4℃ 离心(离心半径13.5cm,12000r/min,15min),取离心后的上清液装入新的离心管。
本实验采用BCA法来测定组织内蛋白含量。取视网膜蛋白提取液2μL,加入200μL BCA试剂盒中的工作液,37℃恒温箱30min后,读取562nm处的吸光度值(A562)。通过提前绘制好的标准曲线,通过测得吸光度,计算出样本中蛋白浓度。
按碧云天生物技术研究所出产的丙二醛(MDA)检测试剂盒及总抗氧化能力检测试剂盒(ABTS法)中的使用说明进行检测。
1.5 视网膜细胞衰老β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-gal)染色观察
将大鼠麻醉后,腹部朝上固定在手术台上,剪开胸腔。使用4%多聚甲醛(paraformaldehyde,PFA)灌注固定大鼠。灌注完毕后用眼科剪快速取出眼球,于角膜处剪出小口后,置于4%PFA中4℃固定24h。在解剖显微镜下除眼前节和晶状体后,将剩余视杯置于10%、20%、30%蔗糖液中梯度脱水。将脱水后的视杯使用OCT包埋,4℃平衡4h后转移到-80℃长期保存。实验前取出,在冰冻切片机上选择过视神经乳头的位置附近制作12μm厚度的视网膜切片。
取出视网膜切片,室温平衡15min,使用石蜡笔圈出组织,按碧云天生物技术有限公司出产的细胞衰老β-半乳糖苷酶染色试剂盒使用说明,对视网膜切片进行染色。最后使用0.5μg/mL DAPI孵育切片1min染核,PBS清洗3次后使用DAKO荧光封片剂封片,加上盖玻片于激光共聚焦下观察荧光结果。因DAPI蓝色荧光与β-gal+蓝绿色不易区分,因此对DAPI进行了红色滤色处理。
1.6 闪光视网膜电图(flicker electroretinograms,F-ERG)
将大鼠麻醉后,按每500g体重注射琥珀胆碱0.1mL的剂量在大鼠大腿进行肌内注射。两眼滴加托吡卡胺、利多卡因混合滴眼液后等待5min。使用康华瑞明视觉电生理检查仪采集视网膜电图。每只鼠眼采集3次,F-ERG图中波谷纵坐标定义为a波值,波谷后第5个波峰纵坐标定义为b波值。
1.7 CCK-8细胞活力检测
将生长状态良好的aRPE19细胞与r28细胞向96孔板中按照每孔加入6000个细胞的密度进行铺板。使用二甲基亚砜(dimethyl sulfoxide,DMSO)配置终浓度为100mmol/L 1,2-DHN母液。使用相应细胞培养基等比稀释成浓度为100、50、25、12.5、6.25、0μmol/L 的1,2-DHN工作液。待铺板细胞贴壁后,加入含不同浓度1,2-DHN的培养基处理细胞48h。
按10∶1的比例向培养基中加入CCK-8溶液。在培养箱内37℃继续孵育1h后,使用酶标仪测定450nm波长处的吸光度。
1.8 统计学处理
对代谢组学数据四分位数间距对偏离值进行过滤,实现对单个Peak的除噪。只保留单组空值不多于50%或所有组中空值不多于50%的峰面积数据对单个Peak进行过滤。对原始数据中的缺失值用最小值二分之一法进行填补。利用内标进行归一化实现数据标准化处理。差异代谢物筛选条件为VIP(该物质在该组对比的OPLS-DA模型得到的变量投影重要度)大于1且P<0.05。
利用SPSS 20.0统计学软件进行分析,所有的数据均采用以![]() 表示,进行单因素方差分析。P<0.05为差异有统计学意义。
表示,进行单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 香烟暴露大鼠血浆、房水及视网膜代谢组学分析
使用熏烟箱对大鼠暴露1个月后,与对照大鼠一同收取血浆、房水和视网膜做代谢组学分析统计。对这些差异代谢物按照来源进行初步筛查后,决定重点关注血浆及房水中的外源性差异代谢物,以便筛查出香烟烟雾中的潜在毒物。通过比对香烟暴露组大鼠与对照组大鼠血浆及房水差异代谢物热图结果发现,香烟暴露大鼠血浆与房水中出现了尼古丁和尼古丁的初级代谢物可替宁,见图1。可替宁是吸食烟草后的体内生物标志物,因此证明了香烟烟雾确实被大鼠吸入体内并发生代谢。图中1,5-萘二胺与3-氨基-2-萘甲酸在香烟暴露大鼠血浆和眼中增高。它们二者是萘的体内中间代谢物1,2-二羟基萘(naphthalene-1,2-diol,1,2-DHN)的相关物质,具有类似的生物学功能,在体内可以相互转化。曾有文章报道,萘是多品牌香烟燃烧后烟雾中含量最高的环芳烃[7]。萘的体内最终代谢物1,2-萘醌具有很强的亲电子性,非常容易与细胞内的生物大分子物质——DNA和蛋白质形成稳定的加合物。使细胞产生不可逆的损伤,诱发组织细胞进入癌症或死亡[8]。

图1 对照组大鼠与香烟暴露组大鼠的血浆及房水中的差异代谢物层次聚类数据矩阵热图
Fig.1 A.Heat map of hierarchical clustering data matrix of differential metabolites in plasma and aqueous humor of CTL group rats and CE group rats
A:血浆,阳离子模式;B:血浆,阴离子模式;C:房水,阳离子模式
视网膜中内源性差异代谢物也展示了香烟暴露对大鼠产生的影响。如2S氨基十八碳4E,6E二烯- 1,3R二醇、反-4,顺-9-十六碳二烯醛、5,7-二乙基-9-甲基-3E,5E,7E,9E-十三碳四烯、9,12,15-十八碳三烯醛等不饱和烃链的在组织中的水平下降,见图2,这提示组织内物质氧化水平升高。同时2-氨基十八烷酸、2-羟基肉桂酸等有机酸在组织内水平升高,棕榈酰胺、十二烷酰胺、油酰乙基酰胺等有机酰胺水平降低,也说明了组织内氧化应激反应的增强。此外肉豆蔻酰肉碱、反-2-十六碳烯酰肉碱、棕榈酰左旋肉碱、缩水甘油基肉碱等诸多酰基肉碱水平普遍下降,表明组织内的脂代谢水平发生下降。通过对差异代谢物进行来源分析后发现,香烟暴露大鼠视网膜中亚油酸代谢通路有非常显著的增强,这与AMD患者视网膜代谢组学结果相一致[9-10]。

图2 对照组大鼠与香烟暴露组大鼠视网膜代谢组学分析结果
Fig.2 The results of metabolomics analysis of the retina of CTL group rats and CE group rats
A:阳离子模式下差异代谢物层次聚类数据矩阵热图;B:阴离子模式下差异代谢物层次聚类数据矩阵热图;C:阴离子模式下差异代谢物代谢通路富集分析气泡图;D:阴离子模式下差异代谢物代谢通路富集分析树状图
2.2 香烟暴露大鼠眼内萘代谢物检测
本研究建立了用于LC-MS的大鼠眼部组织中萘代谢物的物质样品前处理的方法与质谱条件。使用优化后方法检测萘代谢物减小了生物基质效的影响,使待测物质响应更高,保留时间稳定,拖尾与杂峰减少,见图3。
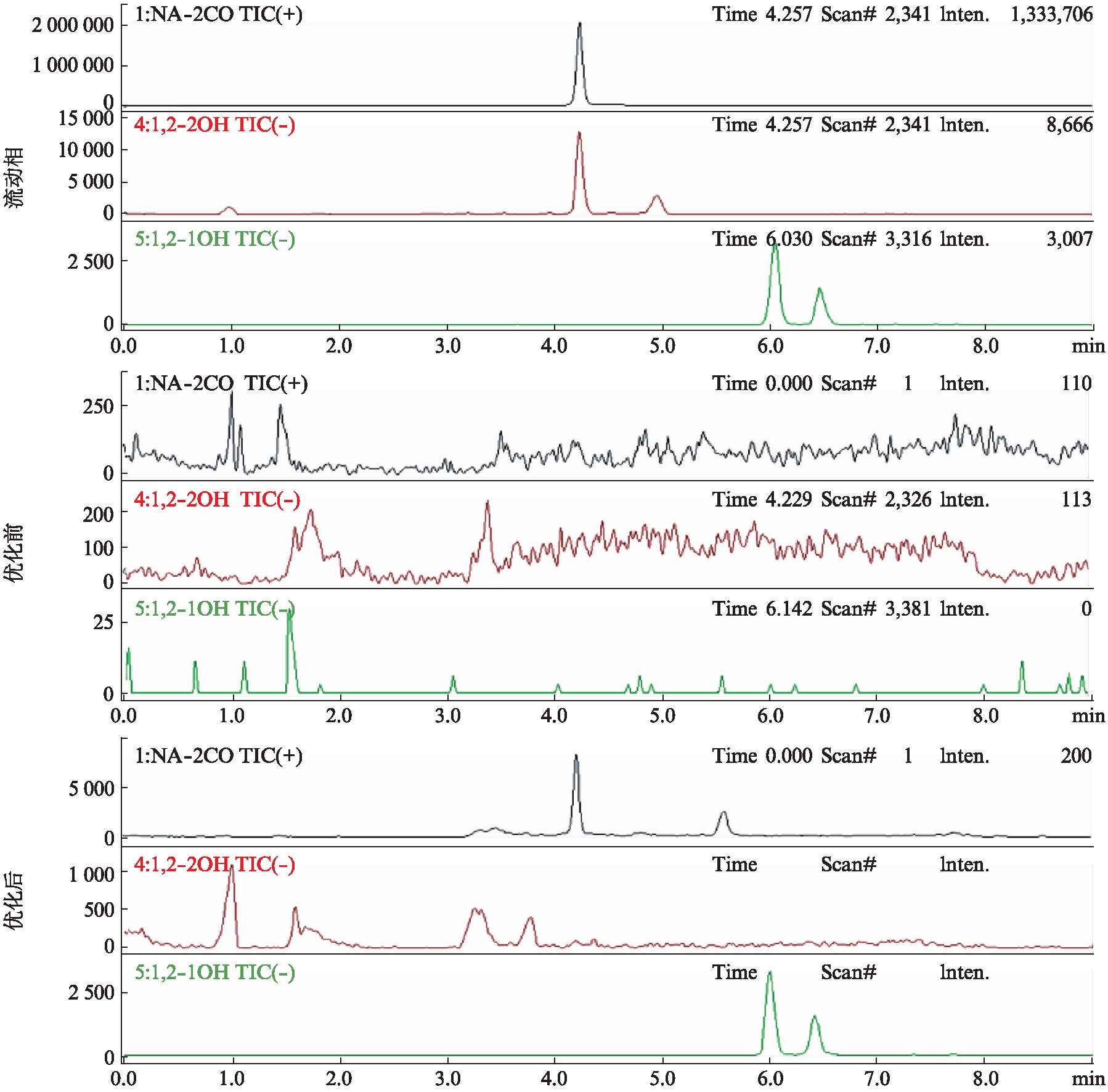
图3 萘代谢物标准品在流动相及优化前后空白生物基质中的色谱表现
Fig.3 Chromatographic performance of standard naphthalene metabolites in mobile phase and blank biological matrix before and after optimization
绿色:1-萘酚、2-萘酚;棕色:1,2-二羟基萘酚;黑色:2-萘醌
实验检测了1-萘酚、2-萘酚、1,2-二羟基萘和1,2-萘醌在组织内的存在情况。发现香烟暴露大鼠的眼内多组织均检测到了不同响应大小的萘代谢物峰。萘代谢物基本以开环后的1,2-二羟基萘与最终氧化形式1,2-萘醌的形式存在于眼部组织中,见图4。其中房水中的1,2-二羟基萘与视网膜中的1,2-萘醌响应峰最高。

图4 大鼠眼中的萘代谢物LC-MS分析结果
Fig.4 LC-MS analysis results of naphthalene metabolites in rat eyes
绿色:1-萘酚,2-萘酚;棕色:1,2-二羟基萘酚;黑色:2-萘醌;样品为6只大鼠眼球收集的混合样品
2.3 香烟暴露大鼠视网膜内MDA水平上升,T-AOC下降
经过6个月的香烟暴露后,香烟暴露大鼠视网膜内MDA水平相比对照明显升高(P<0.05),总抗氧化能力也出现了下降(P<0.05),见图5。这表明较长时间的香烟暴露使得大鼠体内抗氧化物质消耗加速,组织细胞也一定上发生了氧化损伤。同时研究也对萘诱导组大鼠视网膜内MDA水平和T-AOC进行了检测,发现萘诱导组大鼠视网膜内也同样发生了氧化应激,且作用更加剧烈。
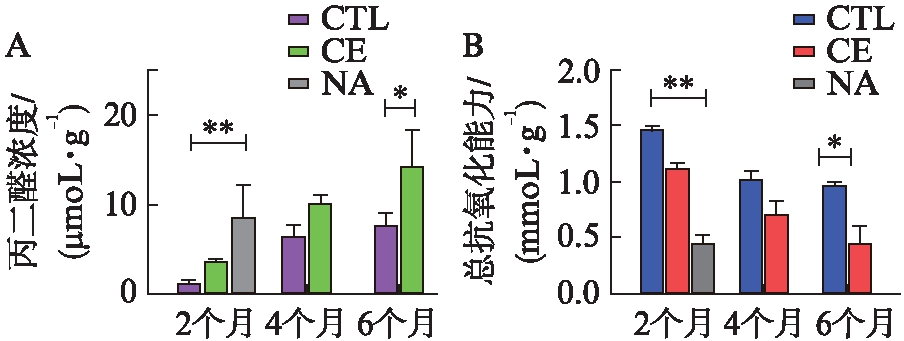
图5 对照组大鼠与香烟暴露组大鼠视网膜内MDA水平及总抗氧化能力分析
Fig.5 The analysis of MDA level and total antioxidant capacity in the retina of CTL group rats and CE group rats
n=6,结果表示为![]()
2.4 香烟暴露引起大鼠视网膜细胞发生衰老
视网膜内巨噬细胞衰老与RPE细胞衰老均与AMD的发病密切相关。代谢组学结果提示香烟暴露大鼠视网膜中有更多具有“衰老标志”的物质在积累。为近一步观察香烟暴露大鼠视网膜细胞是否发生衰老以及衰老发生的部位。本研究使用SA-β-Gal法对大鼠视网膜冰冻切片进行染色。实验发现,香烟暴露大鼠视网膜细胞发生了衰老。且衰老细胞主要集中于RPE细胞层。同时节细胞层也有部分细胞表现出β-gal+,见图6。
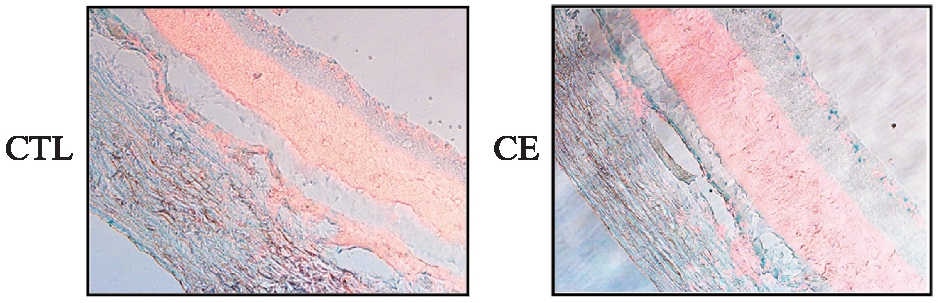
图6 对照组大鼠与香烟暴露组大鼠视网膜切片SA-β-gal染色结果
Fig.6 The SA-β-gal staining results in retina sections of CTL group rats and CE group rats
衰老细胞,蓝绿色;DAPI,红色;n=6,选择视网膜中视神经旁出中段位置拍照
2.5 香烟暴露使得大鼠视网膜功能发生降低
当大鼠经香烟暴露4、6个月时,对其进行F-ERG 检测。F-ERG结果显示,经4个月香烟暴露后,大鼠视网膜b波较正常大鼠发生了下降(187.43 vs 398.21,n=6,P<0.05)。表示视网膜功能在香烟暴露4个月后出现下降。经6个月的香烟暴露后,这种下降的趋势则更为明显(122.7 vs 364.1,n=6,P<0.05),见图7。
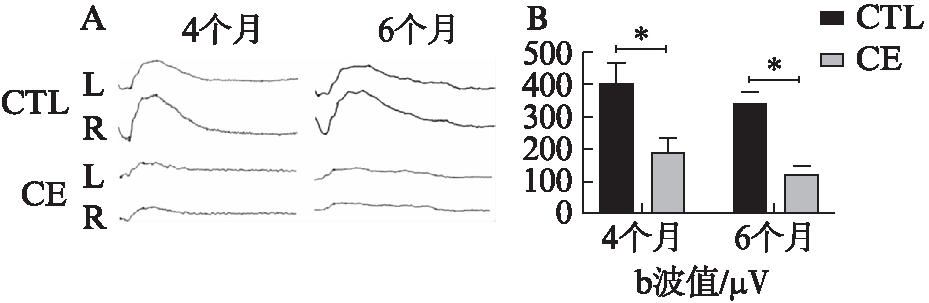
图7 对照组大鼠与香烟暴露组大鼠F-ERG实验检查结果
Fig.7 F-ERG examination results of CTL group rats and CE group rats
A:F-ERG检查波形图;B:对b波值的统计分析结果;n=6,结果表示为![]()
2.6 萘经口灌胃使得大鼠视网膜功能发生降低
对萘诱导组大鼠同样进行F-ERG检测发现,大鼠视网膜b波较正常大鼠发生了显著下降(511.7 vs 375.2,n=6,P<0.01),见图8。表示萘诱导大鼠视网膜功能较对照大鼠发生了显著下降。
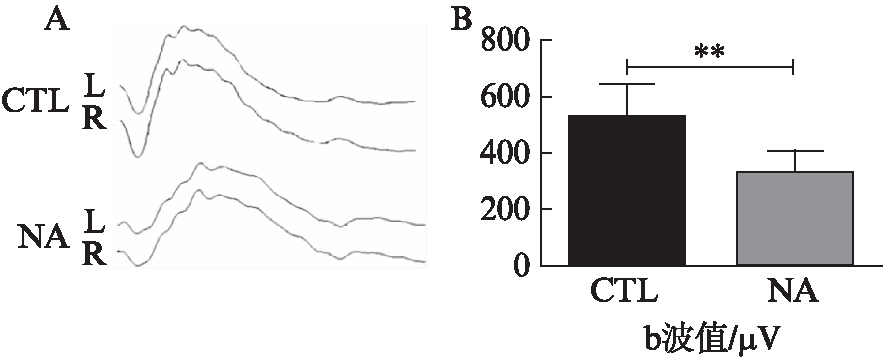
图8 对照组大鼠与萘诱导组组大鼠F-ERG实验检查结果
Fig.8 F-ERG examination results of CTL group rats and NA group rats
A:F-ERG检查波形图;B:对b波值的统计分析结果;n=6,结果表示为![]()
2.7 1,2-DHN会使视网膜细胞活力下降
通过LC-MS在香烟暴露大鼠视网膜内明确发现了1,2-DHN。为进一步确定萘代谢物对视网膜细胞的毒性作用。本研究选择了aRPE19细胞系和r28细胞系的细胞进行了体外实验。结果发现,1,2-DHN在极低的浓度时便会对aRPE19与r28细胞产生强烈的细胞毒性,见图9。图中以相对细胞活力为纵轴,经倍比稀释的1,2-DHN浓度为横轴,观察到1,2-DHN作用于两种细胞的半数致死量仅在10μmol/L左右。
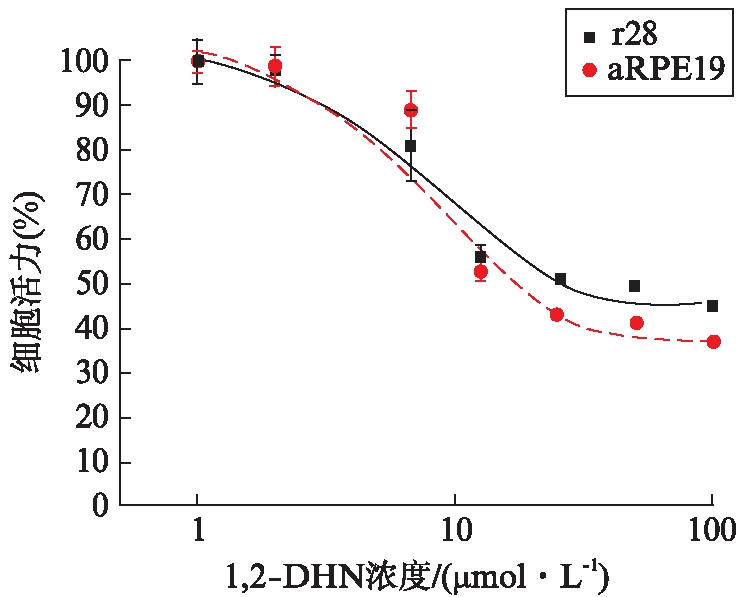
图9 通过CCK-8实验检测到1,2-DHN处理的r28和aRPE19的细胞活力
Fig.9 Cell viability of r28 and aRPE19 treated with 1,2-DHN detected by CCK-8 assay
初始细胞密度:8×104 /孔
3 讨 论
不同于以往基于大规模流行病学调查来进行疾病代谢物的相关研究。近年来非靶向代谢组学分析技术的进步使得代谢物研究更加科学与高效。这使得视网膜中复杂的代谢物库不断完善和积累,如今代谢组学也已经成熟地用于研究诸如高糖高脂等饮食干预、胃肠道菌群、各种微量营养素对AMD发生的各类动物和人体模型的重要研究方法[11]。本研究通过分析香烟暴露组大鼠与对照组大鼠之间代谢图谱的差异,讨论了经香烟暴露后大鼠视网膜中代谢物变化差异。同时合理推测出香烟烟雾中会损伤大鼠视网膜的一种关键毒性物质——萘,并在体内体外设计了简单的实验来验证萘代谢物对视网膜产生的影响。
虽然本研究证明了香烟烟雾中的萘会引起大鼠视网膜受损,但是也不可否认香烟暴露作为一个诱发疾病的环境因素,对视网膜的作用是复杂多样的。此外通过代谢组学,发现香烟暴露会使得大鼠视网膜中包括左旋肉碱在内的多种酰基肉碱在视网膜中的水平发生了下降。左旋肉碱及其衍生物参与体内诸多生理过程,包括糖的有氧代谢,氧化磷酸化,脂肪酸的氧化和渗透等。左旋肉碱可通过发挥抗氧化作用来延缓AMD的发生[12]。临床试验证明,对患有年龄相关性黄斑变性的患者补充乙酰基左旋肉碱,可以改善患者视野平均缺损,视敏度,中央凹敏感性和眼底情况,帮助其恢复视觉功能[13]。视网膜也是眼内肉碱含量最丰富的组织结构之一[14]。香烟暴露引起的大鼠视网膜酰基肉碱水平下降,使得左旋肉碱在体内具有的抗氧化作用也随之降低。这会导致香烟暴露大鼠更易受到氧化损伤。香烟暴露组大鼠视网膜中诸多不饱和烃链水平相较对照组大鼠有着明显的降低,也很好地证明了经香烟暴露后组织内氧化水平升高。同时香烟暴露大鼠视网膜左旋肉碱的水平降低也可能会导致肉碱在视网膜的抗凋亡和维持渗透压的作用受到阻碍,不能很好地发挥其改善RPE细胞和内皮细胞的细胞迁移,增殖和黏附的作用[15],会引起视网膜组织动脉血流异常,进而影响视网膜的功能。AMD的发病机制涉及RPE细胞对光感受器外节的吞噬消化能力下降,使未被完全消化的盘膜残余小体潴留于基底部细胞中,沉积于Bruch膜,形成玻璃膜疣。而玻璃体疣则主要由酯化胆固醇、磷脂酰胆碱和蛋白质形成[16]。磷脂在体内经氧化分解可产生溶血磷脂和脂肪酸等物质,视网膜细胞中磷脂的氧化也会参与AMD发病进程[17]。本研究发现香烟暴露大鼠视网膜中有着较对照更高的磷脂酰胆碱水平,以及更高的脂肪酸水平,这又从另一方面说明了香烟暴露大鼠视网膜中氧化水平的升高。除此以外,香烟暴露大鼠视网膜中亚油酸代谢通路的异常升高。有研究指出摄入过量特定类型的脂肪会增加人或小鼠AMD发病的风险[18]。背后机制涉及亚油酸通过激活p42/44,MAPK,进而诱导NF-κB转录激活,上调一氧化氮合酶和环氧合酶-2的表达,来对AMD发病进程产生影响[19]。并且组织内高浓度的亚油酸还可以直接刺激RPE细胞来加速促炎基因的表达[20]。
本研究使用代谢组学及靶向鉴定的方法明确了萘代谢物在香烟暴露大鼠视网膜中存在。萘在体内的代谢途径包括环氧化物水解酶催化途径制、CYP过氧化物酶催化途径、醛酮还原酶催化途径。萘在环境中经呼吸道或食管进入体内后,首先会被相应组织内的细胞色素P-450酶依赖的单氧化酶转化成不稳的环氧化物中间体,代谢后的环氧化物大部分会在水解酶的作用下形成1,2-二氢-萘二酚,同时一小部分会通过非酶促反应代谢为1-萘酚与2-萘酚。1,2-二氢-萘二酚经血液循环进入眼内后,可以通过组织细胞中的酪氨酸酶将其脱氢氧化形成1,2-二羟基萘。1,2-DHN在组织内又会被快速氧化为1,2-萘醌[21-22]。其实不只局限于视网膜,在采集的香烟暴露大鼠房水和玻璃体的混合样本中,也发现了萘的代谢物。萘代谢物在眼中不同部位的分布略有不同:房水中的萘代谢物主要以1,2-DHN的形式存在,玻璃体中则观察到了1,2-DHN和1,2-萘醌,视网膜中则更多的是以具有强氧化性的最终代谢物1,2-萘醌形式存在。这说明拥有更多细胞的视网膜组织中1,2-DHN到1,2-萘醌的氧化过程发生得更为迅速且彻底。其过程中伴随生成的大量过氧化氢也可直接作用于视网膜细胞来造成氧化损伤。
以往对于吸烟导致AMD的机制解释主要关注在尼古丁上,本研究证明了香烟烟雾中的新毒物——萘,对香烟暴露大鼠视网膜也具有损伤作用,这种损伤也可能同样发生于人类。这或可从一个新的角度帮助认识吸烟与AMD发病之间的关系。此次萘代谢产物对视网膜毒性作用的发现补充了之前流行病学数据的结果。
[1] NITA M,GRZYBOWSKI A.Smoking and eye pathologies.A systemic review.part Ⅱ.Retina diseases,uveitis,optic neuropathies,thyroid-associated orbitopathy[J].Curr Pharm Des,2017,23(4):639-654.
[2] KANTARCI F A,TATAR M G,COLAK H N,et al.A pilot study of choroidal thickness in long-term smokers[J].Retina,2016,36(5):986-991.
[3] GARHÖFER G,RESCH H,SACU S,et al.Effect of regular smoking on flicker induced retinal vasodilatation in healthy subjects[J].Microvasc Res,2011,82(3):351-355.
[4![]() ÇELIK F,
ÇELIK F,![]() Ü,et al.Effect of smoking on choroidal thickness in healthy smokers[J].Curr Eye Res,2014,39(5):504-511.
Ü,et al.Effect of smoking on choroidal thickness in healthy smokers[J].Curr Eye Res,2014,39(5):504-511.
[5] SIZMAZ S,KÜÇÜKERDÖNMEZ C,PINARCI E Y,et al.The effect of smoking on choroidal thickness measured by optical coherence tomography[J].Br J Ophthalmol,2013,97(5):601-604.
[6] DAT N D,CHANG M B.Review on characteristics of PAHs in atmosphere,anthropogenic sources and control technologies[J].Sci Total Environ,2017,609:682-693.
[7] RODGMAN A.Studies of polycyclic aromatic hydrocarbons in cigarette mainstream smoke:identification,tobacco precursors,control of levels:a review[J].Beiträge Zur Tabakforschung Int Tob Res,2014,19(7):361-379.
[8] AHLMANN J.Detection of polycyclic aromatic hydrocarbons in cigarette tar[J].Acta Pathol Microbiol Scand,1958,43(4):379-390.
[9] DAT N D,CHANG M B.Review on characteristics of PAHs in atmosphere,anthropogenic sources and control technologies[J].Sci Total Environ,2017,609:682-693.
[10] LA NS I,DUARTE D,BARROS A S,et al.Human plasma metabolomics in age-related macular degeneration (AMD) using nuclear magnetic resonance spectroscopy[J].PLoS One,2017,12(5):e0177749.
NS I,DUARTE D,BARROS A S,et al.Human plasma metabolomics in age-related macular degeneration (AMD) using nuclear magnetic resonance spectroscopy[J].PLoS One,2017,12(5):e0177749.
[11] RINNINELLA E,MELE M C,MERENDINO N,et al.The role of diet,micronutrients and the gut microbiota in age-related macular degeneration:new perspectives from the Gut-Retina axis[J].Nutrients,2018,10(11):E1677.
[12] ATES O,ALP H H,MUMCU U,et al.The effect of L-carnitine treatment on levels of malondialdehyde and glutathione in patients with age related macular degeneration[J].Eurasian J Med,2008,40(1):1-5.
[13] FEHER J,KOVACS B,KOVACS I,et al.Improvement of visual functions and fundus alterations in early age-related macular degeneration treated with a combination of acetyl-L-carnitine,n-3 fatty acids,and coenzyme Q10[J].Ophthalmologica,2005,219(3):154-166.
[14] PESCOSOLIDO N,IMPERATRICE B,KARAVITIS P.The aging eye and the role of L-carnitine and its derivatives[J].Drugs R D,2008,9(Suppl 1):3-14.
[15] PESCOSOLIDO N,IMPERATRICE B,KARAVITIS P.Ocular disorders secondary to systemic disease and the potential role of carnitines[J].Drugs R D,2008,9(Suppl 1):15-22.
[16] LIUTKEVICIENE R,VILKEVICIUTE A,SMALINSKIENE A,et al.The role of apolipoprotein E (rs7412 and rs429358) in age-related macular degeneration[J].Ophthalmic Genet,2018,39(4):457-462.
[17] SUZUKI M,KAMEI M,ITABE H,et al.Oxidized phospholipids in the macula increase with age and in eyes with age-related macular degeneration[J].Mol Vis,2007,13:772-778.
[18] SEDDON J M,ROSNER B,SPERDUTO R D,et al.Dietary fat and risk for advanced age-related macular degeneration[J].Arch Ophthalmol,2001,119(8):1191-1199.
[19] FANG I M,YANG C H,YANG C M,et al.Linoleic acid-induced expression of inducible nitric oxide synthase and cyclooxygenase Ⅱ via p42/44 mitogen-activated protein kinase and nuclear factor-kappaB pathway in retinal pigment epithelial cells[J].Exp Eye Res,2007,85(5):667-677.
[20] FANG I M,YANG C H,YANG C M,et al.Comparative effects of fatty acids on proinflammatory gene cyclooxygenase 2 and inducible nitric oxide synthase expression in retinal pigment epithelial cells[J].Mol Nutr Food Res,2009,53(6):739-750.
[21] XU G T,ZIGLER J S Jr,LOU M F.Establishment of a naphthalene cataract modelin vitro[J].Exp Eye Res,1992,54(1):73-81.
[22] HRYCAY E G,BANDIERA S M.The monooxygenase,peroxidase,and peroxygenase properties of cytochrome P450[J].Arch Biochem Biophys,2012,522(2):71-89.
[23] RATHBUN W B,HOLLESCHAU A M,COHEN J F,et al.Prevention of acetaminophen- and naphthalene-induced cataract and glutathione loss by CySSME[J].Invest Ophthalmol Vis Sci,1996,37(5):923-929.
[24] CHEN Y,YI L,YAN G Q,et al.Decreased chaperone activity of alpha-crystallins in naphthalene-induced cataract possibly results from C-terminal truncation[J].J Int Med Res,2010,38(3):1016-1028.
[25] SU ER I J,ESPINOSA-HEIDMANN D G,MARIN-CASTANO M E,et al.Nicotine increases size and severity of experimental choroidal neovascularization[J].Invest Ophthalmol Vis Sci,2004,45(1):311-317.
ER I J,ESPINOSA-HEIDMANN D G,MARIN-CASTANO M E,et al.Nicotine increases size and severity of experimental choroidal neovascularization[J].Invest Ophthalmol Vis Sci,2004,45(1):311-317.
[26] KLETTNER A K,DOTHS J,ROIDER J.Nicotine reduces VEGF-secretion and phagocytotic activity in porcine RPE[J].Albrecht Von Graefes Arch Fur Klinische Und Exp Ophthalmol,2012,250(1):33-38.
[27] YAMADA Y,ISHIBASHI K,ISHIBASHI K,et al.The expression of advanced glycation endproduct receptors in RPE cells associated with basal deposits in human maculas[J].Exp Eye Res,2006,82(5):840-848.
[28] CHEN M,GLENN J V,DASARI S,et al.RAGE regulates immune cell infiltration and angiogenesis in choroidal neovascularization[J].PLoS One,2014,9(2):e89548.