全球每年有数以百万的人口罹患结核病[1]。结核病至今依旧位列全球十大死因之一,是单病种病死率最高的传染病[2]。世界卫生组织(World Health Organization,WHO)最新结核病疫情报告[3]显示: 2017年,全球范围内估算有1010万(结核病新发病例,其中男性约580万例,女性约320万例,儿童约100万例。当前,结核病尤其是耐药结核病仍然是严重的公共卫生问题,给公众健康带来重大危害。2017年,全球利福平耐药患者新发56万例,其中约80%是耐多药结核病(MDR-TB),近50%的耐多药结核病例发生在印度、中国和俄罗斯[4]。我国2017年新发利福平耐药(RR-TB)的肺结核约6万例,其临床治疗成功率仅约40%[5]。据此可知,我国的结核病防控形势依旧十分严峻,如何早期诊断并纳入治疗,在耐多药结核病的防控中尤为重要[6]。本研究对江苏省开展结核病分级诊疗和综合防治服务模式后,江苏省各设区市分别采用的两种不同分子生物学快速耐药检测流程对利福平耐药(RR)/耐多药(MDR)患者发现的影响进行分析总结。
1 资料与方法
1.1 一般资料
病例资料来源中国结核病管理信息系统,江苏省结核病登记数据。肺结核患者纳入标准参照《肺结核诊断标准》(WS 288—2017)。
回顾性分析2015年1月1日—2018年12月31日江苏省各设区市结核患者患者报告数、病原学阳性结核患者报告数、耐药患者发现数、利福平单耐药/耐多药患者报告数等指标;对采用两种不同分子生物学耐药检测流程地区的各类患者发现情况、两种不同分子生物学耐药检测流程的时间成本等对比分析。
1.2 两种不同分子生物学耐药检测流程
根据江苏省《结核病分级诊疗综合防治服务模式实施方案》,在江苏省各设区市及其所辖县分别采用两种不同分子生物学耐药检测流程。
1.2.1 流程1 在江苏省南京市、无锡市、宿迁市、连云港市、淮安市、盐城市、扬州市、常州市和苏州市采用。选取痰涂片镜检阴性肺结核患者的痰标本,采用恒温PCR(LAMP)方法,开展分子生物学检测。病原学阳性样本药物敏感性检测: 痰涂片染色显微镜检查阳性样本、恒温PCR方法检测阳性样本、痰培养阳性样本,按照《可感染人类的高致病性病原微生物-菌(毒)种或样本运输要求》,将标本于1周内运送至市级耐多药结核病诊治定点医院,市级定点医院于3日内进行微阵列芯片法(流程1A)或线性探针技术(流程1B)耐药性检测。
1.2.2 流程2 江苏省南通市、徐州市、泰州市和镇江市4个设区市采用。所有活动性肺结核患者的痰标本均开展Xpert MTB-RIF检测。病原学阳性样本(包括痰涂片染色显微镜检查阴性而培养阳性样本、Xpert MTB检测阳性且利福平耐药的样本)按照《可感染人类的高致病性病原微生物-菌(毒)种或样本运输要求》,将标本于1周内运送至市级耐多药结核病诊治定点医院,市级定点医院于3日内进行线性探针技术耐药性检测。
1.3 统计学处理
SPSS 25.0软件进行数据分析。计数资料用率描述,组间比较采用χ2检验和单因素方差分析,趋势分析采用χ2趋势检验;P<0.05为差异具有统计学意义。
2 结 果
2.1 江苏省肺结核患者病原学阳性率比较
通过数据库分析后发现,自2015年开始逐步推广分子生物学检测后,江苏省病原学阳性肺结核病人所占比例有所上升。对比2015年,2018年江苏省全省范围内所有市、县分子检测全部覆盖后,肺结核患者中病原学阳性率有显著提高,病原学阳性率从30.7%提高至51.5%,χ2检验结果显示,2015与2018年的病原学阳性率差异有统计学差异(χ2=2071.02,P=0.000),见表1。
表1 2015—2018年江苏省肺结核患者病原学阳性率比较
Tab.1 Comparison of the positive rate of pathogens in tuberculosis patients with different molecular detection techniques from 2015 to 2018 in Jiangsu Province

年度病原学阳性患者病原学阴性患者肺结核患者患者总数病原学阳性率/%20158032181202615230.720169503187262822933.720179802169192672136.720181049898742037251.5
2.2 分子生物学耐药检测流程组别
采用两种不同分子生物学耐药检测流程的市、县分布如下。江苏省内无锡市、常州市、苏州市、连云港市、淮安市、盐城市、扬州市、宿迁市等8个设区市采用微阵列芯片法进行耐药性检测(流程1A),南京市采用线性探针技术进行耐药性检测(流程1B),其辖区内的47个县采用恒温PCR方法方法检测(流程1);南通市、徐州市、泰州市和镇江市4个设区市采用线性探针技术进行耐药性检测(流程2),其辖区内的30个县采用Xpert MTB-RIF方法检测。
2.3 江苏省耐药肺结核患者发现情况比较
2015—2018年,江苏省的结核病耐药患者患者报告数分别为: 289、358、375和512例。对比2015年,2018年的耐药患者患者报告数明显升高,其中RR报告患者患者数上升尤为显著。χ2检验结果显示,与2015年相比,2018年的耐药患者报告数显著增高(χ2=137.1,P=0.000),见表2。
表2 2015—2018年江苏省耐药患者患者报告情况
Tab.2 Drug resistant TB patients reported in Jiangsu Province from 2015 to 2018 (n)
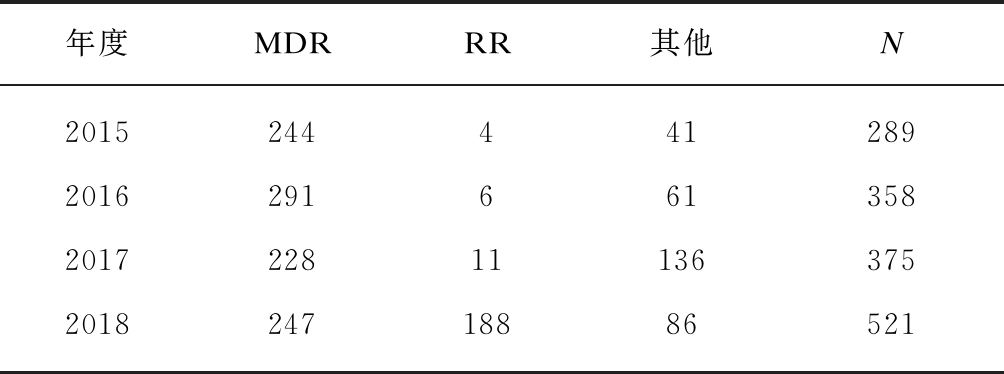
年度MDRRR其他N20152444412892016291661358201722811136375201824718886521
2.4 两种不同流程的地区单耐利福平/耐多药患者发现情况
经数据分析统计,江苏省全省在2015—2018年内,采用“流程1”进行耐药筛查的无锡市、常州市、苏州市、连云港市、淮安市、盐城市、扬州市、宿迁市及南京市9个设区市的报告单耐利福平/耐多药患者占各年度结核病总人数的比率分别为1.10%、1.35%、1.57%和2.26%。采用“流程2”进行耐药筛查的南通市、徐州市、泰州市和镇江市4个设区市的报告单耐利福平/耐多药患者占各年度结核病总人数患者的比率分别为1.11%、1.23%、1.22%和2.06%;两组间数据差异无统计学意义(P>0.05),见图1。

图1 不同流程的地区单耐利福平/耐多药患者 占各年度肺结核总患者数比例
Fig.1 Proportion of RR/MDR patients in total TB patients in different regions
2.5 两种流程的时间成本分析
流程1地区采用恒温PCR法检测: 选取痰涂片染色显微镜检查阴性患者的痰标本,在县级定点诊疗机构完成恒温PCR方法检测: 等待涂阴诊断大约需要3~5d不等,标准操作耗时约4h,可获得结核分枝杆菌分子检测结果,1周内将病原学阳性标本运送至市级耐药肺结核病定点诊疗机构,市级机构于收到样本3d内完成利福平、异烟肼耐药分子检测,故此流程获得耐多药分子诊断结果总耗时大约2周。
流程2地区所有诊断为肺结核的患者均对其痰标本进行Xpert MTB-RIF检测,此方法标准操作耗时约2.5h,可同时获得利福平耐药分子检测结果。即流程2在县级定点诊疗机构完成结核分枝杆菌分子生物学检测同时完成利福平耐药检测,可在2.5h内完成利福平耐药筛查,获得利福平耐药结果,后将利福平耐药患者转入市级定点诊疗机构治疗并完成其他药物的耐药检测。
3 讨 论
近年来,江苏省结核病报告患者数有稳步下降的趋势,但利福平耐药/耐多药患者报告数却存在上升趋势,给结核病防控工作带来了新的挑战,并已成为引起社会各界高度重视的公共卫生问题[7-8]。如何早期发现耐药患者,是目前结核病防控工作的重点和难点,也是目前研究的焦点[9-11]。研究结果证实,结核分枝杆菌出现耐药性的主要机制是其基因组的基因突变,已证实利rpoB基因与福平耐药相关,katG及inhA基因与异烟肼耐药相关[12-13]。在结核杆菌耐药物敏感性实验中,培养加传统药物敏感性试验仍然是实验室诊断的“金标准”,但固体培养基的结核分枝杆菌药物敏感性实验,通常需要2个月左右才能获得结果,不能满足临床需要,易影响患者的早期规范治疗,甚至出现因不能及时诊断耐多药结核病,而导致疫情失控,增加了防控难度[14]。随着现代分子生物学技术的迅速发展,有关耐药结核病分子机制研究的不断进展,耐药结核病的快速诊断技术已逐渐成熟。近年来,江苏省的结核病发患者数有稳步下降的趋势,我省的结核病报告发病数据中,病原学阳性率始终较低。为此,江苏省从2015年开始使用分子生物学方法检测肺结核患者痰标本中的结核分枝杆菌,并对其阳性标本开展耐药基因检测。2015—2018年将分子生物学检测方法在全省各市、县推广,于2018年实现了全省结核病定点诊疗机构范围内结核分枝杆菌及耐药基因的分子生物学检测100%覆盖到辖区内的所有市、县级定点医疗机构。
本研究所采用的分子生物学方法均依据WHO发布的《结核病防治指南》[15]中推荐方法。该指南中推荐采用恒温PCR方法用于结核病患者分子生物学检测,推荐Xpert MTB-RIF法用于结核病患者分子生物学快速检测及利福平耐药基因检测,采用线性探针技术开展利福平及异烟肼耐药筛查。本研究中采用的Xpert MTB-RIF法,线性探针技术法是指南推荐方法;恒温PCR方法及微阵列芯片法是与其同理的我国自主研发的分子生物学检测方法,其中恒温PCR方法用于结核病患者分子生物学检测,微阵列芯片法用于利福平及异烟肼耐药性检测。
本中心将辖区内的13个设区市分为两组,分别采用不同的分子生物学检测流程,以比较不同流程对利福平耐药/耐多药患者发现的影响。流程1中9个市的47个县均采用恒温PCR技术用于结核病患者分子生物学检测,该方法主要是利用特异性引物在恒温聚合酶作用下特异性扩增样本中的结核分枝杆菌核酸片段,再通过检测核酸染料的信号,来判断样本中是否含有结核分枝杆菌。该方法具有较高的灵敏度与特异度。结果阳性的样本再送至市级定点医院完成耐药检测。流程2中4个市的30个县均采用Xpert MTB-RIF技术用于结核病患者分子生物学检测,实现了样本处理、核酸提取及扩增检测多个环节的自动化运行,耗时约为2.5h,同时可完成利福平耐药基因检测,检测阳性的患者转至市级定点诊疗机构就诊。线性探针法和DNA微阵列芯片技术均基于已知耐药基因突变位点,通过对两种最常用的一线抗结核药物: 利福平和异烟肼的rpoB,katG及inhA基因,进行突变位点检测,可以在24h之内对样本中的结核杆菌耐药情况进行评估,从而为临床制定,实施有针对性的个体化治疗方案提供重要诊断依据和用药指导。
本研究重点关注采用分子生物学检测方法对病原学阳性患者发现率和耐药患者风险率的影响,同时探讨江苏省内采用的两种不同分子生物学耐药检测流程对利福平耐药/耐多药患者发现的影响有无差异。本研究结果显示,与2015年相比,2018年江苏省耐药患者报告数有显著提高,分析认为与省内全面采用分子生物学检测方法有关,与Zhao等[6]、Yu等[16]的报道相似。同时本研究证实,相比于采用WHO指南推荐的Xpert MTB和线性探针技术方法(流程2地区),采用我国自主研发的恒温PCR方法及微阵列芯片法的流程1地区,在利福平耐药/耐多药患者发现数上没有显著差异,与Bates等[17]的报道结果相似。
采用两种不同流程的地区2018年单耐利福平/耐多药患者发现发现率均显著高于2015年;两种流程相比,耐药结核患者发现率没有显著差异,分析认为各地实验室可根据自身需求选取适宜的方法及流程完善结核病分子生物学检测及耐药筛查。
在县级结核病定点诊疗机构采用的两种结核分枝杆菌分子生物学检测方法中,恒温PCR技术实验操作包括: 核酸提取、PCR扩增及扩增结果判读,其中核酸提取环节存在一定的生物安全风险,建议在2级生物安全实验室完成。
Xpert MTB-RIF技术一步法操作,基本实现了完全自动化的闭管操作,所需生物安全要求级别与痰涂片操作类似,可以在一级生物安全实验室开展。
此外,由于Xpert MTB-RIF在完成结核分枝杆菌分子生物学检测的同时,可以完成利福平耐药基因的检测,因此可以在较短时间内发现利福平耐药患者,对耐药患者早期发现和早期治疗有一定意义。线性探针可做异烟肼、利福平耐药,微阵列芯片还可做二线耐药,适合在市级耐药结核病定点诊疗机构开展。与恒温PCR技术或Xpert MTB-RIF技术相结合,可满足结核分枝杆菌及其药物敏感性的快速筛查。但分子生物学技术均为基于基因序列的快速检测方法,并不能取代传统的结核杆菌培养和表型药敏实验,现有的各种实验室检测方法均有不同的优缺点,各实验室在建立实验室检测流程时是应根据实际情况做出选择。
[1] ALENE K A, CLEMENTS A C A. Spatial clustering of notified tuberculosis in Ethiopia: a nationwide study[J]. PLoS One, 2019,14(8): e0221027.
[2] MIGLIORI G B, TIBERI S, ZUMLA A, et al. MDR/XDR-TB management of patients and contacts: Challenges facing the new decade. The 2020 clinical update by the Global Tuberculosis Network[J]. Int J Infect Dis, 2020,92S: S15-S25.
[3] WHO. Global tuberculosis report 2020[R/OL]. https:∥apps.who.int/iris/bitstream/handle/10665/336069/9789-240013131-eng.pdf.
[4] LU P, WANG Y J, LIU X T, et al. Malignant gliomas induce and exploit astrocytic mesenchymal-like transition by activating canonical Wnt/β-catenin signaling[J]. Med Oncol, 2016,33(7): 66.
[5] ZHAO W, GUO Z, ZHENG M, et al. Activity of linezolid-containing regimens against multidrug-resistant tuberculosis in mice[J]. Int J Antimicrob Agents, 2014,43(2): 148-153.
[6] ZHAO L L, CHEN Y, LIU H C, et al. Molecular characterization of multidrug-resistant Mycobacterium tuberculosis isolates from China[J]. Antimicrob Agents Chemother, 2014,58(4): 1997-2005.
[7] LIU Z W, DONG H L, WU B B, et al. Is rifampin resistance a reliable predictive marker of multidrug-resistant tuberculosis in China: a meta-analysis of findings[J]. J Infect, 2019,79(4): 349-356.
[8] 龚清河.上海市崇明区2016至2017年活动性肺结核流行病学分析[J].中国临床医学,2018,25(6): 1024-1026.
[9] EROKHINA M V, LEPEKHA L N, VORONEZHSKAYA E E, et al. Application of laser scanning confocal microscopy for the visualization of M.tuberculosis in lung tissue samples with weak Ziehl-Neelsen staining[J]. J Clin Med, 2019,8(8): E1185.
[10] WEI Z H, ZHANG X P, WEI C J, et al. Diagnostic accuracy of in-house real-time PCR assay for Mycobacterium tuberculosis: a systematic review and meta-analysis[J]. BMC Infect Dis, 2019,19(1): 701.
[11] 方勇,肖和平.结核病防治中的多学科合作[J].同济大学学报(医学版),2018,39(4): 6-10.
[12] AL-MUTAIRI N M, AHMAD S, MOKADDAS E M. Correction to: Molecular characterization of multidrug-resistant Mycobacterium tuberculosis(MDR-TB) isolates identifies local transmission of infection in Kuwait, a country with a low incidence of TB and MDR-TB[J]. Eur J Med Res, 2020,25(1): 14.
[13] GONG Z, WANG G R, ZENG J, et al. Differential DNA methylomes of clinical MDR, XDR and XXDR Mycobacterium tuberculosis isolates revealed by using single-molecule real-time sequencing[J]. J Drug Target, 2020: 1-9.
[14] CHUMPA N, KAWKITINARONG K, ROTCHEEWAPHAN S, et al. Evaluation of AnyplexTM Ⅱ MTB/MDR kit’s performance to rapidly detect isoniazid and rifampicin resistant Mycobacterium tuberculosis from various clinical specimens[J]. Mol Biol Rep, 2020,47(4): 2501-2508.
[15] WHO. WHO guidelines on tuberculosis[R/OL]. 2018. https:∥www.who.int/publications/guidelines/tuberculosis/en/
[16] YU X L, WEN Z L, CHEN G Z, et al. Molecular characterization of multidrug-resistant Mycobacterium tuberculosis isolated from south-central in China[J]. J Antibiot(Tokyo), 2014,67(4): 291-297.
[17] BATES M, AHMED Y, CHILUKUTU L, et al. Use of theXpert(®) MTB/RIF assay for diagnosing pulmonary tuberculosis comorbidity and multidrug-resistant TB in obstetrics and gynaecology inpatient wards at the University Teaching Hospital, Lusaka, Zambia[J]. Trop Med Int Health, 2013,18(9): 1134-1140.