Oddi括约肌功能障碍(sphincter of Oddi dysfu-nction, SOD)是一种功能性胃肠病,由Oddi括约肌(sphincter of Oddi, SO)狭窄或运动障碍引起,主要表现为腹痛、肝功能异常和反复发作的特发性急性胰腺炎等,临床诊治较为困难,分为胆源性和胰源性SOD[1]。最新的罗马Ⅳ标准将原先的Milwaukee分型中的胆道Ⅱ型SOD称为可疑胆源性SOD,即典型的胆源性腹痛合并肝功能异常或胆总管扩张,并排除胆总管结石和其他器质性疾病[2]。EST对胆道Ⅰ型效果佳,但对Ⅱ型SOD的治疗效果存在争议[3-4]。本研究回顾性分析了联合应用EST和EPBD对罗马Ⅳ标准中表现为胆源性腹痛和胆总管扩张(无肝功能异常)的可疑胆源性SOD患者的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
本研究回顾性分析了2015年1月—2018年12月同济大学附属东方医院61例SOD并成功行内镜逆行性胰胆管造影(endoscopic retrograde cholangio-pancreatography, ERCP)患者临床资料。所有患者术前均予以告知手术风险并知情同意。纳入标准如下: (1) 患者年龄≥18岁;(2) 符合罗马Ⅳ标准中胆总管扩张型可疑胆源性SOD诊断标准[2],即典型的胆源性腹痛合并胆总管扩张,但无肝功能异常并排除胆总管结石和其他器质性疾病;(3) 均有胆囊切除术史。(4) 随访时间1年。排除标准: (1) 合并严重心肺疾患、肝脏疾病及严重凝血功能障碍;(2) 常规胆总管插管失败行乳头预切开或乳头开窗术者;(3) 术中插管进胰管并放置胰管支架者;(4) 术 后并发重症急性胰腺炎、消化道穿孔等严重并发症,影响胆源性腹痛程度的客观评估。所有纳入本次研究患者均成功行胆总管插管及后续ERCP治疗。术后无重症急性胰腺炎、消化道穿孔及消化道出血等严重并发症。其中31例患者给予内镜下乳头括约肌切开术(endoscopic sphincterotomy, EST)治疗(EST组),30例患者给予EST联合内镜下乳头球囊扩张术(endoscopic papillary balloon dila-tion, EPBD)治疗(联合组)。两组间性别、年龄、术后时间构成比、术中放置鼻胆管引流患者比例差异无统计学意义(P>0.05),见表1。
1.2 方法
1.2.1 设备 侧视十二指肠镜(Olympus Cor-poration,日本),切开刀、黄斑马导丝、CRE扩张球囊、取石球囊(Boston Scientific Corporation,美国)及其他ERCP相关附件。
1.2.2 操作 术中常规给予吸氧、心电监护观察生命体征。按ERCP常规操作胆管插管成功后,常规造影排除胆总管结石或其他胆管器质性病变。对照组进行EST切开并见胆汁通畅流出;联合组在EST切开基础上,根据胆总管直径进行CRE扩张球囊扩张乳头开口(球囊直径不超过胆总管最大直径),持续30~60s。所有患者均尽可能吸尽胆总管内造影剂后结束操作。部分插管时间较长患者放置鼻胆管引流(endoscopic naso-biliary drainage, ENBD)预防ERCP术后胰腺炎(post-ERCP pancreatitis, PEP)或胆道感染。
1.2.3 术后处理 术后常规检查3、24h血常规、血淀粉酶,并仔细观察有无发热、腹痛、腹胀等不适主诉,有无压痛、反跳痛等阳性体征,怀疑PEP或消化道穿孔时行急诊上腹部平扫CT予以证实。所有患者术后均给予禁食、补液、抑制胰酶分泌、抗感染等综合治疗。
表1 两组患者一般资料比较
Tab.1 The comparison in general information between combined group and EST group![]()
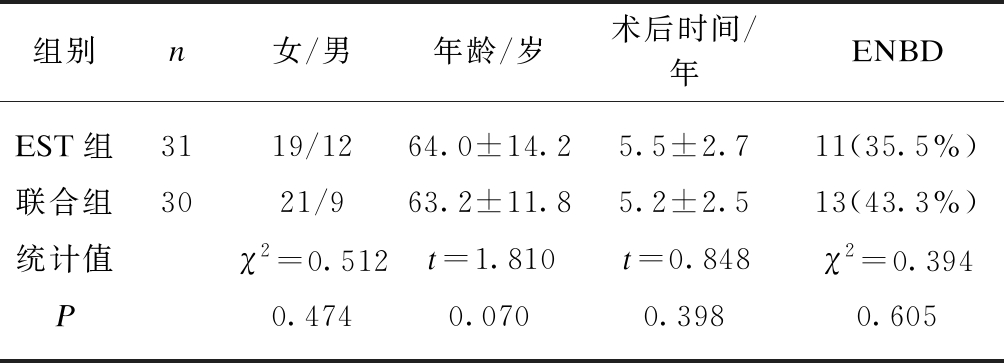
组别n女/男年龄/岁术后时间/年ENBDEST组3119/1264.0±14.25.5±2.711(35.5%)联合组3021/963.2±11.85.2±2.513(43.3%)统计值χ2=0.512t=1.810t=0.848χ2=0.394P0.4740.0700.3980.605
1.3 结果评估
1.3.1 胆源性腹痛改善情况 治疗前及ERCP术后1周、1年对患者的胆源性腹痛进行评估,疼痛程度采用临床上慢性疼痛较多使用的0~10数字评估分量表法(numerical rating scale, NRS): 0为无腹痛,1~3为轻度疼痛,4~6为中度疼痛,7~10为重度疼痛。同时评估腹痛的发作频率、持续时间和疼痛部位(按4分区法),4项评分之和为腹痛的总评分,见表2。
1.3.2 胆管最大直径改善情况 磁共振胰胆管造影(magnetic resonance cholangio-pancreatography, MRCP)观察术前及术后1年胆总管最大直径改变情况,间接反映胆道压力改善状况。
表2 腹痛分级及评分
Tab.2 The grade and score of abdominal pain

疼痛程度每周发作次数每周持续时间/d疼痛部位评分无腹痛0000轻度<3<111中度3~41~222重度≥5≥3≥33
1.3.3 术后并发症的评判标准 PEP、高淀粉酶血症、胆管炎、出血、穿孔等并发症的定义和分级采用国际通用的COTTON标准[5]。
1.4 统计学处理
采用SPSS 20.0统计软件进行数据分析。计量资料以![]() 表示,组内腹痛评分及胆总管直径比较使用两独立样本t检验;腹痛评分为3个时间点测量结果,根据球形检验结果进行多变量方差分析;计数资料以n(%)表示,行χ2检验或Fisher精确法检验。P<0.05为差异有统计学意义。
表示,组内腹痛评分及胆总管直径比较使用两独立样本t检验;腹痛评分为3个时间点测量结果,根据球形检验结果进行多变量方差分析;计数资料以n(%)表示,行χ2检验或Fisher精确法检验。P<0.05为差异有统计学意义。
2 结 果
2.1 胆源性腹痛改善情况
治疗前EST组、联合组腹痛评分分别为6.4±0.9、6.7±0.7,差异无统计学意义(P>0.05);治疗后1周,两组腹痛评分分别为4.0±1.1、3.4±0.5,较治疗前都有较好缓解效果(P<0.05),联合组疗效更明显(P<0.05);1年后,两组间腹痛症状均有所反弹,评分分别为5.1±1.1、4.5±1.0,但与治疗前比较差异仍有统计学意义(P<0.05),联合组疗效优于EST组(P<0.05)。值得注意的是EST组和联合组分别有12例(12/31,38.7%)、4例(4/30,13.3%)患者腹痛完全回复到术前程度,联合组腹痛完全复发者发生率明显低于EST组(P<0.05),见表3。
2.2 胆总管最大直径改善情况
术前及术后1年胆总管最大直径EST组分别为(13.2±1.4) mm、(12.7±1.2) mm,差异有统计学意义(P<0.05);联合组分别为(13.0±1.2) mm、(10.9±1.2) mm,差异有统计学意义(P<0.05);两组患者术后1年胆管直径较术前均降低,间接提升了胆管内压力的下降,但联合组效果优于EST组(P<0.05),见表4。
表3 两组患者胆源性腹痛缓解效果比较
Tab.3 The comparison in relief of abdominal pain between combined group and EST group![]()
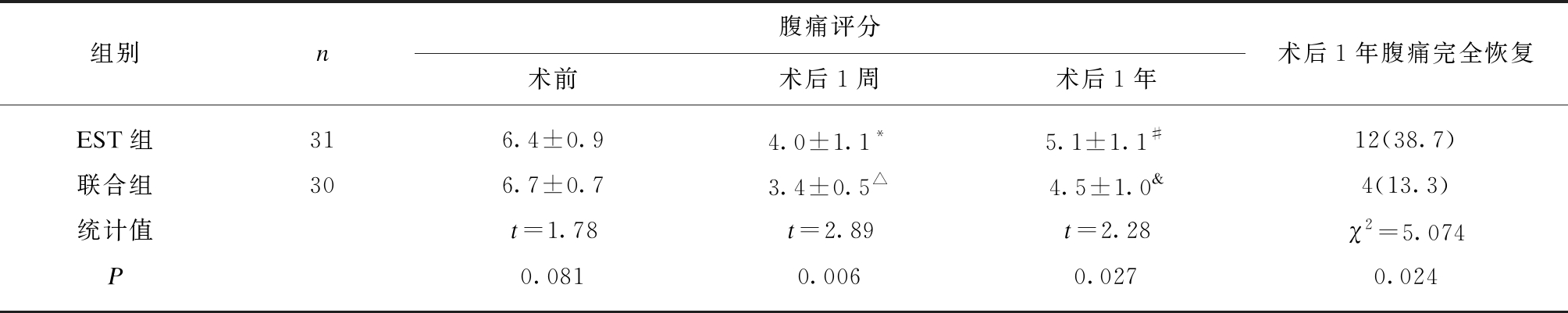
组别n腹痛评分术前术后1周术后1年术后1年腹痛完全恢复EST组316.4±0.94.0±1.1*5.1±1.1#12(38.7)联合组306.7±0.73.4±0.5△4.5±1.0&4(13.3)统计值t=1.78t=2.89t=2.28χ2=5.074P0.0810.0060.0270.024
与同组术前腹痛评分比较,t=15.379,*P=0.000;与同组术前腹痛评分比较,t=6.080,#P=0.000;与同组术前腹痛评分比较,t=27.577,△P=0.000;与同组术前腹痛评分比较,t=11.164,&P=0.000;腹痛评分两组间多变量重复测量分析,分组因素F=2.45,P=0.123;时间因素F=282.32,P=0.000;时间与分组的交互作用F=10.45,P=0.0002
表4 两组患者CBD直径改善效果比较
Tab.4 Comparison of improvement effect of CBD diameter between the two groups![]()

组别术前术后1年EST组(n=31)13.2±1.412.7±1.2*联合组(n=30)13.0±1.210.9±1.2#t0.7635.966P0.4490.000
与同组术前CBD直径比较,t=3.503,*P=0.001;与同组术前CBD直径比较,t=7.628,#P=0.000;两组间CBD直径改善总体效果比较,t=5.20,P=0.000
2.3 术后并发症情况
所有纳入本次研究患者均成功行ERCP治疗,术后无重症急性胰腺炎、消化道穿孔及消化道出血等严重并发症。术后24h内EST组、联合组分别有3例(3/31,9.7%)、5例(5/30,16.7%)并发轻症急性胰腺炎或高淀粉酶血症,两组间差异无统计学意义(χ2=0.184,P=0.473),经禁食、补液、抑制胰酶分泌、抗感染等综合治疗后均在1周内恢复。术后1周内EST组、联合组分别有1例(1/31,3.2%)、2例(2/30,6.7%)并发胆道感染,两组间差异无统计学意义(χ2=0.001,P=0.612),经积极抗感染均在1周内恢复。
3 讨 论
SOD是一种累及SO的良性、非结石性病变,由于SO收缩异常,胆胰壶腹部流出受阻,胆汁、胰液反流引起的胆胰系统一系列病理生理变化,可分为胆源型及胰源型[6]。胆源型SOD多见于胆囊切除术后患者,胆囊切除术后SOD的发生率约13%,而胆囊在位的患者仅为0.9%[7]。SOD既往被分为3种亚型,2016年提出的罗马Ⅳ标准认为Ⅲ型胆源型SOD不存在括约肌功能障碍,应归属于发作性功能性腹痛范畴,因此删除了Ⅲ型SOD的诊断,并建议对胆囊切除术后Ⅱ型胆源型SOD患者诊断为可疑胆源性SOD且必须符合以下要点: (1) 符合胆源型腹痛标准;(2) 肝酶升高或胆道扩张,不可并存。(3) 无胆管结石或其他器质性病变[2]。
可疑SOD其可能的发病机制包括: (1) 神经调节异常: 目前认为胆囊切除术后,正常的胆囊和SO之间的协调功能丧失,容易出现SO痉挛,并致SO基础压明显增高,胆总管内胆汁不能顺利进入十二指肠可引起胆总管内压力明显升高而出现上腹部不适及腹痛。另一方面,痛觉神经敏感性增加也是SOD患者腹痛的原因之一。研究证实在不同电流刺激下SOD患者的疼痛敏感性均明显高于胆囊切除术后无症状患者[8]。(2) 激素调节异常: 除了升高的静息基础括约肌压力外,可疑SOD还与SO周期性收缩频率增加、收缩的逆行传播增加以及对胆囊收缩素(cholecystokinin, CCK)的异常反应有关 [9-10]。SOD患者CCK往往不能完全消除SO的阶段性收缩,使得SO处于持续收缩或痉挛状态,尤其在伴有肠易激综合征的SOD患者中更为常见[11]。如何有效控制SO不规律收缩及痉挛进而降低胆管压力是缓解可疑胆源性SOD的关键。
对SOD最常用的非药物治疗是EST,可使90%的Ⅰ型胆源性SOD患者和70%的Ⅱ型胆源性SOD患者腹痛减轻[12]。有研究认为应该尽可能对Ⅱ型胆道SOD进行Oddi括约肌测压术(sphincter of Oddi manometry, SOM),仅对SO基础压力明显增高者行EST治疗,但SOM作为一项有创操作,术后胰腺炎发生率高达10%~15%[13]。更有研究表明,Ⅱ型SOD患者在内镜治疗前行SOM的获益比率(55%)反而低于经验性EST(60%),并且后者更符合经济性原则[14]。一项针对美国资深内镜专家的调查显示: 只有33.3%的专家会在术前对疑似Ⅱ型SOD患者行SOM检查,故SOM并非是该型患者的常规检查手段[15]。
本次研究中对罗马Ⅳ标准中胆总管扩张型可疑胆源性SOD进行ERCP治疗,术前并未对患者进行SOM检测,推测胆总管扩张程度一定程度上也间接反映了SO压力,所以我们对该类可疑胆源性SOD患者分别进行了EST(EST组)、EST联合EPBD(联合组)治疗,重点观察内镜治疗对腹痛、胆总管扩张的缓解疗效,因为胆源性腹痛是各型SOD最突出的临床表现,疼痛严重到足以中断日常活动或必须急诊处理,严重影响患者生活质量,是诊断SOD的重要依据,也是评估SOD诊断疗效的最具特征性指标。
临床疗效方面,研究结果表明: 和术前相比,术后1周EST组和联合组均有效缓解胆源性腹痛症状(P<0.05),但联合组疗效优于EST组(P<0.05)。术后随访1年时,腹痛程度在两组患者均有所反弹,但与治疗前比较差异仍有统计学意义(P<0.05),联合组疗效更明显(P<0.05)。值得注意的是EST组有高达12例(38.7%)腹痛完全回复到术前,远远高于联合组4例(13.3%,P<0.05)。提示单纯EST术后腹痛复发的几率远远高于联合组。术后1年两组患者胆总管扩张程度均较术前明显减轻(P<0.05);联合组对远期降低胆总管压力的效果优于单独EST(P<0.05)。推测EST虽可有效降低SO痉挛导致的压力增高,有效缓解了胆总管扩张型可疑SOD的腹痛和胆总管扩张,但EST仅仅在一个方向切开,缓解SO痉挛的疗效可能比较短暂;而联合组在EST基础上通过对SO环周作充分均匀的扩张,即EPBD术,对SO在4周各个方向上均有扩张破坏、缓解痉挛的作用,在相当程度上协同并延长了EST的效应,即联合组EST合并EPBD对痉挛SO的破坏作用及降低SO压力效应均远远高于单纯EST,使得联合组的腹痛、胆总管扩张缓解程度均明显优于单纯EST,更为关键的是显著降低了胆源性腹痛完全复发率,值得临床推广。
安全性方面,由于联合组在EST基础上进行了EPBD,对乳头括约肌充分的扩张往往会导致SO短暂的水肿,并导致胰液引流不畅,有文献[16-17]报道EPBD会导致PEP的增高,因此研究术前顾虑联合组PEP的发生率可能会远高于EST组。结果表明,PEP和高淀粉酶血症在联合组发生率稍高于EST组,但差异无统计学意义。考虑扩张引起的SO充血水肿是短暂的,加上扩张前均进行了EST,一定程度上减轻了EPBD导致乳头水肿对胰管的压迫效应。在胆道感染方面,2014年一篇Meta分析[18]指出单纯EPBD相比EST比并不会增加术后胆管炎发生率,甚至可以长期降低胆囊炎的发作。本研究则提示联合组和EST组术后胆道感染发生率差异无统计学意义,分析可疑胆源性SOD中SO本身易处于痉挛状态,虽然EPBD联合EST对括约肌功能的影响大于EST,但是在对抗SO的痉挛及由此导致的腹痛及胆管扩张方面则优于EST,且由于其扩张直径并未超过胆总管最大直径,故其对SO的扩张作用尚不至于导致胆道感染的发生明显增高。因此,本研究认为EPBD配合EST治疗胆总管扩张型可疑胆源性SOD是安全可行的。
当然本研究为回顾性研究,样本量偏小,且1年后的远期胆源性腹痛复发率尚待进一步观察,此外对于胆源性腹痛伴肝功能异常(无胆总管扩张)的可疑SOD上述联合治疗疗效如何也有待进一步研究。
[1] KUTSUMI H, NOBUTANI K, KAKUYAMA S, et al. Sphincter of Oddi disorder: what is the clinical issue?[J]. Clin J Gastroenterol, 2011,4(6): 364-370.
[2] COTTON P B, ELTA G H, CARTER C R, et al. Gallbladder and sphincter of oddi disorders[J]. Gastroenterology, 2016,150(6): 1420-1429.
[3] COTTON P B, DURKALSKI V, ROMAGNUOLO J, et al. Effect of endoscopic sphincterotomy for suspected sphincter of Oddi dysfunction on pain-related disability following cholecystectomy: the EPISOD randomized clinical trial[J]. JAMA, 2014,311(20): 2101-2109.
[4] GEENEN J E, HOGAN W J, DODDS W J, et al. The efficacy of endoscopic sphincterotomy after cholecystectomy in patients with sphincter-of-Oddi dysfunction[J]. N Engl J Med, 1989,320(2): 82-87.
[5] CHRISTOFORIDIS E, GOULIMARIS I, KANELLOS I, et al. The role of juxtapapillary duodenal diverticula in biliary stone disease[J]. Gastrointest Endosc, 2002,55(4): 543-547.
[6] REHMAN A, AFFRONTI J, RAO S. Sphincter of Oddi dysfunction: an evidence-based review[J]. Expert Rev Gastroenterol Hepatol, 2013,7(8): 713-722.
[7] HALL T C, DENNISON A R, GARCEA G. The diagnosis and management of Sphincter of Oddi dysfunction: a systematic review[J]. Langenbecks Arch Surg, 2012,397(6): 889-898.
[8] KURUCSAI G, JO I, FEJES R, et al. Somatosensory hypersensitivity in the referred pain area in patients with chronic biliary pain and a sphincter of Oddi dysfunction: new aspects of an almost forgotten pathogenetic mechanism[J]. Am J Gastroenterol, 2008,103(11): 2717-2725.
I, FEJES R, et al. Somatosensory hypersensitivity in the referred pain area in patients with chronic biliary pain and a sphincter of Oddi dysfunction: new aspects of an almost forgotten pathogenetic mechanism[J]. Am J Gastroenterol, 2008,103(11): 2717-2725.
[9] TANAKA M. Advances in research and clinical practice in motor disorders of the sphincter of Oddi[J]. J Hepatobiliary Pancreat Surg, 2002,9(5): 564-568.
[10] 张东伟,陈锡美,邹颂海.胃动素和胆囊收缩素与肠易激综合征的关系[J].同济大学学报(医学版),2001,22(5): 50-52.
[11] EVANS P R, DOWSETT J F, BAK Y T, et al. Abnormal sphincter of Oddi response to cholecystokinin in postcholecystectomy syndrome patients with irritable bowel syndrome. The irritable sphincter[J]. Dig Dis Sci, 1995,40(5): 1149-1156.
[12] AFGHANI E, LO S K, COVINGTON P S, et al. Sphincter of oddi function and risk factors for dysfunction[J]. Front Nutr, 2017,4: 1.
[13] COTTON P B, GARROW D A, GALLAGHER J, et al. Risk factors for complications after ERCP: a multivariate analysis of 11497 procedures over 12 years[J]. Gastrointest Endosc, 2009,70(1): 80-88.
[14] ARGUEDAS M R, LINDER J D, WILCOX C M. Suspected sphincter of Oddi dysfunction type Ⅱ: empirical biliary sphincterotomy or manometry-guided therapy?[J]. Endoscopy, 2004,36(2): 174-178.
[15] WATSON R R, KLAPMAN J, KOMANDURI S, et al. Wide disparities in attitudes and practices regarding Type Ⅱ sphincter of Oddi dysfunction: a survey of expert US endoscopists[J]. Endosc Int Open, 2016,4(9): E941-E946.
[16] FUJISAWA T, KAGAWA K, HISATOMI K, et al. Is endoscopic papillary balloon dilatation really a risk factor for post-ERCP pancreatitis?[J]. World J Gastroenterol, 2016,22(26): 5909-5916.
[17] HAKUTA R, HAMADA T, NAKAI Y, et al. Multicenter retrospective and comparative study of 5-minute versus 15-second endoscopic papillary balloon dilation for removal of bile duct stones[J]. Endosc Int Open, 2017,5(11): E1027-E1034.
[18] ZHAO H C, HE L, ZHOU D C, et al. Meta-analysis comparison of endoscopic papillary balloon dilatation and endoscopic sphincteropapillotomy[J]. World J Gastroenterol, 2013,19(24): 3883-3891.