股骨颈骨折是股骨头以下至股骨颈基底部之间的骨折,其全球发病率逐年上升[1]。在我国,股骨颈骨折的发生占髋部骨折的48%~54%,多发于中老年人。手术技术和治疗理念的进步使患者预后显著改善[2],然而术后股骨头坏死的发生率仍较高(14.8%~30%)[3-4]。
股骨头坏死由股骨头缺血所致,是术后最严重的并发症。股骨头85%以上的血供来源于旋股内、外侧动脉发出的支持带动脉[5]。骨折发生后,血管过度拉伸、扭转、挫伤导致血循不畅,进而发生缺血及骨形成相关细胞损害、凋亡,造成股骨头坏死[6]。95%的股骨头坏死在术后3年内发生,由于缺少有效的预警机制,大多数患者在确诊坏死时已发生塌陷,失去保髋治疗时机。对于股骨头坏死的独立危险因素尚有争议,病理机制未完全阐明[15],目前很少有相关的风险预测研究。
本研究旨在挖掘股骨颈骨折内固定治疗的患者整个临床病程的与坏死相关的因素,开发预后模型并对其内部验证,得到预后模型以预测患者术后3年内并发股骨头坏死的概率,识别高风险人群。
1 资料与方法
1.1 一般资料
本研究对上海交通大学附属第六人民医院、同济大学附属第十人民医院、同济大学附属同济医院2013年3月至2017年1月间行内固定手术的新发股骨颈骨折患者进行回顾性随访研究,随访时间≥36个月,内固定方式为动态加压的半螺纹空心钉闭合复位内固定。就年龄、性别、受伤原因、体重指数(body mass index, BMI)、受伤至手术时间、骨折类型、复位质量、术后疼痛情况、完全负重时间等病程各阶段的相关因素进行调查,观察结局为伤侧发生股骨头坏死。
1.2 纳入及排除标准
纳入标准: (1) 新发股骨颈骨折行内固定术的患者;(2) 患者年龄为18~80岁;(3) 基线资料完整;(4) 随访时间≥36个月;(5) 伤前无患侧髓膝关节中重度疼痛及活动受限,无强直性脊柱炎、类风湿性关节炎等疾病。
排除标准: (1) 骨折发生2周后入院的陈旧性骨折患者;(2) 病理性骨折患者;(3) 内固定手术失败的患者;(4) 术后患侧发生再度损伤者;(5) 在行影像检查之前,临床已有干预措施,如内固定拆除后重新固定等;(6) 不愿配合调查及依从性差的患者。
1.3 方法
使用医院信息管理系统(hospital information system, HIS)进行电子病历调阅、门诊随访、电话随访的方式,对患者的基线和随访资料分析,通过X线片、CT片(及合成的三维影像)、MRI片、实验室指标结合病例资料判断受伤、复位、术后康复情况以及是否出现股骨头坏死。
1.4 观察指标及诊断标准
股骨头坏死的诊断参照日本厚生省骨坏死研究会(Japanese Investigation Committee, JIC)提出的诊断标准(2012年版)[18];查尔斯合并症指数(Cha-rlson comorbidity index, CCI)使用Roffman修订的量表[22],根据患者既往病史、预后,加权年龄后计算得分;骨折分类根据患者术前三维CT资料,参照Garden等[17]提出的分型标准进行分组;疼痛评分使用VAS疼痛评分标准(0~10分)[19]。
1.5 统计学处理
使用R Studio(3.6.5)软件将随机种子数设100,按3∶1的比例分为训练集和验证集。本研究将16个变量进行单因素分析,将训练集中单因素分析后P<0.05的变量作为候选因子,使用最大偏似然估计似然比检验(向前: LR)法在二分类Logistic回归中筛选变量并分析,确定独立危险因素,得到OR值及回归方程。将独立危险因素作为预测变量,在R Studio应用rms等相关程序包,计算风险评分并建立列线图预测模型,使用Hosmer-Lemeshow拟合优度检验评价模型的校准度。对分割后的验证集数据进行内部验证,分别计算训练集、验证集的受试者工作特征(receiver operating characteristic, ROC)曲线下面积、约登指数、灵敏度、特异度、阳性预测值、阴性预测值等指标,用于评价模型的预测能力。绘制决策曲线[13](decision curve analysis, DCA)以评价并验证模型净收益率。
使用SPSS 20.0软件进行统计描述和分析。采用Kolmogorov-Smimov法对计量资料进行正态性检验,符合正态分布的计量资料以![]() 表示,组间比较采用t检验或方差分析;不满足正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U秩和检验分析;计数资料以率或构成比表示,组间比较采用χ2检验、Fisher精确概率法等分析方法。对各临床变量进行单因素分析,采用双侧检验,以P<0.05为差异有统计学意义。
表示,组间比较采用t检验或方差分析;不满足正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U秩和检验分析;计数资料以率或构成比表示,组间比较采用χ2检验、Fisher精确概率法等分析方法。对各临床变量进行单因素分析,采用双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 患者基线特征与随访资料
对全体股骨颈骨折患者的基线资料和术后随访资料进行统计描述和单因素分析。83例术后3年内发生股骨头坏死,发生率为22.0%。分类变量类别及赋值情况见表1。患者年龄为18~77岁。除年龄、伤侧和CCI外,其他变量在未坏死组与坏死组之间都具有统计学差异,组内分布情况与分析结果见表2。
表1 分类变量赋值表
Tab.1 Voluation for categorical variables

变量名称赋值性别0=男,1=女伤侧1=左,2=右受伤原因1=跌倒,2=坠落,3=车祸Garden分型1=Ⅰ型,2=Ⅱ型,3=Ⅲ型,4=Ⅳ型骨折线位置1=基底型,2=颈中型,3=头颈型,4=头下型嵌插0=无,1=有髋部骨质疏松0=无,1=有骨折嵌插0=无,1=有术前移位1=无移位,2=中心位移,3=中心+旋转位移复位质量1=Ⅰ级,2=Ⅱ级,3=Ⅲ级,4=Ⅳ级术后错位程度1=0~2mm,2=2~5mm,3=5mm以上
表2 股骨颈骨折患者基本特征
Tab.2 Features of patients with femoral neck fracture [M(P25,P75),n(%)]

变量未坏死(n=295)坏死(n=83)Z/χ2P年龄/岁57(47,61)54(44,62)-1.392*0.164男/女159/18044/395.2310.022BMI/(kg·m-2)21.64(20.13,23.44)22.83(20.50,24.54)-3.013*0.003伤侧(左/右)165/13044/390.2230.636受伤原因跌倒271(91.9)66(79.5)坠落3(1.0)6(7.2)车祸21(7.1)11(13.3)11.9430.003Garden分型Ⅰ型16(5.4)3(3.6)Ⅱ型103(34.9)4(4.8)Ⅲ型83(28.1)10(12.0)Ⅳ型93(31.5)66(79.5)63.432*<0.001骨折线位置基底型23(7.8)2(2.4)颈中型22(7.5)12(14.5)头颈型214(72.5)50(6.25)头下型36(12.2)19(22.9)13.348<0.001髋部骨质疏松(无/有)218/7744/3913.285<0.001嵌插(无/有)207/8849/347.1420.008术前移位无移位144(48.8)18(21.7)中心位移27(9.2)0(0)中心+旋转位移124(42.0)65(78.3)35.770<0.001
续表
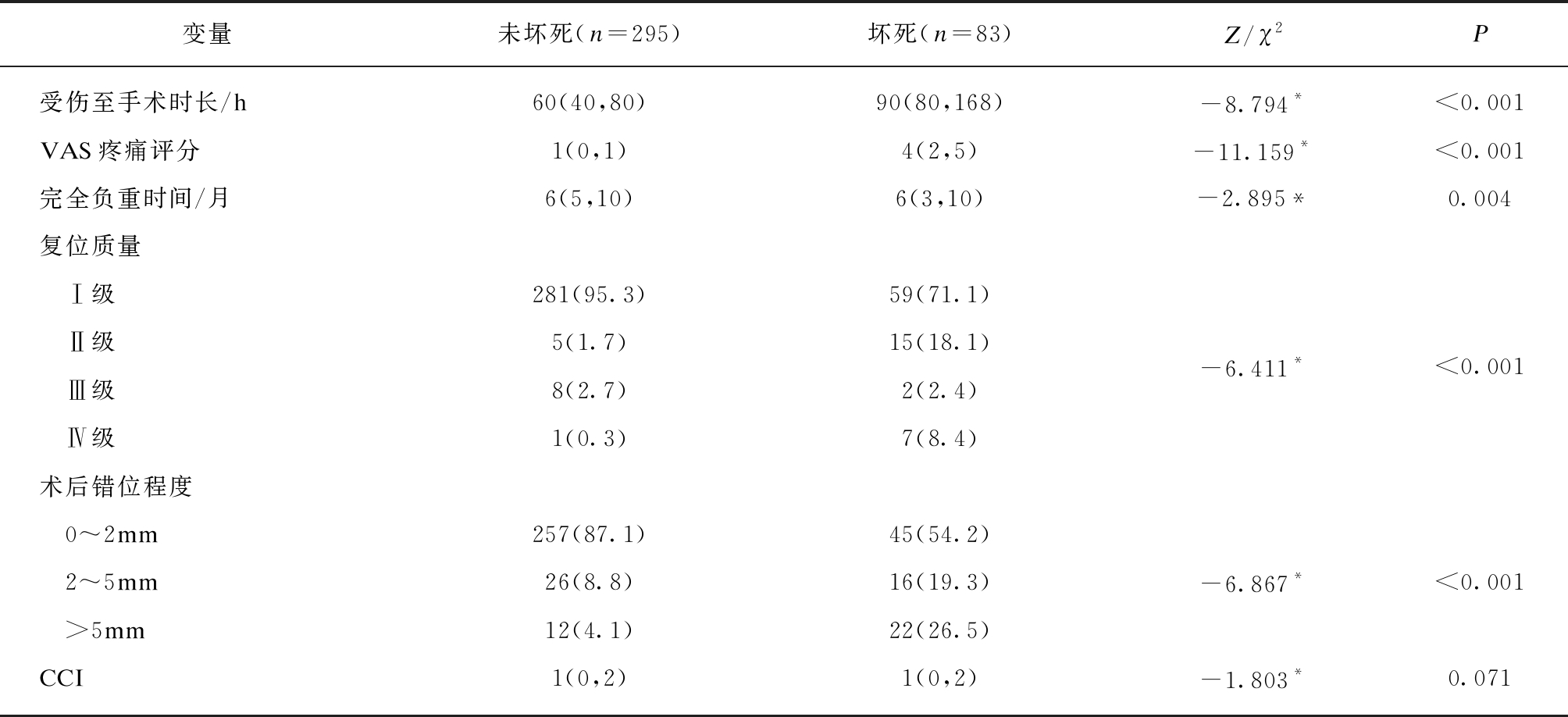
变量未坏死(n=295)坏死(n=83)Z/χ2P受伤至手术时长/h60(40,80)90(80,168)-8.794*<0.001VAS疼痛评分1(0,1)4(2,5)-11.159*<0.001完全负重时间/月6(5,10)6(3,10)-2.895*0.004复位质量Ⅰ级281(95.3)59(71.1)Ⅱ级5(1.7)15(18.1)Ⅲ级8(2.7)2(2.4)Ⅳ级1(0.3)7(8.4)-6.411*<0.001术后错位程度0~2mm257(87.1)45(54.2)2~5mm26(8.8)16(19.3)>5mm12(4.1)22(26.5)-6.867*<0.001CCI1(0,2)1(0,2)-1.803*0.071
2.2 训练集与验证集资料特征比较
将资料按照3∶1比例划分为训练集和验证集,两数据集特征分布见表3。对训练集和验证集中坏死组与未坏死组间的各因素差异分别进行单因素分析,组内分布情况与分析结果见表4。
表3 训练集与验证集患者基本特征
Tab.3 Features of training set and validation set [M(P25,P75),n(%)]

特征训练集验证集未坏死(n=223)坏死(n=61)未坏死(n=72)坏死(n=22)BMI/(kg·m-2)21.5(20.2,23.4)22.8(20.3,25.3)22.2(19.9,23.4)22.8(20.8,23.7)髋部骨质疏松51(22.9)29(47.5)26(36.1)10(45.5)男/女87/13634/2728/4410/12受伤原因 跌倒204(91.5)48(78.7)66(91.7)19(86.4) 坠落3(1.3)5(8.2)01(4.5) 车祸16(7.2)8(13.1)6(8.3)2(9.1)Garden分型 Ⅰ型12(5.4)3(4.9)4(5.6)0 Ⅱ型77(34.5)3(4.9)26(36.1)1(4.5) Ⅲ型61(27.4)9(14.8)22(30.6)1(4.5) Ⅳ型73(32.7)46(75.4)20(27.8)20(90.9)骨折线位置 基底型21(9.4)2(3.3)2(2.8)0 颈中型18(8.1)12(19.7)4(5.6)0 头颈型156(70.0)36(59)58(80.6)14(63.6) 头下型28(12.6)11(18)8(11.1)8(36.4)术前嵌插69(30.9)30(49.2)23(68.1)9(40.9)术前移位 无86(38.6)3(4.9)35(48.6)2(9.1) 中心位移53(23.8)10(16.4)13(18.1)3(13.6) 中心位移+旋转84(37.7)48(78.7)24(33.3)17(77.3)受伤至手术时长/h60(40,70)110(65,143)60(90,220)110(90,220)
续表
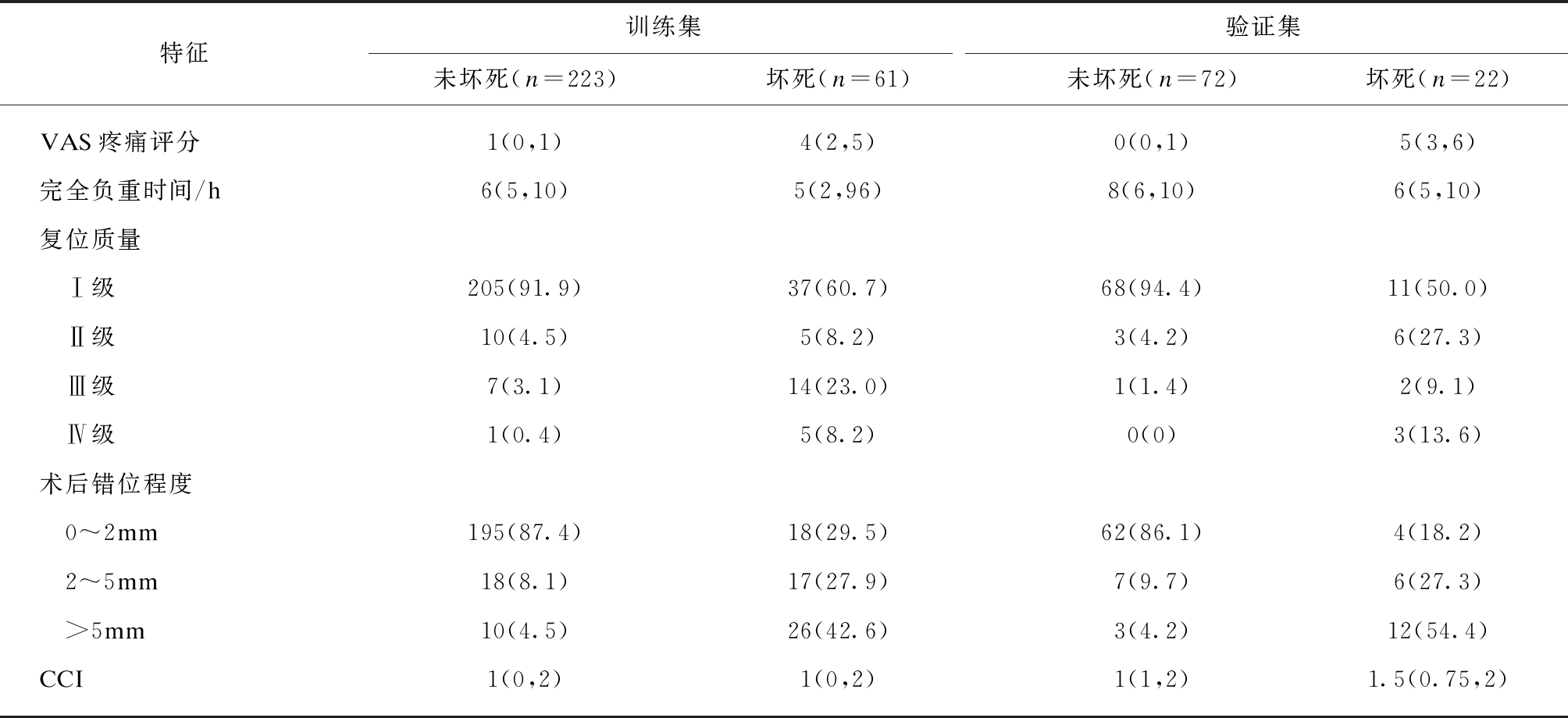
特征训练集验证集未坏死(n=223)坏死(n=61)未坏死(n=72)坏死(n=22)VAS疼痛评分1(0,1)4(2,5)0(0,1)5(3,6)完全负重时间/h6(5,10)5(2,96)8(6,10)6(5,10)复位质量 Ⅰ级205(91.9)37(60.7)68(94.4)11(50.0) Ⅱ级10(4.5)5(8.2)3(4.2)6(27.3) Ⅲ级7(3.1)14(23.0)1(1.4)2(9.1) Ⅳ级1(0.4)5(8.2)0(0)3(13.6)术后错位程度 0~2mm195(87.4)18(29.5)62(86.1)4(18.2) 2~5mm18(8.1)17(27.9)7(9.7)6(27.3) >5mm10(4.5)26(42.6)3(4.2)12(54.4)CCI1(0,2)1(0,2)1(1,2)1.5(0.75,2)
表4 训练集和验证集中坏死组与未坏死组间的差异比较
Tab.4 Comparison of the differences between the necrotic group and non-necrotic group in two sets
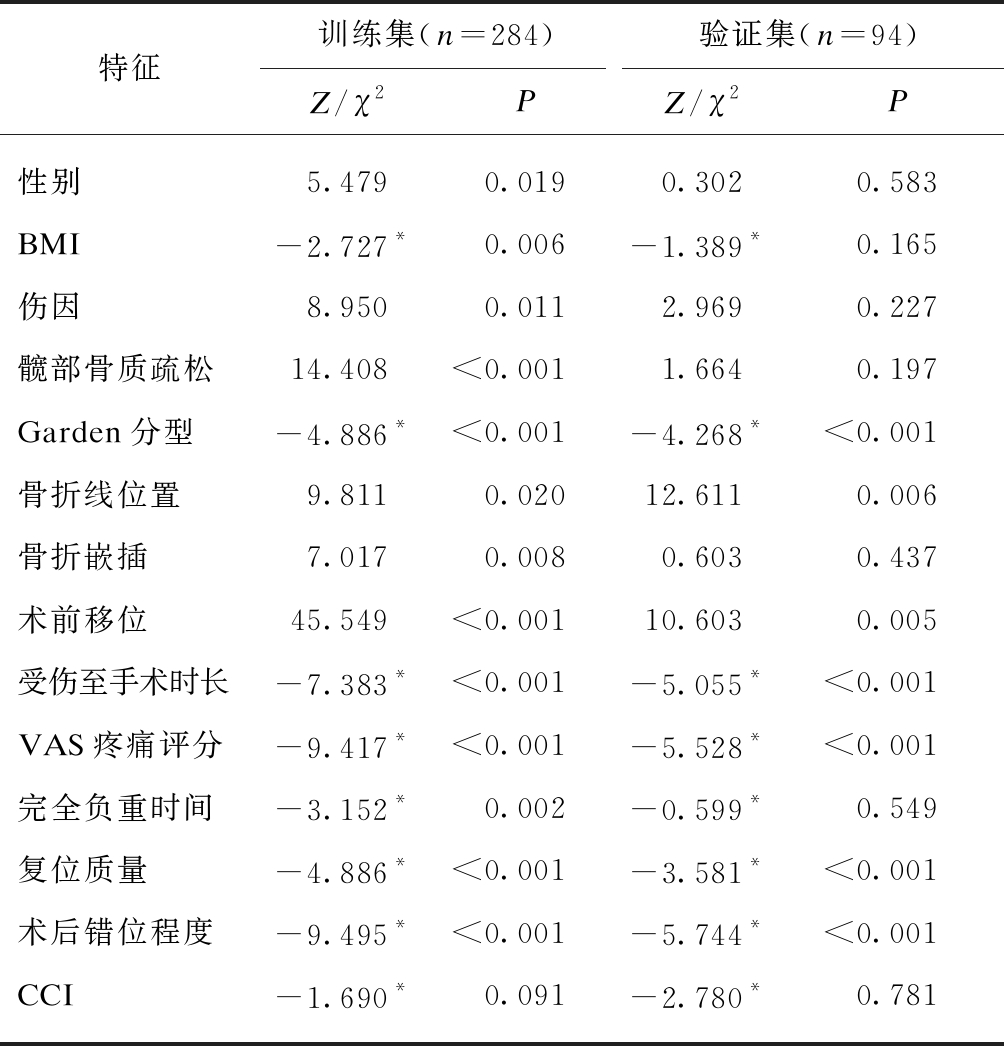
特征训练集(n=284)验证集(n=94)Z/χ2PZ/χ2P性别5.4790.0190.3020.583BMI-2.727*0.006-1.389*0.165伤因8.9500.0112.9690.227髋部骨质疏松14.408<0.0011.6640.197Garden分型-4.886*<0.001-4.268*<0.001骨折线位置9.8110.02012.6110.006骨折嵌插7.0170.0080.6030.437术前移位45.549<0.00110.6030.005受伤至手术时长-7.383*<0.001-5.055*<0.001VAS疼痛评分-9.417*<0.001-5.528*<0.001完全负重时间-3.152*0.002-0.599*0.549复位质量-4.886*<0.001-3.581*<0.001术后错位程度-9.495*<0.001-5.744*<0.001CCI-1.690*0.091-2.780*0.781
*统计量为Z值,采用Mann-whitney U秩和检验
2.3 Logistic回归模型的建立与列线图应用
将训练集数据中经单因素分析后P<0.05的变量纳入二分类Logistic回归模型分析。根据风险预测模型经验法则,使用N=(n×10)/I公式来计算最佳预测变量数,其中N=样本量,n=最终自变量个数,I=结局事件(不良结果)发生个数。已知训练集共有284例病例,坏死数为61例,因此坏死率为21.48%。经计算得出预测变量数为6个,分别为受伤至手术时间、术前嵌插、VAS疼痛评分、移位情况、复位情况、术后错位距离,得到最终的Logistic回归模型,见表5。使用R Studio(3.6.5)rms程序包制作列线图,见图1。

图1 基于Logistic回归的列线图预测模型
Fig.1 Prediction model of nomogram based on Logistic regression
2.4 模型的评价与内部验证
计算并得到了训练集ROC曲线下面积(95%CI)、约登指数、灵敏度、特异度、阳性预测值、阴性预测值等指标,通过上述指标对模型的区分度进行了评价;计算验证集相应指标,对模型区分度进行了内部验证,见表6。Kolmogorov-Smimov拟合优度检验结果显示模型校准度较好(χ2=3.62,R2=0.972,P=0.890),同时,使用R Studio(3.6.5)rms程序包制作决策曲线分析图,评价并验证了模型在不同坏死风险预测阈值下的净收益率,见图2。
表5 训练集多因素Logistic回归分析
Tab.5 Multivariate Logistic regression analysis of training set
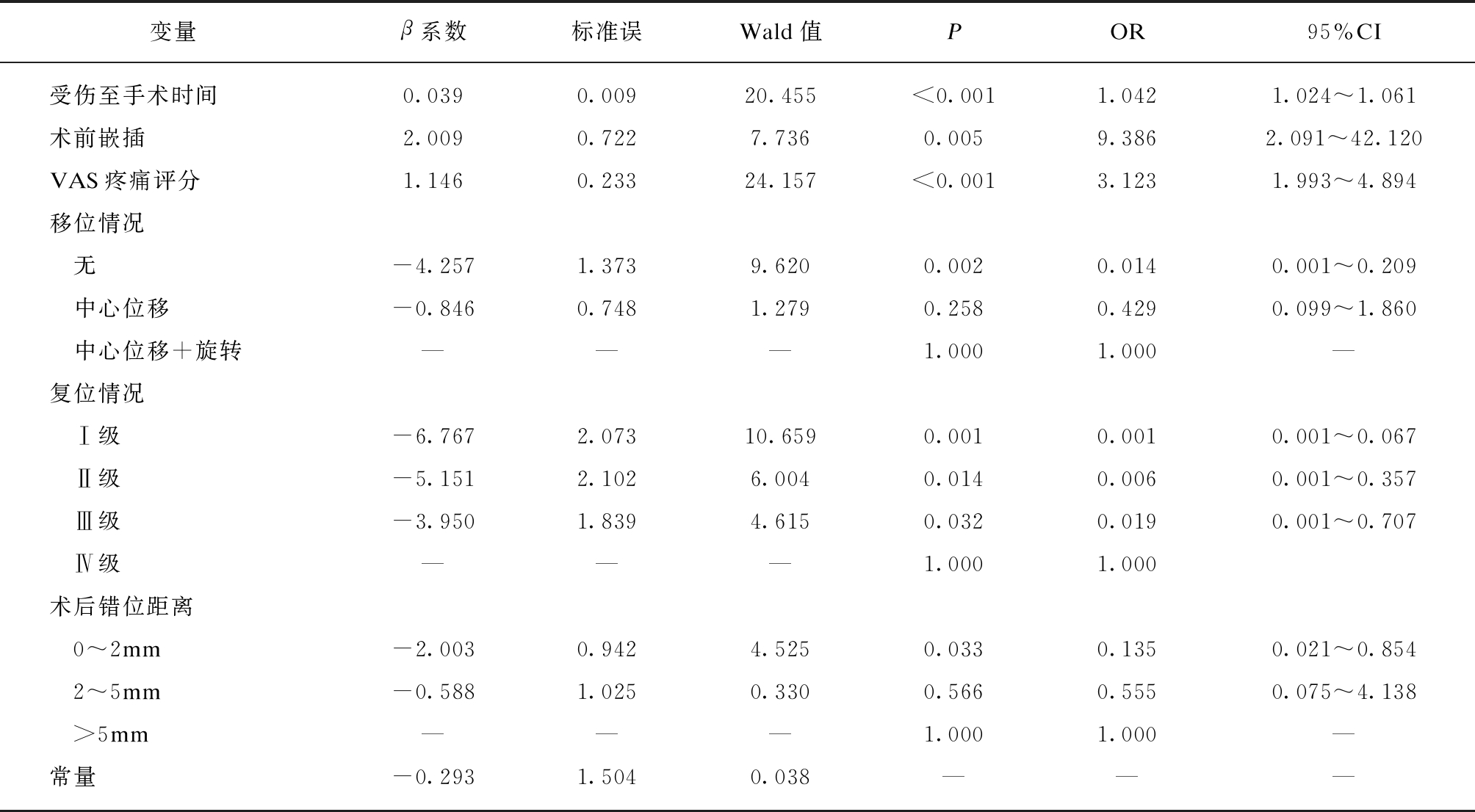
变量β系数标准误Wald值POR95%CI受伤至手术时间0.0390.00920.455<0.0011.0421.024~1.061术前嵌插2.0090.7227.7360.0059.3862.091~42.120VAS疼痛评分1.1460.23324.157<0.0013.1231.993~4.894移位情况 无-4.2571.3739.6200.0020.0140.001~0.209 中心位移-0.8460.7481.2790.2580.4290.099~1.860 中心位移+旋转———1.0001.000—复位情况 Ⅰ级-6.7672.07310.6590.0010.0010.001~0.067 Ⅱ级-5.1512.1026.0040.0140.0060.001~0.357 Ⅲ级-3.9501.8394.6150.0320.0190.001~0.707 Ⅳ级———1.0001.000术后错位距离 0~2mm-2.0030.9424.5250.0330.1350.021~0.854 2~5mm-0.5881.0250.3300.5660.5550.075~4.138 >5mm———1.0001.000—常量-0.2931.5040.038———
表6 模型区分度评价和内部验证
Tab.6 Discrimination of the model and internal validation
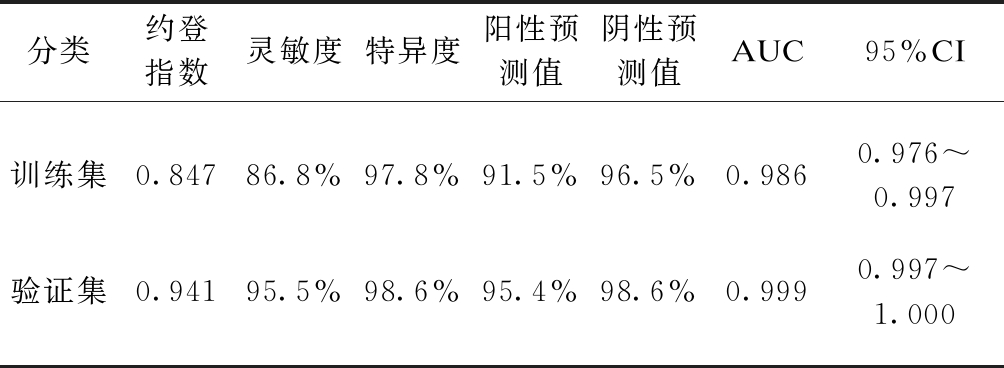
分类约登指数灵敏度特异度阳性预测值阴性预测值AUC95%CI训练集0.84786.8%97.8%91.5%96.5%0.9860.976~0.997验证集0.94195.5%98.6%95.4%98.6%0.9990.997~1.000
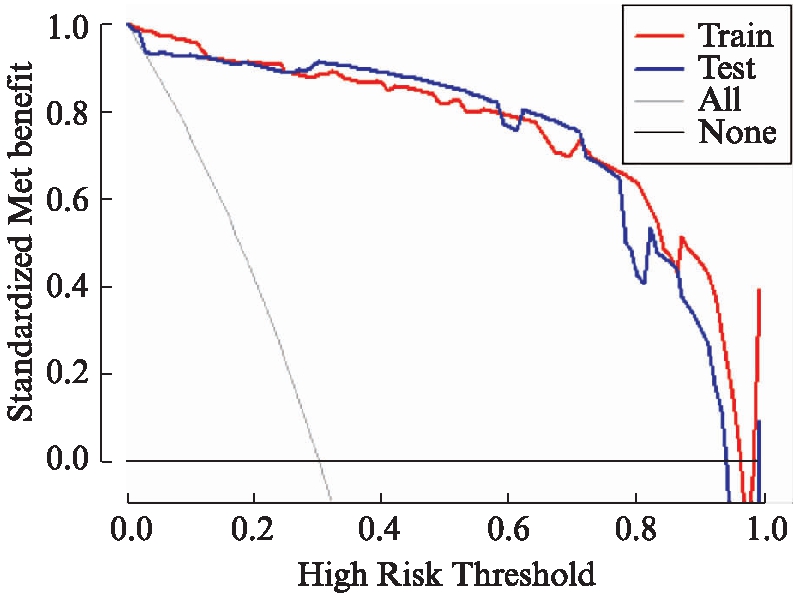
图2 模型的DCA曲线及内部验证
Fig.2 DCA curve and its internal validation
3 讨 论
对于中青年股骨颈骨折患者,首选治疗方案是内固定保髋手术[4,14]。但内固定技术的发展并未使术后股骨头坏死的发生率显著降低。股骨头坏死难以早期诊断,0期患者没有相应体征,即使依靠灵敏度最高的MRI技术也很难发现,给临床诊断带来了很大困难。中青年股骨颈骨折患者大多是由高能量创伤造成的,如车祸、坠落等,骨折移位的病例占60%以上,更易发生坏死[2]。目前有髋关节置换以及游离腓骨移植术等多种保髋治疗方法,对于有保髋指征的中青年患者,应早发现早治疗。本研究通过多因素Logistic回归挖掘了危险因素,纳入了“受伤至手术时间”、“术前移位情况”、“骨折端嵌插”、“复位质量”、“VAS疼痛评分”、“术后错位程度”6个自变量开发了列线图预后模型。模型约登指数为0.847,ROC曲线下面积为0.874(0.976~0.997)。当风险阈值范围为0%~95%之间时,模型可使患者受益,且拥有良好的区分度和净收益率。验证集约登指数为0.941,ROC曲线下面积为0.999(0.997~1.000),训练集与验证集的DCA曲线大致吻合,内部验证结果反映了模型具备较好的总体性能和可重复性。
本研究分析了从骨折至坏死整个病程中的相关因素。大量研究表明,移位型骨折的坏死率显著高于非移位性骨折。从患者骨折的那一刻起,血管的损伤已经发生。Forgon等[9]的研究表明,95%的Garden 3型和80%的Garden 4型骨折患者在术前仍存留上支持带动脉的血供,没有发生缺血。传统的骨折分型法如Garden分型、Pauwells角分型对手术复位、术后愈合有指导意义,但是不能较好地反映股骨头血管损伤。本研究发现暴力导致的骨折位移和股骨头偏转会增加术后坏死的风险,与Cui等[10]的结论一致。受伤后,骨折端嵌插会导致血管发生扭结,若嵌插不解除会持续影响血循并减少过半的血运,如果不及早解除嵌插或进行手术,则会极大增加坏死风险,并且术前发生嵌插的患者在术后更容易发生坏死[9],本研究结果证实了这一观点。本研究还发现受伤后至手术的时间间隔越长,术后越容易发生坏死。有学者发现暴力导致的血管破裂使髋关节囊发生血肿[11],且关节囊压力会随时间推移而增加[12]。同时,上升的关节囊压力会使股骨头内压力加剧升高,这一现象不仅影响支持带血管血循,还破坏骨细胞和股骨头内微血管,进一步增加坏死风险[5]。可以认为,骨折导致的股骨头移位、偏转、骨折端嵌插扭结了血管,与血肿、关节囊积液带来的囊内股内高压共同阻滞甚至阻断了血液循环。
在达到满意的Garden对线指数后,患者下手术台,说明手术复位成功。但良好的手术复位并不能保证患者获得满意的预后。另外,即使患者髋关节的Garden对线指数尚可接受(Ⅱ级、Ⅲ级),但X线正侧位片显示股骨颈不光滑,股骨头的凸面与股骨颈的凹面形成的S形曲线不平滑甚至相切,因而仅靠正侧位X线片显示的Garden对线指数并不能说明髋关节达到解剖复位。本研究发现,患者在术后的3年内仍可能发生股骨颈错位甚至髋部畸形,如髋外翻或内翻,以及股骨头的前倾或后倾。因此,基于术后影像学的预后指标选取了随访中最后一次或最不理想的一次检查中所表现的Garden对线指数和错位程度。目前,已有多项研究表明术后的髋关节形态和康复情况影响坏死,与本次研究结果比较一致。但是,也有学者发现,当股骨颈骨折移位严重时,手术后阳性支撑的复位结构可以让患者获得良好的预后。尽管阳性支撑复位意味着错位以及股骨颈曲线不光滑,但患者术后的坏死率并无增加。导致缺血的病因、具体机制、直接证据尚待更为详细的研究。可能的原因: 术后的髋关节畸形使得股骨头血管长期扭曲,血循长期受阻。另一个重要的预测因素是术后疼痛。VAS疼痛评分是一份真实性、可靠性较高的量表,在临床预后研究中被广泛运用[19]。术后,在起身、坐下、气温骤降时,患者普遍会有一过性的轻微酸痛感。本研究结果表示,疼痛加剧至VAS 4级以上时,3年内坏死的风险极高,是坏死前的主要指征。尽管疼痛不是坏死的病因,但症状值得高度重视。当髋关节骨细胞发生组织学变化时,会发生疼痛。疼痛加剧后,应该立即就医。Li等[14]基于生物力学的有限元分析发现,当坏死发生时,患者日常生活对髋关节力学负荷的增加会使坏死病灶面积增加,尤其是股骨头前部和外侧区域的病灶更有可能加速扩大并提前发生塌陷。
临床预测模型是一种风险与获益评估的量化工具[7],又称风险评分,已大量应用于外科领域[20],尤其是关节骨科及创伤骨科。Cui等[10]的研究中运用了Mimics软件定量评价股骨颈骨折患者的股骨头移位、偏转角度,然而其预测因子局限于术前影像学指标。Noh等[21]的研究使用了核骨素扫描成像技术重点观察了针道征对于股骨头坏死的预测作用,但是建模样本量偏少。据了解,只有上述2项研究做了股骨颈骨折患者术后股骨头坏死的多因素分析并计算了灵敏度、特异度等区分度指标,但均未构建可视化、可计算的预后风险评分。
本研究仍具有一些局限。首先,本研究的观察结局为二分类变量,未考虑到术后“股骨头生存期”和诊断时坏死分期等相关信息;其次,由于条件限制及其他可行性因素,本研究未能用定量指标以更精确地测量和评估所观察的指标;第三,它虽然属于多中心研究,但病例全部来源于三甲医院,对使用回顾性资料所建立的模型仅进行了内部验证。其是否适用于二甲医院和上海以外的医院,有待进一步外部验证和更大样本的前瞻性研究。尽管如此,我们的研究仍然稳健、可靠。
近年来,随着医疗技术的提高,股骨头坏死后保髋治疗的适应证、适应人群正在不断扩大[16]。本研究期望该模型准确预测患者术后3年内发生股骨头坏死的概率,识别高风险人群。本模型适用于18~80岁的行动态加压的半螺纹空心钉闭合复位内固定术的新发股骨颈骨折患者,其优势是指标易测,有助于伤后股骨头坏死的早发现、早治疗,有更新、临床推广的潜力。今后可在现有模型的基础上定量分析不同移位方向、偏转度数对术后并发症的影响,将定量资料的预测因子替代原有的分类变量形式的预测因子以更新模型,用综合区分改善度(integrated discrimination improvement, IDI)和净重分类改善度(net reclassification improvement, NRI)比较不同版本预测模型的性能[7]。
综上所述,本研究基于6项独立危险因素,为股骨颈骨折患者开发了内固定术后并发股骨头坏死的列线图预测模型并进行了内部验证,模型具有良好的综合性能,能较准确地预测股骨颈骨折术后股骨头坏死的发生,可为临床个体化防治股骨头坏死提供科学指导。
[1] GJERTSEN J E, ENGESAETER L B, FURNES O, et al. The Norwegian Hip Fracture Register: experiences after the first 2 years and 15576 reported operations[J]. Acta Orthop, 2008,79(5): 583-593.
[2] THORNGREN K G, HOMMEL A, NORRMAN P O, et al. Epidemiology of femoral neck fractures[J]. Injury, 2002,33(Suppl 3): C1-C7.
[3] YANG J J, LIN L C, CHAO K H, et al. Risk factors for nonunion in patients with intracapsular femoral neck fractures treated with three cannulated screws placed in either a triangle or an inverted triangle configuration[J]. J Bone Joint Surg Am, 2013,95(1): 61-69.
[4] 马文辉,张英泽.股骨颈骨折: 问题及对策[J].中国组织工程研究,2014,18(9): 1426-1433.
[5] PRASAD K S R K. CORR insights®: epiphyseal arterial network and inferior retinacular artery seem critical to femoral head perfusion in adults with femoral neck fractures[J]. Clin Orthop Relat Res, 2017,475(8): 2024-2026.
[6] 林俊东,徐建成,何彬娟,等.微导管超选择插管在早期股骨头缺血性坏死介入治疗中的应用[J].中华临床医师杂志(电子版),2015,9(22): 4229-4233.
[7] COLLINS G S, REITSMA J B, ALTMAN D G, et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis(TRIPOD): the TRIPOD statement[J]. BJOG, 2015,122(3): 434-443.
[8] AUSTIN P C, STEYERBERG E W. Events per variable(EPV) and the relative performance of different strategies for estimating the out-of-sample validity of logistic regression models[J]. Stat Methods Med Res, 2017,26(2): 796-808.
[9] FORGON M. Nail fixation of the neck of femur, as emergency operation[J]. Magy Traumatol Orthop, 1970,13: 312-317.
[10] CUI S S, ZHAO L K, WANG Y M, et al. Using Naive Bayes Classifier to predict osteonecrosis of the femoral head with cannulated screw fixation[J]. Injury, 2018,49(10): 1865-1870.
[11] CHRISTAL A A, TAITSMAN L A, DUNBAR R P, et al. Fluoroscopically guided hip capsulotomy: effective or not? A cadaveric study[J]. J Orthop Trauma, 2011,25(4): 214-217.
[12] BONNAIRE F A, WEBER A T. The influence of haemarthrosis on the development of femoral head necrosis following intracapsular femoral neck fractures[J]. Injury, 2002,33(Suppl 3): C33-C40.
[13] KERR K F, BROWN M D, ZHU K H, et al. Assessing the clinical impact of risk prediction models with decision curves: guidance for correct interpretation and appropriate use[J]. J Clin Oncol, 2016,34(21): 2534-2540.
[14] LI H G, LI F, LIU N S, et al. Risk prediction of femoral head necrosis: a finite element analysis based on fracture mechanics[J]. Int J Comput Methods, 2020,17(6): 1950019.
[15] 中华医学会骨科学分会创伤骨科学组,中国医师协会骨科医师分会创伤专家工作委员会.成人股骨颈骨折诊治指南[J].中华创伤骨科杂志,2018,20(11): 921-928.
[16] 中国医师协会骨科医师分会显微修复工作委员会,中国修复重建外科专业委员会骨缺损及骨坏死学组,中华医学会骨科分会显微修复学组.成人股骨头坏死临床诊疗指南(2016)[J].中华骨科杂志,2016,36(15): 945-954.
[17] GARDEN R S. Malreduction and avascular necrosis in subcapital fractures of the femur[J]. J Bone Joint Surg Br, 1971,53(2): 183-197.
[18] GARDENIERS J W M, GOSLING-GARDENIERS A C, RIJNEN W H C. The ARCO staging system: generation and evolution since 1991[M]∥Osteonecrosis. Berlin: Springer-Verlag, 2014: 215-218.
[19] LE MAY S, BALLARD A, KHADRA C, et al. Comparison of the psychometric properties of 3 pain scales used in the pediatric emergency department: visual analogue scale, faces pain scale-revised, and colour analogue scale[J]. Pain, 2018,159(8): 1508-1517.
[20] 秦家骏,陈先震.基于机器学习的老年创伤性颅脑损伤预后研究[J].同济大学学报(医学版),2020,41(2): 221-227.
[21] NOH J H, LEE J Y, HWANG S, et al. Prediction of femoral head avascular necrosis following femoral neck fracture:“pin-tract sign” of 99mTc-HDP pinhole bone scan after metallic fixation[J]. HIP International, 2019,30(5): 112070001986049.
[22] ROFFMAN C E, BUCHANAN J, ALLISON G T. Charlson comorbidities index[J]. J Physiother, 2016,62(3): 171.