非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是临床上较为常见的一类与肥胖、2型糖尿病、血脂异常密切相关的以肝细胞内脂质沉积为特征的肝脏疾病,包括单纯性非酒精性脂肪肝(non-alcoholic fatty liver, NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)、NASH相关肝纤维化及肝硬化和肝细胞癌[1]。近年来,NAFLD的全球患病率越发升高,全球的患病率约为24.24%,其中南美洲(30.34%)和中东(31.37%)报告的患病率最高,亚洲(27.37%)的患病率仅次之[2]。我国近年来NALFD患病率迅速增长,流行病学显示其患病率高达12.5%~38.17%,已成为我国慢性肝病最常见的原因[3-6]。目前该病的发病理论机制复杂,多种理论[7]如二次打击学说、多次打击学说、肠道菌群失调、脂质异位沉积等学说的提出都只是冰山一角,该病完整的病因机理学说仍未建立。
磷脂酶D(phospholipase D, PLD)是一类催化磷酸二酯键的酶,催化水解磷脂酰胆碱,生成磷脂酸(phosphatidic acid, PA)和胆碱[8]。PA是细胞内重要的脂质第二信使,也是其他脂质信号分子的前体,包括二酰基甘油(diacylglycerol, DAG)和溶血磷脂酸(lysobisphosphatidic acide, LPA)[8-9]。PA、LPA和DAG对多种细胞通路有影响,包括细胞内囊泡运输,内吞作用,胞吐作用,肌动蛋白细胞骨架动力学,细胞增殖、分化,迁移和存活[10]。有研究[11]表明,PLD1激活可促进葡萄糖转运体4(Glut4)的转运与葡萄糖的摄取,通过siRNA干扰选择性沉默PLD1表达可抑制Glut4的易位,与胰岛素抵抗有关,此外,发现PLD参与脂质滴的产生和成脂分化[12-13]。糖、脂代谢异常在NAFLD的发生发展中起着重要作用,推测PLD1可能与NAFLD有着千丝万缕的联系,但到目前为止,尚无研究表明它们之间的确切关联。本研究旨在观察磷脂酶D1对非酒精性脂肪性肝病体外细胞模型成脂作用的影响,探讨PLD1对非酒精性脂肪性肝病成脂作用的机制。
1 材料与方法
1.1 细胞与试剂
人肝癌细胞系HepG2购自中国上海中科院细胞库。DMEM细胞培养基购自美国Sigma公司;胎牛血清(Fetal Bovine Serum)购自澳洲CellSera公司;青霉素、链霉素、PBS、BSA购自江苏凯基生物技术有限公司;油酸、棕榈酸、油红O染料、尼罗红染料、DMSO购自美国Sigma公司;LipofectamineTM 2000购自美国Thermo公司;CCK-8检测试剂盒购自苏州新赛美生物科技有限公司;si-PLD1 RNA购自吉玛基因有限公司;Ad-PLD1慢病毒过表达载体购自上海诺百生物科技有限公司;RNAfast200抽提试剂盒购自上海飞捷生物技术有限公司;逆转录PrimeScript RT reagent Kit with gDNA Eraser、qRT-PCR TB Green Premix Ex TaqⅡ试剂盒购自日本TaKaRa公司。
1.2 方法
1.2.1 细胞培养及分组 HepG2细胞用含10%FBS和1%青霉素、链霉素的DMEM培养液于37℃、含5% CO2培养箱中培养。将细胞以1×105个/mL密度接种到6孔板中,培养24h后的细胞用于后续实验。将细胞分为空白对照组、FFA模型对照组、si-PLD1干预组、si-PLD1+FFA模型干预组、Ad-PLD1干预组、Ad-PLD1+FFA模型干预组。
1.2.2 FFA处理 接种HepG2细胞待细胞完全贴壁后,用PBS洗1次后更换培养液为不含FBS、含1mmol/L FFA(棕榈酸∶油酸摩尔浓度比例=2∶1)的DMEM培养液,处理24h后用于后续实验。
1.2.3 CCK-8检测FFA对细胞毒性 取对数生长期的HepG2细胞,以每孔5000个细胞的密度接种于96孔板中。待细胞完全贴壁后加入含1mmol/L FFA的DMEM培养液,同时设置不含FFA的对照组,每组设6个复孔,培养24h后弃培养液,加入含CCK-8试剂的培养液,2h后用酶标仪检测450nm出的吸光度(A450)值。
1.2.4 油红O染色 空白对照组和FFA模型对照组细胞用FFA处理24h后,弃培养液,用PBS洗1~3次后加入4% PFA固定细胞10min,弃4% PFA,PBS洗1~3次后加入油红O工作液避光孵育15~20min,弃油红O染液,PBS洗1~3次后加入苏木精染核30s。
1.2.5 细胞转染 转染前1d,取处于对数生长期的HepG2细胞,按以1×105个/mL密度接种到6孔板中,待细胞完全贴壁后,用PBS清洗1次,加入含10%FBS的DMEM培养液。si-PLD1 RNA的转染浓度为100nmol/L。将siRNA+optimem和Lipo-2000+optimem孵育5min,再将孵育完毕的siRNA和Lipo-2000混匀后孵育15~20min,孵育完毕后将混合液加入培养板中,轻轻混匀,将培养板放入37℃、含5% CO2培养箱中培养24h。
1.2.6 病毒感染 病毒感染前1d,取处于对数生长期的HepG2细胞,按以2×105个/mL密度接种到12孔板中,待细胞融合度约为50%后,更换培养液,取慢病毒液按MOI值=100稀释加入到培养液中,如有必要加入聚凝胺(polybrene)至终浓度 5~10μg/mL。将培养板放入37℃、含5% CO2培养箱中培养4~6h 后,吸去含病毒的培养液,用正常培养液小心洗细胞2~3次,加入含10%FBS的DMEM培养液培养48h。
1.2.7 流式细胞术检测平均荧光强度 各组HepG2细胞处理后,弃培养液,用PBS洗1~3次后加入胰酶消化。终止消化后吹打至细胞悬液后收集至离心管,离心半径8.5cm,1000r/min,离心 5min,弃上清液;加入PBS重悬细胞,离心半径 8.5cm,1000 r/min ,离心5min,弃上清液,重复1~3次;加入4% PFA固定细胞5min;离心半径8.5cm,1000r/min,离心5min,弃上清液;加入PBS重悬细胞,离心半径8.5cm,1000 r/min,离心5min,弃上清液,重复1~3次;加入0.75μg/mL尼罗红染液,避光孵育 15min 后用流式细胞仪检测各组细胞平均荧光强度。
1.2.8 RT-qPCR检测细胞中PLD和成脂相关基因mRNA的表达 用RNA抽提试剂盒提取处理完的细胞总RNA,检测纯度后反转录为cDNA。以cDNA为模板、β-actin为内参进行实时荧光定量PCR,反应体系为10μL。反应程序: 95℃ 30s;95℃ 5s,60℃ 30s,40个循环;引物序列见表1。用2-ΔΔCt的方法计算各基因相对表达量。
1.3 统计学处理
采用Prism 7.0统计软件进行数据分析,数据采用![]() 表示,两组间比较采用Student t检验,设置检验水准α=0.05,P<0.05为差异有统计学意义。
表示,两组间比较采用Student t检验,设置检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 构建非酒精性脂肪肝体外细胞模型
将细胞分为空白对照组和FFA模型对照组,1mmol/L FFA处理模型对照组24h后,行油红O染色,结果示模型对照组细胞内脂滴明显聚集。通过Image J量化分析空白对照组和FFA模型对照组脂滴形成情况,结果示FFA模型对照组脂滴相较于空白对照组的脂滴面积明显增多,可达10.28倍,差异有统计学意义(P<0.001)。说明1mmol/L FFA处理HepG2细胞24h可成功构建非酒精性脂肪肝体外细胞模型,见图1。
表1 用于实时荧光定量PCR的基因引物序列
Tab.1 Primer sequence of each gene for quantitative real-time PCR

基因种系引物序列(5'→3')正向反向PLD1人AAAAGGAGCCACG-GGTAAAATTGGACGGCCG-GAGAGAPLD2人CAGATGGAGTCCG-ATGAGGTGCCGCTGG-TATATCTT-TCGGTGSREBP1人ACAGTGACTTCCC-TGGCCTATGCATGGACGGGTA-CATCTTCAAFASN人TCTGGTTCT-TACGTC-TGTTGCCTGTGCAGTC-CCTAG-CTTTCCDGAT2人GAATGGGAGTGGC-AATGCTATCCTCGAAGATCAC-CT-GCTTGTGPAT4人GGTATCCGCAAAC-TCTACATGAACCACTTCGACGAAT-CTCTTTGAβ-actin人CATGTACGTTGCT-ATCCAGGCCTCCTTAATGT-CACG-CACGAT
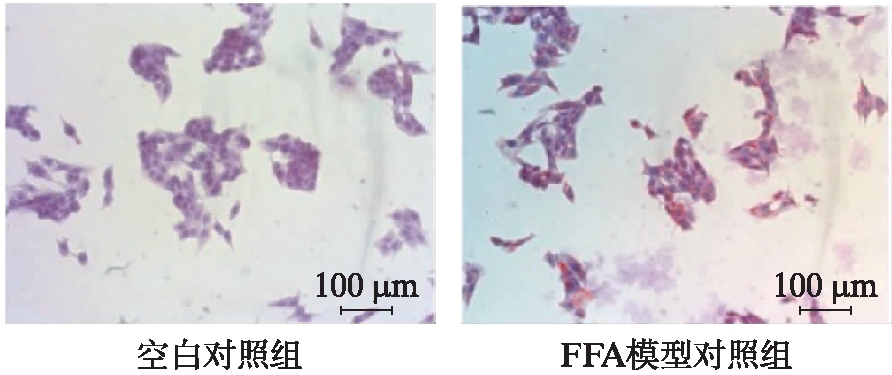
图1 油红O染色HepG2细胞内脂滴情况(×200)
Fig.1 Oil red staining of lipid droplets in HepG2 cells(×200)
2.2 FFA毒性检测
将细胞分为正常对照组和FFA模型对照组,FFA处理细胞24h后,CCK-8检测结果显示,FFA对HepG2细胞没有毒性作用,相反,FFA能促进HepG2细胞生长,FFA模型对照组的细胞活力是空白对照组的1.27倍,差异有统计学意义(P<0.01)。
2.3 PLD在非酒精性脂肪肝体外模型中的表达
将细胞分为空白对照组和FFA模型对照组,通过RT-qPCR检测PLD1和PLD2 mRNA的表达水平。结果显示,FFA模型对照组相较于对照组的PLD1 mRNA和PLD2 mRNA表达水平均降低,且PLD1 mRNA表达降低差异有统计学意义(P<0.05),PLD2 mRNA变化差异无统计学意义,见图2。因此推测细胞内脂滴聚集和PLD1有关。
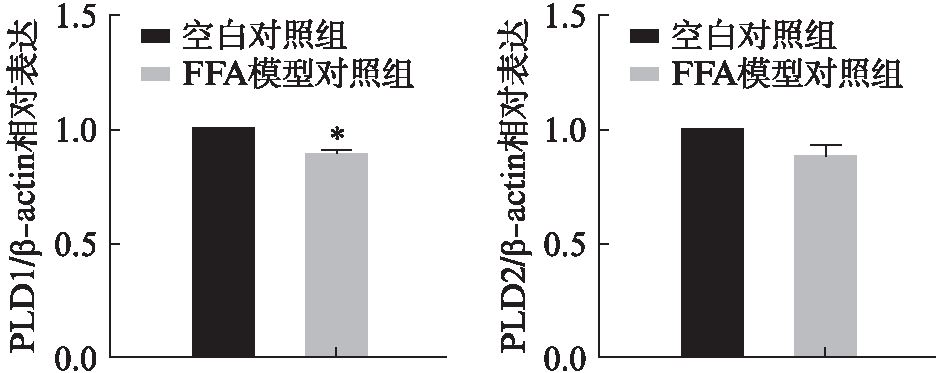
图2 FFA处理前后HepG2细胞中PLD1和PLD2的表达
Fig.2 Expression of PLD1/PLD2 in HepG2 cells after FFA treatment 与对照组相比,*P<0.05
2.4 PLD1 siRNA对非酒精性脂肪肝体外模型脂滴形成程度的影响
以PLD1为靶标,用si-PLD1小干扰RNA沉默PLD1基因,以观察PLD1对脂滴形成的影响。si-PLD1 RNA转染细胞24h后,行油红O染色,结果显示空白对照组和si-PLD1对照组都无明显脂滴形成,且细胞生长良好,si-PLD1 RNA未对细胞生长产生明显影响,见图3。

图3 空白对照组和si-PLD1对照组细胞内脂滴情况(×400)
Fig.3 Oil red staining of lipid droplets in the normal control group and the si-PLD1 control group(×400)
si-PLD1 RNA转染细胞24h后,si-PLD1对照组相比空白对照组PLD1 mRNA的表达水平显著降低(P<0.001),si-PLD1+FFA模型干预组相比FFA模型对照组PLD1的表达水平显著降低,差异有统计学意义(P<0.01),见图4。表明si-PLD1 RNA的沉默效果明显。
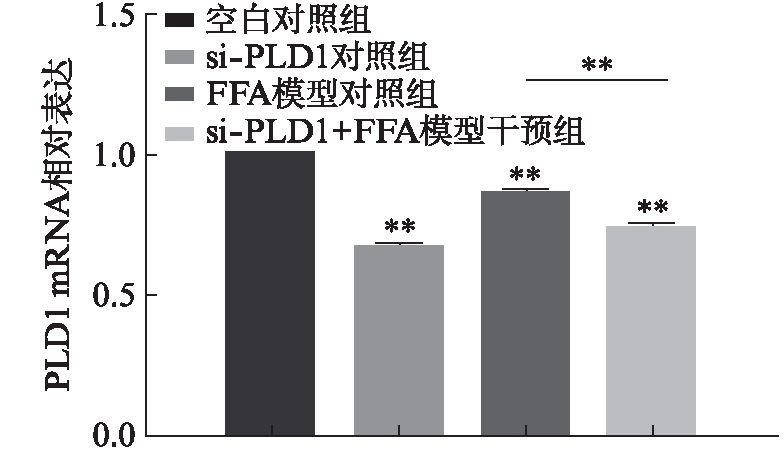
图4 si-PLD1 RNA转染后HepG2细胞中PLD1的表达
Fig.4 Expression of PLD1 in HepG2 cells after si-PLD1 RNA transfection 与对照组相比,**P<0.01,n=3
流式细胞术检测结果显示,FFA模型对照组较正常对照组平均荧光强度增加(P<0.001);而si-PLD1+FFA模型干预组较FFA模型对照组平均荧光强度明显降低(P<0.001),见图5。说明FFA处理HepG2细胞24h后,细胞内脂滴聚集显著增多,非酒精性脂肪肝体外细胞模型构建成功;且siRNA沉默PLD1后细胞内的脂滴可明显减少,说明si-PLD1能抑制细胞内脂滴生成。
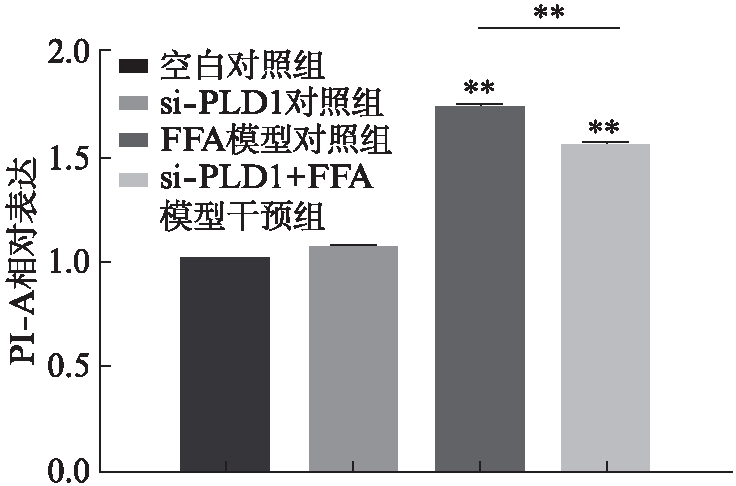
图5 si-PLD1 RNA转染后HepG2细胞 尼罗红染色的平均荧光强度
Fig.5 Mean fluorescence of Nile Red stained of HepG2 cells after si-PLD1 RNA transfection 与对照组相比,**P<0.01,n=3
2.5 PLD1 siRNA对非酒精性脂肪肝体外模型中成脂基因的影响
为探究PLD1影响HepG2细胞的脂滴形成的机制,本研究检测了成脂基因FASN、DGAT2和GPAT4 mRNA的表达水平。结果显示,FFA模型对照组相比空白对照组FASN mRNA水平明显增加(P<0.05),而si-PLD1+FFA模型干预组较FFA模型对照组mRNA水平明显降低(P<0.01)。FFA模型对照组相比空白对照组DGAT2 mRNA水平明显增加(P<0.01),si-PLD1+FFA模型干预组较FFA模型对照组mRNA水平明显增加(P<0.05)。GPAT4结果显示,FFA模型对照组相比空白对照组mRNA水平明显降低(P<0.01),si-PLD1+FFA模型干预组较FFA模型对照组mRNA水平也明显降低,差异有统计学意义(P<0.05),见图6。
2.6 Ad-PLD1过表达对非酒精性脂肪肝体外模型脂滴形成程度的影响
用Ad-PLD1过表达PLD1基因的慢病毒感染HepG2细胞,以观察PLD1对脂滴形成的影响。Ad-PLD1慢病毒感染细胞24h后,行油红O染色,结果显示空白对照组和Ad-PLD1对照组都无明显脂滴形成,细胞生长良好,Ad-PLD1慢病毒未对细胞生长产生明显影响,见图7。
Ad-PLD1慢病毒感染细胞48h后,用1mmol/L FFA处理细胞24h。qRT-PCR检测结果显示,Ad-PLD1对照组相比空白对照组PLD1的表达水平显著升高,可达4.88倍(P<0.001),Ad-PLD1+FFA模型干预组相比FFA模型对照组PLD1的表达水平也显著升高(P<0.001),Ad-PLD1的过表达效果明显,见图8。
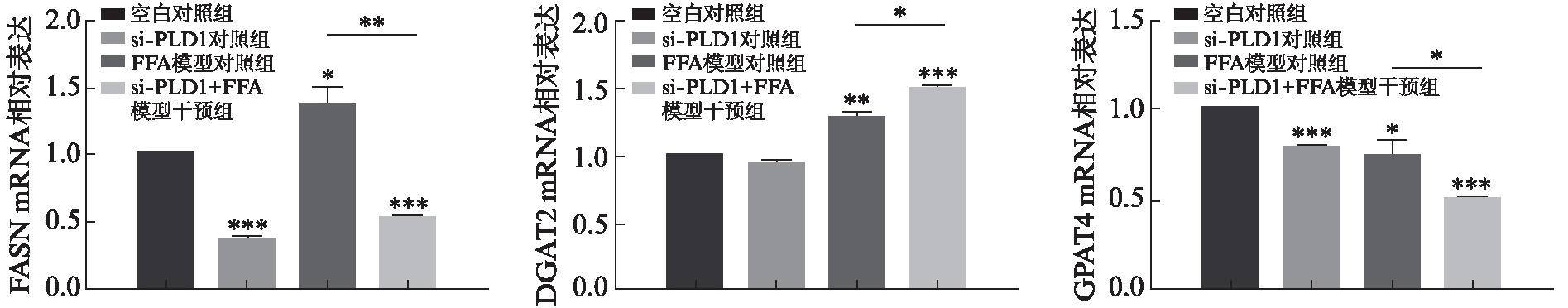
图6 si-PLD1 RNA转染后HepG2细胞成脂基因的mRNA表达水平
Fig.6 Expression of adipogenesis genes in HepG2 cells after si-PLD1 RNA transfection 与对照组相比,*P<0.05,**P<0.01,***P<0.001,n=4
收集细胞行尼罗红染色,流式细胞术检测结果显示,FFA模型对照组较正常对照组平均荧光强度增加(P<0.001),且Ad-PLD1+FFA模型干预组较FFA模型对照组平均荧光强度明显增加(P<0.001),见图9。说明FFA处理HepG2细胞24h后,细胞内脂滴聚集显著增多,非酒精性脂肪肝体外细胞模型构建成功;且Ad-PLD1过表达PLD1后细胞内的脂滴可明显增多,说明Ad-PLD1可促进细胞内脂滴生成。
2.6 Ad-PLD1过表达对非酒精性脂肪肝体外模型中成脂基因的影响
qRT-PCR结果显示,FFA模型对照组相比空白对照组FASN mRNA水平明显增加(P<0.05),且Ad-PLD1+FFA模型干预组较FFA模型对照组mRNA水平明显增加(P<0.05)。DGAT2结果示: FFA模型对照组相比空白对照组mRNA水平明显增加(P<0.01),而Ad-PLD1+FFA模型干预组较FFA模型对照组mRNA水平明显降低(P<0.01)。GPAT4结果示,FFA模型对照组相比空白对照组mRNA水平明显降低(P<0.01),Ad-PLD1+FFA模型干预组较FFA模型对照组mRNA水平也明显增加,差异有统计学意义(P<0.05),见图10。
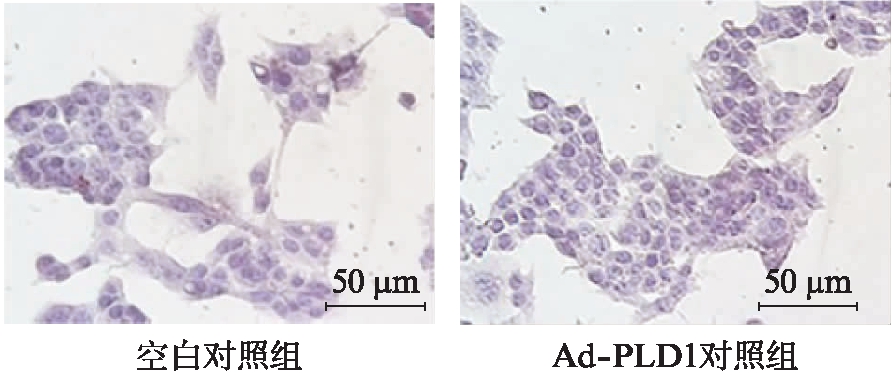
图7 空白对照组和si-PLD1对照组 细胞内脂滴情况(×400)
Fig.7 Oil red staining of lipid droplets in the normal control group and the si-PLD1 control group(×400)

图8 Ad-PLD1慢病毒感染后HepG2 细胞中PLD1的表达
Fig.8 Expression of PLD1 in HepG2 cells after Ad-PLD1 lentivirus infection 与对照组相比,*P<0.01,n=3
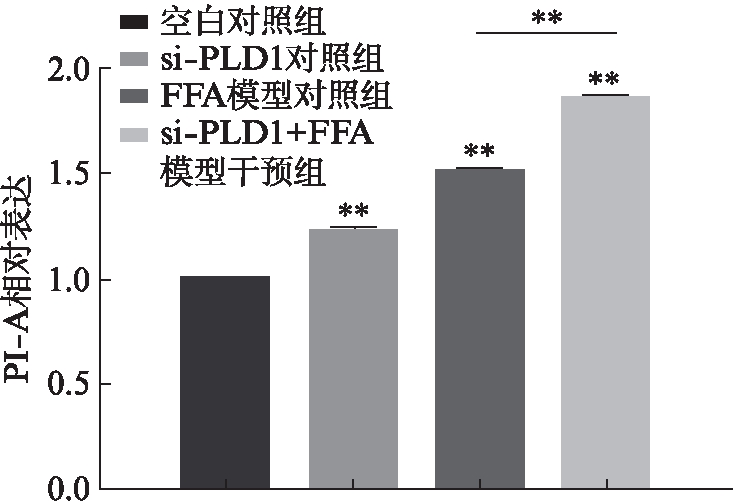
图9 Ad-PLD1慢病毒感染后HepG2细胞 尼罗红染色的平均荧光强度
Fig.9 Mean fluorescence of Nile Red stained of HepG2 cells after Ad-PLD1 lentivirus infection 与对照组相比,**P<0.01,n=4
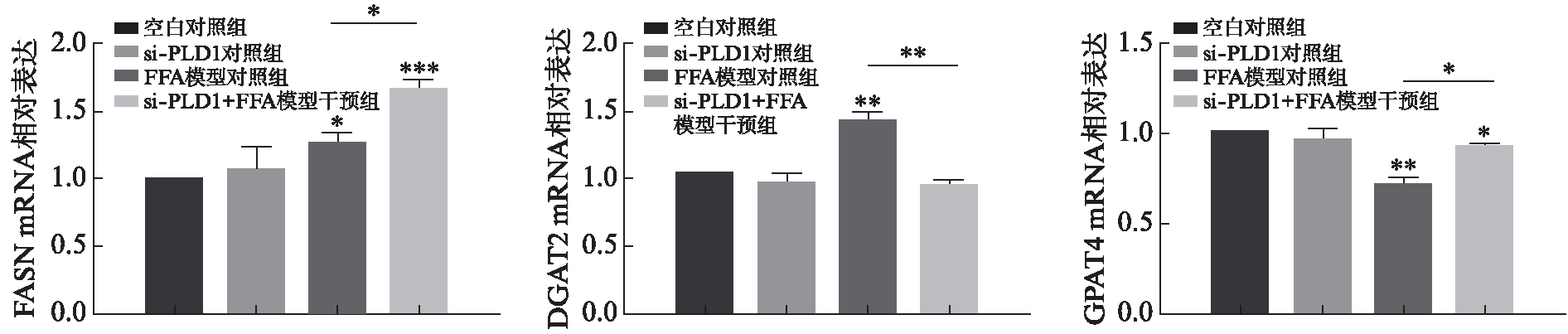
图10 Ad-PLD1慢病毒感染后HepG2细胞成脂基因的mRNA表达水平
Fig.10 Expression of adipogenesis genes in HepG2 cells after Ad-PLD1 lentivirus infection 与对照组相比,*P<0.05,**P<0.01,n=4
3 讨 论
目前有多种理论来解释NAFLD的发病,但其完整发病机制尚不明确,其中值得肯定的是胰岛素抵抗和脂代谢紊乱在NAFLD发病中始终发挥着至关重要的作用[14]。尽管PLD1在癌症、感染和神经退行性疾病中的作用已被探究的相当深入[9,15-16],但PLD1与NAFLD之间的关系尚仍不清楚。据报道,PLD1可通过增强ERK2诱导的动力蛋白磷酸化来调节脂滴形成[17-18],PLD1的过表达可促进脂质滴的形成,而使用siRNA抑制PLD1的表达则可抑制脂质滴的形成,这与本研究结果相一致。此外,还有报道表明PLD1通过mTOR-IRS-1丝氨酸636/639的磷酸化调节成脂分化[19-20]。PLD1可通过调节其与PED/PEA15相互作用来调节葡萄糖转运[21-22],进而影响胰岛素抵抗。近年来有基于计算机模拟的研究,从PLD1和PED/PEA15中筛选了线性肽段,证明该肽可作为竞争性抑制剂中断PLD1-PED/PEA15的相互作用,从而恢复胰岛素刺激的葡萄糖摄取[23]。
本研究通过构建si-PLD1 RNA沉默PLD1基因和构建Ad-PLD1慢病毒过表达PLD1基因,来研究PLD1在NAFLD体外细胞模型中对成脂的影响。本研究有充分的证据表明,PLD1参与HepG2细胞的细胞内脂肪生成;沉默PLD1后,细胞内脂滴减少,且可在FFA诱导的FASN上调基础上下调FASN;而过表达PLD1后,细胞内脂滴增多,可在FFA诱导的FASN上调基础上继续上调FASN。因此推断,PLD1参与肝脏脂肪生成,并可促进肝脏脂肪生成。但值得注意的是,沉默PLD1可使FFA诱导上调的DGAT2进一步上调,而使FFA诱导下调的GPAT4进一步下调。二酰基甘油酰基转移酶2(DGAT2)催化甘油三酸酯合成的最后一步,甘油3- 磷酸酰基转移酶4(GPAT4)是将甘油-3-磷酸转化为1-酰基-sn-甘油-3-磷酸(溶血磷脂酸或LPA)的关键一步,这意味着沉默PLD1可使细胞内三酰甘油增加,而溶血磷脂酸减少。而PLD1过表达结果则与沉默PLD1后的结果相反。
三酰甘油是NAFLD患者肝脏中储存的主要脂质,曾经被认为是引起脂毒性的主要原因,但现有研究证据更加支持甘油三酸酯可能发挥保护作用[24],根据脂毒性学说的观点,肝细胞内的三酰甘油并不会导致胰岛素抵抗和肝细胞损伤,真正引起NASH的核心机制是游离脂肪酸及其代谢产物如胆固醇、棕榈酸、溶血磷脂酰胆碱和神经酰胺等非三酰甘油的脂毒性肝损害,包括内质网应激[25]、炎症[26]、细胞凋亡、坏死和畸形等,而三酰甘油脂滴则作为一种平行现象,甚至是对肝细胞的一种保护现象[27-29]。在本研究中,沉默PLD1使溶血磷脂酸减少,而三酰甘油保护性增加,这和脂毒性学说一致。相反,过表达PLD使溶血磷脂酸增多,而三酰甘油却有所减低。这表明,虽然PLD1能促进肝细胞内脂肪生成,但似乎并不是一个保护性因素,PLD1具体在NAFLD中扮演着什么角色,还有待进一步探究。
本研究初步探究了PLD1在NAFLD体外细胞模型中对脂肪生成的影响。已经确定,沉默PLD1可使NAFLD细胞模型中的脂滴减少,而过表达PLD1可使NAFLD细胞模型中的脂滴增多。这些发现表明PLD1可能在NAFLD的发生和发展中起着至关重要的作用,且PLD1可能是预防和治疗NAFLD的新靶标。下一步本课题组将在动物体内进一步验证PLD1和NAFLD的关联,探究PLD抑制脂滴生成的相关机制,尽可能为非酒精性脂肪性肝病寻找新的治疗靶点。
[1] CHALASANI N, YOUNOSSI Z, LAVINE J E, et al. The diagnosis and management of nonalcoholic fatty liver disease: practice guidance from the American association for the study of liver diseases[J]. Hepatology, 2018,67(1): 328-357.
[2] YOUNOSSI Z M, KOENIG A B, ABDELATIF D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016,64(1): 73-84.
[3] FAN J G, ZHU J, LI X J, et al. Prevalence of and risk factors for fatty liver in a general population of Shanghai, China[J]. J Hepatol, 2005,43(3): 508-514.
[4] HU X N, HUANG Y Q, BAO Z J, et al. Prevalence and factors associated with nonalcoholic fatty liver disease in Shanghai work-units[J]. BMC Gastroenterol, 2012,12: 123.
[5] LI Z Z, XUE J, CHEN P, et al. Prevalence of nonalcoholic fatty liver disease in mainland of China: a meta-analysis of published studies[J]. J Gastroenterol Hepatol, 2014,29(1): 42-51.
[6] ZHOU Y J, LI Y Y, NIE Y Q, et al. Prevalence of fatty liver disease and its risk factors in the population of South China[J]. World J Gastroenterol, 2007,13(47): 6419-6424.
[7] MACHADO M V, DIEHL A M. Pathogenesis of nonalcoholic steatohepatitis[J]. Gastroenterology, 2016,150(8): 1769-1777.
[8] SELVY P E, LAVIERI R R, LINDSLEY C W, et al. Phospholipase D: enzymology, functionality, and chemical modulation[J]. Chem Rev, 2011,111(10): 6064-6119.
[9] BROWN H A, THOMAS P G, LINDSLEY C W. Targeting phospholipase D in cancer, infection and neurodegenerative disorders[J]. Nat Rev Drug Discov, 2017,16(5): 351-367.
[10] COCKCROFT S. Signalling roles of mammalian phospholipase D1 and D2[J]. Cell Mol Life Sci, 2001,58(11): 1674-1687.
[11] HUANG P, ALTSHULLER Y M, HOU J C, et al. Insulin-stimulated plasma membrane fusion of Glut4 glucose transporter-containing vesicles is regulated by phospholipase D1[J]. Mol Biol Cell, 2005,16(6): 2614-2623.
[12] ANDERSSON L, BOSTRÖM P, ERICSON J, et al. PLD1 and ERK2 regulate cytosolic lipid droplet formation[J]. J Cell Sci, 2006,119(Pt 11): 2246-2257.
[13] YOON M S, CHEN J. PLD regulates myoblast differentiation through the mTOR-IGF2 pathway[J]. J Cell Sci, 2008,121(Pt 3): 282-289.
[14] 王雨涵,高影.非酒精性脂肪性肝病并发2型糖尿病诊断和治疗的研究进展[J].吉林大学学报(医学报),2020, 46(6): 1324-1331.
[15] NORTON L J, ZHANG Q F, SAQIB K M, et al. PLD1 rather than PLD2 regulates phorbol-ester-, adhesion-dependent and Fc{gamma}-receptor-stimulated ROS production in neutrophils[J]. J Cell Sci, 2011,124(Pt 12): 1973-1983.
[16] GOMEZ-CAMBRONERO J. Phospholipase D in cell signaling: from a myriad of cell functions to cancer growth and metastasis[J]. J Biol Chem, 2014,289(33): 22557-22566.
[17] MARCHESAN D, RUTBERG M, ANDERSSON L, et al. A phospholipase D-dependent process forms lipid droplets containing caveolin, adipocyte differentiation-related protein, and vimentin in a cell-free system[J]. J Biol Chem, 2003,278(29): 27293-27300.
[18] ANDERSSON L, BOSTRÖM P, ERICSON J, et al. PLD1 and ERK2 regulate cytosolic lipid droplet formation[J]. J Cell Sci, 2006,119(Pt 11): 2246-2257.
[19] GAO S Q, ITO H, MURAKAMI M, et al. Mechanism of increased PLD1 gene expression during early adipocyte differentiation process of mouse cell line 3T3-L1[J]. J Cell Biochem, 2010,109(2): 375-382.
[20] SONG H I, YOON M S. PLD1 regulates adipogenic differentiation through mTOR-IRS-1 phosphorylation at serine 636/639[J]. Sci Rep, 2016,6: 36968.
[21] CONDORELLI G, VIGLIOTTA G, IAVARONE C, et al. PED/PEA-15 gene controls glucose transport and is overexpressed in type 2 diabetes mellitus[J]. EMBO J, 1998,17(14): 3858-3866.
[22] CONDORELLI G, VIGLIOTTA G, CAFIERI A, et al. PED/PEA-15: an anti-apoptotic molecule that regulates FAS/TNFR1-induced apoptosis[J]. Oncogene, 1999,18(31): 4409-4415.
[23] BAIG M H, KAUSAR M A, HUSAIN F M, et al. Interfering PLD1-PED/PEA15 interaction using self-inhibitory peptides: an in silico study to discover novel therapeutic candidates against type 2 diabetes[J]. Saudi J Biol Sci, 2019,26(1): 160-164.
[24] TRIGLYCERIDE CORONARY DISEASE GENETICS CONSORTIUM AND EMERGING RISK FACTORS COLLABORATION, SARWAR N, SANDHU M S, et al. Triglyceride-mediated pathways and coronary disease: collaborative analysis of 101 studies[J]. Lancet, 2010,375(9726): 1634-1639.
[25] HAN J, KAUFMAN R J. The role of ER stress in lipid metabolism andlipotoxicity[J]. J Lipid Res, 2016,57(8): 1329-1338.
[26] SZABO G, PETRASEK J. Inflammasome activation and function in liver disease[J]. Nat Rev Gastroenterol Hepatol, 2015,12(7): 387-400.
[27] CUSI K. Role of obesity and lipotoxicity in the development of nonalcoholic steatohepatitis: pathophysiology and clinical implications[J]. Gastroenterology, 2012,142(4): 711-725.
[28] NEUSCHWANDER-TETRI B A. Nontriglyceride hepatic lipotoxicity: the new paradigm for the pathogenesis of NASH[J]. Curr Gastroenterol Rep, 2010,12(1): 49-56.
[29] NEUSCHWANDER-TETRI B A. Hepatic lipotoxicity and the pathogenesis of nonalcoholic steatohepatitis: the central role of nontriglyceride fatty acid metabolites[J]. Hepatology, 2010,52(2): 774-788.