间充质干细胞(mesenchymal stem/stromal cells, MSCs)是成体干细胞的一种,来源于胚胎发育早期的中胚层[1],可从骨髓[2]、脂肪组织[3]、脐带[4]、羊水[5]等分离获得。MSCs因具有免疫调节作用,在自身免疫性疾病、炎症、肿瘤等疾病的治疗领域发挥重要作用[6]。
目前,有不少研究致力于提高MSCs的免疫调节能力,从而优化治疗效果。其中,对MSCs进行预处理是一种较为简单的方法。常见的预处理方法有炎症因子预处理[7]和缺氧/低氧预处理[8]。但是关于炎症因子预处理MSCs对其免疫调节能力的影响,尚存在诸多争议。有研究表明,炎症因子如IFN-γ预处理MSCs,可以增强其免疫抑制特性,减轻炎症反应[9]。但也有研究显示,IFN-γ和TNF-α联合预处理的MSCs引起结肠炎小鼠模型疾病的恶化[10]。因此,阐明炎症因子调节MSCs免疫应答的分子机制,有利于MSCs应用于炎症性疾病的临床治疗。IFN-γ是一种常见的炎症因子,可由多种类型的细胞产生,包括激活的T细胞、NK细胞、NKT细胞以及巨噬细胞,在先天和适应性免疫反应中发挥重要作用[11-14]。本研究通过分析GEO数据库中GSE77814芯片表达数据,旨在探究IFN-γ预处理对MSCs转录组的改变,同时比较了不同浓度IFN-γ预处理的区别,深入揭示了炎症因子IFN-γ调节MSCs免疫应答的分子机制,为炎症因子预处理对其免疫调节能力的影响提供依据。
1 材料与方法
1.1 来源
从GEO数据库(https:∥www.ncbi.nlm.nih.gov/geo/)下载GSE77814骨髓间充质干细胞的基因表达数据,实验材料与实验步骤参考文献[15]。该芯片所用的平台为GPL13497 Agilent-026652 Whole Human Genome Microarray 4x44K v2(Probe Name version)。选取其中9例对照组的数据分别与3例IFN-γ(6.5ng/mL,低浓度组)预处理48h、3例IFN-γ(65ng/mL,高浓度组)预处理48h的数据进行分析。
1.2 差异基因的获取
使用GEO数据库自带的GEO2R(https:∥www.ncbi.nlm.nih.gov/geo/geo2r)的R语言程序对数据进行分析,剔除未知基因及非编码RNA。以错误发现率(false discovery rate, FDR)<0.05且|logFC|≥1为差异基因(differentially expressed genes, DEGs)筛选条件,对IFN-γ-H DEGs中上调和下调变化最大的前15位基因做热图。
1.3 差异基因的GO富集分析和KEGG富集分析
对IFN-γ-L DEGs和IFN-γ-H DEGs分别采用DAVID 6.8数据库进行GO富集分析(Gene Ontology,http:∥geneontology.org/),采用KEGG Mapper(Kyoto Encyclopedia of Genes and Genomes, https:∥www.kegg.jp/)进行KEGG信号通路富集分析。
1.4 Uniprot蛋白数据分析
利用Uniprot数据库(https:∥www.uniprot.org/)对IFN-γ-L DEGs和IFN-γ-H DEGs中上调的基因所编码的蛋白分别进行细胞亚定位的分析。
1.5 蛋白互作网络分析
利用STRING数据库(https:∥string-db.org/)对IFN-γ-L DEGs和IFN-γ-H DEGs中上调的基因分别构建蛋白相互作用网络(protein-protein interaction network, PPI network),置信度为0.4。将得到的PPI网络图导入Cytoscape 3.7.2软件,利用cytoHubba插件计算度值(degree),以此作为关键靶基因的筛选的标准。
1.6 GSEA富集分析
由于一代富集分析方法如GO富集分析和KEGG富集分析是对筛选后的差异基因进行分析,存在遗漏其他重要基因的弊端。因此,这里使用二代富集分析方法GSEA 4.0.3(Gene Set Enrichment Analysis)对mRNA表达谱数据进行KEGG信号通路富集分析,旨在提供更全面的分析结果。以MsigDB数据库中获得基因集c2.cp.kegg.v7.0.symbols作为参照基因集,设定富集基因集的范围为15~500个基因,随机组合重复次数设置为1000次,寻找预处理后差异显著的基因及其富集的通路。
2 结 果
2.1 差异基因分析
以FDR<0.05且|logFC|≥1为差异基因筛选条件。IFN-γ低浓度组与未处理组相比,共筛选出152个差异基因,其中133个为上调基因,19个为下调基因。IFN-γ高浓度组与未处理组相比,共筛选出648个差异基因,其中431个为上调基因,217个为下调基因。可以看出,IFN-γ高浓度处理条件下产生的差异基因几乎包含了低浓度处理条件下产生的差异基因,且高浓度处理产生的差异基因数目更多,各差异基因组别之间有重叠关系,见图1、表1~3。该结果表明,IFN-γ的浓度对MSCs转录组的影响较大。此外,趋化因子(如CXCL9、CCL8)和经典的抑炎因子IDO-1在高浓度的IFN-γ处理下才出现较高的表达。图2为高浓度组处理下上调和下调差异倍数最大的15个基因的热图。
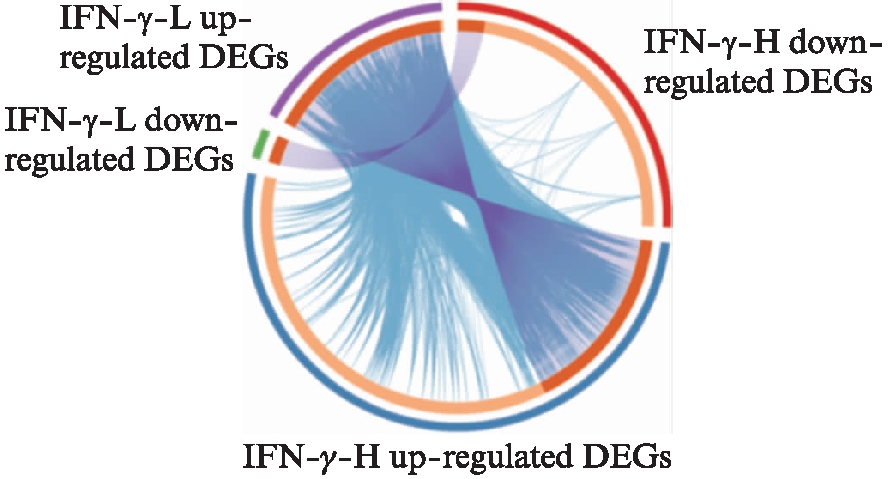
图1 差异基因的Circos图
Fig.1 The Circos plot of DEGs
Circos图中,紫色的线连接相同的基因,蓝色的线连接富集于相同本体条目的基因;该图在Metascape平台(http:∥www.metascape.org/)绘制完成
2.2 GO富集分析结果
IFN-γ-L DEGs的分析结果显示,这些基因共参与105种生物学过程、35种细胞组分和32种分子功能。其中,FDR<0.01的生物学过程有20种、细胞组分有12种、分子功能有3种。绝大多数影响的生物学过程都与免疫相关,“免疫反应”富集的基因数目最多(n=34,FDR为3.14×10-20);“IFN-γ介导的信号通路”最为显著(n=30,FDR为1.94×10-41)。这些基因影响了多种细胞组分,主要集中于细胞生物膜系统。显著影响的分子功能只有3个条目: 肽抗原结合、MHC Ⅱ类分子受体活性和抗原肽转运蛋白1(transporter associated with antigen processing 1, TAP 1)结合。IFN-γ-H DEGs的分析结果显示,这些基因共参与177种生物学过程、43种细胞组分和49种分子功能。其中,FDR<0.01的生物学过程有19种、细胞组分有7种、分子功能有2种。富集的条目与IFN-γ-H DEGs的富集结果接近。图3列出了对生物学过程、细胞组分和分子功能影响最显著的前10项GO条目(若有)。
表1 IFN-γ-L DEGs上调表达差异倍数最大的前10个基因
Tab.1 Top 10 up-regulated genes of IFN-γ-L DEGs
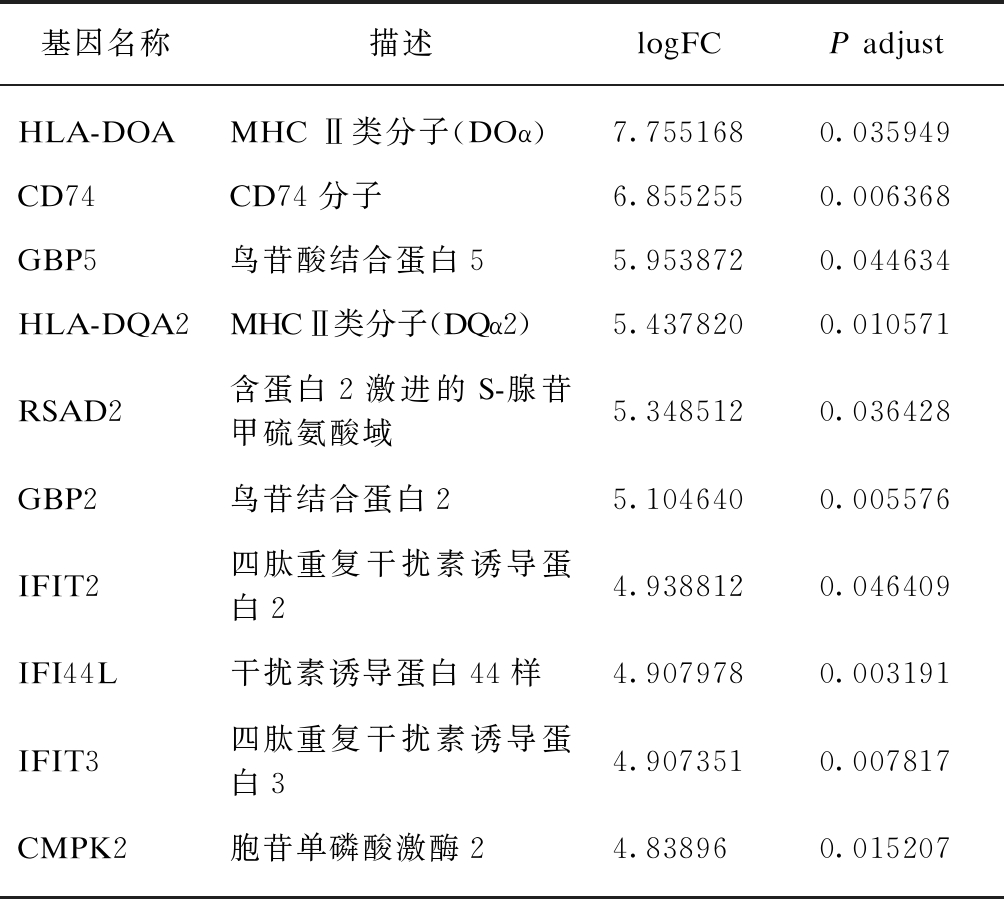
基因名称描述logFCP adjustHLA-DOAMHC Ⅱ类分子(DOα)7.7551680.035949CD74CD74分子6.8552550.006368GBP5鸟苷酸结合蛋白55.9538720.044634HLA-DQA2MHC Ⅱ类分子(DQα2)5.4378200.010571RSAD2含蛋白2激进的S-腺苷甲硫氨酸域5.3485120.036428GBP2鸟苷结合蛋白25.1046400.005576IFIT2四肽重复干扰素诱导蛋白24.9388120.046409IFI44L干扰素诱导蛋白44样4.9079780.003191IFIT3四肽重复干扰素诱导蛋白34.9073510.007817CMPK2胞苷单磷酸激酶24.838960.015207
表2 IFN-γ-L DEGs下调表达差异倍数最大的10个基因
Tab.2 Top 10 down-regulated genes of IFN-γ-L DEGs

基因名称描述logFCP adjustRPL27A核糖体蛋白L27A-3.424890.003191TNFRSF10D肿瘤坏死因子受体超家族成员10D-3.056360.000182CLN8神经细胞蜡样质脂褐质沉积病蛋白8-2.931510.007490GAP43生长相关蛋白43-1.833460.012670NT5DC25'-核苷酸酶(DC2)-1.828240.000290NFYA核转录因子Y(ɑ)-1.445310.024488ZNF469锌指蛋白469-1.398380.033039HEATR5A含5A的HEAT重复-1.324730.000381NKX3-2NK3同源框2-1.277370.014928ITGA10整合素α10-1.253210.046800
表3 IFN-γ-H DEGs上调表达差异倍数最大的10个基因
Tab.3 Top 10 up-regulated genes of IFN-γ-H DEGs
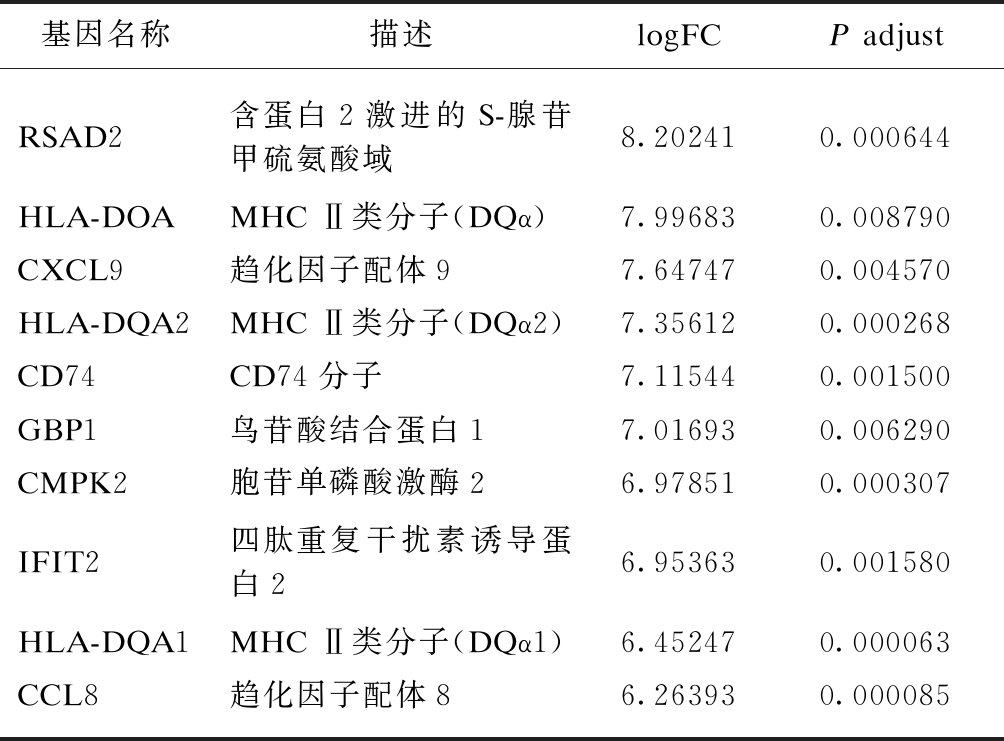
基因名称描述logFCP adjustRSAD2含蛋白2激进的S-腺苷甲硫氨酸域8.202410.000644HLA-DOAMHC Ⅱ类分子(DQα)7.996830.008790CXCL9趋化因子配体97.647470.004570HLA-DQA2MHC Ⅱ类分子(DQα2)7.356120.000268CD74CD74分子7.115440.001500GBP1鸟苷酸结合蛋白17.016930.006290CMPK2胞苷单磷酸激酶26.978510.000307IFIT2四肽重复干扰素诱导蛋白26.953630.001580HLA-DQA1MHC Ⅱ类分子(DQα1)6.452470.000063CCL8趋化因子配体86.263930.000085
表4 IFN-γ-H DEGs下调表达差异倍数最大的10个基因
Tab.4 Top 10 down-regulated genes of IFN-γ-H DEGs
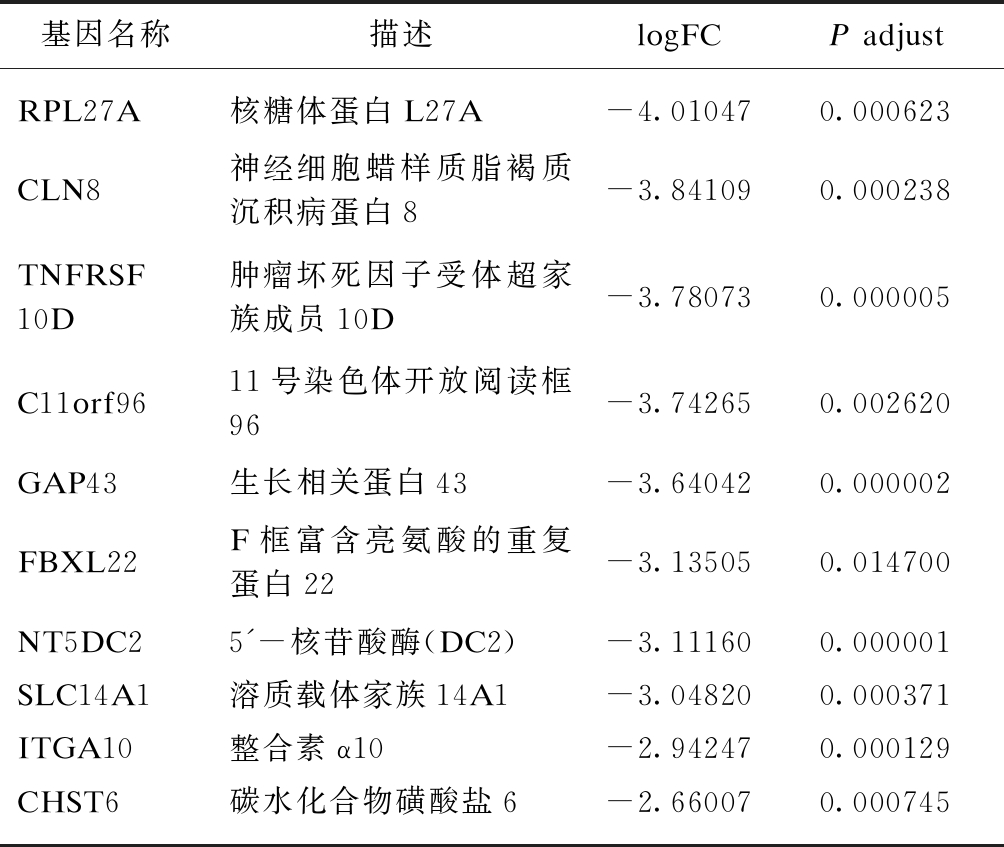
基因名称描述logFCP adjustRPL27A核糖体蛋白L27A-4.010470.000623CLN8神经细胞蜡样质脂褐质沉积病蛋白8-3.841090.000238TNFRSF10D肿瘤坏死因子受体超家族成员10D-3.780730.000005C11orf9611号染色体开放阅读框96-3.742650.002620GAP43生长相关蛋白43-3.640420.000002FBXL22F框富含亮氨酸的重复蛋白22-3.135050.014700NT5DC25'-核苷酸酶(DC2)-3.111600.000001SLC14A1溶质载体家族14A1-3.048200.000371ITGA10整合素α10-2.942470.000129CHST6碳水化合物磺酸盐6-2.660070.000745
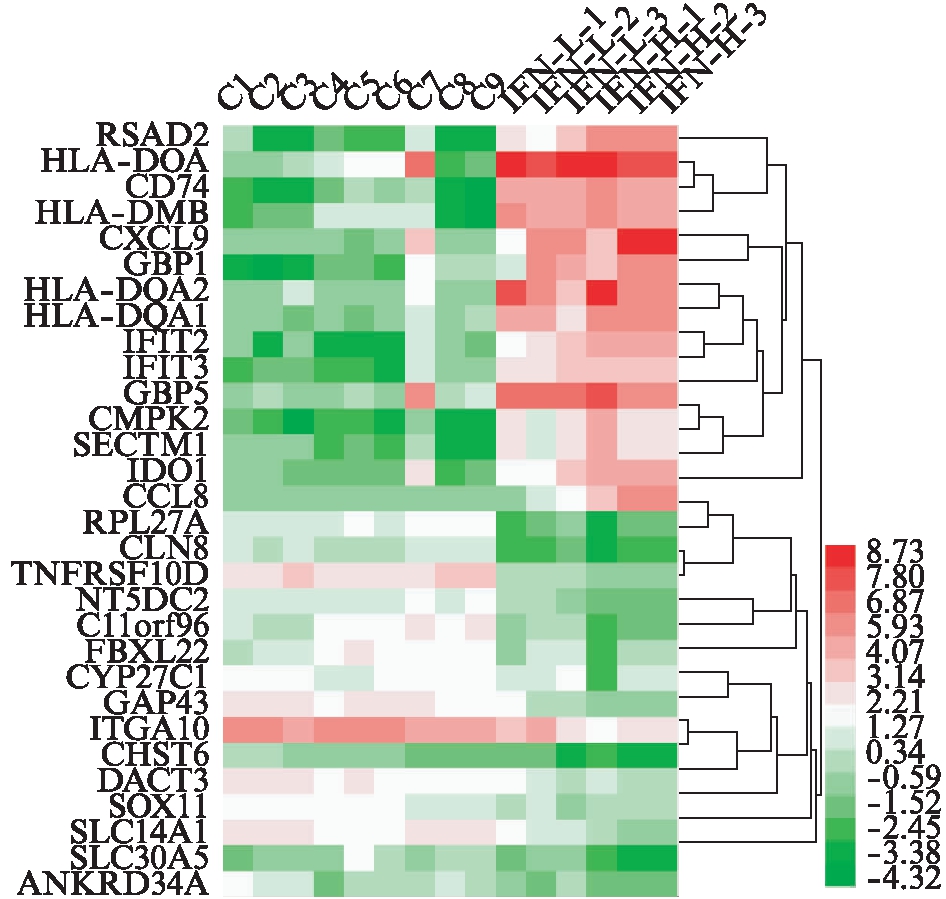
图2 IFN-γ高浓度组上调和下调表达差异倍数最大的前15名基因热图
Fig.2 Top 15 up-regulated and down-regulated gene expression of IFN-γ (high concentration) heat map

图3 差异基因的GO富集分析
Fig.3 GO analysis for DEGs
A: IFN-γ-L DEGs;B: IFN-γ-H DEGs;蓝色代表生物学过程,绿色代表细胞组分,红色代表分子功能
2.3 KEGG富集分析结果
分析结果显示,IFN-γ-L DEGs和IFN-γ-H DEGs主要参与免疫、感染相关的信号通路,如单纯疱疹病毒Ⅰ型感染、EB病毒感染、抗原处理与递呈、流感病毒A等。此外,IFN-γ-H DEGs的富集结果中出现了代谢通路,且是富集数目最多的。
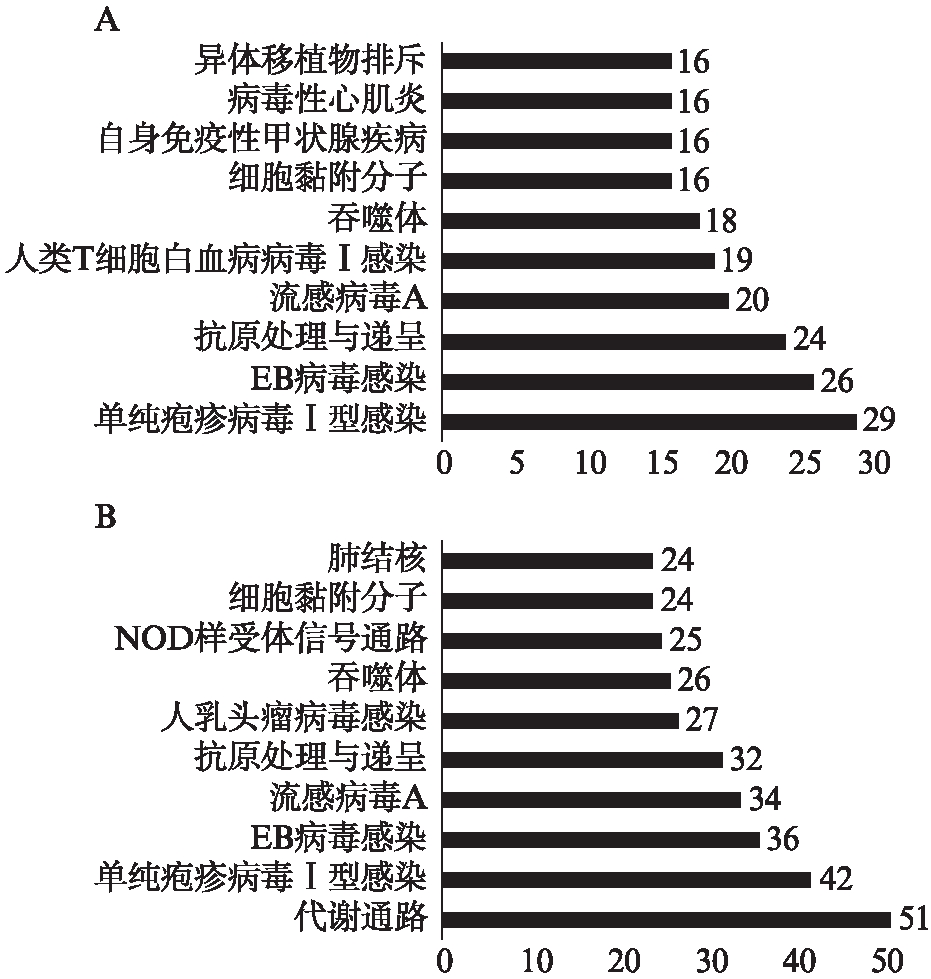
图4 差异基因的KEGG富集分析
Fig.4 KEGG analysis for DEGs
A: IFN-γ-L DEGs;B: IFN-γ-H DEGs
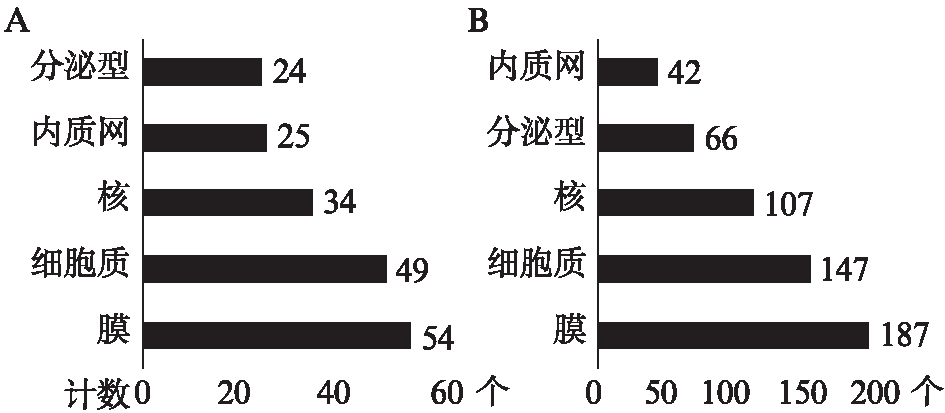
图5 上调差异基因表达蛋白的分布情况(前5位)
Fig.5 Proteins classified by cellular components (top 5)
A: IFN-γ-L DEGs;B: IFN-γ-H DEGs
2.4 Uniprot分析结果
对上调差异基因利用Uniprot数据库进行细胞亚定位分析。IFN-γ-L DEGs的133个上调基因中,132个有蛋白注释。IFN-γ-H DEGs的431个上调基因中,427个有蛋白注释。这些蛋白绝大多数属于生物膜系统,与2.2利用DAVID数据库进行GO细胞组分富集分析的结果相一致。由于MSCs行使免疫调节功能与旁分泌作用密切相关,本研究对差异基因所编码的分泌型蛋白进一步分析。低浓度处理条件下产生的分泌型蛋白对应的基因表达差异最大的前5位为TNFSF13B、OAS1、SECTM1、TNFSF10、IL18BP;而高浓度处理条件下的前5位为CXCL9、GBP1、CCL8、SCTM1、OAS1。
2.5 PPI网络分析结果
图6和图7分别为IFN-γ-L DEGs和IFN-γ-H DEGs中上调表达的差异基因所构建的PPI网络图。图8揭示了两组分别筛选得到的前10位hub基因(颜色越偏向红色代表该靶蛋白的度值越大)。
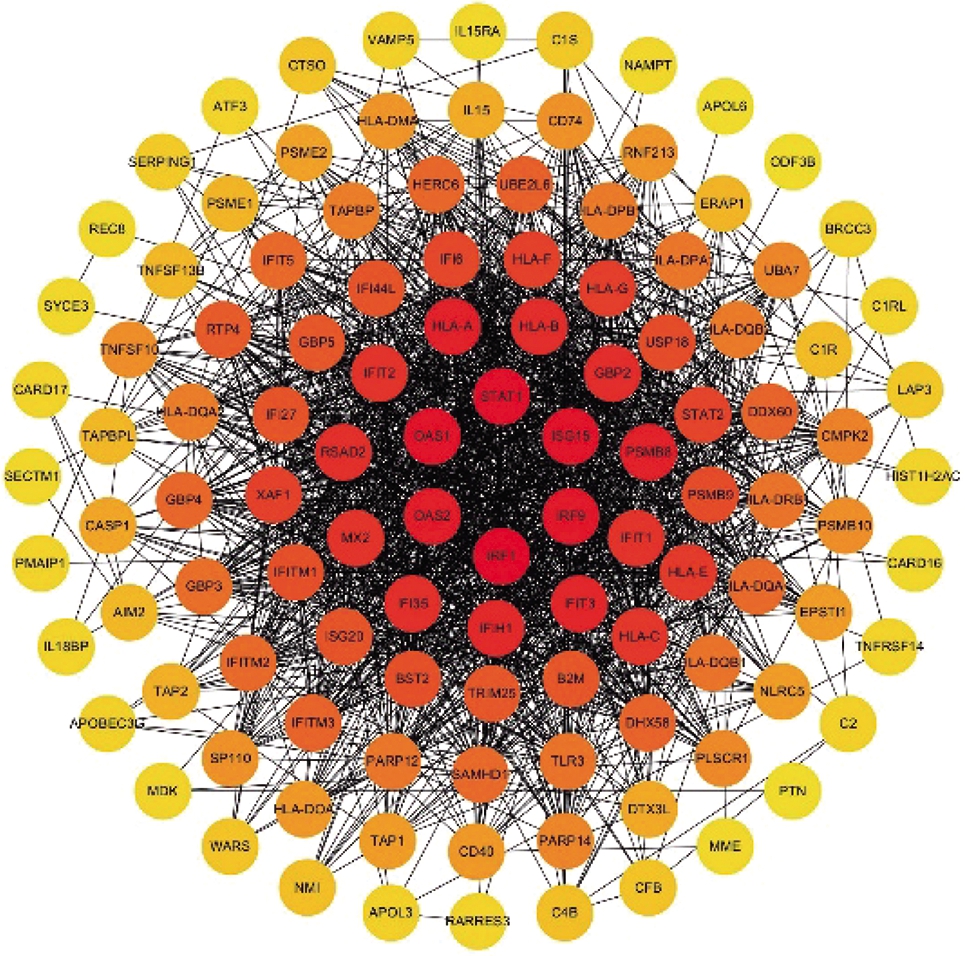
图6 上调基因的PPI网络图(IFN-γ-L DEGs)
Fig.6 PPI network of up-regulated IFN-γ-L DEGs

图7 上调基因的PPI网络图(IFN-γ-H DEGs)
Fig.7 PPI network of up-regulated IFN-γ-H DEGs
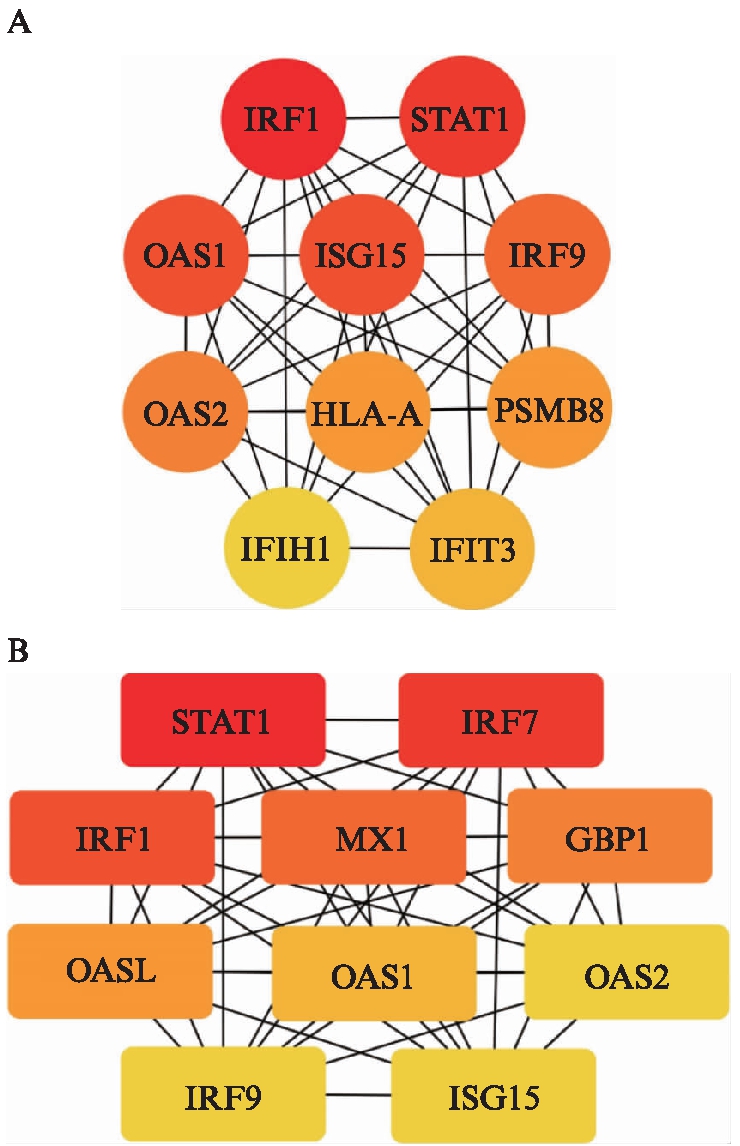
图8 关键靶基因图
Fig.8 PPI network of hub genes
A: IFN-γ-L DEGs;B: IFN-γ-H DEGs
2.6 GSEA富集分析结果
以FDR<25%且标准化的P<0.05的基因集为阳性基因集,炎症因子预处理后富集最显著的前10项结果见表5~6。高浓度预处理组和低浓度预处理组富集最显著的KEGG信号通路都是自身免疫性甲状腺疾病,见图9。
表5 IFN-γ低浓度预处理后富集的KEGG 信号通路及相关数据
Tab.5 KEGG pathways enriched in IFN-γ(low concentration) primed MSCs and associated statistics
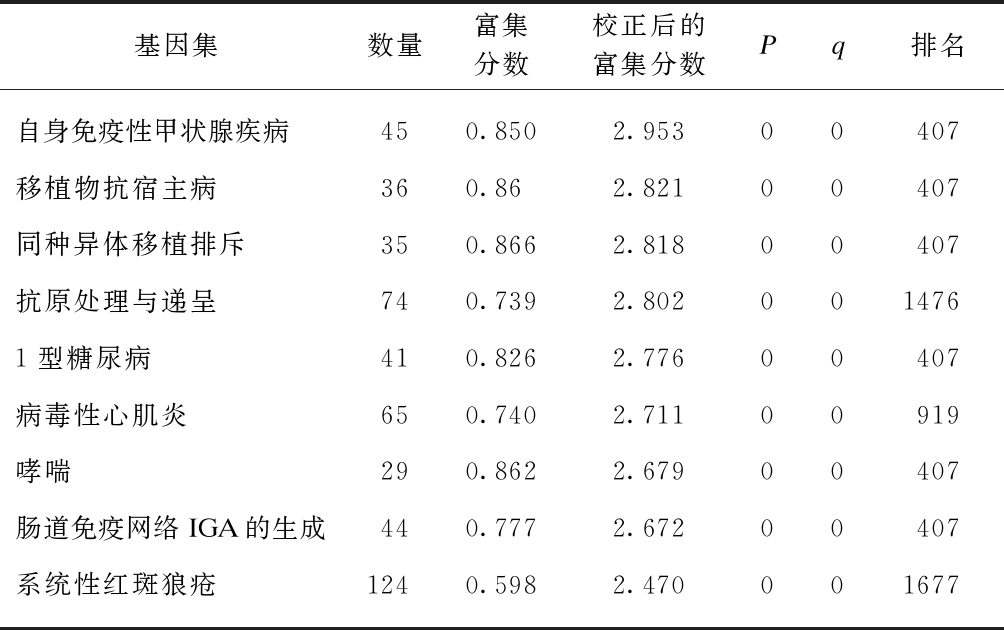
基因集数量富集分数校正后的富集分数Pq排名自身免疫性甲状腺疾病450.8502.95300407移植物抗宿主病360.862.82100407同种异体移植排斥350.8662.81800407抗原处理与递呈740.7392.8020014761型糖尿病410.8262.77600407病毒性心肌炎650.7402.71100919哮喘290.8622.67900407肠道免疫网络IGA的生成440.7772.67200407系统性红斑狼疮1240.5982.470001677
表6 IFN-γ高浓度预处理后富集的KEGG 信号通路及相关数据
Tab.6 KEGG pathways enriched in IFN-γ(high concentration) primed MSCs and associated statistics
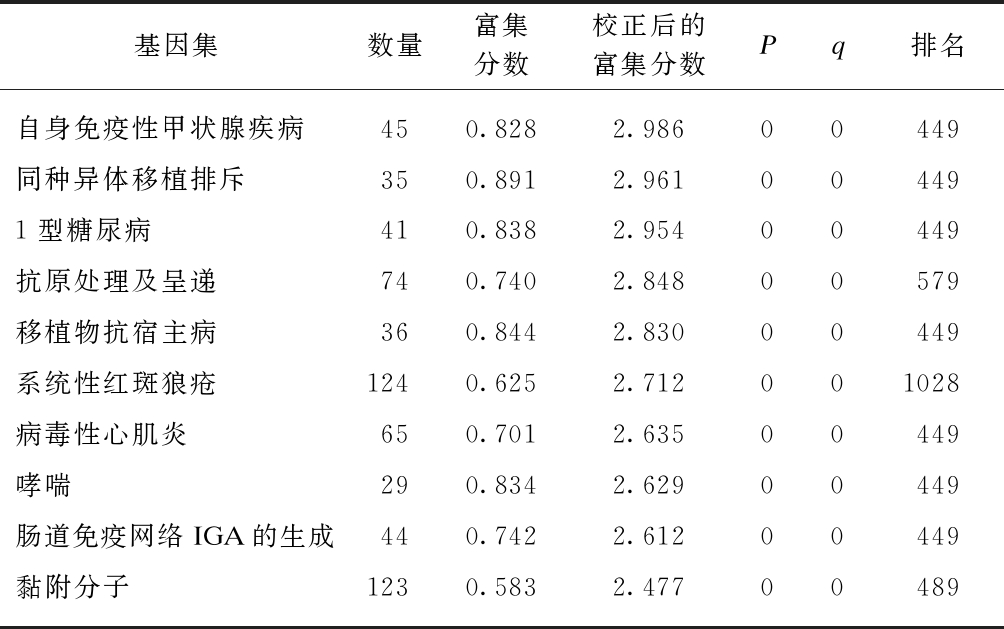
基因集数量富集分数校正后的富集分数Pq排名自身免疫性甲状腺疾病450.8282.98600449同种异体移植排斥350.8912.961004491型糖尿病410.8382.95400449抗原处理及呈递740.7402.84800579移植物抗宿主病360.8442.83000449系统性红斑狼疮1240.6252.712001028病毒性心肌炎650.7012.63500449哮喘290.8342.62900449肠道免疫网络IGA的生成440.7422.61200449黏附分子1230.5832.47700489
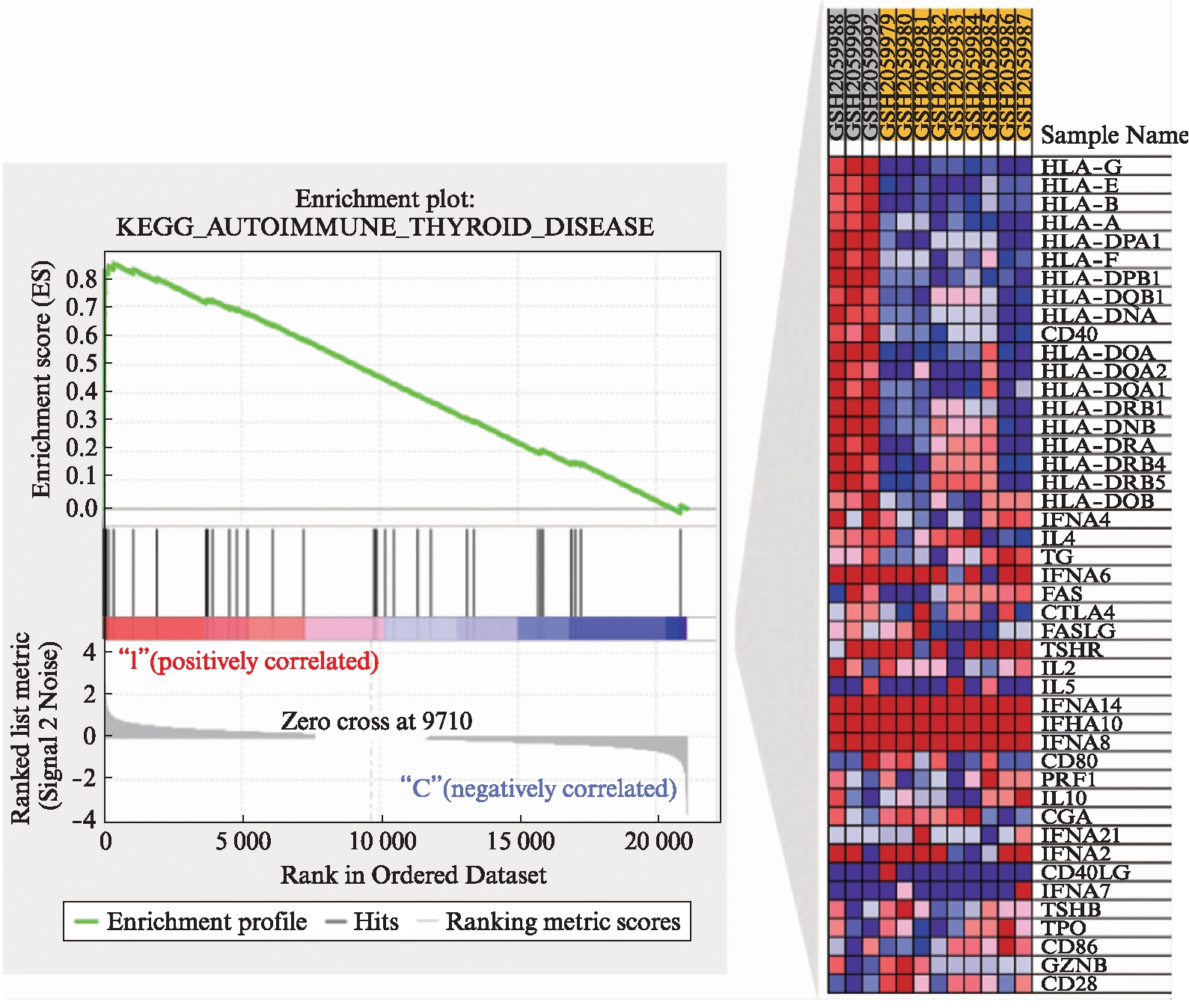
图9 自身甲状腺疾病的富集分析结果及相关基因集(IFN-γ低浓度处理)
Fig.9 GSEA analysis for autoimmune thyroid disease and positively enriched associated molecules(low concentration of IFN-γ treatment)
3 讨 论
本研究从GEO数据库下载得到骨髓间充质干细胞经炎症因子IFN-γ处理(6.5ng/mL,48h;65ng/mL,48h)和未处理组的芯片数据,利用GEO2R对数据进行分析。以FDR<0.05且|logFC|≥1为差异基因筛选条件,后续对编码已知mRNA的差异基因进行分析。数据原作者Jin等[15]主要关注IFN-γ和TNF-α联合预处理对MSCs转录组水平的影响,并未深入分析IFN-γ预处理对MSCs的影响。虽然作者指出IFN-γ和TNF-α具有协同作用,但有研究表明,IFN-γ对MSCs免疫应答的影响占据主要部分[16],因此有必要深入阐明IFN-γ所发挥的作用。此外,原作者将不同浓度的炎症因子预处理的转录组测序结果混合分析。尽管相比于不同种类的炎症因子刺激,炎症因子的浓度差异影响较小,但仍不可忽略。目前,关于IFN-γ的预处理浓度与MSCs免疫调节能力之间的关系较少,且背后分子机制的研究仍处于空白。因此,本研究从转录组水平揭示了不同浓度的IFN-γ预处理对MSCs基因表达水平的影响,以期为炎症因子预处理对MSCs影响的研究进行补充。
本研究中,IFN-γ低浓度组与未处理组相比,共筛选出152个差异基因,其中133个为上调基因,19个为下调基因。IFN-γ高浓度组与未处理组相比,共筛选出648个差异基因,其中431个为上调基因,217个为下调基因。该结果表明,炎症因子对间充质干细胞的转录组具有较大影响且机制复杂,并且与炎症因子处理浓度有密切关系。
IFN-γ-L DEGs中,上调表达差异最大的基因主要和免疫相关,如MHC I类和MHC Ⅱ类相关分子、白介素相关基因。其中,有些基因会促进炎症反应,如CD74和GBP5。CD74是巨噬细胞迁移抑制因子(macrophage migra-tion inhibitory factor, MIF)的特异性受体,与MIF结合后,可以激活细胞内的信号转导系统,如p38MAPK,促进炎症因子的释放[17]。GBP5可以促进炎性小体的组装和活化,促进炎症的发生[18]。IFN-γ高浓度预处理使趋化因子和抑炎因子的表达量大大提升。在炎症因子的刺激下,细胞的信号通路会产生变化。KEGG富集的结果显示,无论是低浓度组还是高浓度组,IFN-γ都主要影响和免疫、抗感染等相关的通路。而对IFN-γ-H DEGs的富集分析结果显示,代谢通路富集到的基因数目最多,提示高浓度的IFN-γ预处理可能对MSCs代谢产生较大的影响。有研究表明,IFN-γ预处理MSCs能使其代谢方式从原来的线粒体呼吸(mitochondrial respiration)转化为有氧糖酵解(aerobic glycolysis)。这种代谢方式的转换使得MSCs的代谢能力增强,提升了其促炎因子如PGE2的释放水平,从而转化为免疫抑制表型[19]。以血清剥夺的方式预处理48h,MSCs的能量代谢也会从氧化磷酸化为主转变为糖酵解为主,并上调糖异生相关的酶的表达。这种代谢方式的转变有助于移植的MSCs在恶劣微环境中的存活,并能提高其免疫抑制能力[20]。因此,炎症因子对MSCs细胞代谢的影响,以及MSCs细胞代谢与免疫调节功能之间的关系,有待进一步阐明。
MSCs的免疫调节能力受微环境影响很大[21]。尽管不少体外研究证实了MSCs具有良好的免疫抑制作用,但体内研究的结果并不十分明朗,可能与体内微环境不同有关。体内微环境的炎症因子水平在不同疾病及不同个体中往往不尽相同。2014年,Wang等[22]提出MSCs的免疫调节具有可塑性的观点,其能根据微环境的变化转化为促炎型MSCs或抑炎型MSCs。在急性炎症期时,高浓度的炎症因子会刺激MSCs释放大量抑炎因子如IDO-1和趋化因子,从而抑制炎症反应。而在有低水平的炎症因子暴露下,MSCs则表现出促炎的表型[23]。本研究的分析结果也与其相符。此外,炎症因子刺激时间也会影响MSCs的免疫应答。MSCs在IFN-γ刺激后短时间内,会大量上调表达MHC分子,导致免疫原性升高,容易产生异体排斥。但随着刺激时间增加,MSCs能够自主下调表面MHC分子表达,降低免疫原性[24]。近年来,MSCs分泌的胞外囊泡(MSC-EVs)引起很大关注。胞外囊泡携带亲本细胞来源的生物活性分子及基因调控信息,能通过与细胞直接接触或被细胞内吞后释放效应分子而影响受体细胞的功能,实现细胞间通讯[25]。已有不少文献报道,MSCs分泌的胞外囊泡能影响多种免疫细胞,在修复组织损伤、抑制局部炎症和调节免疫中发挥重要作用[26-28]。由于其为生物活性物质而非活体细胞,因此可控性较强,容易制订生产管理方案,疗效也较稳定,避免了MSCs存在的受微环境影响而展现出免疫调节可塑性的问题,有望代替MSCs发挥生物学功能。
综上,炎症因子预处理对MSCs的免疫应答能够产生深远影响,因此要全面考虑炎症因子种类、浓度、处理时间等不同所产生的差异。
[1] SHENG G J. The developmental basis of mesenchymal stem/stromal cells(MSCs)[J]. BMC Dev Biol, 2015,15: 44.
[2] KREBSBACH P H, KUZNETSOV S A, BIANCO P, et al. Bone marrow stromal cells: characterization and clinical application[J]. Crit Rev Oral Biol Med, 1999,10(2): 165-181.
[3] ZUK P A, ZHU M, ASHJIAN P, et al. Human adipose tissue is a source of multipotent stem cells[J]. Mol Biol Cell, 2002,13(12): 4279-4295.
[4] LEE O K, KUO T K, CHEN W M, et al. Isolation of multipotent mesenchymal stem cells from umbilical cord blood[J]. Blood, 2004,103(5): 1669-1675.
[5] IN ’T ANKER P S, SCHERJON S A, KLEIJBURG-VAN DER KEUR C, et al. Amniotic fluid as a novel source of mesenchymal stem cells for therapeutic transplantation[J]. Blood, 2003,102(4): 1548-1549.
[6] 刘贤俊,刘海亮,景波,等.人不同组织间充质干细胞免疫调控能力的比较[J].同济大学学报(医学版),2017,38(6): 12-17.
[7] LUO R X, LU Y R, LIU J P, et al. Enhancement of the efficacy of mesenchymal stem cells in the treatment of ischemic diseases[J].Biomed Pharmacother, 2019,109: 2022-2034.
[8] LIU W, RONG Y, WANG J, et al. Exosome-shuttled miR-216a-5p from hypoxic preconditioned mesenchymal stem cells repair traumatic spinal cord injury by shifting microglial M1/M2 polarization[J]. J Neuroinflammation, 2020,17(1): 47.
[9] KLINKER M W, MARKLEIN R A, LO SURDO J L, et al. Morphological features of IFN-γ-stimulated mesenchymal stromal cells predict overall immunosuppressive capacity[J]. Proc Natl Acad Sci USA, 2017,114(13): E2598-E2607.
[10] HU S, YUAN J, XU J, et al. TNF-α and IFN-γ synergistically inhibit the repairing ability of mesenchymal stem cells on mice colitis and colon cancer[J]. Am J Transl Res, 2019,11(9): 6207-6220.
[11] SCHMIDT M E, MEYERHOLZ D K, VARGA S M. Pre-existing neutralizing antibodies prevent CD8 T cell-mediated immunopathology following respiratory syncytial virus infection[J]. Mucosal Immunol, 2020,13(3): 507-517.
[12] KUMAR P, RAJASEKARAN K, NANBAKHSH A, et al. IL-27 promotes NK cell effector functions via Maf-Nrf2 pathway during influenza infection[J]. Sci Rep, 2019,9(1): 4984.
[13] QIN Y Y, OH S, LIM S, et al. Invariant NKT cells facilitate cytotoxic T-cell activation via direct recognition of CD1d on T cells[J]. Exp Mol Med, 2019,51(10): 1-9.
[14] MA J W, WEI K K, LIU J W, et al. Glycogen metabolism regulates macrophage-mediated acute inflammatory responses[J]. Nat Commun, 2020,11(1): 1769.
[15] JIN P, ZHAO Y L, LIU H, et al. Interferon-γ and tumor necrosis factor-α polarize bone marrow stromal cells uniformly to a Th1 phenotype[J]. Sci Rep, 2016,6: 26345.
[16] ENGLISH K, BARRY F P, FIELD-CORBETT C P, et al. IFN-gamma and TNF-alpha differentially regulate immunomodulation by murine mesenchymal stem cells[J]. Immunol Lett, 2007,110(2): 91-100.
[17] GHOOCHANI A, SCHWARZ M A, YAKUBOV E, et al. MIF-CD74 signaling impedes microglial M1 polarization and facilitates brain tumorigenesis[J]. Oncogene, 2016,35(48): 6246-6261.
[18] SHENOY A R, WELLINGTON D A, KUMAR P, et al.GBP5 promotes NLRP3 inflammasome assembly and immunity in mammals[J]. Science, 2012,336(6080): 481-485.
[19] EFEYAN A, COMB W C, SABATINI D M. Nutrient-sensing mechanisms and pathways[J]. Nature, 2015,517(7534): 302-310.
[20] MOYA A, LAROCHETTE N, PAQUET J, et al. Quiescence preconditioned human multipotent stromal cells adopt a metabolic profile favorable for enhanced survival under ischemia[J]. Stem Cells, 2017,35(1): 181-196.
[21] SHI Y, WANG Y, LI Q, et al. Immunoregulatory mechanisms of mesenchymal stem and stromal cells in inflammatory diseases[J]. Nat Rev Nephrol, 2018,14(8): 493-507.
[22] WANG Y, CHEN X, CAO W, et al. Plasticity of mesenchymal stem cells in immunomodulation: pathological and therapeutic implications[J]. Nat Immunol, 2014,15(11): 1009-1016.
[23] WANG Y F, HUANG J Y, GONG L, et al. The plasticity of mesenchymal stem cells in regulating surface HLA-I[J]. iScience, 2019,15: 66-78.
[24] QIU G G, ZHENG G P, GE M H, et al. Functional proteins of mesenchymal stem cell-derived extracellular vesicles[J]. Stem Cell Res Ther, 2019,10(1): 359.
[25] RANI S, RYAN A E, GRIFFIN M D, et al. Mesenchymal stem cell-derived extracellular vesicles: toward cell-free therapeutic applications[J]. Mol Ther, 2015,23(5): 812-823.
[26] SHIGEMOTO-KURODA T, OH J Y, KIM D K, et al. MSC-derived extracellular vesicles attenuate immune responses in two autoimmune murine models: type 1 diabetes and uveoretinitis[J]. Stem Cell Rep, 2017,8(5): 1214-1225.
[27] MARTIN-RUFINO J D, ESPINOSA-LARA N, OSUGUI L, et al. Targeting the immune system with mesenchymal stromal cell-derived extracellular vesicles: what is the cargo’s mechanism of action?[J]. Front Bioeng Biotechnol, 2019,7: 308.
[28] YIN K, WANG S H, ZHAO R C. Exosomes from mesenchymal stem/stromal cells: a new therapeutic paradigm[J]. Biomark Res, 2019,7: 8.