我国2015年胃癌新发病例(67.9万例)和死亡病例(49.8万例)均居恶性肿瘤第2位,晚期胃癌的5年生存率不足10%,而早期胃癌的5年生存率达90%[1]。因此,早期发现胃癌及癌前病变至关重要。胃黏膜肠上皮化生(gastric intestinal metaplasia, GIM)的发生与胃癌的发病率呈显著正相关[2]。根据Correa模型,若肠上皮化生没有得到有效控制,会进一步演变为异型增生,继而进展为早期胃癌[3]。临床流行病学调查提示,GIM进展至胃癌约需10~20年,而异型增生演变为胃癌仅需3~5年。GIM为临床干预胃癌发生提供了较宽的时间窗,所以又被认为是预防胃癌的关键阶段。因此,提高GIM的早期诊断率同时简化诊断过程,提高诊断的有效性,加强GIM随访有重要的临床意义。
胃镜检查是诊断GIM的有效手段,但GIM在普通白光内镜下的表现缺乏特异性,目前诊断的金标准仍然是组织病理学,由于其病变多为片状及灶性分布,难以达到靶向活检,因此白光内镜下GIM的检出率较低。近年来广泛应用于临床的先进的内镜技术如色素内镜、窄带成像技术(narrow band imaging, NBI)、放大内镜(magnifying endoscopy, ME)等可以更加清晰地分辨胃黏膜微细结构,对GIM的诊断或有较高的灵敏度及特异度[4-6]。胃内亮蓝嵴(light blue crest, LBC)是GIM在NBI下的内镜标志,2005年由Uedo等[7]在研究中发现并报道,定义为位于上皮细胞表面或脑回样结构嵴部的纤细的浅蓝色的线状结构,并提出其可能为GIM的特征性表现,但国内对此研究尚少。2007年,Yao等[8]通过ME观察,发现白色不透明物质(white opaque substance, WOS),定义为黏膜上皮的一种白色不透明物质,并提出WOS可能为GIM的新标志。但目前对于WOS的研究主要集中在其对早癌的诊断价值,在国内尚无WOS与GIM相关性的研究。本研究对既往确诊为慢性萎缩性胃炎在本院行早癌筛查患者进行NBI-ME观察,评估胃内LBC、WOS等内镜下表现与GIM的相关性。
1 资料与方法
1.1 一般资料
患者纳入标准: 于2017年1月—2019年9月,纳入年龄>18岁,既往确诊为慢性萎缩性胃炎在西安交通大学第二附属医院行早癌筛查患者。于检查前告知患者本研究相关意义及风险,患者均签署知情同意书。本研究由西安交通大学第二附属医院伦理委员会审查通过(伦理编号: 2017076)。
排除标准: (1) 存在低级别瘤变/高级别瘤变/早癌/进展期癌;(2) 年老衰弱等不能耐受胃镜检查;(3) 既往胃部手术史;(4) 过去2周内服用非甾体抗炎药、质子泵抑制剂(PPI)或抗生素;(5) 严重的非控制性凝血异常疾病;(6) 妊娠和哺乳期。
1.2 器械和操作方法
放大内镜使用奥林帕斯H260Z,观察顺序为普通白光下(A3模式)远观及抵近观察胃壁动度,胃黏膜形态、光泽,观察有无慢性萎缩性胃炎、可疑GIM表现;如有则需仔细观察,记录特征,留取图像。其后更换为NBI模式(A8模式)观察可疑病变,继而更换为放大模式(A8模式)观察可疑病变微结构及微血管特征,记录有无LBC及WOS,并留取图像。最后用一次性活检钳(南京微创,MTN-ABF-23)在每处可疑GIM部位取活组织1~3块。若无可疑GIM区域,则根据悉尼系统要求取5块标本,胃窦2块取自距幽门2~3cm的大弯和小弯,胃体2块取自距贲门8cm的大弯和小弯(约距胃角近侧4cm)和胃角1块。
1.3 组织病理学检查
所有活检标本均于10%甲醛中固定,后行石蜡包埋,切片,H-E染色。所有标本均由一位经验丰富的病理学家进行评估,其并不知道内镜检查结果。根据最新的2017年慢性萎缩性胃炎诊疗共识意见制定的病理诊断和分类方法诊断。
1.4 统计学方法
应用SPSS 20.0统计软件。年龄采用![]() 计量资料行t检验,计数资料采用χ2检验进行多组比较,绘制不同诊断指标的ROC曲线。P<0.05为差异有统计学意义。
计量资料行t检验,计数资料采用χ2检验进行多组比较,绘制不同诊断指标的ROC曲线。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
从2017年1月至2019年9月,共有101例患者纳入,GIM患者53例,患病率52.48%。患者平均年龄为(55.7±10.2)岁,其中男性76例(75.25%),女性25例(24.75%)。57例(56.44%)患者Hp阳性,44例(43.56%)Hp阴性。此外,在所有患者中,萎缩类型为C型的占绝大多数(85例,84.16%)。
2.2 内镜观察结果
2.2.1 普通白光胃镜 非萎缩胃炎表现为红白相间,以红为主,黏膜光滑(图1A);萎缩性胃炎表现为黏膜红白相间,以白相为主,部分黏膜血管显露;可伴有黏膜颗粒或结节状等表现(图1B);可疑GIM普通内镜表现为: 单发或多发的 2~3mm大小灰白色或淡黄色结节,略呈扁平状突出于胃黏膜,表面呈绒毛状或细颗粒状(图1C)。

图1 普通白光胃镜下正常、萎缩及可疑GIM胃黏膜表现
Fig.1 Normal, atrophic and suspicious GIM of gastric
mucosa under conventional endoscopy
A: 白光内镜下正常胃黏膜表现;B: 白光内镜下萎缩性胃炎表现;C: 白光内镜下可疑GIM表现
2.2.2 LBC判断标准 在NBI+ME下,黏膜上皮细胞表面或者脑回样结构嵴部的纤细、亮蓝白色的线样结构,即亮蓝嵴。由于其常位于上皮表面的腺管小凹边缘,故通常不会影响对黏膜下微血管的观察,见图2。
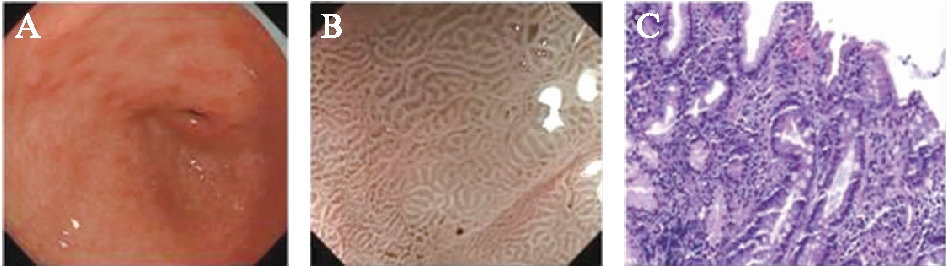
图2 LBC的白光内镜、NBI-ME及组织病理学表现
Fig.2 The appearance of LBC under conventional
endoscopy, NBI-ME and histology
A: 白光内镜下LBC表现;B: NBI-ME下LBC表现;C: 呈现LBC的胃黏膜组织病理学表现
2.2.3 WOS判断标准 黏膜上皮的白色不透明物质,可呈细密点样、线样、网格状或不规则点片状,边缘欠光滑,位于中间部分的上皮细胞内,常会影响对黏膜下微血管的观察,见图3。
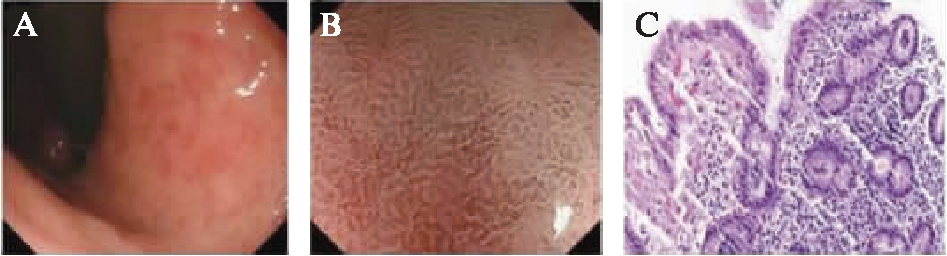
图3 WOS的白光内镜、NBI-ME及组织病理学表现
Fig.3 The appearance of WOS under conventional
endoscopy, NBI-ME and histology
A: 白光内镜下WOS表现;B: NBI-ME下WOS表现;C: 呈现WOS的胃黏膜组织病理学表现
2.3 LBC、WOS与GIM发生的相关性
LBC阳性组和LBC阴性组的GIM发生率分别为33/46(71.74%)和20/55(36.36%),两组间GIM发生率差异有统计学意义(χ2=12.570,P<0.0001),见表1。WOS阳性组和WOS阴性组的GIM发生率分别为8/11(72.73%)和45/90(50%),两组间GIM发生率差异无统计学意义(χ2=2.030,P>0.05),见表1。
LBC、WOS均阳性或任一阳性(即LBC阳性且WOS阳性,LBC阳性和WOS阴性,或LBC阴性和WOS阳性)和LBC阴性且WOS阴性组GIM的发病率分别为38/54(70.37%)和15/47(31.91%),两组间GIM发生率差异有统计学意义(χ2=14.901,P<0.0001),见表1。
表1 NBI-ME下发现LBC和/或WOS的
组织学GIM发生率
Tab.1 Histological GIM incidence of LBC and/or
WOS under NBI-ME
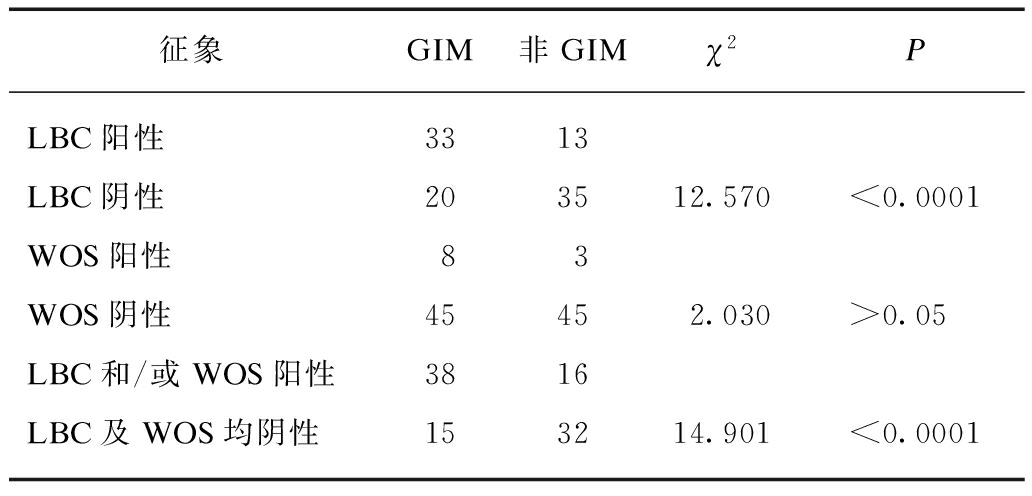
征象GIM非GIMχ2PLBC阳性3313LBC阴性203512.570<0.0001WOS阳性83WOS阴性45452.030>0.05LBC和/或WOS阳性3816LBC及WOS均阴性153214.901<0.0001
单用LBC诊断的灵敏度(62.26%)远高于单用WOS者(15.09%),但WOS的特异度(93.75%)高于LBC(79.92%)。相应的,LBC诊断的阴性预测值(63.64%)高于WOS(50%),而阳性预测值略低(71.74%)。相较而言,WOS有着更高的阳性似然比(2.42),LBC的阴性似然比更低(0.52),见表2。
联合LBC及WOS,即LBC、WOS均阳性或任一阳性组对比LBC阴性且WOS阴性组有着更高的灵敏度(71.70%),阴性预测值(68.09%),约登指数(38.36%)和更低的阴性似然比(0.42),见表2。图4分别为单用LBC,单用WOS和联合使用LBC及WOS的ROC曲线。其中,单用LBC的ROC曲线下面积为0.676(95%CI: 0.570~0.782),单用WOS的ROC曲线下面积为0.544(95%CI: 0.432~0.657),联合使用LBC及WOS的ROC曲线下面积为0.692(95%CI: 0.587~0.797)。
表2 LBC和WOS对GIM的诊断价值
Tab.2 Diagnostic value of LBC and WOS for GIM

征象灵敏度特异度阳性预测值阴性预测值阳性似然比阴性似然比约登指数LBC62.26%79.92%71.74%63.64%2.300.5235.18%WOS15.09%93.75%72.73%50%2.420.928.84%LBC和/或WOS71.70%66.67%70.37%68.09%2.150.4238.36%
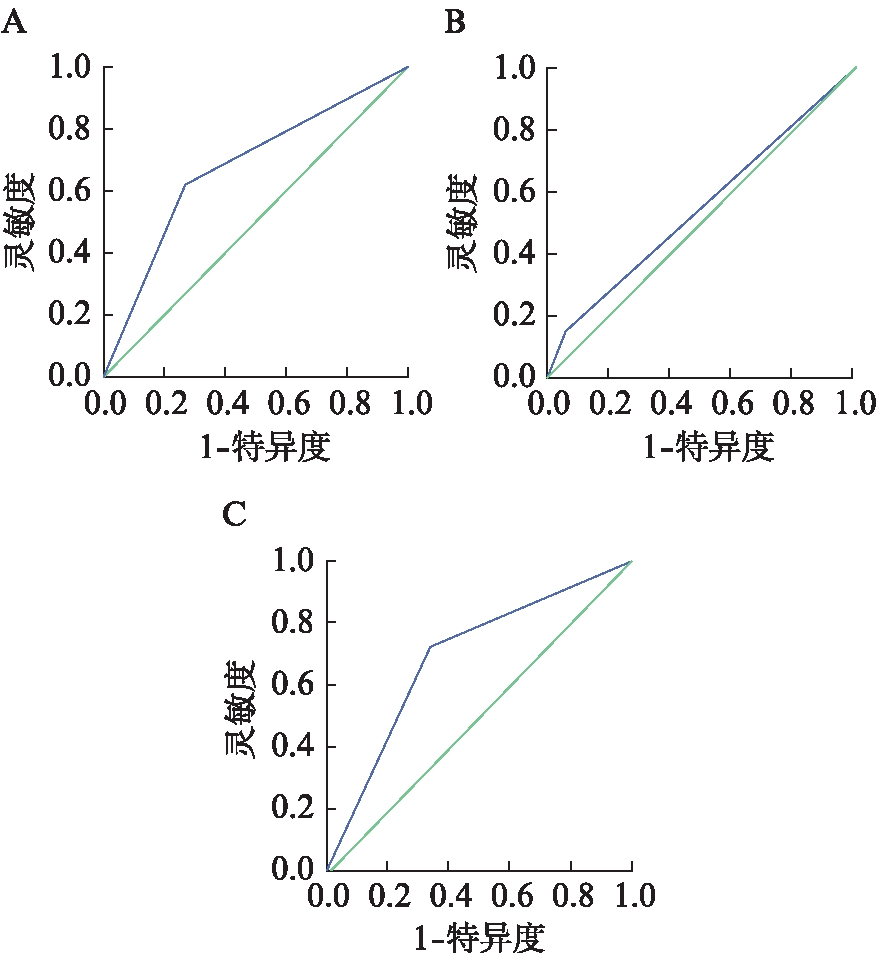
图4 LBC、WOS及LBC联合WOS诊断GIM的
受试者工作特征曲线
Fig.4 Receiver operating characteristics curves of LBC,
WOS and LBC combined with WOS
in the diagnosis of GIM
A: LBC诊断GIM的ROC曲线;B: WOS诊断GIM的ROC曲线;C: 联合LBC及WOS诊断GIM的ROC曲线
2.4 GIM与Hp感染及萎缩类型的相关性
Hp阳性组和Hp阴性组的GIM的发生率分别为32/57(56.14%)和21/44(47.73%),两组间GIM发生率差异无统计学意义(χ2=0.705,双侧P=0.401),见表3。C型萎缩组和O型萎缩组的GIM的发生率分别为44/85(51.76%)和9/16(56.25%),两组间GIM发生率差异无统计学意义(χ2=0.109,双侧P=0.742),见表3。
表3 Hp感染状态及萎缩类型与GIM的相关性
Tab.3 Relationship between HP infection status and type of atrophy with intestinal metaplasia
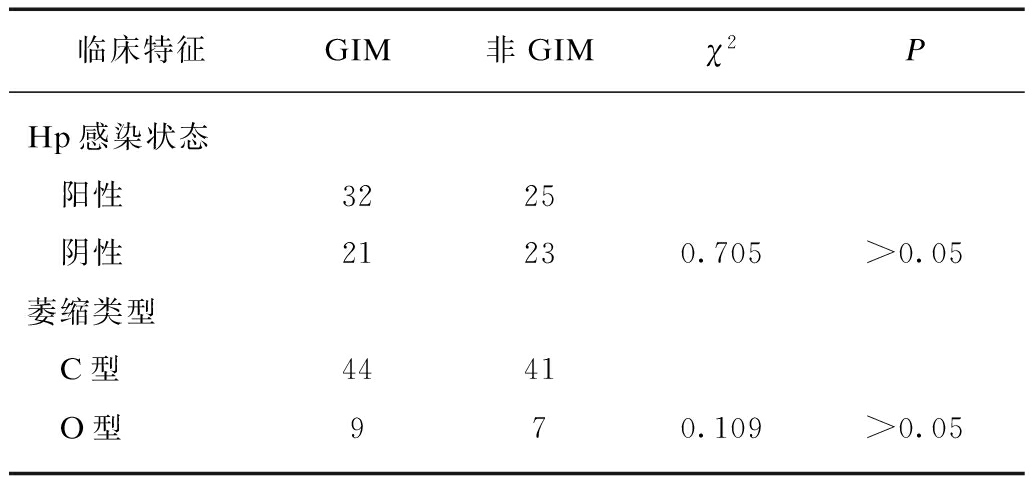
临床特征GIM非GIMχ2PHp感染状态 阳性3225 阴性21230.705>0.05萎缩类型 C型4441 O型970.109>0.05
3 讨 论
GIM人群中发生胃癌的风险是正常人群的6倍[9],但传统白光内镜及组织学活检诊断GIM均有一定局限性,内镜医生需要通过内镜技术和理论知识的进步提高GIM的诊断准确率。
NBI通过发射窄带光谱,增加消化道黏膜不同结构对比度进而辨别消化道疾病。LBC自2005年在NBI内镜下被最早发现,其出现的次数与免疫染色CD10高度表达及上皮细胞阿辛蓝染色阳性相关。现在认为LBC是肠上皮细胞刷状缘上的微绒毛对短波段窄光的一种反射现象。国外已有众多研究证实其可出现在GIM中,并逐渐发现单纯运用LBC诊断GIM缺乏一定准确度,而联合其他胃黏膜放大内镜表现,内镜诊断的灵敏度及特异度可达到最高95.2%和98.7%[10-11]。本研究通过NBI联合ME观察既往诊断为慢性萎缩性胃炎成为GIM及早期胃癌高危患者的胃黏膜表现,收录数据自2017年起,是国内较早的此类研究。研究提示单用LBC诊断GIM的灵敏度及特异度均低于既往国外研究,并未显示更高的诊断效能,因此LBC诊断GIM的影响因素值得深入探讨。LBC灵敏度(62.26%)低于既往研究(80%~100%)[12-13],提示GIM不一定出现LBC,分析原因或与操作医师对LBC判断差异有关。同时可能与NBI内镜模式的不同,Hp感染引起胃黏膜炎症存在干扰判断有关等。另外,既往有研究表明LBC与GIM严重程度及类型有关,轻度GIM可由组织病理学检出,而不一定显示LBC征象。特异度(79.92%)高于灵敏度(62.26%),提示LBC不存在,则非GIM可能性大,这与既往研究均一致[12-13]。
因其存在干扰了ME下用来鉴别胃黏膜病变良恶性的表面微血管(microvascular pattern, MVP)的观察,WOS被发现并定义[8],后阐明其实质为脂滴在上皮内或上皮下的聚积,由于强烈的光反射作用,其呈现不透明的白色。在此后的观察中,WOS被发现存在于胃腺瘤、胃癌,独立于LBC出现在GIM上皮中,对其研究越来越集中于其在异型增生、胃癌、结直肠癌、结直肠增生性息肉中的表征意义,包括研究其形态规则与否,分布位置位于黏膜内或黏膜下,与肿瘤类型,恶变倾向相关性等[14-17]。关于胃内WOS对GIM的提示意义,国内外研究均鲜有涉及。近来Kanemitsu[18]等研究证实WOS对组织学诊断GIM的灵敏度和特异度分别为50.0%和100.0%,WOS和LBC均是内镜诊断GIM的有效标志,但其样本例数较少,仅有40例。在本研究中,WOS灵敏度很低,推测可能因较少的脂滴不足以形成强烈的光反射,ME便不能观察到[19]。另外,由于WOS的出现与Hp感染、胃内酸状况有关[20],致使胃黏膜萎缩、Hp感染对其的出现及判断均有影响。本研究发现,WOS有很高的特异度(93.75%),意味着非GIM出现WOS的概率很低。与Kanemitsu等[18]研究不同的是,当联合LBC及WOS后,其诊断的灵敏度提高,特异度仍不及单用WOS,且达不到既往研究中87.5%灵敏度及93.8%特异度。因此,通过本研究,可以认为在临床工作中将胃内LBC联合WOS作为GIM筛查指标,而WOS阴性作为排除征象,可以较大程度提高诊断准确性。
另外,本研究未发现GIM与Hp是否感染有相关性。Hp感染的作用主要存在于胃癌发生的起始阶段,其可以增加癌前病变(包括GIM及异型增生)的发生,但发生GIM及异型增生后,Hp感染不再是主要促癌因素。本研究中单纯区分了Hp阳性及Hp阴性,未进一步细分为是否为根除后Hp阴性。因此,单纯区分Hp感染状态为阳性及阴性,不足以显示GIM发生差异的原因。
除了ME,其他技术如激光共聚焦内镜几乎可以达到显微镜和光学活检的诊断效率,如果能联合ME征象与激光共聚焦技术等联合分析,可以明显提高GIM的诊断准确率并减少活检的数量。因此,本研究在一定程度上证实了ME诊断GIM的可行性,但仍存在一定的局限性。后续研究中将增加样本量,充分利用NBI电子染色优势,联合多种内镜技术,从而提高内镜诊断GIM与病理学诊断的一致性。
[1] ZONG L, ABE M, SETO Y, et al. The challenge of screening for early gastric cancer in China[J]. Lancet, 2016,388(10060): 2606.
[2] JENCKS D S, ADAM J D, BORUM M L, et al. Overview of current concepts in gastric intestinal metaplasia and gastric cancer[J]. Gastroenterol Hepatol(N Y), 2018,14(2): 92-101.
[3] CORREA P. A human model of gastric carcinogenesis[J].Cancer Res, 1988,48(13): 3554-3560.
[4] SONG J, ZHANG J X, WANG J, et al. Meta-analysis: narrow band imaging for diagnosis of gastric intestinal metaplasia[J]. PLoS One, 2014,9(4): e94869.
[5] 黄永辉,周丽雅,林三仁,等.胃黏膜萎缩、肠上皮化生及异型增生的放大内镜表现及其诊断价值[J].中华消化内镜杂志,2005,22(4): 231-235.
[6] CAPELLE L G, HARINGSMA J, DE VRIES A C, et al. Narrow band imaging for the detection of gastric intestinal metaplasia and dysplasia during surveillance endoscopy[J]. Dig Dis Sci, 2010,55(12): 3442-3448.
[7] UEDO N, ISHIHARA R, IISHI H, et al. A new method of diagnosing gastric intestinal metaplasia: narrow-band imaging with magnifying endoscopy[J]. Endoscopy, 2006,38(8): 819-824.
[8] YAO K S, IWASHITA A,TANABEH, et al. White opaque substance within superficial elevated gastric neoplasia as visualized by magnification endoscopy with narrow-band imaging: a new opticalsign for differentiating between adenoma and carcinoma[J]. GastrointestEndosc, 2008,68(3): 574-580.
[9] 徐美东,初元.内镜治疗早期食管癌和癌前病变的现状与展望[J].同济大学学报(医学版),2019,40(5): 535-541,661.
[10] OKUBO M, TAHARA T, SHIBATA T, et al. Light blue crest and ridge/villous patterns in the uninvolved gastric antrum by magnifying NBI endoscopy correlate with serum pepsinogen and gastric cancer occurrence[J]. Hepatogastroenterology, 2014,61(130): 525-528.
[11] KANG H M, KIM G H, PARK D Y, et al. Magnifying endoscopy of gastric epithelial dysplasia based on the morphologic characteristics[J]. World J Gastroenterol, 2014,20(42): 15771-15779.
[12] WANG L, HUANG W, DU J, et al. Diagnostic yield of the light blue crest sign in gastric intestinal metaplasia: a meta-analysis[J]. PLoS One, 2014,9(3): e92874.
[13] SAVARINO E, CORBO M, DULBECCO P, et al. Narrow-band imaging with magnifying endoscopy is accurate for detecting gastric intestinal metaplasia[J]. World J Gastroenterol, 2013,19(17): 2668-2675.
[14] HISABE T, YAO K S, IMAMURA K, et al. Novel endoscopic findings as visualized by magnifying endoscopy with narrow-band imaging: white opaque substance is present in colorectal hyperplastic polyps[J]. Digestion, 2016,93(2): 127-131.
[15] ACCIOLY M T, PACHECO P, MAYA-MONTEIRO C M, et al. Lipid bodies are reservoirs of cyclooxygenase-2 and sites of prostaglandin-E2 synthesis in colon cancer cells[J]. Cancer Res, 2008,68(6): 1732-1740.
[16] KAWASAKI K, KURAHARA K, YANAI S, et al. Significance of a white opaque substance under magnifying narrow-band imaging colonoscopy for the diagnosis of colorectal epithelial neoplasms[J]. Gastrointest Endosc, 2015,82(6): 1097-1104.
[17] HISABE T, YAO K S, IMAMURA K, et al. White opaque substance visualized using magnifying endoscopy with narrow-band imaging in colorectal epithelial neoplasms[J]. Dig Dis Sci, 2014,59(10): 2544-2549.
[18] KANEMITSU T, YAO K S, NAGAHAMA T, et al. Extending magnifying NBI diagnosis of intestinal Metaplasia in the stomach: the white opaque substance marker[J]. Endoscopy, 2017,49(6): 529-535.
[19] YAO K S, IWASHITA A, NAMBU M, et al. Nature of white opaque substance in gastric epithelial neoplasia as visualized by magnifying endoscopy with narrow-band imaging[J]. Dig Endosc, 2012,24(6): 419-425.
[20] TOGO K, UEO T, YAO K S, et al. White opaque substance visualized by magnifying narrow-band imaging is associated with intragastric acid conditions[J]. Endosc Int Open, 2018,6(7): E830-E837.