NUAK2,即NUAK家族SNF1样激酶2,又名SNARK(SNF1/AMPK-related kinase),是腺苷酸活化的蛋白激酶(AMPK)相关激酶家族的第4个成员,于1995年首次被发现[1]。人NUAK2的cDNA全长3443bp,编码628个氨基酸蛋白,相对分子质量约为69000,染色体定位为1q32.1[2-3]。
NUAK2在人体内的作用尚不十分明确,已有的研究表明NUAK2对于介导细胞间的分离、维持肌动蛋白应力纤维的稳定是必需的[2,4],在维持骨骼肌的质量、调控心肌细胞葡萄糖的转运及脂肪细胞的稳定方面也发挥着重要作用[5-7]。除此之外,现有的关于NUAK2与肿瘤相关性得研究提示NUAK2可能发挥着促进肿瘤发生、发展、侵袭和转移的作用,同时,除了应激状态可以使NUAK2的活性上调以外[8],某些细胞因子也可以调控NUAK2的活性,包括一些肿瘤相关的细胞因子,如LKB1、死亡受体CD95、TNF-α和EB病毒潜伏膜蛋白(LMP1)等都可以上调NUAK2的活性[9-12],因此,NUAK2在肿瘤中发挥的具体作用值得进一步探索。
迄今为止,NUAK2是否与乳腺癌的发生发展相关尚无定论,本实验通过测定乳腺癌组织中的NUAK2基因表达的产物——NUAK2蛋白的表达水平,结合相关的临床、病理特征进行分析,初步推断NUAK2在乳腺癌中发挥的作用。由于乳腺癌不同的分子分型的治疗方法及预后存在差异,因此本研究把最常见的Luminal型乳腺癌单独作为研究对象,为今后更深入的研究提供依据。
1 资料与方法
1.1 患者来源及纳入、排除标准
随机抽取从2015年1月1日—2015年12月31日在同济大学附属第十人民医院甲状腺乳腺外科接受手术治疗的Luminal型浸润性乳腺癌患者53例(分子分型根据《NCCN指南2017年第4版乳腺癌》[13])。手术方式包括乳腺癌改良根治术、保留乳房的乳腺癌切除术。术中常规予以腋窝淋巴结清扫术或前哨淋巴结活检术,前哨淋巴结活检阳性患者追加进行腋窝淋巴结清扫术。所有患者均按照相关指南决定是否接受术后化疗、内分泌治疗、靶向治疗和放疗。
有以下情况之一者,不作为本研究的对象。有乳腺癌远处转移者;双侧乳腺癌患者;既往有其他恶性肿瘤病史患者;未按照医嘱接受术后辅助化疗、内分泌治疗、靶向治疗、放疗者,或化疗、内分泌治疗、靶向治疗、放疗中断的患者。
1.2 随访
随访方式主要以住院复查随访、门诊随访和电话随访为主,术后1~2年内至少每3个月随访1次,第3~4年至少每4~6个月随访1次。随访内容包括触诊体检、血生化、血常规和肝脏彩超。有症状患者、或复发风险较高患者根据情况予以检查骨扫描、CT或MRI,但不作为常规随访检查项目。随访开始时间为术后第1天,随访结束时间截点为2019年4月30日。
总体生存期(overall survival, OS)定义为纳入本研究的患者自接受手术之日起至因乳腺癌引起死亡的时间。无复发生存期(recurrence-free survival, RFS)定义为纳入本研究的患者自接受手术之日其至发现肿瘤复发或转移的时间。
满足下列情况之一者作为删失数据(censored case),终止随访时间即为研究结束时间。(1) 观察对象中途失访者;(2) 观察对象死于其他与研究无关的原因者;(3) 观察对象的生存期超过了研究的结束时间截点。
1.3 石蜡切片的制作
根据纳入研究的53例患者信息,调取同济大学附属第十人民医院病理科常规石蜡包埋的组织,针对肿瘤组织和距离肿瘤5cm以上的正常乳腺组织,选取最佳切面,使用切片机进行切片,切片厚度控制在4~6μm。
用毛笔蜡带挑取切片,放入40~45℃水浴锅中进行展片,等到蜡片充分展平后,取一清洁载玻片,载玻片上涂一薄层蛋白甘油,然后在水中捞取切片,保证其平整地黏附在载玻片上,放到格盘内,置38℃ 温箱中烘干。
最终获得乳腺癌切片标本53例,正常乳腺组织切片标本47例,根据相关信息在载玻片上做好标记。此外额外制作足量的切片标本以进行预实验确定免疫组化染色时的抗体稀释比例。
1.4 免疫组化染色
本研究使用NUAK2抗体来自Proteintech公司的兔多克隆抗体,使用Ultraview DAB全自动免疫组化仪进行免疫组化染色。
将石蜡切片放入全自动免疫组化仪器的切片槽内,检查各试剂均足量,完成信息确认点击开始,按照仪器使用指南启动全自动免疫组化仪,步骤如下。(1) 加热载玻片至75℃,孵育4min;(2) 将载玻片降温至72℃,孵育4min;使用脱蜡液(EZ)脱蜡12min;冲洗载玻片,加热载玻片至100℃;(3) 免疫组化抗原修复缓冲液(CC1)修复64min;(4) 冲洗载玻片,将载玻片降温至37℃;(5) 添加紫外线抑制剂(UV inhibitor),孵育4min;(6) 冲洗载玻片,添加NUAK2抗体,抗体稀释比例分别为1∶20、1∶50、1∶100、1∶200、1∶400、1∶500,孵育16min;(7) 冲洗载玻片,添加UV HRP UNIV MULT,孵育8min;(8) 冲洗载玻片,同时添加UV DAB和UV DAB H2O2,孵育 8min;(9) 冲洗载玻片,添加UV COPPER,孵育4min;(10) 冲洗载玻片,添加hematoxylin Ⅱ,孵育4min;冲洗载玻片,添加BLUING REAGENT,孵育4min;(11) 取出切片,使用洗洁精和温水浸泡、柔和冲洗,将油迹清洗干净,然后放入乙醇中浸泡脱水,乙醇浓度依次为85%、95%和100%,二甲苯透明两次,加入中性树脂封片,镜下观看。
首先按照上述步骤进行预实验确定最佳抗体稀释比例为1∶400,重复上述步骤,对53例乳腺癌标本及47例正常乳腺组织标本进行免疫组化染色。
1.5 免疫组织化学结果评分
免疫组化评分由两位病理科医师进行,在显微镜下使用低倍镜观察选出最佳视野范围,在此范围中再使用高倍镜(10×40)随机观察5个视野,免疫组化评分被定义为染色阳性细胞频率和染色强度的乘积。
染色阳性细胞频率评分标准为: 在高倍镜下的5个视野中,阳性细胞比例<5%计为0分,5%~25%计为1分,26%~50%计为2分,51%~75%计为3分,76%以上计为4分。
染色强度评分标准为: 在高倍镜下观察,无特异性染色即为染色阴性,计为0分,染色为淡黄色为弱阳性染色计为1分,棕黄色为中度阳性计为2分,深棕色为强阳性计为3分。
最终以染色阳性细胞频率评分与染色强度评分的乘积作为免疫组化最终评分结果,凡遇两位病理医师评分差异较大者,联系第3位病理医师进行评分得出最终结果,最终评分结果为0~12分。
1.6 统计学方法
所有数据处理均使用SPSS 20.0统计软件进行,计量资料以![]() 的形式表示,使用的统计学方法包括秩和检验、 χ2检验、Kaplan-Meier曲线分析、log-rank检验和Cox比例风险回归模型等。P<0.05为差异具有统计学意义。
的形式表示,使用的统计学方法包括秩和检验、 χ2检验、Kaplan-Meier曲线分析、log-rank检验和Cox比例风险回归模型等。P<0.05为差异具有统计学意义。
2 结 果
2.1 患者临床、病理数据及预后的基本概况
本研究共纳入Luminal型乳腺癌患者53例,均为女性;年龄31~70岁,平均为(52.2±1.25)岁,其中32例已绝经;病理学类型: 45例浸润性导管癌、4例浸润性小叶癌、4例粘液癌;Luminal A型患者23例,Luminal B型患者30例;患者肿瘤病理学分级Ⅰ级9例、Ⅱ级28例、Ⅱ~Ⅲ级7例(Ⅱ~Ⅲ指分级介于Ⅱ级和Ⅲ级之间)、Ⅲ级9例;3例患者组织标本脉管内有癌栓;5例患者Her2阳性;肿瘤最大径0.5~6cm,平均(2.05±0.122) cm;转移腋窝淋巴结数目为0~28枚,平均(2.42±0.731)枚;Ki-67值为5%~80%,平均(29.15±2.293)%;病理TNM分期: Ⅰ 期22例、Ⅱ 期19例和 Ⅲ 期12例;随访时间为9~51个月,平均为(41.23±1.08)个月,其中48例获得完整随访,5例中途失访,失访率为9.43%;至随访时间结束,出现肿瘤复发或转移的患者共10例,其中8例因肿瘤复发转移死亡,死于其他原因者0例。
2.2 NUAK2蛋白在Luminal型乳腺癌组织和癌旁组织中的表达及差异
免疫组化染色显示,NUAK2蛋白在乳腺癌组织中的细胞核、细胞浆内均有表达,但以核表达为主,典型的NUAK2蛋白在乳腺癌组织及癌旁组织中的免疫组化染色情况见图1。根据其核表达水平进行免疫组化评分,53例乳腺癌组织免疫组化评分平均得分为(3.660±0.437)分,而47例癌旁乳腺组织平均得分为(2.128±0.294)分,NUAK2蛋白在乳腺癌组织中的表达高于癌旁乳腺组织(P=0.032)。通过两两配对比较同时拥有乳腺癌组织及癌旁组织的47例患者的组织标本,其中乳腺癌组织中NUAK2免疫组化评分高于癌旁正常组织的有26例、相等的有10例、低于癌旁正常组织的有11例,分别占比55.3%、21.3%和23.4%,这47例乳腺癌组织中NUAK2免疫组化评分均值为(3.893±0.476)分,高于47例癌旁乳腺癌组织的(2.128±0.294)分(P=0.000<0.05)。另外,根据NUAK2在组织中免疫组化评分的高低,以0≤评分<3、3≤评分<6、6≤评分<9、9≤评分≤12分为4组,在乳腺癌组织中,各组分布频数为26、10、14和3,而在癌旁乳腺组织中则为38、6、2和1,提示在乳腺癌组织中NUAK2蛋白也更趋向于高表达,且差异具有统计学意义(P=0.005),见表1。
2.3 NUAK2蛋白在Luminal型乳腺癌组织中的表达水平与患者临床、病理特征和预后的关系
根据临床、病理及随访数据将患者进行分组,比较不同组别的NUAK2免疫组化评分是否存在差异,死亡患者的NUAK2评分明显升高,且差异具有统计学意义(P=0.037<0.05,秩和检验),提示NUAK2蛋白的高表达可能与乳腺癌患者的预后不良相关,见表2。

图1 NUAK2蛋白在乳腺癌组织及癌旁组织中的免疫组化染色情况
Fig.1 The immunohistochemical staining of NUAK2 protein in breast cancer and adjacent tissuesA和E、B和F、C和G、D和H分别为4例患者的癌旁组织和乳腺癌组织的镜下照片;免疫组化染色结果显示肿瘤组织细胞核染色强度高于癌旁组织
表1 乳腺癌组织和癌旁组织的免疫组化评分在各组中的分布
Tab.1 The distribution of immunohistochemical scores in breast and adjacent tissues in each group
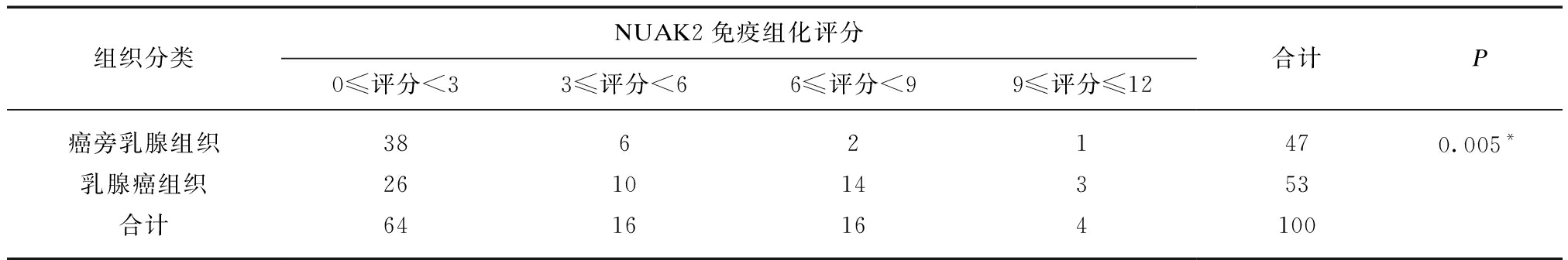
组织分类NUAK2免疫组化评分0≤评分<33≤评分<66≤评分<99≤评分≤12合计P癌旁乳腺组织38621470.005*乳腺癌组织261014353合计6416164100
使用行×列表χ2检验,*P<0.05
2.4 NUAK2蛋白表达水平与患者复发、死亡的相关性分析
为进一步分析NUAK2蛋白表达水平和乳腺癌患者复发、死亡等预后情况的相关性,依据53例患者NUAK2评分的中位数(NUAK2评分=3分)将其分为两组,得到NUAK2低表达组(评分≤3分)27例[均值为(1.074±0.168)分],NUAK2高表达组(评分>3分)26例[均值为(6.3462±0.460)分],使用Kaplan-Meier曲线分析法进行统计学分析,两组患者无复发生存和总体生存曲线见图2~3。NUAK2高表达组和低表达组的无复发生存率分别为69.2%和91.7%,高表达组无复发生存率明显降低,差异具有统计学意义(P=0.035);NUAK2高表达组和低表达组的总体生存率分别为72.6%和94.1%,差异同样具有统计学意义(P=0.024),提示NUAK2高表达组乳腺癌患者更容易复发、死亡;另外,《NCCN指南2017年第4版乳腺癌》中乳腺癌术后复发风险评估显示: 乳腺癌术后复发风险的危险度与年龄、原发肿瘤(pT)分期、病理学分级、脉管是否存在癌栓、HER2基因是否扩增以及是否有淋巴结转移相关,从而分析NUAK2高表达组和低表达组患者与这些因素的相关性,显示NUAK2高表达组患者较低表达组更容易出现淋巴结转移,且差异具有统计学意义(P=0.038),见表3。
表2 乳腺癌组织中NUAK2表达水平与临床、病理特征之间的关系
Tab.2 The correlation between the expression level of
NUAK2 in breast cancer tissues and some clinical and pathological features
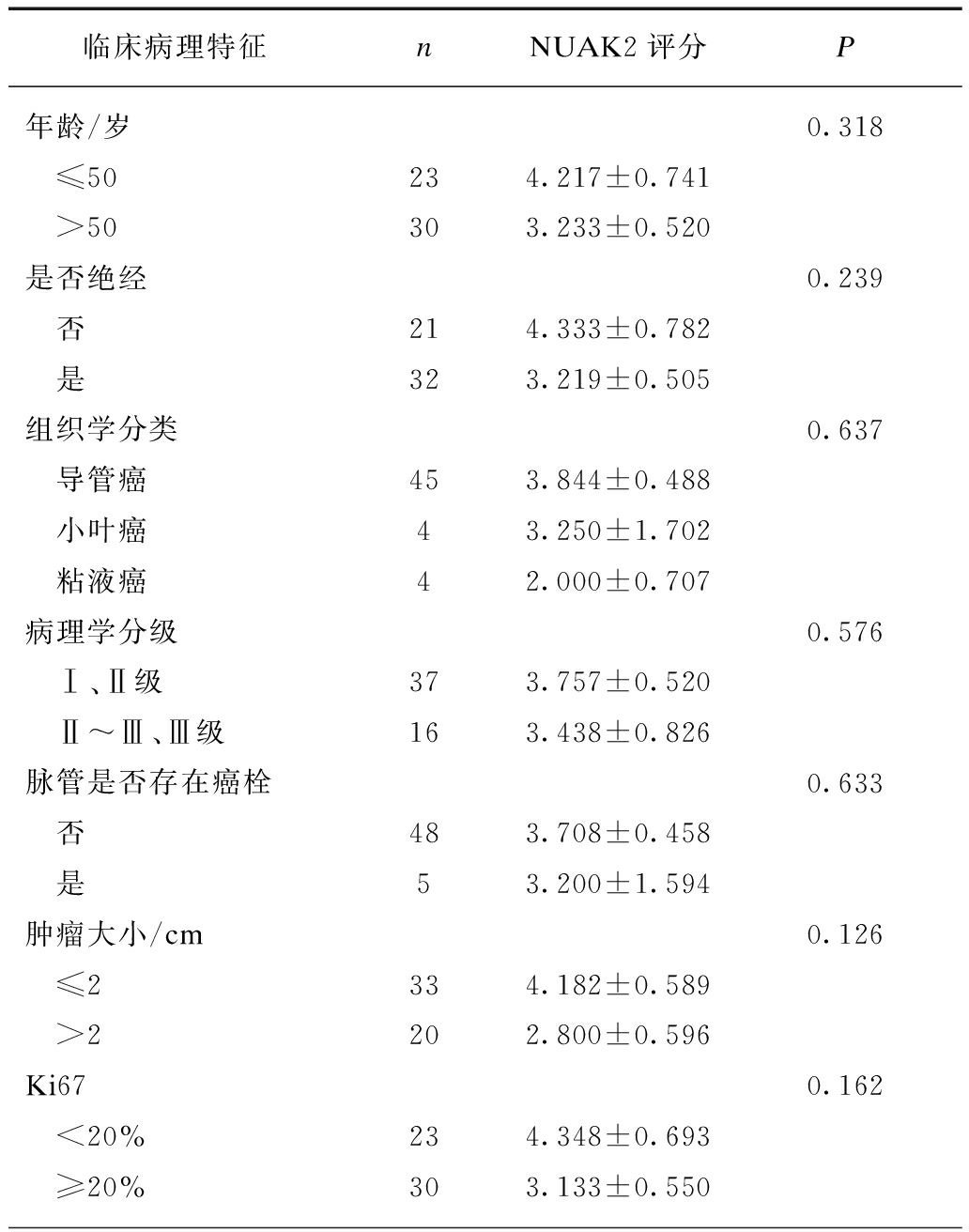
临床病理特征nNUAK2评分P年龄/岁0.318 ≤50234.217±0.741 >50303.233±0.520是否绝经0.239 否214.333±0.782 是323.219±0.505组织学分类0.637 导管癌453.844±0.488 小叶癌43.250±1.702 粘液癌42.000±0.707病理学分级0.576 Ⅰ、Ⅱ级373.757±0.520 Ⅱ~Ⅲ、Ⅲ级163.438±0.826脉管是否存在癌栓0.633 否483.708±0.458 是53.200±1.594肿瘤大小/cm0.126 ≤2334.182±0.589 >2202.800±0.596Ki670.162 <20%234.348±0.693 ≥20%303.133±0.550
续表
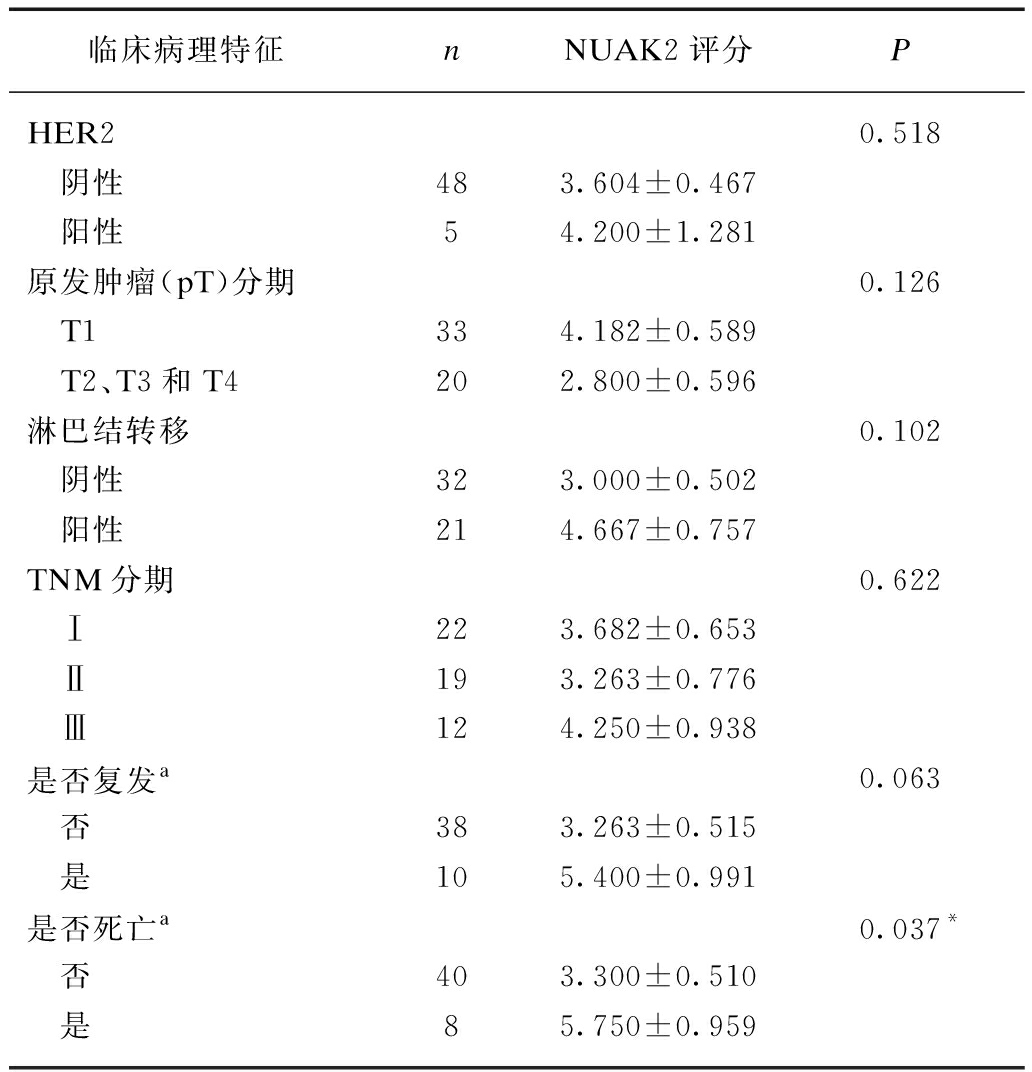
临床病理特征nNUAK2评分PHER20.518 阴性483.604±0.467 阳性54.200±1.281原发肿瘤(pT)分期0.126 T1334.182±0.589 T2、T3和T4202.800±0.596淋巴结转移0.102 阴性323.000±0.502 阳性214.667±0.757TNM分期0.622 Ⅰ223.682±0.653 Ⅱ193.263±0.776 Ⅲ124.250±0.938是否复发a0.063 否383.263±0.515 是105.400±0.991是否死亡a0.037* 否403.300±0.510 是85.750±0.959
依据是否复发、是否死亡进行分组时已将失访患者剔除;使用的统计学方法为两独立样本秩和检验、多个独立样本秩和检验,*P<0.05
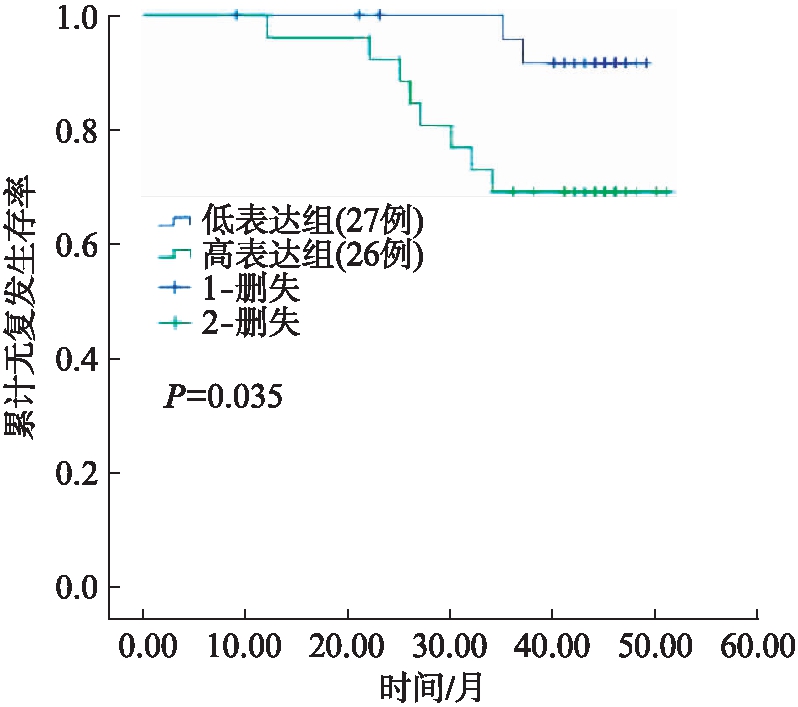
图2 Kaplan-Meier生存曲线分析NUAK2蛋白表达水平与患者无复发生存率的关系
Fig.2 Kaplan-meier survival curve analysis of the correlation between the expression level of NUAK2 protein and recurrence-free survival
2.5 Luminal型乳腺癌患者术后无复发生存时间、总体生存时间的影响因素分析
利用Cox比例风险回归模型分析与患者预后相关的影响因素。由于本研究样本量较少,变量较多,首先进行单因素分析筛选出可能相关的变量,见表4。为避免筛选条件太严格将真正影响预后的变量删除,参考其他相关研究的做法,适当将P值的限制放宽(大多数研究将其放宽为0.1~0.15),在此设定P<0.1者即可纳入下一步的多因素分析;另外,虽然某些指标在单因素Cox风险回归分析时被认为是无关变量(P值≥0.1),若这些指标被证实与乳腺癌的复发相关,亦将其纳入多因素分析;经处理后将年龄、病理学分级、脉管癌栓情况、Her2、原发肿瘤分期(pT)、区域淋巴结分期(pN)和NUAK2评分纳入多因素Cox比例风险回归模型,见表5。结果显示原发肿瘤分期、区域淋巴结分期以及NUAK2评分与乳腺癌的复发相关,而原发肿瘤分期与乳腺癌的死亡相关,推测NUAK2蛋白可以作为是预测乳腺癌复发的独立危险因素。

图3 Kaplan-Meier生存曲线分析NUAK2蛋白表达水平与患者总体生存率的关系
Fig.3 Kaplan-meier survival curve analysis of the correlation between the expression level of NUAK2 protein and overall survival
表3 NUAK2表达水平与乳腺癌复发相关指标的关系
Tab.3 The correlation between NUAK2 expression level and related indicators of breast cancer recurrence
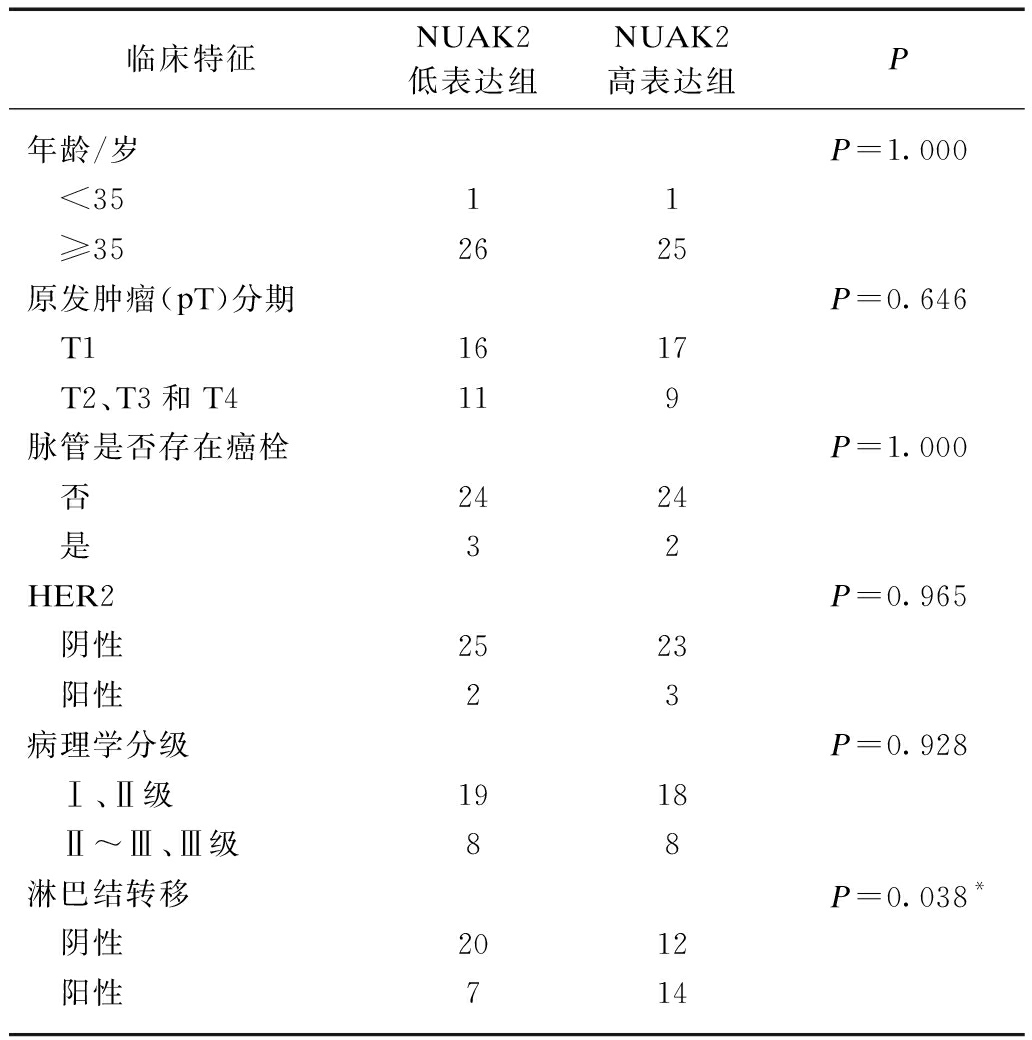
临床特征NUAK2低表达组NUAK2高表达组P年龄/岁P=1.000 <3511 ≥352625原发肿瘤(pT)分期P=0.646 T11617 T2、T3和T4119脉管是否存在癌栓P=1.000 否2424 是32HER2P=0.965 阴性2523 阳性23病理学分级P=0.928 Ⅰ、Ⅱ级1918 Ⅱ~Ⅲ、Ⅲ级88淋巴结转移P=0.038* 阴性2012 阳性714
使用四格表χ2检验专用公式或四格表校正χ2检验公式进行统计学分析,*P<0.05
表4 单因素Cox比例风险回归模型分析结果
Tab.4 The results of univariate Cox proportional risk regression model
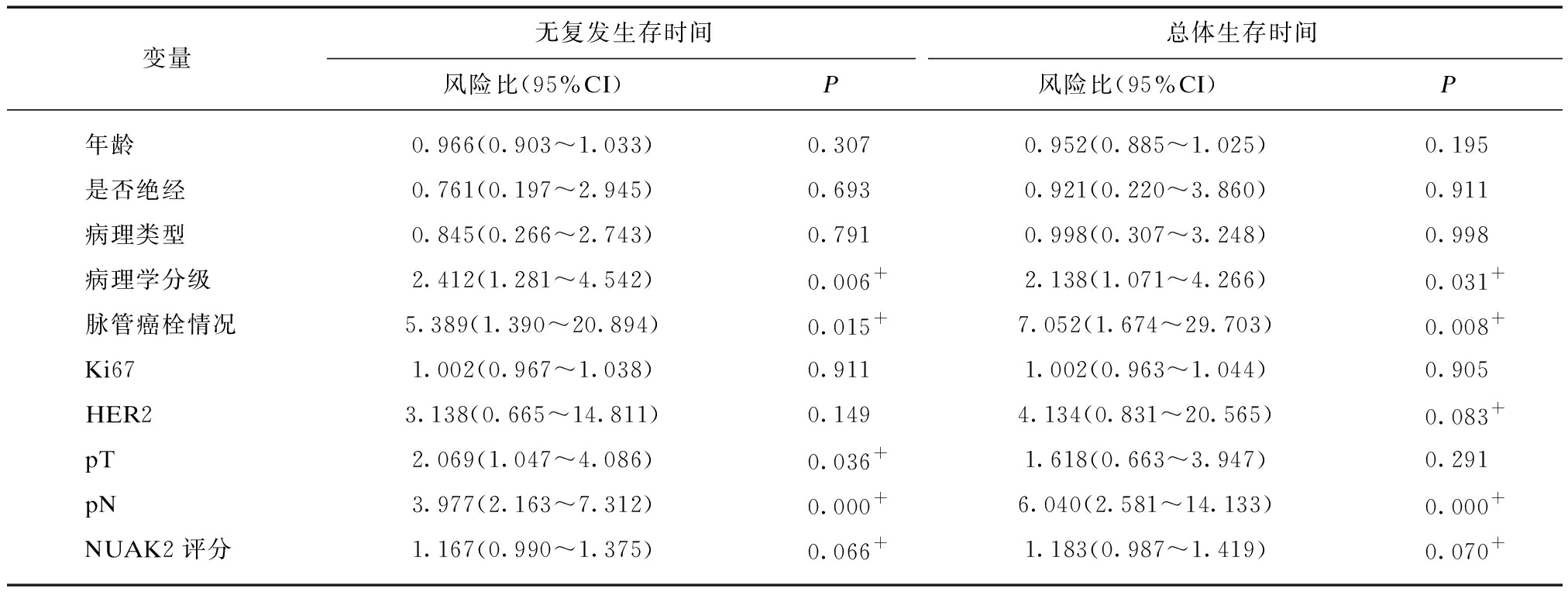
变量无复发生存时间总体生存时间风险比(95%CI)P风险比(95%CI)P年龄0.966(0.903~1.033)0.3070.952(0.885~1.025)0.195是否绝经0.761(0.197~2.945)0.6930.921(0.220~3.860)0.911病理类型0.845(0.266~2.743)0.7910.998(0.307~3.248)0.998病理学分级2.412(1.281~4.542)0.006+2.138(1.071~4.266)0.031+脉管癌栓情况5.389(1.390~20.894)0.015+7.052(1.674~29.703)0.008+Ki671.002(0.967~1.038)0.9111.002(0.963~1.044)0.905HER23.138(0.665~14.811)0.1494.134(0.831~20.565)0.083+pT2.069(1.047~4.086)0.036+1.618(0.663~3.947)0.291pN3.977(2.163~7.312)0.000+6.040(2.581~14.133)0.000+NUAK2评分1.167(0.990~1.375)0.066+1.183(0.987~1.419)0.070+
pT: 原发肿瘤分期;pN: 区域淋巴结分期;+P<0.10者纳入下一步的多因素分析
表5 多因素Cox比例风险回归模型分析结果
Tab.5 The results of multivariate Cox proportional risk regression model
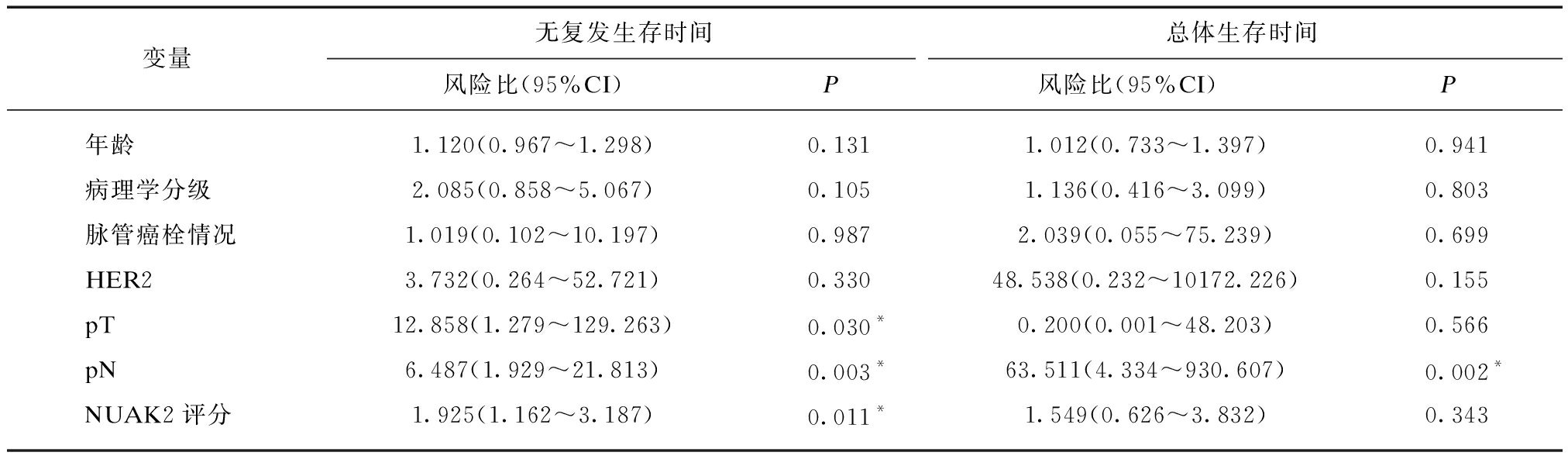
变量无复发生存时间总体生存时间风险比(95%CI)P风险比(95%CI)P年龄1.120(0.967~1.298)0.1311.012(0.733~1.397)0.941病理学分级2.085(0.858~5.067)0.1051.136(0.416~3.099)0.803脉管癌栓情况1.019(0.102~10.197)0.9872.039(0.055~75.239)0.699HER23.732(0.264~52.721)0.33048.538(0.232~10172.226)0.155pT12.858(1.279~129.263)0.030*0.200(0.001~48.203)0.566pN6.487(1.929~21.813)0.003*63.511(4.334~930.607)0.002*NUAK2评分1.925(1.162~3.187)0.011*1.549(0.626~3.832)0.343
pT: 原发肿瘤分期;pN: 区域淋巴结分期;*P<0.05
3 讨 论
2018年的数据显示,在全球范围内的女性群体之中,乳腺癌的发患者数和死亡人数均已位列第一[14]。回顾乳腺癌治疗的历史,不难发现手术范围的扩大并不能改善生存率,而近年来乳腺癌患者生存率的改善,主要归功于早期发现、早期诊断以及术后综合辅助治疗的不断完善。尽管如此,仍然有一部分患者无法避免地出现肿瘤的复发和转移,因此,寻找新的风险基因和治疗靶点从而获得新的分型、新的药物和治疗策略势在必行。
3.1 NUAK2在多种肿瘤中扮演着“促癌”的作用
在NUAK2与其他肿瘤的相关性研究中,Fu等[15]发现在脑胶质瘤组织中,NUAK2表达上调,其表达与疾病的晚期有关,体外研究发现,NUAK2过表达促进了A172胶质瘤细胞的增殖、迁移和侵袭,而携带靶向的NUAK2沉默抑制了A172胶质瘤细胞的增殖。Namiki等[16-18]在黑色素瘤的相关研究中,敲除NUAK2可以诱导黑色素瘤细胞的衰老,降低s期比例,减少迁移,体内分析显示,下调NUAK2会抑制小鼠黑色素瘤的生长,高水平NUAK2表达的肢端黑色素瘤患者复发的风险大于低水平NUAK2表达的肢端黑色素瘤患者,表明NUAK2的表达与黑色素瘤细胞的致癌特性和肢端黑色素瘤患者的生存密切相关。在另一项NUAK2和胃癌关系的研究中,NUAK2蛋白在肿瘤组织和正常胃组织中的表达存在差异,同时NUAK2能显著促进胃癌细胞的增殖,NUAK2过表达降低了G1期细胞百分率,增加了S期细胞百分率[19]。Western印迹法分析和miRNA微阵列显示,过表达NUAK2导致增殖标志物c-myc、增殖细胞核抗原、细胞周期蛋白依赖性激酶2、miRNA 21、胃癌干细胞标志物醛脱氢酶1、CD44、CD133表达水平升高[19]。而本研究的结果表明,NUAK2蛋白在Luminal型乳腺癌组织细胞核中较正常乳腺组织高表达,其表达水平与患者的淋巴结转移、复发及预后情况存在相关性,这也与上述提到的研究结果相一致,可见NUAK2可能在乳腺癌等多种肿瘤中发挥着促进肿瘤发生、生长、侵袭、转移的作用。
3.2 NUAK2可能是乳腺癌的一个原癌基因且通过基因扩增的方式活化
原癌基因活化后可以通过表达产物的质和量的变化或表达方式在时间及空间上的改变,使细胞脱离正常的信号控制,从而发生恶性转化,而本研究的结果恰恰显示了NUAK2基因表达的产物——NUAK2蛋白在Luminal型乳腺癌患者的肿瘤组织中高表达,且表达水平与的淋巴结转移、复发及预后相关。
而早在2008年,Argos等[20]为了识别与乳腺癌发生有关的新基因,选取接受手术的浸润性乳腺癌患者的病理切片标本,对其正常组织及肿瘤组织的DNA进行了全基因组扫描并进行对比,结果提示染色体区域1q32.1为拷贝数扩增显著的区域,而人NUAK2基因的染色体定位恰恰就是1q32.1;另外,查阅TCGA数据库,NUAK2基因在四种分子分型的乳腺癌组织中的表达量均高于正常乳腺组织。
原癌基因活化的方式包括基因突变、基因扩增、染色体易位和获得启动子和增强子,结合Argos等[20]的研究、TCGA数据库的资料以及本研究的结果,NUAK2可能是通过基因扩增的方式使其表达产物——NUAK2蛋白增加,从而发挥促进乳腺癌发生发展的作用。
3.3 NUAK2可能通过与TGF-β通路、HIPPO通路相互作用而发挥“促癌”作用
本研究虽然提示NUAK2蛋白与Luminal型乳腺癌存在相关性,但关于其具体的作用机制未能明确。然而,可以根据此前的研究作出一定的假设。
Kolliopoulos等[21]发现在TGF-β信号通路中,NUAK2是该通路的一个靶基因,更重要的是,NUAK2在其中发挥着正反馈的作用,相当于TGF-β信号通路的增强子,可以增强TGF-β的活性;而当沉默NUAK2时,TGF-β的活性是明显受抑制的。Gill等[22]发现,在HIPPO通路中,NUAK2是YAP/TAZ的激活剂,可以直接抑制lats介导的YAP/TAZ磷酸化,进而上调YAP/TAZ的活性;另外NUAK2是YAP/TAZ的一个下游因子,YAP/TAZ只有通过诱导NUAK2,才能实现YAP/TAZ信号通路的有效性,说明NUAK2是YAP/YAZ的一个靶基因且在其中起到正反馈的作用。而Yuan等[23]的研究得到了类似的结果,他们以肝癌为模型,确定NUAK2是YAP发挥作用的重要中介,NUAK2的缺失将会抑制YAP的作用,进一步深入研究表明,NUAK2可以被YAP诱导活化并反作用于YAP从而介导YAP的自我强化。
TGF-β信号通路可以诱导乳腺上皮细胞发生上皮-间质转化,对乳腺癌的侵袭、转移以及耐药性发挥促进作用;而YAP/TAZ作为HIPPO信号通路的核心组件,也可以促进乳腺癌细胞的生长、进展、转移,影响着乳腺癌患者的预后。所以,有可能NUAK2是通过与TGF-β通路、HIPPO通路相互作用而发挥促癌的作用,但是否如此,本研究无法提供依据,需要更进一步的研究进行验证。
综上所述,NUAK2可能在乳腺癌等多种肿瘤中都发挥着促进肿瘤发生、生长、侵袭、转移的作用。虽然本研究仅以Luminal型乳腺癌患者作为研究对象,样本量也较小,不足以代表NUAK2蛋白在所有分子分型的乳腺癌组织中的表达情况;且本研究仅使用免疫组化方法、从蛋白的层面分析了NUAK2蛋白在Luminal型乳腺癌组织中的表达情况,方法较为单一,半定量实验说服力也不足;但总体来说,不管是在乳腺癌中还是其他肿瘤中,NUAK2都有着很高的研究价值。希望通过本研究,能吸引更多的研究者去进一步探索,揭开NUAK2的面纱,相信其结果是让人期待的。
[1] ROSEN C F, POON R, DRUCKER D J. UVB radiation-activated genes induced by transcriptional and posttranscriptional mechanisms in rat keratinocytes[J]. Am J Physiol, 1995, 268(4 Pt 1): C846-C855.
[2] LEFEBVRE D L, BAI Y, SHAHMOLKY N, et al. Identification and characterization of a novel sucrose-non-fermenting protein kinase/AMP-activated protein kinase-related protein kinase, SNARK[J]. Biochem J, 2001, 355(Pt 2): 297-305.
[3] SUZUKI A, KUSAKAI G, KISHIMOTO A, et al. Induction of cell-cell detachment during glucose starvation through F-actin conversion by SNARK, the fourth member of the AMP-activated protein kinase catalytic subunit family[J]. Biochem Biophys Res Commun, 2003, 311(1): 156-161.
[4] VALLENIUS T, VAAHTOMERI K, KOVAC B, et al. An association between NUAK2 and MRIP reveals a novel mechanism for regulation of actin stress fibers[J]. J Cell Sci, 2011, 124(Pt 3): 384-393.
[5] LESSARD S J, RIVAS D A, SO K, et al. The AMPK-related kinase SNARK regulates muscle mass and myocyte survival[J]. J Clin Invest, 2016, 126(2): 560-570.
[6] SUN X L, LESSARD S J, AN D, et al. Sucrose nonfermenting AMPK-related kinase(SNARK) regulates exercise-stimulated and ischemia-stimulated glucose transport in the heart[J]. J Cell Biochem, 2019, 120(1): 685-696.
[7] LI J, FENG B, NIE Y H, et al. Sucrose nonfermenting-related kinase regulates both adipose inflammation and energy homeostasis in mice and humans[J]. Diabetes, 2018, 67(3): 400-411.
[8] LEFEBVRE D L, ROSEN C F. Regulation of SNARK activity in response to cellular stresses[J]. Biochim Biophys Acta, 2005, 1724(1-2): 71-85.
[9] LIZCANOJ M, GÖRANSSON O, TOTH R, et al. LKB1 is a master kinase that activates 13 kinases of the AMPK subfamily, including MARK/PAR-1[J]. EMBO J, 2004, 23(4): 833-843.
[10] LEGEMBRE P, SCHICKEL R, BARNHART B C, et al. Identification of SNF1/AMP kinase-related kinase as an NF-kappaB-regulated anti-apoptotic kinase involved in CD95-induced motility and invasiveness[J]. J Biol Chem, 2004, 279(45): 46742-46747.
[11] BRIGHT N J, THORNTON C, CARLING D. The regulation and function of mammalian AMPK-related kinases[J]. Acta Physiol(Oxf), 2009, 196(1): 15-26.
[12] KIM J H, KIM W S, PARK C. SNARK, a novel downstream molecule of EBV latent membrane protein 1, is associated with resistance to cancer cell death[J]. Leuk Lymphoma, 2008, 49(7): 1392-1398.
[13] GRADISHAR W J, ANDERSON B O, BALASSANIAN R, et al. Breast cancer, version 4.2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2018, 16(3): 310-320.
[14] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424.
[15] FU T G, WANG L, LI W, et al. miR-143 inhibits oncogenic traits by degrading NUAK2 in glioblastoma[J]. Int J Mol Med, 2016, 37(6): 1627-1635.
[16] NAMIKI T, YAGUCHI T, NAKAMURA K, et al. NUAK2 amplification coupled with PTEN deficiency promotes melanoma development via CDK activation[J]. Cancer Res, 2015, 75(13): 2708-2715.
[17] NAMIKI T, COELHO S G, HEARING V J. NUAK2: an emerging acral melanoma oncogene[J]. Oncotarget, 2011, 2(9): 695-704.
[18] NAMIKI T, TANEMURA A, VALENCIA J C, et al. AMP kinase-related kinase NUAK2 affects tumor growth, migration, and clinical outcome of human melanoma[J]. Proc Natl Acad Sci USA, 2011, 108(16): 6597-6602.
[19] TANG L, TONG S J, ZHAN Z, et al. Expression of NUAK2 in gastric cancer tissue and its effects on the proliferation of gastric cancer cells[J]. Exp Ther Med, 2017, 13(2): 676-680.
[20] ARGOS M, KIBRIYA M G, JASMINE F, et al. Genomewide scan for loss of heterozygosity and chromosomal amplification in breast carcinoma using single-nucleotide polymorphism arrays[J]. Cancer Genet Cytogenet, 2008, 182(2): 69-74.
[21] KOLLIOPOULOS C, RAJA E, RAZMARA M, et al. Transforming growth factor β(TGFβ) induces NUAK kinase expression to fine-tune its signaling output[J]. J Biol Chem, 2019, 294(11): 4119-4136.
[22] GILL M K, CHRISTOVA T, ZHANG Y Y, et al. A feed forward loop enforces YAP/TAZ signaling during tumorigenesis[J]. Nat Commun, 2018, 9(1): 3510.
[23] YUAN W C, PEPE-MOONEY B, GALLI G G, et al. NUAK2 is a critical YAP target in liver cancer[J]. Nat Commun, 2018, 9(1): 4834.