降钙素原(procalcitonin, PCT)是一种重要的炎症状态诊断标志物,其对于由细菌引起的炎症反应有较好的诊断价值,可用于鉴别感染病原体的类型[1]。伴随着对PCT研究的深入,发现其可能是一种新型的心力衰竭(heart failure, HF)血清学标志物[2],并且与患者是否处于感染状态无关[3-4]。慢性心力衰竭(chronic heart failure, CHF)是维持性血液透析(maintenance hemodialysis, MHD)患者死亡原因之一[5-6],并且MHD患者因心功能衰竭而导致的低血压状态或透析过程中低血压,成为血液透析失败、影响透析充分性的重要因素。然而在终末期肾脏疾病(end-stage renal disease, ESRD)人群中利钠肽针对CHF的诊断、预后评估价值并不理想[7]。本研究探讨在ESRD这一特殊人群中PCT和CHF的关系,为进一步进行相关研究提供依据。
1 资料与方法
1.1 一般资料
对2019年1月—2019年12月在上海市浦东新区人民医院肾内科血液透析中心收治的MHD患者进行筛查,选取147例MHD患者,其中男84例、女63例,年龄31~90岁,其中MHD合并CHF患者98例,MHD不合并CHF患者49例。本次纳入研究的147例MHD患者透析通路以自体动静脉内瘘为主(143例)、仅有个别患者采用半永久导管(4例)。根据纽约心脏病协会(NYHA)心功能分级: Ⅱ级(轻度心力衰竭)45例,Ⅲ级(中度心力衰竭)44例,Ⅳ级(重度心力衰竭)9例。选取同期在上海市浦东新区人民医院肾内科收治的慢性肾脏病5期(chronic kidney disease stage 5, CKD G5)非透析患者50例,其中男26例、女24例,年龄35~86岁;选取同期在上海市浦东新区人民医院健康体检者50例作为正常对照组,其中男22例、女28例,年龄32~92岁,各项体检指标均正常。
1.2 入组标准
(1) MHD患者入组标准: 年龄>18岁;透龄≥6个月;维持性血液透析,标准碳酸氢盐透析液;每周透析3次,单次Kt/V(单室模型)>1.2;所有治疗和管理根据KDIGO临床实践指南。
(2) MHD合并CHF入组标准: 在我院门诊或住院进行维持性血液透析合并慢性心力衰竭,慢性心力衰竭符合《2016年ESC急性和慢性心力衰竭诊断和治疗指南》的诊断标准。
(3) MHD未合并CHF入组标准: 在我院门诊或住院进行维持性血液透析并无心力衰竭患者(包括无不稳定心绞痛、房性早搏、室性早搏、心房颤动、阵发性室上性心动过速、预激综合征等非致命性心律失常)。
(4) 慢性肾脏病5期未透析组入组标准: 符合KDIGO制定的慢性肾脏疾病分期标准。
1.3 排除标准
MHD合并CHF组、MHD未合并CHF组、慢性肾脏病5期未透析组及正常对照组的排除标准: 感染(体温≥38℃、WBC不在正常范围内、有其他辅助检查结果支持感染;若WBC轻度升高,但在不应用抗生素情况下隔日复查血常规,WBC恢复正常则考虑应激因素而非感染因素所致,不予排除)及急性心肌梗死、肝硬化、胰腺炎、甲状腺髓样癌、外伤、近期手术、大面积烧伤等影响血清PCT水平的非感染性疾病。
1.4 临床资料
(1) 一般临床资料: 年龄、性别、透析龄、相对容量清除、单室尿素清除指数(single chamber urea clearance index, spKt/v)、尿素氮清除率(urea nitro-gen removal rate, URR)、透前收缩压(透前SBP)、透前舒张压(透前DBP);
(2) 实验室指标(透析前): PCT、C-反应蛋白(C reactive protein, CRP)、N末端B型利钠肽原(amino terminal B type natriuretic peptide, NT-proBNP)、血红蛋白(hemo-globin, Hb)、白蛋白(albumin, Alb)、钙(calcium, Ca)、磷(phosphorus, P)、钙磷乘积(Ca×P)、全段甲状旁腺激素(parathyroid hormone, iPTH)、三酰甘油(triglyce-ride, TG)、胆固醇(cholesterol, Chol)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high density liptein cholesterol, HDL-C)、二氧化碳(CO2)、葡萄糖(glucose, Glu)、肌酐(creatinine, Cr)、尿素氮(blood urea nitrogen, BUN)、钠(Na)。
1.5 统计学方法
采用SPSS 19.0统计软件进行统计分析。资料正态性检验采用Kolmogorov-Smirnov法。对于符合正态分布的计量资料,采用![]() 表示,两组间比较应用独立样本t检验;不满足正态分布的计量资料,采用偏态数据用中位数(P25,P75)表示,两组间比较应用两组独立样本Kolmogorov-Smirnov Z检验;计数资料采用频数(百分率)形式表示,两组间比较应用χ2检验。不满足正态分布的计量资料多组间平均水平差异比较采用Kruskal-Wallis H法,两两比较时采用Bonferroni法调整检验水准。诊断实验采用ROC曲线分析。将MHD合并CHF组和MHD未合并CHF组两组间的临床资料进行比较,将P<0.05有统计学差异的变量纳入以有无CHF为因变量的二元Logistic回归模型中,探讨MHD患者合并CHF的主要影响因素,分析时选用向前法,自动剔除P>0.10变量。所有分析均以P<0.05为差异有统计学意义。
表示,两组间比较应用独立样本t检验;不满足正态分布的计量资料,采用偏态数据用中位数(P25,P75)表示,两组间比较应用两组独立样本Kolmogorov-Smirnov Z检验;计数资料采用频数(百分率)形式表示,两组间比较应用χ2检验。不满足正态分布的计量资料多组间平均水平差异比较采用Kruskal-Wallis H法,两两比较时采用Bonferroni法调整检验水准。诊断实验采用ROC曲线分析。将MHD合并CHF组和MHD未合并CHF组两组间的临床资料进行比较,将P<0.05有统计学差异的变量纳入以有无CHF为因变量的二元Logistic回归模型中,探讨MHD患者合并CHF的主要影响因素,分析时选用向前法,自动剔除P>0.10变量。所有分析均以P<0.05为差异有统计学意义。
2 结 果
2.1 基线数据特征
本次研究共纳入247例研究对象,结果显示: 3组间除男性(性别)差异无统计学意义(P>0.05),其余变量差异均有统计学意义(P均<0.05)。见表1。
表1 不同观察组间基线数据特征
Tab.1 Characteristics of baseline data among different observation groups
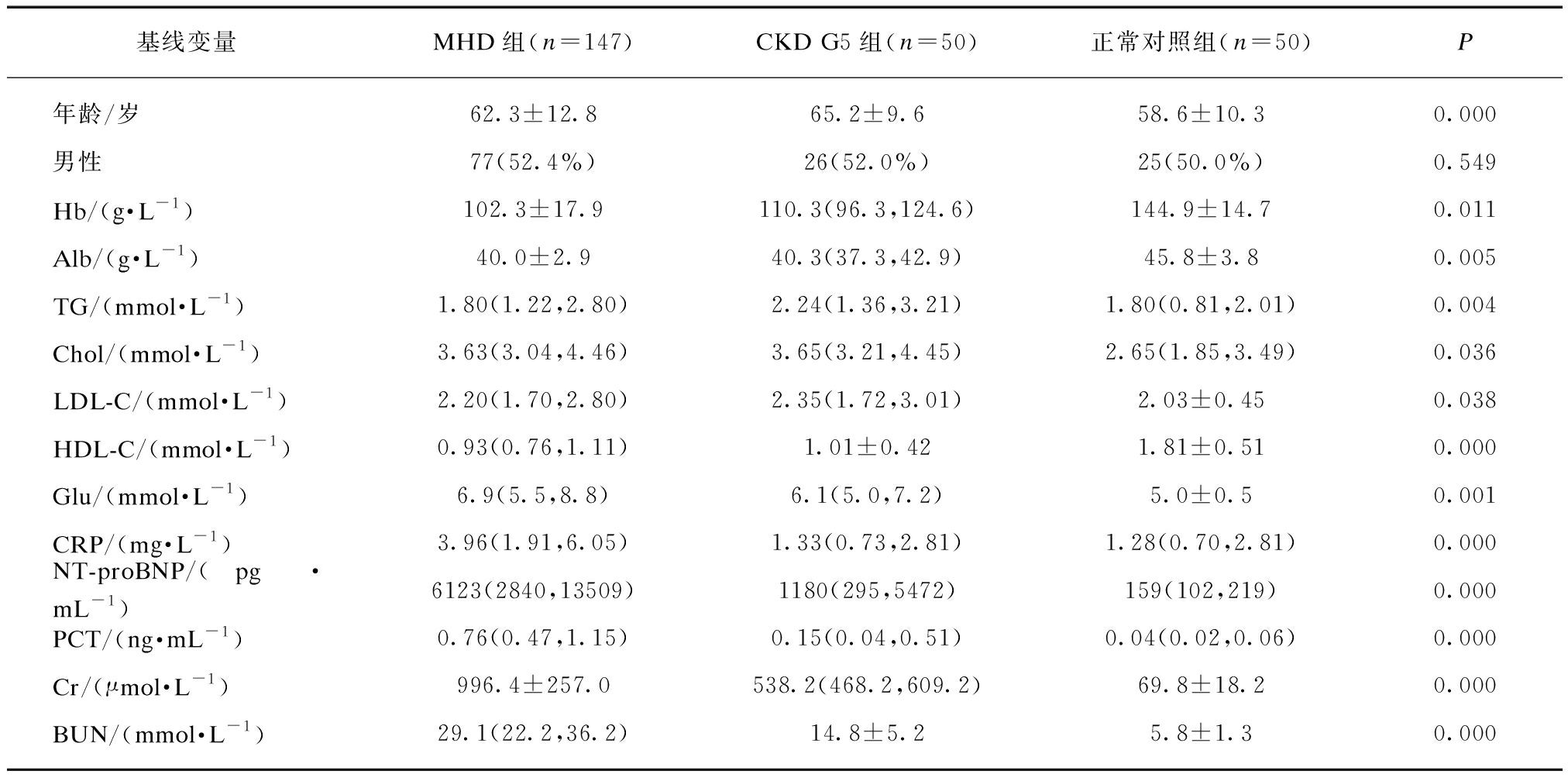
基线变量MHD组(n=147)CKD G5组(n=50)正常对照组(n=50)P年龄/岁62.3±12.865.2±9.658.6±10.30.000男性77(52.4%)26(52.0%)25(50.0%)0.549Hb/(g·L-1)102.3±17.9110.3(96.3,124.6)144.9±14.70.011Alb/(g·L-1)40.0±2.940.3(37.3,42.9)45.8±3.80.005TG/(mmol·L-1)1.80(1.22,2.80)2.24(1.36,3.21)1.80(0.81,2.01)0.004Chol/(mmol·L-1)3.63(3.04,4.46)3.65(3.21,4.45)2.65(1.85,3.49)0.036LDL-C/(mmol·L-1)2.20(1.70,2.80)2.35(1.72,3.01)2.03±0.450.038HDL-C/(mmol·L-1)0.93(0.76,1.11)1.01±0.421.81±0.510.000Glu/(mmol·L-1)6.9(5.5,8.8)6.1(5.0,7.2)5.0±0.50.001CRP/(mg·L-1)3.96(1.91,6.05)1.33(0.73,2.81)1.28(0.70,2.81)0.000NT-proBNP/(pg·mL-1)6123(2840,13509)1180(295,5472)159(102,219)0.000PCT/(ng·mL-1)0.76(0.47,1.15)0.15(0.04,0.51)0.04(0.02,0.06)0.000Cr/(μmol·L-1)996.4±257.0538.2(468.2,609.2)69.8±18.20.000BUN/(mmol·L-1)29.1(22.2,36.2)14.8±5.25.8±1.30.000
2.2 不同观察组间血清PCT、CRP和NT-proBNP检测结果分析
MHD合并CHF组、MHD不合并CHF组、慢性肾脏病5期组和正常对照组之间血清PCT、CRP和NT-proBNP检测水平差异有统计学意义(P<0.01)。两两比较显示: PCT水平各组间均有统计学意义(P<0.05),并且PCT水平依次降低;NT-proBNP水平除MHD合并CHF组、MHD不合并CHF组两组间无统计学意义(P>0.05)外,其余各组间均有统计学意义(P均<0.05);CRP水平除MHD合并CHF组和MHD不合并CHF组、MHD不合并CHF组和CKD G5组、CKD G5组和正常对照组组间无统计学意义(P>0.05)外,其余各组间均有统计学意义(P均<0.05),见表2。
表2 不同观察组间血清PCT、CRP和NT-proBNP检测结果比较
Tab.2 Comparison of serum PCT, CRP and NT proBNP detection results among different observation groups [M(P25,P75)]

组别nPCT/(ng·mL-1)CRP/(mg·L-1)NT-proBNP/(pg·mL-1)MHD合并CHF组980.86(0.67,1.15)4.35(2.40,6.25)7570(3460,16750)MHD不合并CHF组490.47(0.36,0.66)3.36(0.77,6.74)#4384(2047,9766)#CKD G5组500.15(0.04,0.51)1.33(0.73,2.81)*1180(295,5472)正常对照组500.04(0.02,0.06)1.28(0.70,2.81)△159(102,219)P0.0000.0000.000
与MHD合并CHF组比较,#P>0.05;与MHD不合并CHF组比较,*P>0.05;与CKD G5组比较,△P>0.05;其余各组P均<0.05
2.3 不同心功能分级患者间血清PCT、CRP和NT-proBNP检测结果分析
MHD合并CHF不同心功能分级患者之间血清PCT、CRP和NT-proBNP检测水平差异,除PCT有统计学意义(P<0.01)外,CRP和NT-proBNP检测水平差异均无统计学意义(P均>0.05)。PCT两两比较显示: 心功能分级Ⅲ级和Ⅳ级组间无统计学意义(P>0.05)外,其余各组间均有统计学意义(P均<0.01),并且随着心力衰竭等级的增加,PCT水平升高,见表3。
表3 不同心功能分级患者血清PCT、CRP和NT-proBNP检测结果比较
Tab.3 Comparison of serum PCT, CRP and NT proBNP levels in patients with different cardiac function classification [M(P25,P75)]
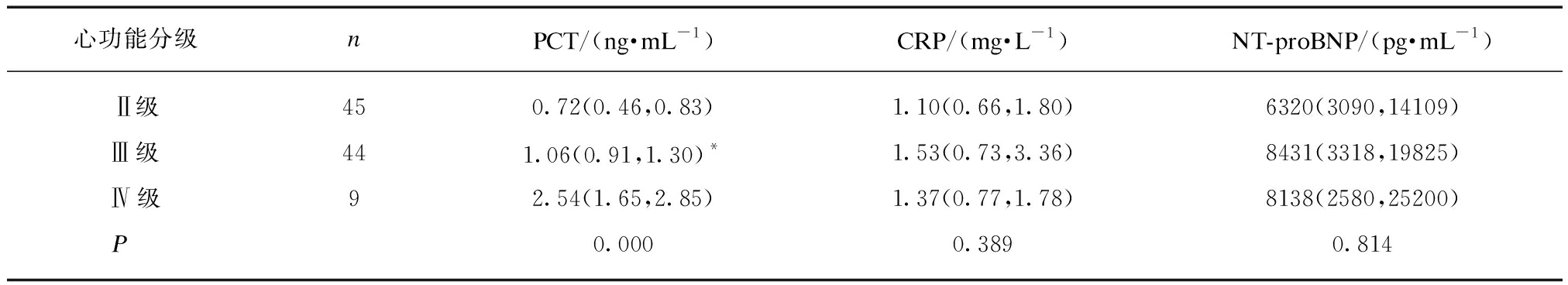
心功能分级nPCT/(ng·mL-1)CRP/(mg·L-1)NT-proBNP/(pg·mL-1)Ⅱ级450.72(0.46,0.83)1.10(0.66,1.80)6320(3090,14109)Ⅲ级441.06(0.91,1.30)*1.53(0.73,3.36)8431(3318,19825)Ⅳ级92.54(1.65,2.85)1.37(0.77,1.78)8138(2580,25200)P0.0000.3890.814
与心功能Ⅳ级组比较,*P>0.05;其余各组P均<0.01
2.4 血清PCT、CRP和NT-proBNP三者作为诊断MHD合并CHF患者的性能
2.4.1 PCT诊断性能 PCT、CRP和NT-proBNP三者分别用于诊断MHD合并CHF患者的曲线下面积分别为0.771(95%CI: 0.688~0.855,P<0.001);0.474(95%CI: 0.374~0.574,P>0.05);0.600(95%CI: 0.502~0.698,P>0.05)。PCT作为诊断MHD合并CHF患者的性能,其灵敏度为77.6%,特异度为77.6%,最大约登指数(临界点: 0.551ng/mL)。
2.4.2 PCT和NT-proBNP联合诊断性能 PCT和NT-proBNP两者联合用于诊断MHD合并CHF患者的诊断曲线下面积为0.782(95%CI: 0.701~0.863,P<0.001)。PCT和NT-proBNP两者联合作为诊断MHD合并CHF的性能,其灵敏度为78.6%,特异度为73.0%。
PCT和NT-proBNP两者联合用于诊断MHD合并CHF患者的诊断曲线下面积和单独PCT用于诊断MHD合并CHF患者的诊断曲线下面积没有明显差别,见图1。
2.5 血清PCT作为诊断MHD合并CHF不同心功能分级患者的性能
由于Ⅰ级心力衰竭属于无任何症状心力衰竭,该类患者很难准确归类且检测数据变异性大,因此分析样本均来自Ⅱ级至Ⅳ级心力衰竭患者。由于Ⅳ级心力衰竭患者较少,仅9例,且上述研究PCT两两比较显示Ⅲ级和Ⅳ级心力衰竭组间无统计学意义(P>0.05)外,因此心力衰竭Ⅲ级和Ⅳ级患者合并为一组,心力衰竭Ⅱ级为另外一组。PCT作为诊断MHD合并CHF不同心功能分级患者的曲线下面积为0.855(95%CI: 0.774~0.937,P<0.001),灵敏度为84.9%,特异度为82.2%,最大约登指数(临界点: 0.671ng/mL),见图2。
2.6 MHD合并CHF组和MHD未合并CHF组间临床资料比较
MHD合并CHF组的年龄、spKt/v、PCT较MHD未合并CHF组高,差异有统计学意义(P=0.000,P=0.040,P=0.000);MHD合并CHF组的透析龄、Alb、Ca、P、Ca×P、iPTH、TG、Cr、BUN、Na较MHD未合并CHF组低,差异有统计学意义(P=0.004,P=0.010,P=0.040,P=0.017,P=0.028,P=0.028,P=0.007,P=0.000,P=0.036,P=0.009);而两组间性别、血管通路(自体动静脉内瘘)、相对容量清除、URR、透前SBP、透前DBP、Hb、Chol、LDL-C、HDL-C、CO2、Glu、CRP、NT-proBNP差异无统计学意义(P>0.05),见表4。

图1 各指标诊断MHD合并CHF界值
Fig.1 The cut-off value of each index in diagnosis of MHD combined with CHF

图2 血清PCT诊断不同心功能分级界值
Fig.2 Cut off value of serum PCT in diagnosis of different cardiac function
表4 MHD合并CHF组和MHD未合并CHF组的临床资料比较
Tab.4 Comparison of clinical data between MHD with CHF group and MHD without CHF group
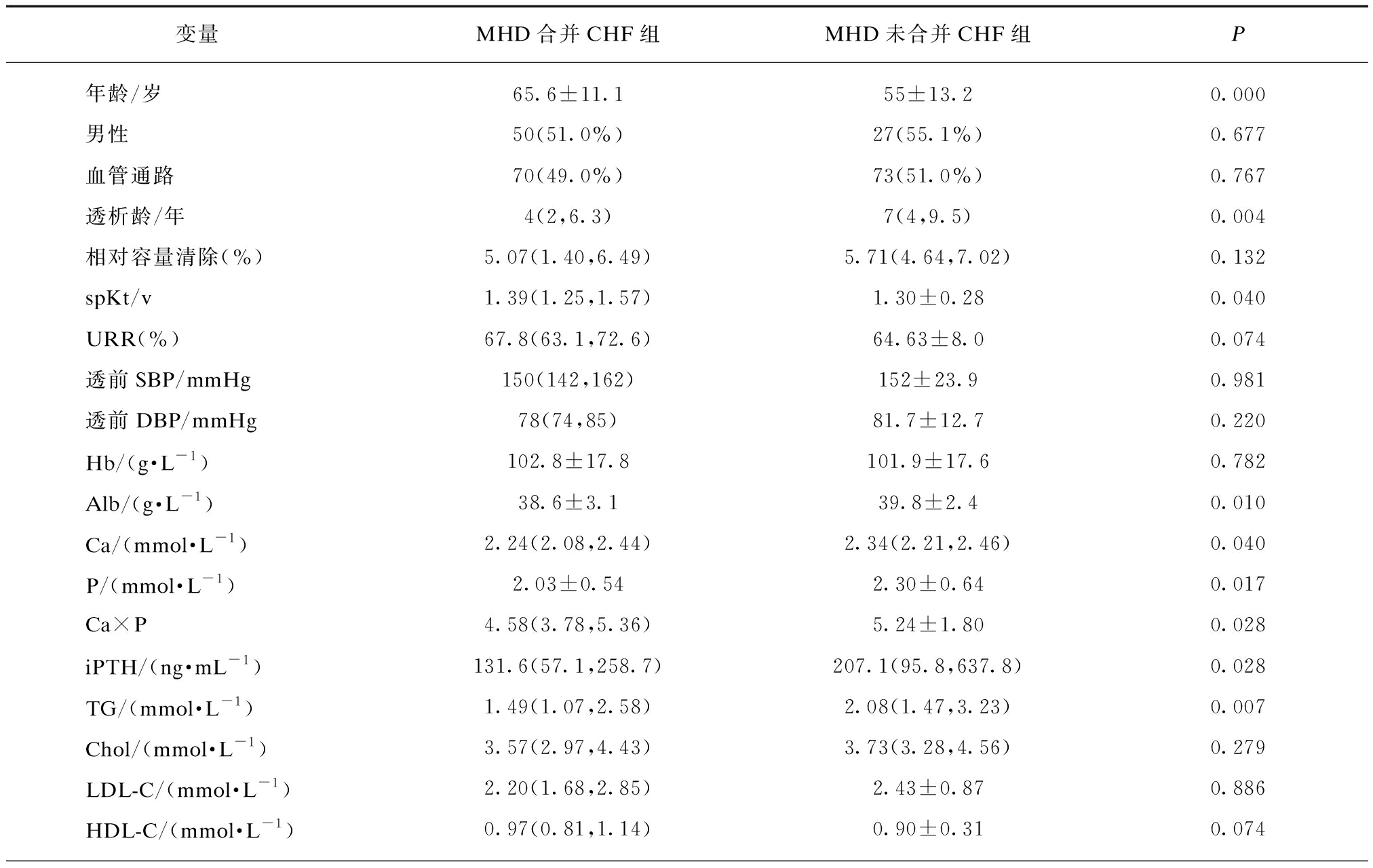
变量MHD合并CHF组MHD未合并CHF组P年龄/岁65.6±11.155±13.20.000男性50(51.0%)27(55.1%)0.677血管通路70(49.0%)73(51.0%)0.767透析龄/年4(2,6.3)7(4,9.5)0.004相对容量清除(%)5.07(1.40,6.49)5.71(4.64,7.02)0.132spKt/v1.39(1.25,1.57)1.30±0.280.040URR(%)67.8(63.1,72.6)64.63±8.00.074透前SBP/mmHg150(142,162)152±23.90.981透前DBP/mmHg78(74,85)81.7±12.70.220Hb/(g·L-1)102.8±17.8101.9±17.60.782Alb/(g·L-1)38.6±3.139.8±2.40.010Ca/(mmol·L-1)2.24(2.08,2.44)2.34(2.21,2.46)0.040P/(mmol·L-1)2.03±0.542.30±0.640.017Ca×P4.58(3.78,5.36)5.24±1.800.028iPTH/(ng·mL-1)131.6(57.1,258.7)207.1(95.8,637.8)0.028TG/(mmol·L-1)1.49(1.07,2.58)2.08(1.47,3.23)0.007Chol/(mmol·L-1)3.57(2.97,4.43)3.73(3.28,4.56)0.279LDL-C/(mmol·L-1)2.20(1.68,2.85)2.43±0.870.886HDL-C/(mmol·L-1)0.97(0.81,1.14)0.90±0.310.074
续表
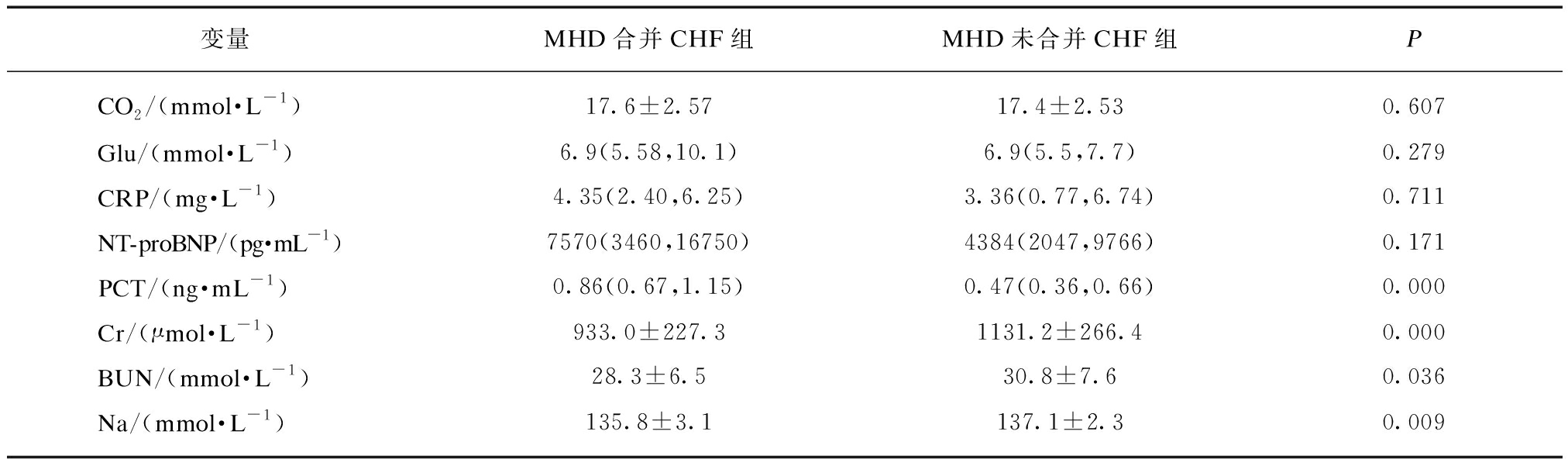
变量MHD合并CHF组MHD未合并CHF组PCO2/(mmol·L-1)17.6±2.5717.4±2.530.607Glu/(mmol·L-1)6.9(5.58,10.1)6.9(5.5,7.7)0.279CRP/(mg·L-1)4.35(2.40,6.25)3.36(0.77,6.74)0.711NT-proBNP/(pg·mL-1)7570(3460,16750)4384(2047,9766)0.171PCT/(ng·mL-1)0.86(0.67,1.15)0.47(0.36,0.66)0.000Cr/(μmol·L-1)933.0±227.31131.2±266.40.000BUN/(mmol·L-1)28.3±6.530.8±7.60.036Na/(mmol·L-1)135.8±3.1137.1±2.30.009
1mmHg=0.133kPa
为明确MHD合并CHF组的主要影响因素,将有统计学差异的年龄、透析龄、spKt/v、Alb、Ca、P、Ca×P、iPTH、TG、PCT、Cr、BUN、Na为自变量,纳入以有无CHF为因变量的二项分类Logistic回归分析。结果显示年龄、透析龄、PCT、Cr是MHD合并CHF的危险因素,PCT每增加1ng/mL,CHF发生相对风险增加9倍,见表5。
表5 MHD合并CHF危险因素二项分类Logistic回归分析
Tab.5 Binary Logistic regression analysis of risk factors of
MHD combined with CHF
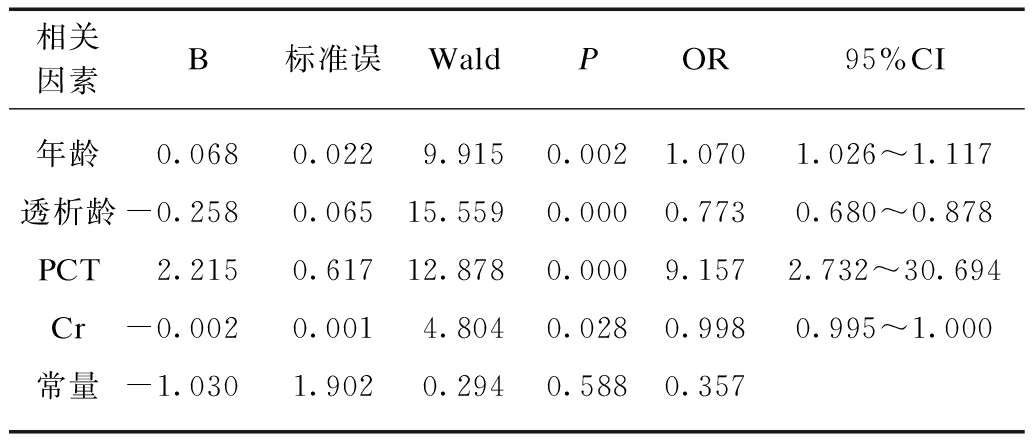
相关因素B标准误WaldPOR95%CI年龄0.0680.0229.9150.0021.0701.026~1.117透析龄-0.2580.06515.5590.0000.7730.680~0.878PCT2.2150.61712.8780.0009.1572.732~30.694Cr-0.0020.0014.8040.0280.9980.995~1.000常量-1.0301.9020.2940.5880.357
3 讨 论
Assicot等[8]于1993年首先报道了PCT在诊断细菌感染导致的全身炎症反应的价值。侯晓敏[9]报道PCT的水平与炎症程度呈正相关,可以在疾病早期判别炎症的严重程度。1999年,Niebauer等[10]将血清PCT在心力衰竭中进行了首次评估,发现心力衰竭组血清PCT浓度较健康对照组高。由于心力衰竭标志物利钠肽(BNP/NT-proBNP)对于ESRD人群的诊断效能不佳,因此针对ESRD这一特殊人群,探讨PCT在MHD合并CHF诊断中的可能应用价值和针对这一人群制定PCT的界值是十分有必要的。本研究显示,MHD合并CHF患者的PCT水平高于MHD未合并CHF患者;随着心力衰竭的严重程度升高,PCT水平也相应升高;PCT可能是MHD合并CHF患者的主要影响因素之一。
本研究显示: MHD合并CHF组、MHD不合并CHF组、慢性肾脏病5期组和正常对照组的血清PCT水平呈依次降低,表明在没有感染的状况下,心力衰竭可能会导致PCT浓度增高,PCT可能可以作为MHD合并CHF的潜在标志物。慢性肾脏病5期组PCT水平高于正常对照组,这与Dahaba等[11]的回顾性研究相类似,在临床及实验室无明确感染证据的情况下,未接受透析的慢性肾衰患者的PCT基线水平高于健康对照组。这可能主要与尿毒症本身直接升高了PCT水平或者通过调节IL-6、TNF-α的水平影响PCT有关[12]。慢性肾脏病5期组PCT水平低于MHD组合并/未合并CHF组,这与Herget-Rosenthal等[13]回顾性研究结论相类似,血液透析患者体内PCT水平较未透析的慢性肾脏病5期患者升高,同时PCT的升高与心血管事件的发生率具有正相关。这可能是血液透析患者无明显临床症状的感染情况下,体内仍存在轻度的炎症反应,导致PCT升高。MHD合并CHF组PCT水平高于MHD不合并CHF组,这与Banach等[14]以LVEF≤45%的CHF患者为研究对象的研究结论相类似,未感染的CHF患者血清PCT水平会有所升高,可能原因为心力衰竭可能会通过肠道淤血导致内毒素的重吸收从而抬高体内PCT水平[15]。值得注意的是,虽然NT-proBNP水平在MHD合并CHF组、MHD不合并CHF组、慢性肾脏病5期组和正常对照组之间呈依次降低的趋势,但是其水平在MHD合并CHF组和MHD不合并CHF组间差异无统计学意义,说明利钠肽作为正常人群心力衰竭标志物的诊断效能,可能不适用ESRD人群,用于诊断MHD合并CHF的效能欠佳。究其原因在于NT-proBNP的代谢途径是肾脏,而作为低相对分子质量蛋白质的PCT并非主要依靠肾脏清除[16],所以肾功能障碍并不会对PCT的临床诊断决策产生很大影响[17]。此外,MHD患者BNP水平受透析时机和持续时间影响,也不适用于评估心功能。
本研究发现: 随着心力衰竭程度的加重,PCT水平呈升高趋势,提示血清PCT水平可能是协助评估心力衰竭严重程度的潜在标志物[4,18]。原因可能为随着心力衰竭严重程度的加重,肠道淤血更加严重,导致PCT水平的间接升高。这与李培培等[19]研究结果类似,即排除感染的重度心力衰竭患者(Ⅳ级)PCT水平较轻中度心力衰竭患者(Ⅱ~Ⅲ级)PCT水平高。但是本研究重度心力衰竭患者(Ⅳ级)PCT水平和中度心力衰竭患者(Ⅲ级)PCT水平差异无统计学意义,这可能与本次研究重度心力衰竭患者(Ⅳ级)例数较少(9例),统计效能不足;同时本研究人群为ESRD人群,而李培培等[19]研究为非ESRD人群,这些可能影响研究结论。
血清PCT、CRP和NT-proBNP三者作为诊断MHD合并CHF患者的性能比较结果表明: PCT可能可以用于MHD合并CHF的诊断(诊断曲线下面积分别为0.771),诊断界值为0.551ng/mL。目前PCT用于诊断没有明确感染的MHD合并心力衰竭的界值尚未报道,并且针对正常健康人群的PCT界值,也因为检测方法等的不同,存在较大差异[20-21]。临床医师在面对没有明确感染的MHD患者血清PCT水平升高时,是否可以考虑心功能的受损情况,还需要进一步前瞻性、大样本、多中心的研究。本研究表明,PCT可能可以用于MHD合并CHF患者不同心功能分级的诊断(诊断曲线下面积分别为0.855),诊断界值为0.671ng/mL。Logistic回归分析显示,PCT与MHD患者合并CHF密切相关,即PCT每增加1ng/mL,CHF发生相对风险增加9倍。因此,当MHD患者血清PCT水平大于0.551ng/mL,要评估其心功能,密切监测。
本次研究不足: 本实验为单中心的横断面研究,不能说明因果关系,只能说明PCT与心力衰竭发生相关;本研究纳入很多心力衰竭相关变量,Logistic回归分析也未发现变量的共线性和交互作用,但是可能存在未知混杂变量;样本量较少,尤其心力衰竭Ⅳ级患者,并且没有将不同CHF种类与PCT关系阐明,具有一定局限性;心力衰竭评估采用较为主观的NYHA标准,尽管3位临床医师参与评估,但可能存在偏倚。血清PCT水平在MHD合并CHF诊断中的价值及其影响因素仍需多中心、大样本、前瞻性的试验来进一步验证,以明确其与MHD患者的心血管事件、死亡率之间的关系。
综上所述,本次研究表明,PCT可能是一个潜在的用于诊断MHD合并CHF的标志物,并且在评估MHD合并CHF患者心力衰竭严重程度上展示了较高的灵敏度和特异度,为PCT应用于中国ESRD人群的CHF诊断以及评估心力衰竭严重性提供了可靠依据与转化基础。以期为临床医师提供CHF患者血液透析时更适用的心力衰竭诊断和评估指标,便于提示早期干预措施的采用,从而有助于减轻医疗系统的负担、改善患者的预后,提高血液透析患者的生活质量。今后的研究方向着重于: PCT水平与不同心力衰竭种类的关系、对MHD合并CHF患者的预后评估及不同透析方式下的PCT水平与MHD合并CHF的关系。
[1] MARUNA P, NEDELN KOV
KOV K, GÜRLICH R. Physiology and genetics of procalcitonin[J]. Physiol Res, 2000,49(Suppl 1): S57-S61.
K, GÜRLICH R. Physiology and genetics of procalcitonin[J]. Physiol Res, 2000,49(Suppl 1): S57-S61.
[2] DE BOER R A, DANIELS L B, MAISEL A S, et al. State of the art: newer biomarkers in heart failure[J]. Eur J Heart Fail, 2015,17(6): 559-569.
[3] VILLANUEVA M P, MOLLAR A, PALAU P, et al. Procalcitonin and long-term prognosis after an admission for acute heart failure[J]. Eur J Intern Med, 2015,26(1): 42-48.
[4] AÏSSOU L, SORBETS E, LALLMAHOMED E, et al. Prognostic and diagnostic value of elevated serum concentration of procalcitonin in patients with suspected heart failure. A review and meta-analysis[J]. Biomarkers, 2018,23(5): 407-413.
[5] 黄清容,何茂婷.血浆N-端脑利钠肽前体在心力衰竭中的应用价值[J].中国医学工程,2014,22(6): 17-18.
[6] RODEHEFFER R J. The new epidemiology of heart failure[J]. Curr Cardiol Rep, 2003,5(3): 181-186.
[7] 宋蕾,仇方忻,苏军,等.维持性血液透析患者血清氨基末端脑钠肽水平的测定与分析[J].国际泌尿系统杂志,2015,35(6): 881-884.
[8] ASSICOT M, GENDREL D, CARSIN H, et al. High serum procalcitonin concentrations in patients with sepsis and infection[J]. Lancet, 1993,341(8844): 515-518.
[9] 侯晓敏.血清降钙素原和C反应蛋白联合检测对老年人急性胆管炎严重程度的评估价值[J].同济大学学报(医学版),2018,39(2): 112-116.
[10] NIEBAUER J, VOLK H D, KEMP M, et al. Endotoxin and immune activation in chronic heart failure: a prospective cohort study[J]. Lancet, 1999,353(9167): 1838-1842.
[11] DAHABA A A, REHAK P H, LIST W F. Procalcitonin and C-reactive protein plasma concentrations in nonseptic uremic patients undergoing hemodialysis[J]. Intensive Care Med, 2003,29(4): 579 -583.
[12] MARUNA P, NEDELNIKOVA K, GÜRLICH R. Physiology and genetics of procalcitonin[J]. Physiol Res, 2000,49(Suppl 1): S57-S61.
[13] HERGET-ROSENTHAL S, KLEIN T, MARGGRAF G, et al. Modulation and source of procalcitonin in reduced renal function and renal replacement therapy[J]. Scand J Immunol, 2005,61(2): 180-186.
[14] BANACH J, WOLOWIEC L, ROGOWICZ D, et al. Procalcitonin(PCT) predicts worse outcome in patients with chronic heart failure with reduced ejection fraction(HFrEF)[J]. Dis Markers, 2018,2018: 9542784.
[15] HE Y Y, YAN W, LIU C L, et al. Usefulness of S100A12 as a prognostic biomarker for adverse events in patients with heart failure[J]. Clin Biochem, 2015,48(4/5): 329-333.
[16] SCHMIDT M, BURCHARDI C, SITTER T, et al. Procalcitonin in patients undergoing chronic hemodialysis[J]. Nephron, 2000,84(2): 187-188.
[17] MEISNER M, LOHS T, HUETTEMANN E, et al. The plasma elimination rate and urinary secretion of procalcitonin in patients with normal and impaired renal function[J]. Eur J Anaesthesiol, 2001,18(2): 79-87.
[18] CANBAY A, CELEBI O O, CELEBI S, et al. Procalcitonin: a marker of heart failure[J]. Acta Cardiol, 2015,70(4): 473-478.
[19] 李培培.除外感染的充血性心力衰竭患者血清降钙素原水平的意义及主要影响因素[D].长春: 吉林大学,2019.
[20] SCHUETZ P, CHRIST-CRAIN M, THOMANN R, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial[J]. JAMA, 2009,302(10): 1059-1066.
[21] CVETINOVIC N, ISAKOVIC A M, LAINSCAK M, et al. Procalcitonin in heart failure: hic et nunc[J]. Biomark Med, 2017,11(10): 893-903.