动脉瘤性蛛网膜下腔出血(aneurysmal subara-chnoid hemorrhage, aSAH)是一种发病率高、死亡率高的脑血管意外[1-2],其严重程度通常采用Hunt-Hess分级进行评估[3],Hunt-Hess 1~3级的患者,如果积极治疗,通常预后较好,故称为低级别动脉瘤;而Hunt-Hess 4~5级的患者,即使积极处理,大多数患者预后很差,故称为高级别动脉瘤,Hunt-Hess分级能较好地预测临床预后,在临床上广泛应用。早期脑损伤和迟发性脑缺血是不良预后的主要原因[4]。目前aSAH后的脑损伤机制尚不清楚,越来越多的证据表明,血小板聚集和炎症反应参与了aSAH后的病理生理改变[5-6]。
全身免疫炎症指数(systemic immune-inflammation index, SII)是通过(血小板计数×中性粒细胞计数)/淋巴细胞计数计算得出,是反映自身炎症状态和免疫状态的指标。一些研究已经证实了SII在许多癌症中的预后价值[7-9]。既往已有多项研究证实中性粒细胞-淋巴细胞比值(neutrophil-lymphocyte ratio, NLR),血小板-淋巴细胞比值(platelet-lymphocyte ratio, PLR)在aSAH中的临床意义[10-12],仍没有研究探究SII在aSAH中的作用。考虑到NLR,PLR和SII在计算上的相似性,推测SII在aSAH中也具有相似的作用。本研究通过比较不同Hunt-Hess分级患者入院时SII,探讨其在评估动脉瘤性蛛网膜下出血严重程度的临床价值。
1 资料与方法
1.1 一般资料
回顾性收集和分析2015年1月—2019年1月在同济大学附属第十人民医院神经外科接受治疗的261例aSAH患者的数据资料。本研究的纳入标准为: (1) 头 颅CT和/或腰穿检查证实的非创伤性蛛网膜下出血;(2) CT血管造影(computed tomographic angi-ography, CTA)和/或数字减影血管造影(digital subtra-ction angiography, DSA)证实颅内动脉瘤破裂是蛛网膜下出血的病因;(3) 入院后48h内接受血管内治疗或开颅夹闭;(4)发病到入院的时间<24h。本研究的排除标准: (1) 合并其他脑血管疾病,如动静脉畸形、动静脉瘘、烟雾病等;(2) 患者发病前合并有严重系统性疾病,如血液系统疾病、免疫系统疾病、近期感染性疾病、严重的肝肾功能不全等。此研究方案已获得同济大学附属第十人民医院伦理委员会的批准(伦理编号: SHSY-IEC-4.1/20-92/01)。
1.2 方法
记录所有患者的基线资料,包括年龄、性别、病史、入院时Hunt-Hess分级、动脉瘤大小、动脉瘤位置、有无急性脑积水等。急性脑积水定义为发病后72h内出现脑积水症状及脑室扩大(头颅CT中尾状核指数≥0.20)。为了便于分析,对一些特殊变量进行分类: 根据动脉瘤最长径,将肿瘤大小分为“<5mm”“5~10mm”和“≥10mm”,动脉瘤的位置分为“大脑前动脉”“颈内动脉”“大脑中动脉”和“椎基底动脉”。将Hunt-Hess 1~3级分为“低级别”,Hunt-Hess 4~5级分为“高级别”。在发病3个月后通过电话或者门诊随访,根据mRS评分评价患者的功能预后,mRS评分≤2认为是预后良好,mRS评分> 2认为是预后不良。在患者入院时抽取血液样本,并在静脉采血后1h内通过自动分析仪(XE-2100,日本,Sysmex公司)进行血常规检测。
1.3 统计学方法
使用SPSS 21.0版软件进行统计学处理。连续变量以中位数和四分位间距(interquartile range, IQR)表示,分类变量以频数和频率表示。对连续变量采用Mann-Whitney U检验,对于分类变量采用χ2检验。使用Spearman分析进行相关行分析。通过构建受试者工作特征曲线(receiver operating characteristic, ROC),并计算计算曲线下面积(area under the curve, AUC)来评价SII对于aSAH级别的预测能力。将单因素分析中P<0.10的变量纳入到多因素Logistic回归模型中,P<0.05为差异有统计学意义。
2 结 果
2.1 纳入患者的基本资料
本研究共纳入261例患者,其中男性100例,女性161例,平均年龄为(59±12)(IQR: 52~67)岁,其中动脉瘤位于大脑前动脉91例,颈内动脉94例,大脑中动脉41例,椎基底动脉35例。动脉瘤大小<5mm 共151例,5~10mm共88例,>10mm共22例。入院时并发急性脑积水36例(36/261,13.8%),患者纳入流程见图1。
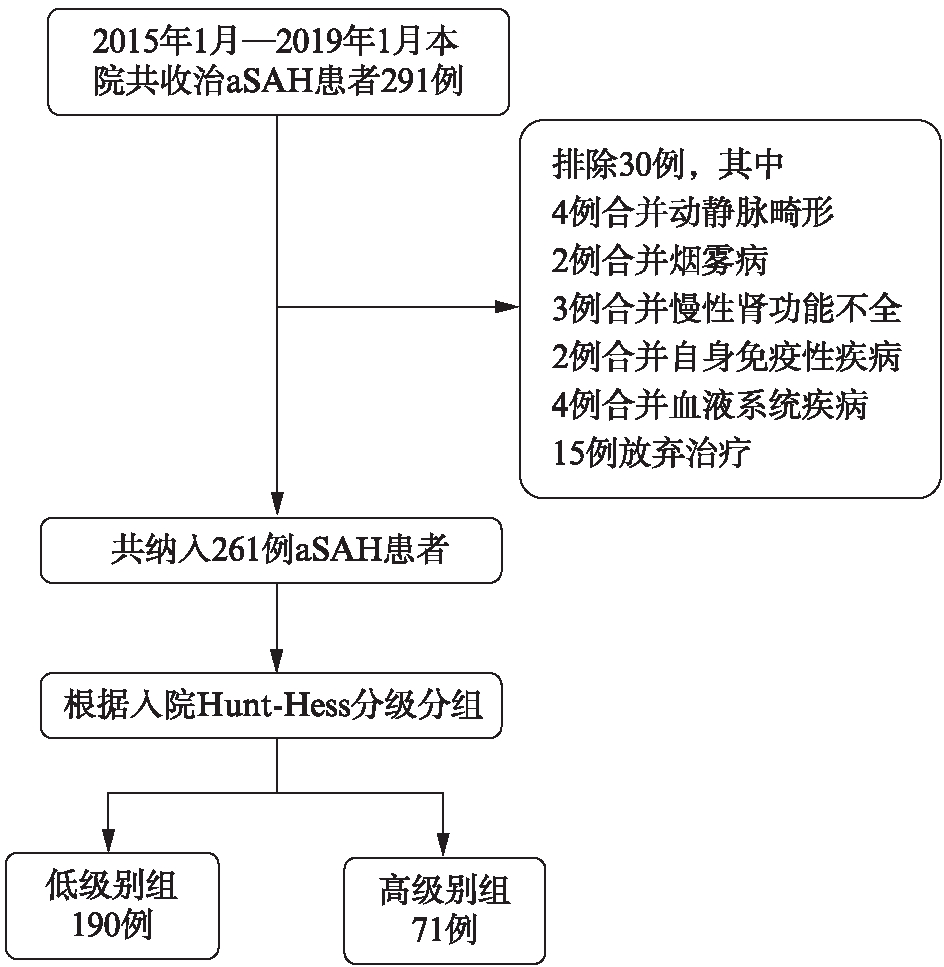
图1 纳入研究对象的流程
Fig.1 Flowchart of the cohort
2.2 不同Hunt-Hess分级患者临床资料的比较
根据入院Hunt-Hess分级将患者分成两组,其中低级别组190例,高级别组71例。两组年龄、急性脑积水、红细胞、血红蛋白、白细胞、中性粒细胞、淋巴细胞,CRP、NLR、PLR、SII差异有统计学意义(P<0.05),见表1。
表1 不同Hunt-Hess分级aSAH患者临床资料的单因素分析
Tab.1 Univariate analysis of aSAH patients with different Hunt-Hess grades
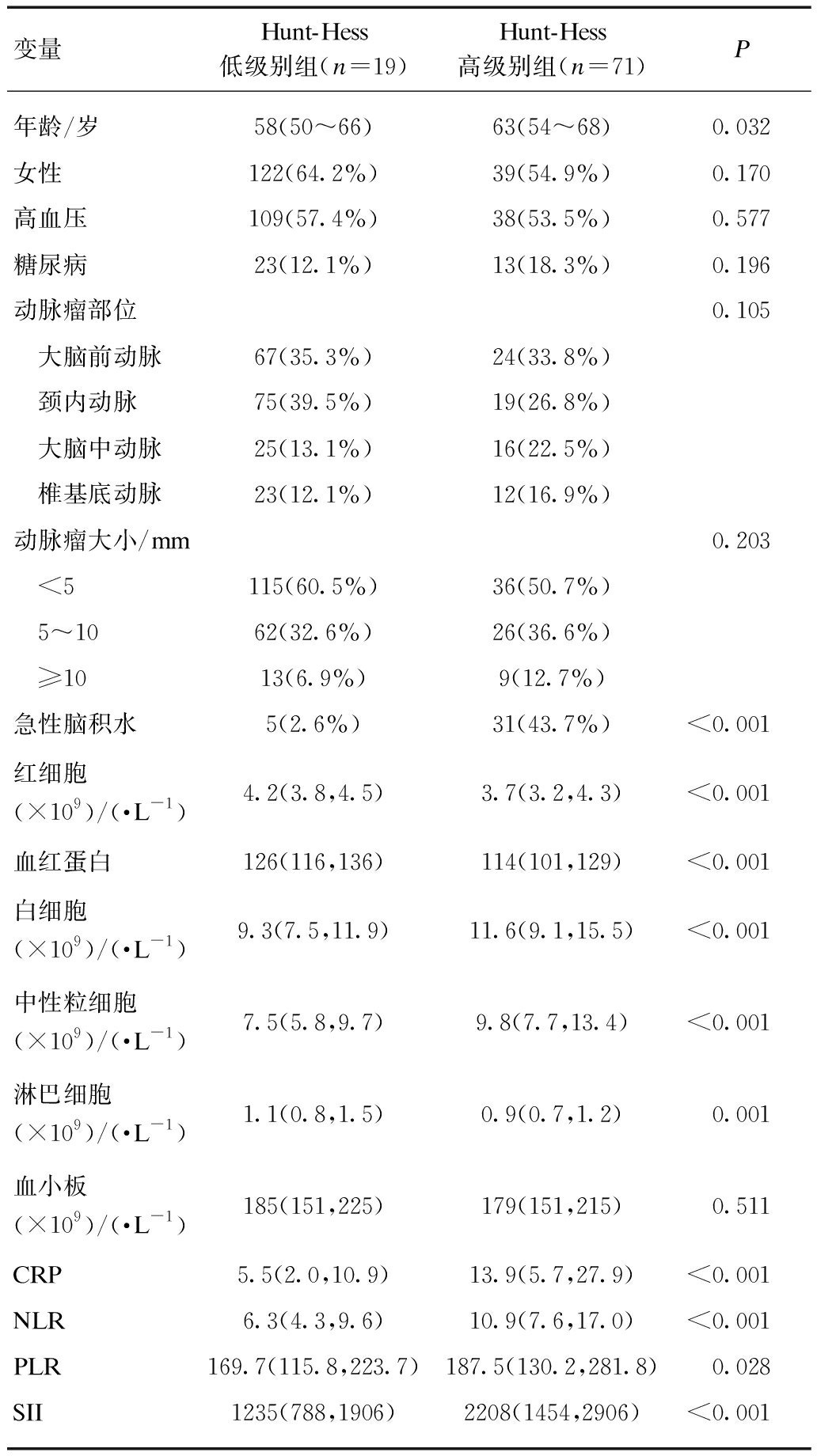
变量Hunt-Hess低级别组(n=19)Hunt-Hess高级别组(n=71)P年龄/岁58(50~66)63(54~68)0.032女性122(64.2%)39(54.9%)0.170高血压109(57.4%)38(53.5%)0.577糖尿病23(12.1%)13(18.3%)0.196动脉瘤部位0.105 大脑前动脉67(35.3%)24(33.8%) 颈内动脉75(39.5%)19(26.8%) 大脑中动脉25(13.1%)16(22.5%) 椎基底动脉23(12.1%)12(16.9%)动脉瘤大小/mm0.203 <5115(60.5%)36(50.7%) 5~1062(32.6%)26(36.6%) ≥1013(6.9%)9(12.7%)急性脑积水5(2.6%)31(43.7%)<0.001红细胞(×109)/(·L-1)4.2(3.8,4.5)3.7(3.2,4.3)<0.001血红蛋白126(116,136)114(101,129)<0.001白细胞(×109)/(·L-1)9.3(7.5,11.9)11.6(9.1,15.5)<0.001中性粒细胞(×109)/(·L-1)7.5(5.8,9.7)9.8(7.7,13.4)<0.001淋巴细胞(×109)/(·L-1)1.1(0.8,1.5)0.9(0.7,1.2)0.001血小板(×109)/(·L-1)185(151,225)179(151,215)0.511CRP5.5(2.0,10.9)13.9(5.7,27.9)<0.001NLR6.3(4.3,9.6)10.9(7.6,17.0)<0.001PLR169.7(115.8,223.7)187.5(130.2,281.8)0.028SII1235(788,1906)2208(1454,2906)<0.001
连续变量以中位数(P25,P75)表示,分类变量以频数和频率表示;CRP: C反应蛋白,NLR: 中性粒细胞/淋巴细胞比,PLR: 血小板/淋巴细胞比
2.3 影响Hunt-Hess分级的多因素Logistic回归分析
多因素Logistic回归分析显示,急性脑积水(OR=44.006,95%CI: 11.885~162.937,P<0.001)、CRP(OR=1.021,95%CI: 1.001~1.042,P=0.043)、红细胞计数(OR=0.193,95%CI: 0.049~0.755,P=0.018)、PLR(OR=0.986,95%CI: 0.976~0.996,P=0.008)和SII(OR=1.001,95%CI: 1.000~1.002,P=0.046)是Hunt-Hess分级的独立预测因素,见表2。
表2 预测高Hunt-Hess级别的多因素回归分析
Tab.2 Multivariate analysis of predictors for high Hunt-Hess grade

变量OR(95%CI)P急性脑积水44.006(11.885~162.937)<0.001CRP1.021(1.001~1.042)0.043红细胞0.193(0.049~0.755)0.018PLR0.986(0.976~0.996)0.008SII1.001(1.000~1.002)0.046
2.4 SII与Hunt-Hess分级的相关性分析
Spearman相关性分析表明,SII与Hunt-Hess分级呈低度正相关(r=0.355,P<0.001)。
2.5 ROC曲线分析
使用ROC曲线分析SII对Hunt-Hess分级的预测能力,结果显示,AUC为0.730(95%CI: 0.657~0.803,P<0.001),表明SII对于Hunt-Hess分级有较好的预测能力,见图2。计算约登指数,选取1976作为截断值,发现SII≥1976对于预测高Hunt-Hess分级拥有60.6%的敏感度和80.0%的特异度。

图2 SII预测Hunt-Hess分级的受试者工作特征曲线
Fig.2 Receiver operating characteristic curve for the predictive value of SII for high Hunt-Hess grade
2.6 不同SII患者的临床资料比较
根据SII临界值将患者分成两组,分析两组间临床资料上的差异。结果表明入院时SII较高的患者(SII≥1976)具有更高的Hunt-Hess分级(P<0.001),更高的急性脑积水发生率(P=0.001)及更差的功能预后(P<0.001),见表3。
表3 不同SII分组的患者的临床资料比较
Tab.3 Baseline characteristics of included aSAH patients dichotomized to the identified SII threshold(1976)

变量SII<1976(n=180)SII≥1976(n=81)P年龄/岁59(52~66)59(52~67)0.445性别(女性)111(61.7%)50(61.7%)0.992高血压104(57.8%)43(53.1%)0.480糖尿病23(12.8%)13(16.0%)0.478Hunt-Hess分级<0.001 1~3级152(84.4%)38(46.9%) 4~5级28(15.6%)43(53.1%)动脉瘤部位0.328 大脑前动脉61(33.9%)30(37.0%) 颈内动脉71(39.4%)23(28.4%) 大脑中动脉25(13.9%)16(19.8%) 椎基底动脉23(12.8%)12(14.8%)动脉瘤大小/mm0.086 <5110(61.1%)41(50.6%) 5~1059(32.8%)29(35.8%) ≥1011(6.1%)11(13.6%)治疗方式0.198 血管内治疗142(78.9%)58(71.6%) 开颅夹闭38(21.1%)23(28.4%)急性脑积水16(8.9%)20(24.7%)0.001mRS评分<0.001 ≤2161(89.4%)32(39.5%) >219(10.6%)49(60.5%)
连续变量以中位数和四分位间距表示,分类变量以频数和频率表示
3 讨 论
SII是一种基于外周血淋巴细胞、中性粒细胞和血小板计数的炎症指标,反映了人体炎症和免疫状态平衡情况。既往已有多项研究揭示了SII在多种肿瘤中具有预测患者预后的作用[7-9],目前还鲜有研究报道SII在非肿瘤领域的作用。本研究是为了探究aSAH患者发病时SII水平与病情严重程度的相关性,将患者入院时Hunt-Hess分级分成两组,经过统计分析发现,Hunt-Hess高级别组患者入院时拥有更高的SII值,SII是高级别aSAH的独立危险因素,相关性分析发现,SII与Hunt-Hess分级呈现低度正相关,ROC曲线分析表明SII对于Hunt-Hess分级具有较好的预测能力,表明SII可作为反应aSAH病情严重程度的新生化指标。
aSAH发病后由于全身应激反应的刺激而导致白细胞增多和血小板活化,从而引发后续脑损伤[13]。在aSAH后的早期阶段,血小板活化和炎症因子表达就会出现急速升高[14-15]。同时Hunt-Hess分级越高,其升高越显著,表明血小板活化和炎症程度与脑损伤呈正相关。Frontera等[15]发现血小板活化是早期脑损伤和短期预后的独立预测因子。血小板聚集可引起微血栓形成、局部缺血,导致组织死亡。在动物模型中,SAH后神经元立即死亡,并伴有微血管中的血小板聚集[16]。炎症介导的早期脑损伤的可能机制包括血脑屏障的破坏,神经元的死亡,突触损伤,长期势差的丧失和白质损伤等[17]。同时,aSAH诱发的免疫抑制在所有患者中均有发生,但仅在高级别患者中持续存在。严重的免疫抑制与感染性并发症和不良预后的高度相关[18]。SII升高代表患者处于一种促凝状态(更高的血小板计数)和免疫失调状态(更高的中性粒细胞计数和更低的淋巴细胞计数)。aSAH发病后,出血对患者的损伤越重,患者Hunt-Hess评分越高,患者体内的血小板活化和炎症反应越剧烈,患者入院时SII的水平也就越高。
SII是肿瘤研究领域的一种新型炎症标志物。与其他炎症生物标志物(如降钙素原、CRP、IL-6)相比,SII有几个优点: (1) 测量快速、廉价,只需要进行常规的血常规检测并进行计算就可以得出。(2) 反映了患者的炎症和血液凝聚状态,而炎症与微血栓形成均在aSAH后的病理生理变化中扮演了关键角色[19-21],因此SII可以作为监测aSAH患者炎症程度与促栓能力指标。(3) 是一个比值,比其他血液参数更稳定。因此,SII具有一定的临床推广前景。
本研究具有一定的创新性。(1) 这是第一次将SII这一新型指标应用到动脉瘤性蛛网膜下腔出血这一疾病模型中,揭示了SII与aSAH严重程度的相关性;(2) SII能够反映病情的严重程度,而且是一个客观指标,而Hunt-Hess的评判具有一定的主观性,因此在实际临床工作中,可以将两者结合,使病情判断更加精准。对于高级别动脉瘤性蛛网膜下出血的患者(Hunt-Hess 4~5级),建议实时动态检测患者的SII水平变化,对于较高SII水平者,表明出血的打击更大,患者全身炎症反应和血小板聚集程度更重,预后可能更差。本研究也发现,入院时SII较高的患者,3个月的功能预后较差,表明SII对于aSAH患者的预后具有潜在的预测能力,但需要后续的研究加以证实。
本研究存在一些缺陷。(1) 这是一项单中心的回顾性观察研究,样本量相对较小;(2) 只纳入了患者入院时SII的水平,未能观察SII在患者病程中的变化;(3) 只研究了SII水平与患者入院时疾病严重程度的关系,未能深入研究其对后续血管痉挛,迟发性脑缺血及预后的关系,这也是后续工作的重点。
SII是aSAH高Hunt-Hess分级的独立危险因素,SII可以作为判断动脉瘤性蛛网膜下出血严重程度的新型指标,具有一定的临床意义。
[1] GALEA J, OGUNGBENRO K, HULME S, et al. Reduction of inflammation after administration of interleukin-1 receptor antagonist following aneurysmal subarachnoid hemorrhage: results of the subcutaneous interleukin-1Ra in SAH(SCIL-SAH)study[J]. J Neurosurg, 2018,128(2): 515-523.
[2] RIDWAN S, URBACH H, GRESCHUS S, et al. Health care costs of spontaneous aneurysmal subarachnoid hemorrhage for rehabilitation, home care, and in-hospital treatment for the first year[J]. World Neurosurg, 2017,97: 495-500.
[3] HUNT W E, HESS R M. Surgical risk as related to time of intervention in the repair of intracranial aneurysms[J]. J Neurosurg, 1968,28(1): 14-20.
[4] AL-KHINDI T, MACDONALD R L, SCHWEIZER T A. Cognitive and functional outcome after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2010,41(8): e519-e536.
[5] SABRI M, AI J, LAKOVIC K, et al. Mechanisms of microthrombi formation after experimental subarachnoid hemorrhage[J]. Neuroscience, 2012,224: 26-37.
[6] ZHENG V Z, WONG G K C. Neuroinflammation responses after subarachnoid hemorrhage: a review[J]. J Clin Neurosci, 2017,42: 7-11.
[7] SHI H T, JIANG Y Q, CAO H G, et al. Nomogram based on systemic immune-inflammation index to predict overall survival in gastric cancer patients[J]. Dis Markers, 2018,2018: 1787424.
[8] XIE Q K, CHEN P, HU W M, et al. The systemic immune-inflammation index is an independent predictor of survival for metastatic colorectal cancer and its association with the lymphocytic response to the tumor[J]. J Transl Med, 2018,16(1): 273.
[9] ZHANG W T, WANG R L, MA W C, et al. Systemic immune-inflammation index predicts prognosis of bladder cancer patients after radical cystectomy[J]. Ann Transl Med, 2019,7(18): 431.
[10] AL-MUFTI F, AMULURU K, DAMODARA N, et al. Admission neutrophil-lymphocyte ratio predicts delayed cerebral ischemia following aneurysmal subarachnoid hemorrhage[J]. J Neurointerv Surg, 2019,11(11): 1135-1140.
[11] TAO C Y, WANG J J, HU X, et al. Clinical value of neutrophil to lymphocyte and platelet to lymphocyte ratio after aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2017,26(3): 393-401.
[12] GIEDE-JEPPE A, REICHL J, SPRÜGEL M I, et al. Neutrophil-to-lymphocyte ratio as an independent predictor for unfavorable functional outcome in aneurysmal subarachnoid hemorrhage[J]. J Neurosurg, 2019,132(2): 400-407.
[13] KASIUS K M, FRIJNS C J, ALGRA A, et al. Association of platelet and leukocyte counts with delayed cerebral ischemia in aneurysmal subarachnoid hemorrhage[J]. Cerebrovasc Dis, 2010,29(6): 576-583.
[14] SEHBA F A, MOSTAFA G, FRIEDRICH V Jr, et al. Acute microvascular platelet aggregation after subarachnoid hemorrhage[J]. J Neurosurg, 2005,102(6): 1094-1100.
[15] FRONTERA J A, PROVENCIO J J, SEHBA F A, et al. The role of platelet activation and inflammation in early brain injury following subarachnoid hemorrhage[J]. Neurocrit Care, 2017,26(1): 48-57.
[16] FRIEDRICH V, FLORES R, SEHBA F A. Cell death starts early after subarachnoid hemorrhage[J]. Neurosci Lett, 2012,512(1): 6-11.
[17] PROVENCIO J J. Inflammation in subarachnoid hemorrhage and delayed deterioration associated with vasospasm: a review[J]. Acta Neurochir Suppl, 2013,115: 233-238.
[18] SARRAFZADEH A, SCHLENK F, MEISEL A, et al. Immunodepression after aneurysmal subarachnoid hemorrhage[J]. Stroke, 2011,42(1): 53-58.
[19] LUCKE-WOLD B P, LOGSDON A F, MANORANJAN B, et al. Aneurysmal subarachnoid hemorrhage and neuroinflammation: a comprehensive review[J]. Int J Mol Sci, 2016,17(4): 497.
[20] TERPOLILLI N A, BREM C, BÜHLER D, et al. Are we barking up the wrong vessels? cerebral microcirculation after subarachnoid hemorrhage[J]. Stroke, 2015,46(10): 3014-3019.
[21] ROMANO J G, RABINSTEIN A A, ARHEART K L, et al. Microemboli in aneurysmal subarachnoid hemorrhage[J]. J Neuroimaging, 2008,18(4): 396-401.