肺动静脉畸形(pulmonary arteriovenous malfo-rmation, PAVM)是发生在肺部的异常血管畸形,是肺动静脉间的直接沟通[1-3]。PAVM的发病率低,80%的PAVM是先天性疾病,与遗传性出血性毛细血管扩张症(hereditary haemorrhagic telangiectasia, HHT)相关[4-7]。大多数PAVM不会引起临床症状,少数会有低氧血症、脑梗、脑脓肿等症状[8-10];PAVM自发性破裂导致的咯血罕见,但是最致命[11]。
介入栓塞治疗作为PAVM的一线治疗手段,其安全性、有效性在之前研究中已经得到证实[12-13]。但在既往的报道中对于PAVM破裂这种严重并发症的治疗,目前多为个案报道[14],且治疗方法以内科保守治疗为主如静脉使用止血药物等。因此本研究目的在于,对PAVM破裂相关性咯血的患者的诊治进行分析,以期对这类患者的诊治流程提供最佳方案。
1 资料与方法
1.1 研究对象
选取自2016年9月—2019年12月内在同济大学附属上海市肺科医院就诊并经过胸部CT或胸部CT血管成像(computed tomography angiography, CTA)确诊为PAVM的240例患者。
入选标准:(1)患者均以咯血为首发临床症状,并排除因其他原因引起肺部出血;(2)无其他介入手术一般禁忌证(碘剂过敏、严重心、肺、肝、肾功能衰竭、凝血功能障碍,严重甲状腺功能亢进、全身重度感染或穿刺点局部感染、妊娠3个月以上者等);(3)患者及家属知情同意并接受介入治疗。
排除标准:(1)患者确诊PAVM,但经检查评估,是由于支气管动脉等体循环动脉引起的咯血;(2)有介入手术一般禁忌证;(3)不同意介入手术治疗。此期间共54例患者在我院接受介入治疗,共筛选出8例患者为研究对象。本研究中所有患者术前均知情同意,并签署手术同意书。
1.2 术前评估
术前询问病史,根据Curacao标准明确HHT的临床诊断(符合2个条件为临床疑似HHT,3个及以上为临床确诊HHT)[15]。PAVM的分型以CTA图像为依据,将PAVM分为单纯型和复杂型(单纯型PAVM定义为只有1个供血动脉,复杂型PAVM定义为拥有2个或2个以上供血动脉)[6,16]。此外,根据PAVM的位置和数量,还将其分为单侧单发型、单侧多发型、双侧多发型。所有患者均根据CTA进行手术计划的制订。术前常规记录患者血常规、动脉血气改变。
1.3 手术方法
常规仰卧位、双侧腹股沟区消毒铺巾后,应用1%利多卡因进行穿刺部位局部浸润麻醉,穿刺右侧股静脉后行改良Seldinger法置入5F血管鞘(日本泰尔茂公司)。用0.035~150cm超滑导丝(日本泰尔茂公司)引入4F猪尾造影导管(日本泰尔茂公司)行肺动脉造影,PAVM显影后,根据PAVM位置引入4F椎动脉导管(美国Cordis公司)送至瘤体近端肺段动脉主干内,之后利用2F微导管(日本朝日公司)超选择至责任血管后,定位于瘤体近端肺动脉分支1~1.5cm处,测量近端供血动脉的直径,选择大于近端动脉直径30%~50%的MircoNester弹簧圈(美国Cook公司)进行栓塞,每次送入1根微弹簧圈后,根据复造影结果,依次送入小规格MircoNester或Tornado微弹簧圈(美国Cook公司)行栓塞,直至瘤体不显影[17]。栓塞结束后复造影未见PAVM显影。遂拔管、撤鞘止血。
1.4 术后处理
术后平卧,穿刺点沙袋压迫止血6h,双下肢制动12h。术后予以3d静脉抗感染治疗及鼻导管吸氧(3L/min)。术后第2天复查血常规、动脉血气。
1.5 术后随访
所有患者术后均遵嘱进行随访复查。介入栓塞治疗后第1个月行胸部CTA检查,如第1次随访CTA未发现PAVM复发的证据,下次随访行胸部CT扫描。当PAVM复发或患者死亡时终止随访。
1.6 统计学处理
采用SPSS 19.0进行统计分析。所有数值型结果均以![]() 表示,采用配对样本t检验来比较手术前后的差异。P<0.05为差异有统计学意义。
表示,采用配对样本t检验来比较手术前后的差异。P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者的临床基本情况结果
自2016年9月—2019年12月在同济大学附属上海市肺科医院所有确诊PAVM的240例患者中,有54例接受了介入栓塞治疗;54例接受手术患者中,以咯血为首发症状的患者列为本次入组人群,并在对其影像学资料进行回顾性分析,将因为支气管动脉等体循环动脉引起的咯血患者排除在外。共计筛选出8例PAVM破裂相关性咯血的患者,基本资料如表1所示。PAVM自发破裂导致咯血患者占总体PAVM的3.33%。其中女性7例,男性1例,平均年龄(51.38±13.60)岁。6例被临床诊断为HHT。入院后检测示所有患者的氧分压、血氧饱和度、血红蛋白水平均低于正常水平,无严重炎症反应。87.5%的患者无基础疾病。
表1 破裂性PAVMs患者的基本情况
Tab.1 Baseline characteristics of patients with ruptured PAVMs
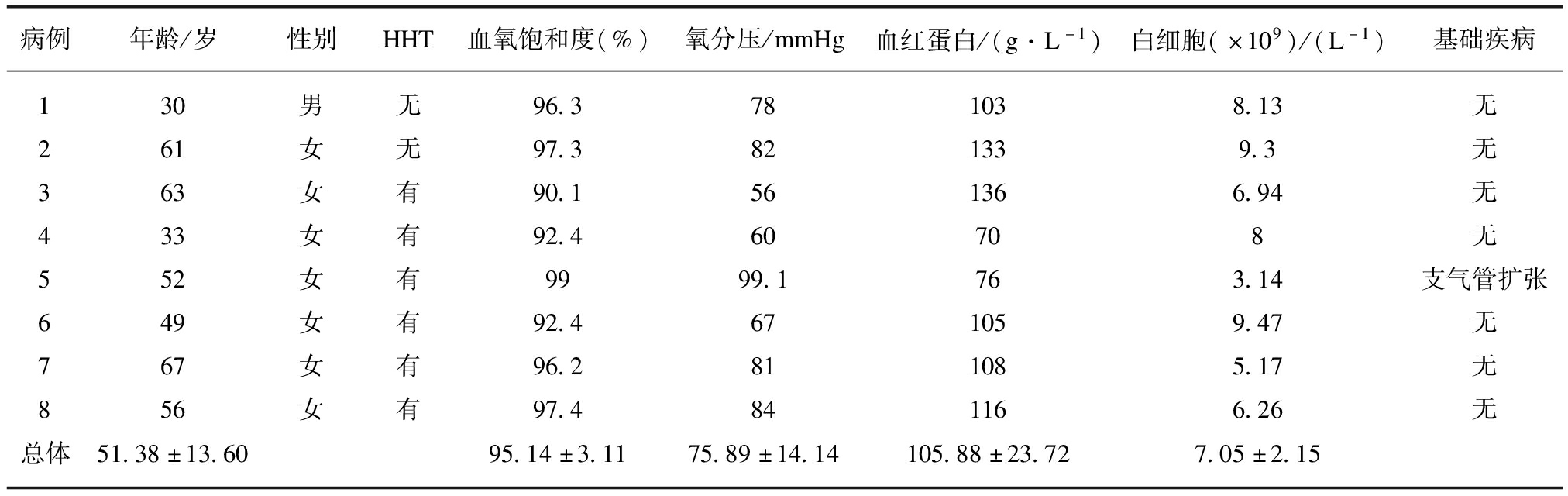
病例年龄/岁性别HHT血氧饱和度(%)氧分压/mmHg血红蛋白/(g·L-1)白细胞(×109)/(L-1)基础疾病130男无96.3781038.13无261女无97.3821339.3无363女有90.1561366.94无433女有92.460708无552女有9999.1763.14支气管扩张649女有92.4671059.47无767女有96.2811085.17无856女有97.4841166.26无总体51.38±13.6095.14±3.1175.89±14.14105.88±23.727.05±2.15
2.2 已确诊的PAVM的基本影像学特征
8例患者共检出13个病灶,其中单发型PAVM 5例,单侧多发型PAVM 1例,双侧多发性PAVM 2例,13个病灶中有10个为单纯型,3个为复杂型。7例PAVM位于肺胸膜下,4例PAVM于肺外周带1/3处,11例PAVM位于两肺中下肺叶,见表2。
表2 已诊断的PAVM特征
Tab.2 Characteristics of detected PAVM
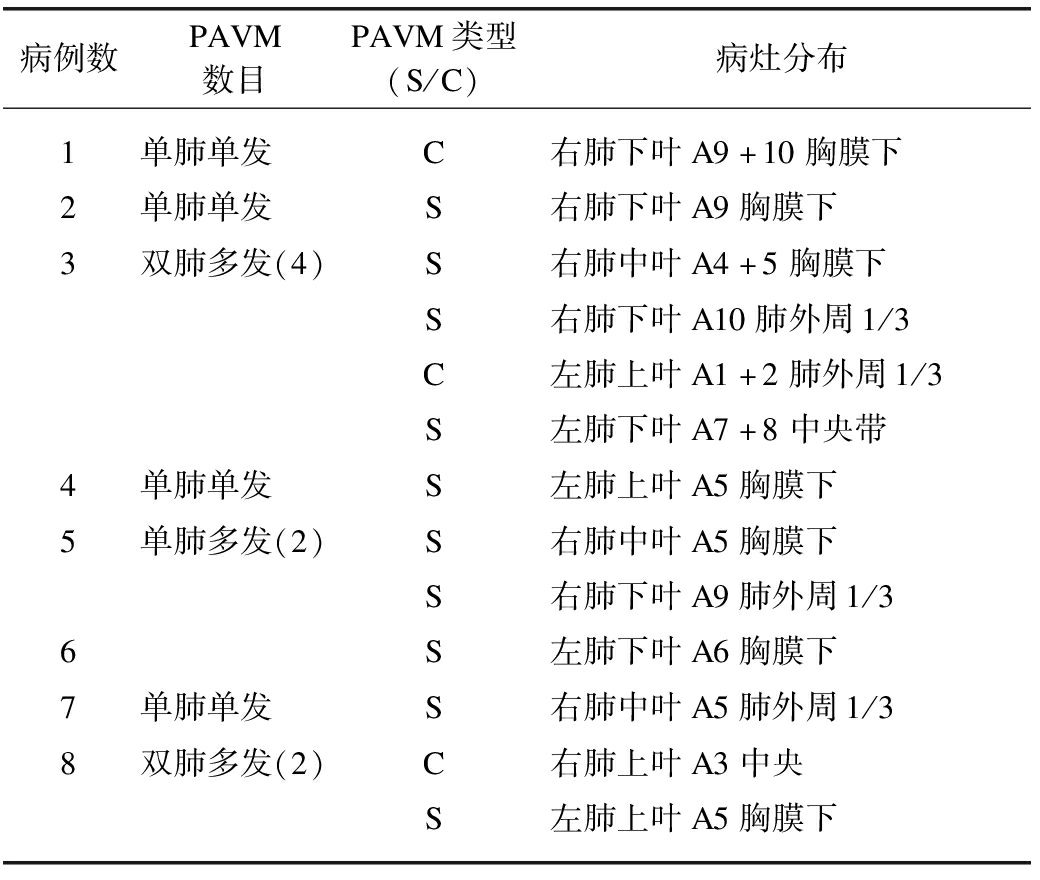
病例数PAVM数目PAVM类型(S/C)病灶分布1单肺单发C右肺下叶A9+10胸膜下2单肺单发S右肺下叶A9胸膜下3双肺多发(4)S右肺中叶A4+5胸膜下S右肺下叶A10肺外周1/3C左肺上叶A1+2肺外周1/3S左肺下叶A7+8中央带4单肺单发S左肺上叶A5胸膜下5单肺多发(2)S右肺中叶A5胸膜下S右肺下叶A9肺外周1/36S左肺下叶A6胸膜下7单肺单发S右肺中叶A5肺外周1/38双肺多发(2)C右肺上叶A3中央S左肺上叶A5胸膜下
S/C: 单纯型/复杂型;A1~10: 肺动脉分段
2.3 介入栓塞治疗的结果及术后随访分析
8例患者共计13处病变接受了介入栓塞治疗,介入栓塞成功率100%,栓塞材料根据术前CTA及术中造影结果选择合适尺寸的弹簧圈,见图1。所有患者围手术期均无并发症发生。
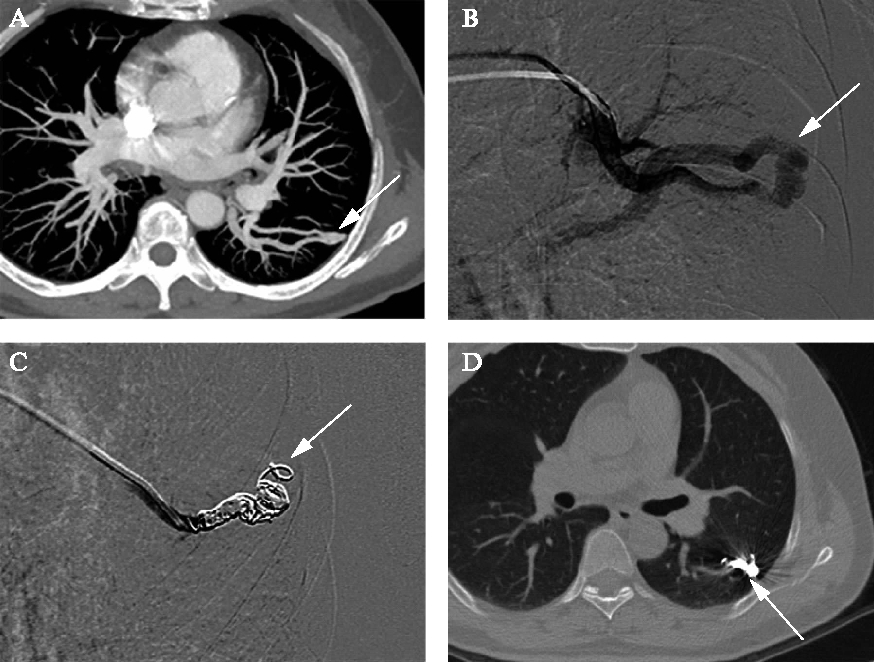
图1 PAVM的介入栓塞治疗
Fig.1 Transvascular embolization for PAVM
A: CTA确诊PAVM并进行定位,箭头处为确诊处定位;B、C: 术中造影确认并进行血管栓塞,箭头处为栓塞血管部位;D: 术后1个月复查示PAVM无复发,箭头处无术后残留
介入栓塞治疗后2d复查血常规、动脉血气。结果显示,治疗前后氧分压、血氧饱和度、血红蛋白、白细胞水平差异有统计学意义(P=0.025,P=0.003,P=0.022,P=0.017),见表3。术后平均住院时间为(3.86±1.48)d。
表3 患者术前与术后2天基本情况比较
Tab.3 Comparison of Baseline characteristics before and 2 days after embolization
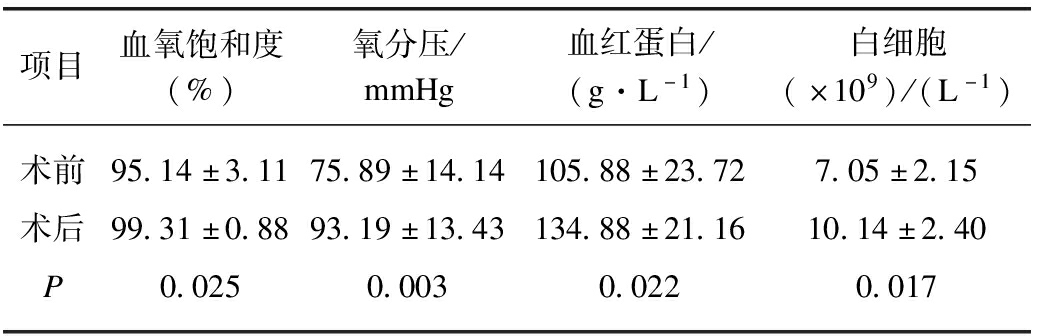
项目血氧饱和度(%)氧分压/mmHg血红蛋白/(g·L-1)白细胞(×109)/(L-1)术前95.14±3.1175.89±14.14105.88±23.727.05±2.15术后99.31±0.8893.19±13.43134.88±21.1610.14±2.40P0.0250.0030.0220.017
1mmHg=0.133kPa
术后患者平均随访时间(14.63±10.06)个月,随访期间均无PAVM复发,其中1例1年后死于心力衰竭,余7例患者均仍在随访中。
3 讨 论
PAVM为肺动静脉间异常的沟通,其一般性状稳定,多无明显临床症状,在早年的研究中,多是体检或是在诊治其他肺部疾病时经胸部X线检查偶然发现,PAVM是罕见病,其致命性出血性并发症更为罕见,Hodgson等[18]早间研究中PAVM发病率约为0.002%~0.003%。近些年来,以CT为主要诊断手段,PAVM的发病率逐年增长,上升到0.038%,这比之前认为的更为常见[7]。此外,少数患者会因为肺内持续的左向右持续分流出现低氧血症、脑梗、脑脓肿等并发症,但因为目前国内外对于PAVM的研究多在PAVM静止的情况下,PAVM自发破裂引起咯血症状的极为少见,目前多为个案报道[15]。因此对于PAVM及其并发症的诊治,应该引起临床医生的重视。
目前国内外没有大样本量的研究,因此本研究只能从医院的诊疗经验中进行总结以及论述。本研究是目前国内外PAVM自发破裂相关性咯血的最大的单中心回顾性分析研究。在本研究中,PAVM破裂的发生率为3.33%,低于之前学者的研究报告[6]。本研究认为这是由于CT的广泛使用提高了PAVM的发现概率。以往研究认为多数的PAVM发生与HHT相关,其中女性更为常见,这与本研究结果相一致,HHT患者、尤其女性HHT患者是发生PAVM自发破裂的重要危险因素[19]。因此,建议接诊咯血患者时,必须考虑到PAVM发生自发性破裂的情况,尤其是有明确HHT家族史的女性[20]。对于咯血患者,术前强烈建议完善CTA检查,有利于发现PAVM,有助于对病变进行分类并指导下一步的治疗[21-22]。对于病情不稳定的患者,也强烈建议在气管插管和气道保护后完善术前的CTA检查。
目前对于PAVM的治疗包括外科切除、介入栓塞治疗及保守治疗。一旦CTA检查明确诊断后,通常保守治疗效果不佳,即刻止血率较低;而由于出血性贫血、呼吸功能不全等情况,活动性大咯血的患者在外科手术过程中死亡率较高,因此推荐可急诊行介入栓塞治疗[12]。此外,急诊外科手术通常需要较长的准备时间,在此期间,PAVM可能再次破裂出血。相较之下,介入栓塞治疗仅需要局部麻醉,即使患者一般情况较差,在行气道保护及镇静后,手术仍可进行。另外,与急诊外科手术相比,介入栓塞治疗创伤小,可重复性高,即刻止血效果好,术后恢复快,手术并发症较少,在以前的研究中,已经是未破裂型PAVM的一线治疗方法。在此基础上,建议介入栓塞治疗也应该成为破裂性PAVM的最佳选择。
此外,在介入栓塞治疗过程中,本研究发现PAVM影像学表现具有一定的规律性。84.61%的病变位于两肺中下叶的外周带,这与之前的研究结果相一致[3]。虽然单纯型PAVM占绝大多数,但造影时要注意多支供血动脉发生的可能,以防栓塞时出现供血动脉遗漏,造成栓塞不完全引起术后复发。
另外,在造影时若发现多处PAVM病变,建议对所有符合条件的病变(供血动脉直径≥3mm)均进行栓塞[16,23]。目前关于PAVM栓塞后对肺动脉压的影响尚未有明确定论,是否会因为肺动脉压力变化诱发其他PAVM病变的自发破裂,目前尚不清楚。在本研究中,虽然未对肺动脉压力进行测定,但所有诊断为多发PAVM病变的患者,均对符合条件的病变进行了一次性栓塞治疗,术后并未出现呼吸困难、低氧血症等。因此,除了破裂的PAVM外,对所有符合条件的PAVM进行一次性栓塞治疗是安全可行的。
此外,8例患者在术前均出现不同程度的失血性贫血和低氧血症,术后发生不同程度的炎症反应。因此,术后予以适当的抗感染治疗及鼻导管吸氧是必不可少的。及时的介入栓塞治疗配合适当的支持治疗,可极大地促进患者的恢复。
虽然本研究是目前关于PAVM破裂相关性咯血的最大样本量的单中心回顾性分析研究,但研究存在一定的局限性。所有在本院确诊的240例PAVM患者并没有一一确认HHT家族史;而列入研究对象的8例患者均未进行HHT基因检测。此外,本研究并没有在栓塞前后对肺动脉压力的变化进行监测。
总结来说,当发生大咯血时,必须考虑到PAVM的急性自发性破裂情况的发生,特别是有明确家族HHT病史的女性患者。在治疗前,胸部的CTA检查是非常必要的,能帮助明确咯血病因,并指导下一步治疗方案。对于因PAVM急性自发破裂引起的大咯血,急诊行介入栓塞治疗应是最好选择。
[1] CARTIN-CEBA R, SWANSON K L, KROWKA M J.Pulmonary arteriovenous malformations[J].Chest, 2013,144(3): 1033-1044.
[2] SWANSON K L, PRAKASH U B S, STANSON A W.Pulmonary arteriovenous fistulas: mayo clinic experience, 1982—1997[J].Mayo Clin Proc, 1999,74(7): 671-680.
[3] WONG H H, CHAN R P, KLATT R, et al.Idiopathic pulmonary arteriovenous malformations: clinical and imaging characteristics[J].Eur Respir J, 2011,38(2): 368-375.
[4] COTTIN V, PLAUCHU H, BAYLE J Y, et al.Pulmonary arteriovenous malformations in patients with hereditary hemorrhagic telangiectasia[J].Am J Respir Crit Care Med, 2004,169(9): 994-1000.
[5] GUTTMACHER A E, MARCHUK D A, WHITE R I JR.Hereditary hemorrhagic telangiectasia[J].N Engl J Med, 1995,333(14): 918-924.
[6] FAUGHNAN M E, GRANTON J T, YOUNG L H.The pulmonary vascular complications of hereditary haemorrhagic telangiectasia[J].Eur Respir J, 2009,33(5): 1186-1194.
[7] SHOVLIN C L.Pulmonary arteriovenous malformations[J].Am J Respir Crit Care Med, 2014,190(11): 1217-1228.
[8] ROBERTSON R J, ROBERTSON I R.Pulmonary arteriovenous malformations[J].Thorax, 1995,50(7): 707-708.
[9] HOLZER R J, CUA C L.Pulmonary arteriovenous malformations and risk of stroke[J].Cardiol Clin, 2016,34(2): 241-246.
[10] ETIEVANT J, SI-MOHAMED S, VINUREL N, et al.Pulmonary arteriovenous malformations in hereditary haemorrhagic telangiectasia: Correlations between computed tomography findings and cerebral complications[J].Eur Radiol, 2018,28(3): 1338-1344.
[11] FERENCE B A, SHANNON T M, WHITE R I Jr, et al.Life-threatening pulmonary hemorrhage with pulmonary arteriovenous malformations and hereditary hemorrhagic telangiectasia[J].Chest, 1994,106(5): 1387-1390.
[12] NAGANO M, ICHINOSE J, SASABUCHI Y, et al.Surgery versus percutaneous transcatheter embolization for pulmonary arteriovenous malformation: Analysis of a national inpatient database in Japan[J].J Thorac Cardiovasc Surg, 2017,154(3): 1137-1143.
[13] REMY-JARDIN M, DUMONT P, BRILLET P Y, et al.Pulmonary arteriovenous malformations treated with embolotherapy: helical CT evaluation of long-term effectiveness after 2-21-year follow-up[J].Radiology, 2006,239(2): 576-585.
[14] LITZLER P Y, DOUVRIN F, BOUCHART F, et al.Combined endovascular and video-assisted thoracoscopic procedure for treatment of a ruptured pulmonary arteriovenous fistula: Case report and review of the literature[J].J Thorac Cardiovasc Surg, 2003,126(4): 1204-1207.
[15] KIM H J, LEE J S, OH Y M, et al.Clinical characteristics of pulmonary arteriovenous malformations in Koreans[J].Respirology, 2015,20(1): 155-159.
[16] WHITE R I Jr, POLLAK J S, WIRTH J A.Pulmonary arteriovenous malformations: diagnosis and transcatheter embolotherapy[J].J Vasc Interv Radiol, 1996,7(6): 787-804.
[17] CUSUMANO L R, DUCKWILER G R, ROBERTS D G, et al.Treatment of recurrent pulmonary arteriovenous malformations: comparison of proximal versus distal embolization technique[J].Cardiovasc Intervent Radiol, 2020,43(1): 29-36.
[18] HODGSON C H, KAYE R L.Pulmonary arteriovenous fistula and hereditary hemorrhagic telangiectasia: a review and report of 35 cases of fistula[J].Dis Chest, 1963,43: 449-455.
[19] VELTHUIS S, BUSCARINI E, MAGER J J, et al.Predicting the size of pulmonary arteriovenous malformations on chest computed tomography: a role for transthoracic contrast echocardiography[J].Eur Respir J, 2014,44(1): 150-159.
[20] KRITHARIS A, AL-SAMKARI H, KUTER D J.Hereditary hemorrhagic telangiectasia: diagnosis and management from the hematologist’s perspective[J].Haematologica, 2018,103(9): 1433-1443.
[21] WHITE R I Jr.Pulmonary arteriovenous malformations: how do we diagnose them and why is it important to do so?[J].Radiology, 1992,182(3): 633-635.
[22] DUTTON J A, JACKSON J E, HUGHES J M, et al.Pulmonary arteriovenous malformations: results of treatment with coil embolization in 53 patients[J].AJR Am J Roentgenol, 1995,165(5): 1119-1125.
[23] FAUGHNAN M E, PALDA V A, GARCIA-TSAO G, et al.International guidelines for the diagnosis and management of hereditary haemorrhagic telangiectasia[J].J Med Genet, 2011,48(2): 73-87.