我国泌尿系统肿瘤的发病率和病死率呈明显的上升趋势[1]。肾恶性肿瘤、膀胱恶性肿瘤等比较常见的泌尿系恶性肿瘤患者由于长期血尿,常常存在低蛋白血症、贫血和营养不良等状况,手术所带来的创伤和应激往往会使其加重,导致各种并发症的发生,对术后康复产生不利影响[2-3]。加速康复外科(enhanced recovery after surgery, ERAS)[4-5]是指为使患者快速康复,在围手术期采用一系列经循证医学证据证实有效的优化处理措施,以减轻患者心理和生理的创伤应激反应,从而减少并发症、缩短住院时间、降低住院费用、降低再入院风险及死亡风险。这些措施包括术前进行肠道准备、避免长时间禁食、有效镇痛、术后早期活动、早期经口进食等。ERAS在临床方面的研究多集中在胃肠道肿瘤,在泌尿系恶性肿瘤方面的研究仅处于起步阶段;且关于ERAS营养管理对机体营养状况和手术预后影响的研究为数甚少,大多数研究倾向于外科学或者护理学领域,国内目前缺乏营养学领域的在泌尿系恶性肿瘤患者中的应用研究[2-3],而营养管理也是ERAS实施过程中重要的组成部分。因此,本研究就ERAS中的营养管理在泌尿系恶性肿瘤中的应用进行探讨,分析这些措施对于泌尿系恶性肿瘤患者临床结局的影响,为ERAS及其营养管理在泌尿系恶性肿瘤患者围手术期的开展提供更多的理论依据。
1 资料与方法
1.1 研究对象
选择2017年12月—2018年4月在同济大学附属第十人民医院泌尿外科的住院患者作为研究对象,采用定点连续采样,纳入标准:(1)经病理确诊为泌尿系恶性肿瘤,且无远处转移;(2)拟行泌尿系恶性肿瘤切除术的择期患者;(3)空腹血糖正常,无原发性糖尿病、糖耐量受损及其他代谢性疾病者;(4)患者及家属知情并且同意。排除标准:(1)有严重视听障碍或认知障碍;(2)术前接受过放化疗或服用过其他影响代谢药物;(3)急诊手术患者;(4)伴有胃食管反流、胃排空障碍、幽门梗阻等胃肠道梗阻性疾病;(5)伴有严重的心、脑、肺、肝等脏器疾病;(6)已发生远处转移、复发肿瘤、多原发癌或并其他部位的肿瘤患者。
1.2 研究方法
1.2.1 分组 根据围手术期营养管理方法的不同采用ERAS围手术期营养管理的患者纳入实验组,采用传统围手术期营养管理的患者纳入对照组,见表1。
表1 实验组与对照组围手术期营养管理措施比较
Tab.1 Comparison of perioperative nutritional management between intervention group and control group

措施实验组(n=57)对照组(n=45)营养评估营养风险筛查和营养状况评估营养风险筛查和营养状况评估禁食禁水术前禁食6h、禁水2h术前禁食12h、禁水4h代谢准备术前10h口服12.6%麦芽糊精果糖混合溶液800mL,术前2h口服400mL无特殊准备术后进食术后当天即可饮水,逐渐过渡到流质或肠内营养及普食未强调,待排气后恢复饮食
1.2.2 观察指标 本研究观察指标包括一般资料、实验室检查、主观舒适度、康复及临床结局。一般资料包括年龄、性别、BMI、恶性肿瘤发生部位、营养风险筛查评分(nutritional risk screening 2002, NRS 2002)、患者主观整体营养评估(patient-generated subjective global assessment, PG-SGA)评分及营养支持情况。其中,NRS 2002≥3分存在营养风险,<3分1周后复筛;PG-SGA评分0~1分为营养良好,定性评估等级为A;2~8分为可疑或中度营养不良,定性评估等级为B;≥9分为重度营养不良,定性评估等级为C[6-7]。规范营养支持是指应用肠外和或肠内营养≥3d且每日非蛋白热量供20~30kcal/kg[8]。实验室检查包括白细胞(white blood cell, WBC)、血红蛋白(hemoglobin, HB)、淋巴细胞计数(lymphocyte count, LY)、C反应蛋白(C-reactive protein, CRP)、空腹血糖(fasting blood glucose, FBG)、血清白蛋白(serum albumin, ALB)、前白蛋白(prealbumin, PA)。主观舒适度采用视觉模拟评分法(visual analogue scale, VAS)对患者术前和术后24h内进行评价,包括饥饿感、口渴感、疼痛感和焦虑感。临床结局相关指标包括恢复进口进食时间、术后并发症发生率(胃肠道并发症、感染性并发症及泌尿系统并发症等)、疾病转归情况(痊愈、好转、不变、恶化和死亡)。
1.3 统计学处理
使用SPSS 21.0软件进行统计分析,计量资料用![]() 表示,符合正态分布的计量资料,组间比较采用两独立样本的t检验、组内比较采用配对t检验;非正态分布的计量资料,组间比较采用Wilcoxon Mann-Whitney U秩和检验、组内比较采用Wilcoxon符号秩和检验。等级资料采用Wilcoxon Mann-Whitney U秩和检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
表示,符合正态分布的计量资料,组间比较采用两独立样本的t检验、组内比较采用配对t检验;非正态分布的计量资料,组间比较采用Wilcoxon Mann-Whitney U秩和检验、组内比较采用Wilcoxon符号秩和检验。等级资料采用Wilcoxon Mann-Whitney U秩和检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本研究共纳入患者102例,实验组、对照组分别为57例、45例。实验组中膀胱恶性肿瘤39例,肾恶性肿瘤18例;对照组中膀胱恶性肿瘤34例,肾恶性肿瘤11例,结果显示组间差异无统计学意义(P>0.05),表明两组之间具有可比性。两组营养风险及重度营养不良发生率差异均无统计学意义(实验组: 35.10%、8.77%;对照组: 26.67%、15.56%)。实验组存在营养风险患者全部规范应用营养支持,对照组中有9例接受营养支持,占存在营养风险患者的75%,见表2。
表2 实验组与对照组一般资料比较
Tab.2 Comparison of general information of intervention group and control group
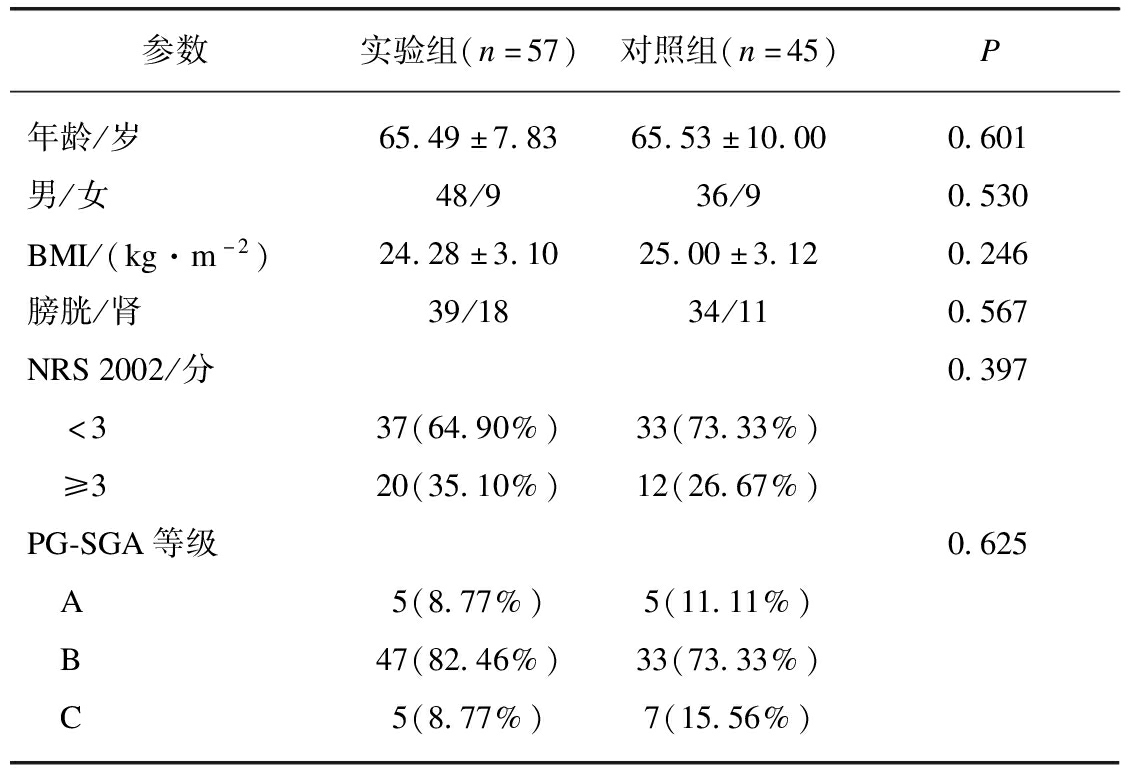
参数实验组(n=57)对照组(n=45)P年龄/岁65.49±7.8365.53±10.000.601男/女48/936/90.530BMI/(kg·m-2)24.28±3.1025.00±3.120.246膀胱/肾39/1834/110.567NRS2002/分0.397 <337(64.90%)33(73.33%) ≥320(35.10%)12(26.67%)PG-SGA等级0.625 A5(8.77%)5(11.11%) B47(82.46%)33(73.33%) C5(8.77%)7(15.56%)
2.2 术前术后实验室指标及主观舒适度指标
两组术后LY、HB、ALB、PA较术前显著下降,WBC、CRP和FBG较术前明显上升。与对照组相比实验组术后CRP水平及FBG水平明显降低、术后PA水平明显升高(P<0.05)。实验组术前及术后的口渴感明显低于对照组,(术前Z=-2.839,P=0.005,术后Z=-3.124,P=0.002)。与对照组相比实验组术前的焦虑感明显降低,见表3。
表3 实验组与对照组手术前后生化指标及主观舒适度指标比较
Tab.3 Comparison of biochemical indexes and subjective comfort indexes before and after operation in intervention group and control group
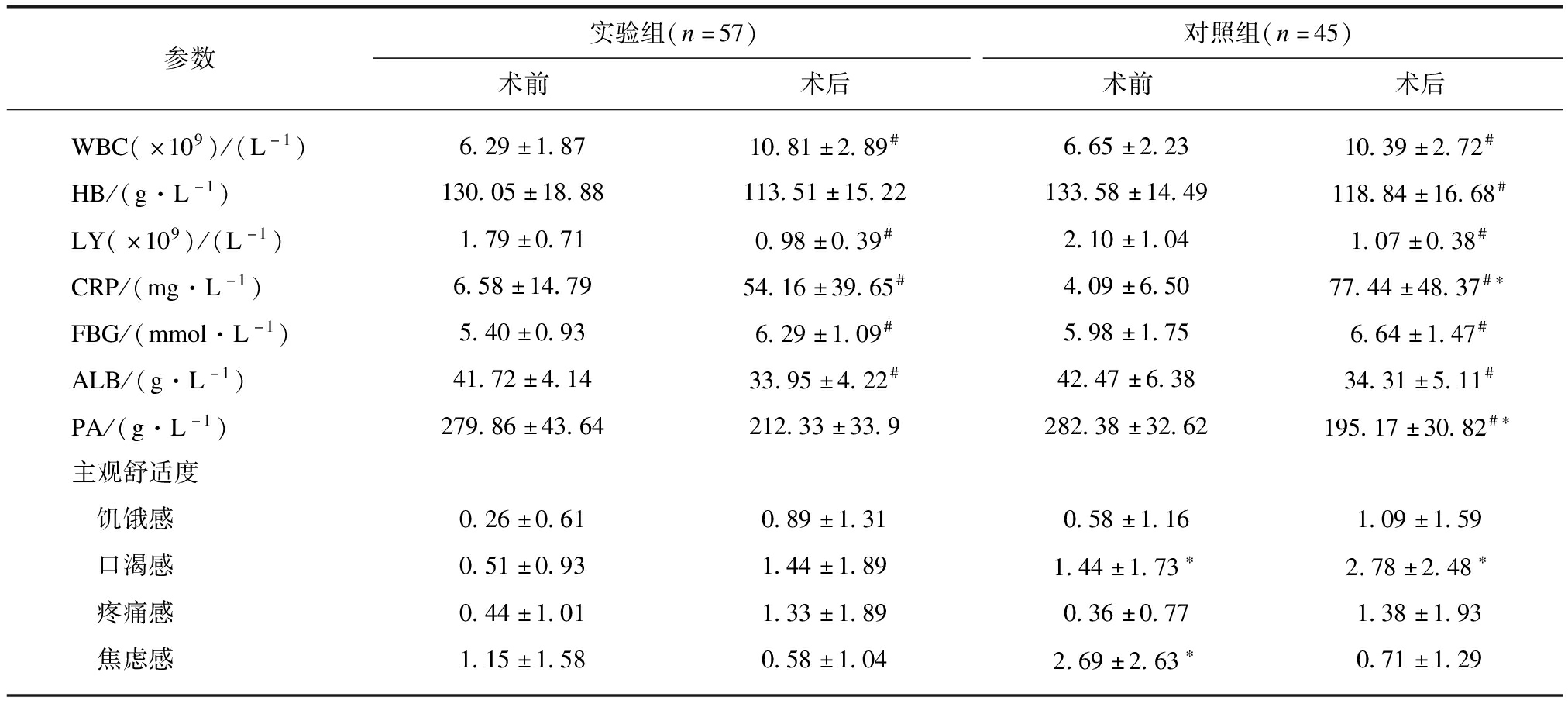
参数实验组(n=57)对照组(n=45)术前术后术前术后WBC(×109)/(L-1)6.29±1.8710.81±2.89#6.65±2.2310.39±2.72#HB/(g·L-1)130.05±18.88113.51±15.22133.58±14.49118.84±16.68#LY(×109)/(L-1)1.79±0.710.98±0.39#2.10±1.041.07±0.38#CRP/(mg·L-1)6.58±14.7954.16±39.65#4.09±6.5077.44±48.37#∗FBG/(mmol·L-1)5.40±0.936.29±1.09#5.98±1.756.64±1.47#ALB/(g·L-1)41.72±4.1433.95±4.22#42.47±6.3834.31±5.11#PA/(g·L-1)279.86±43.64212.33±33.9282.38±32.62195.17±30.82#∗主观舒适度 饥饿感0.26±0.610.89±1.310.58±1.161.09±1.59 口渴感0.51±0.931.44±1.891.44±1.73∗2.78±2.48∗ 疼痛感0.44±1.011.33±1.890.36±0.771.38±1.93 焦虑感1.15±1.580.58±1.042.69±2.63∗0.71±1.29
组内术后与术前比较,#P<0.05;对照组与实验组比较,*P<0.05
2.2 营养状况及康复相关指标
实验组术后恢复经口进食的时间明显早于对照组、疾病转归情况(痊愈和好转)明显优于对照组。术后并发症发生率实验组(10.5%)低于对照组(24.4%),其中两组各有3例患者出现胃肠道并发症。疾病转归实验组优于对照组(Z=-2.455,P=0.014),实验组、对照组痊愈率分为93.0%、75.6%。与对照组相比,实验组住院时间和住院费用虽无统计学差异,但呈下降趋势,见表4。
表4 实验组与对照组营养康复相关指标比较
Tab.4 Comparison of malnutrition rehabilitation-related indicators between intervention group and control group
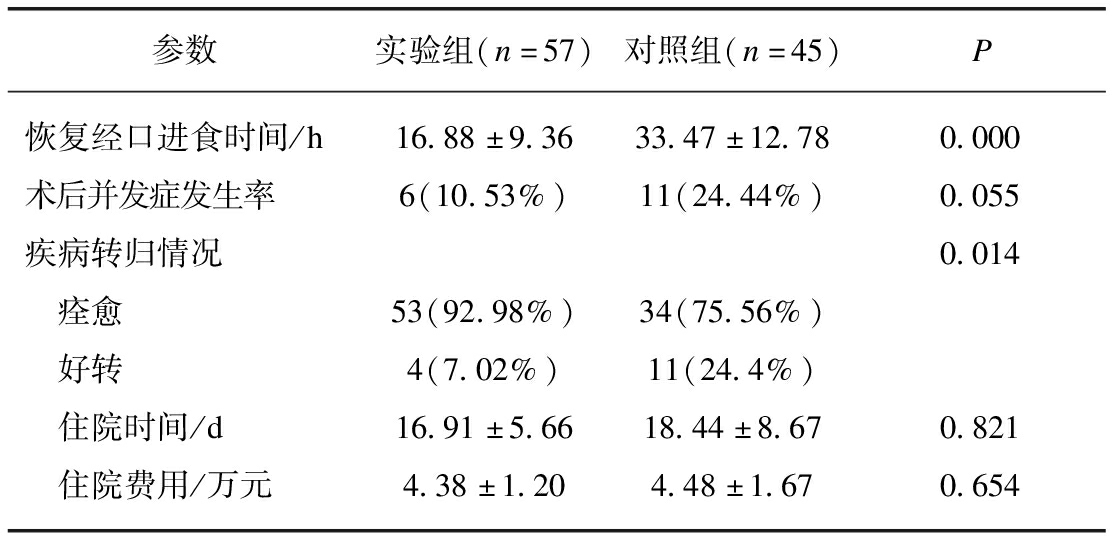
参数实验组(n=57)对照组(n=45)P恢复经口进食时间/h16.88±9.3633.47±12.780.000术后并发症发生率6(10.53%)11(24.44%)0.055疾病转归情况0.014 痊愈53(92.98%)34(75.56%) 好转4(7.02%)11(24.4%) 住院时间/d16.91±5.6618.44±8.670.821 住院费用/万元4.38±1.204.48±1.670.654
3 讨 论
营养不良是术后并发症的独立预后因素[9-10],及早筛查与改善营养不良是术前评估的重要内容,在促进快速康复方面具有重要意义。Thomas等[11]发现营养状况与手术预后存在着密切的相关性。采用PG-SGA对患者营养状况进行评估,本研究中91.23%的患者可能存在营养不良,其中重度营养不良者占8.77%。这与术后机体处于高分解代谢状态,对蛋白质和能量供应的需求急剧增加[12]有关,同时由于手术创伤的影响,蛋白质合成、利用障碍从而加重了患者的低蛋白血症,使得营养不良的状态更加严重。
ERAS的核心理念就是减少应激和创伤,尽可能使机体内在生理功能维持在稳定状态。长时间禁食会使机体处于代谢应激状态,可致胰岛素抵抗,还可能产生烦躁焦虑等负性情绪、术后肠麻痹时间延长、血流动力学紊乱或障碍、虚脱甚至休克[13]等不良影响。其中缩短患者术前禁食禁饮时间并口服碳水化合物是ERAS减少应激反应的重要措施。本研究发现无论是实验组还是对照组术后血糖水平均较术前有显著升高。这可能与手术导致应激激素如皮质醇和儿茶酚胺分泌过多,降低胰岛素敏感性;术中交感神经活性增高可同时降低胰岛素水平,促进生长激素和胰高血糖素分泌,患者易出现应激性高血糖。目前已有研究[14]表明术前口服碳水化合物可以刺激胰岛素释放,促进β细胞分泌胰岛素并改善胰岛素敏感性,减轻术后的分解代谢,改善机体氮平衡,减少术后瘦组织群丢失,从而改善胰岛素抵抗,并且能明显降低术后的血糖水平[15]。本研究结果与前述机制相符,缩短禁食时间后实验组术后的血糖水平较对照组呈下降趋势,这也间接表明术前补充碳水化合物可以降低胰岛素抵抗,降低术后高血糖的发生。
血浆急性相蛋白往往在术后升高,如损伤持续存在,血浆急性相蛋白可维持在较高水平,监测血浆急性相蛋白的水平有助于预后判断。两组术后C反应蛋白水平较术前均显著升高,实验组术后升高程度显著低于对照组,这同样证实了术后机体易呈现应激状态,术前缩短禁食时间可改善机体术后的应激状态。有关术前口服葡萄糖水对患者术后血清白蛋白影响的研究[16]发现,实验组与对照组术后ALB水平较术前均有不同程度的下降,而实验组患者术后ALB高于对照组,表明术前口服碳水化合物一定程度上能改善患者的营养状态。本研究发现,两组术后HB、ALB和PA均较术前呈下降趋势,这也间接证实了手术易导致机体分解代谢增强。由于PA半衰期短,对营养状况变化十分敏感,当营养状态得到改善时,PA浓度能迅速增高,较白蛋白更能及时反映机体的营养状况。本研究中,实验组术后PA浓度下降程度显著优于对照组,表明ERAS营养管理在一定程度上能使患者的营养状况在短期内得到改善。
泌尿系恶性肿瘤手术患者术前存在一定的焦虑、抑郁,而长时间禁食所带来的饥饿和口渴则会加重患者的焦虑感[17],焦虑是手术患者最常见的应激反应之一[18]。本研究发现与对照组相比,实验组术前及术后口渴感和术前焦虑感明显降低。减轻患者术前口渴感和焦虑感是术前口服碳水化合物的作用,而术后口渴感的改善则要归功于术后早期经口进食。人体的口渴中枢位于下丘脑,当患者术前处于长时间禁食禁饮的状态下时,细胞外液的渗透压升高,刺激下丘脑视上核等处的渗透压感受器和侧面的口渴中枢,反射性地引起口渴感觉,提示机体去补充水分[14]。所以,术前口服碳水化合物溶液能调节血浆渗透压,从而减轻患者术前的口渴感。ERAS鼓励患者术后尽早恢复进食进水,通过液体量的补充来缓解术后口渴感。术前口服碳水化合物能有效改善患者术前体内糖分的储备状态,并反馈地影响下丘脑对焦虑情绪的调节,缓解焦虑[19-20]。以上可能是术前口服碳水化合物能改善术前口渴感和焦虑感、及术后口渴感的原因。
本研究实验组术后恢复经口进食时间显著短于对照组,但并没有增加并发症发生率,对住院时间及住院费用未产生明显影响。且本研究实验组患者的疾病转归优于对照组。可能是术前口服碳水化合物、术后早期经口进食和围手术期营养支持共同作用的结果。这些措施一方面减轻患者术后的应激反应,改善机体内环境状态,另一方面,患者的营养状况也得到改善,利于患者术后康复和疾病治疗。
综上所述,加速康复外科中的营养管理对于泌尿系恶性肿瘤患者而言能减少手术造成的应激反应,利于改善术后营养状况及疾病转归,从而促进康复。然而本研究在样本量、监测指标的选择上有所局限,今后还需扩大样本量进行深入的研究,以探讨营养管理作为ERAS实施过程中的重要环节在临床应用中的重要意义。
[1] 张永贞,杨国庆,张思维,等.中国2009年肾及泌尿系统其他癌发病和死亡分析[J].中国肿瘤,2013,22(5): 333-337.
[2] 唐朝朋,徐振宇,周文泉.加速康复外科结合腹腔镜技术在泌尿外科应用的现状与展望[J].医学综述,2013,19(13): 2418-2421.
[3] 刘念,刘川,胡自力,等.快速康复外科理念在前列腺癌根治术围手术期中应用的meta分析[J].科学咨询(科技·管理),2019,10(4): 41-45.
[4] 赵玉沛,李宁,杨尹默,等.中国加速康复外科围手术期管理专家共识(2016)[J].中华外科杂志,2016,54(6): 413-418.
[5] KEHLET H.Future perspectives and research initiatives in fast-track surgery[J].Langenbecks Arch Surg, 2006,391(5): 495-498.
[6] KONDRUP J, ALLISON S P, ELIA M, et al.ESPEN guidelines for nutrition screening 2002[J].Clin Nutr, 2003,22(4): 415-421.
[7] 李涛,吕家华,郎锦义,等.恶性肿瘤放疗患者营养治疗专家共识[J].肿瘤代谢与营养电子杂志,2018,5(4): 358-365.
[8] SINGER P, BLASER A R, BERGER M M, et al.ESPEN guideline on clinical nutrition in the intensive care unit[J].Clin Nutr, 2019,38(1): 48-79.
[9] ZHONG J X, KANG K, SHU X L.Effect of nutritional support on clinical outcomes in perioperative malnourished patients: a meta-analysis[J].Asia Pac J Clin Nutr, 2015,24(3): 367-378.
[10] 吴国豪.恶性肿瘤患者营养不良的原因及防治对策[J].中华胃肠外科杂志,2010,13(3): 170-172.
[11] THOMAS M N, KUFELDT J, KISSER U, et al.Effects of malnutrition on complication rates, length of hospital stay, and revenue in elective surgical patients in the G-DRG-system[J].Nutrition, 2016,32(2): 249-254.
[12] JIE B, JIANG Z M, NOLAN M T, et al.Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk[J].Nutrition, 2012,28(10): 1022-1027.
[13] 唐朝朋,徐振宇,高建平,等.加速康复外科在腹腔镜肾癌根治术中应用的安全性及有效性研究[J].腹腔镜外科杂志,2012,17(12): 935-939.
[14] 秦薇,江烂林,张丰,等.术前口服碳水化合物对胃肠道肿瘤手术后胰岛素抵抗及应激反应的研究[J].护士进修杂志,2017,32(23): 2119-2122.
[15] 王治国.浅谈加速康复外科模式下术前口服碳水化合物在结直肠外科中的应用及可能机制[J].中华结直肠疾病电子杂志,2017,6(0): 15-20.
[16] 李强.术前2h进食葡萄糖水对腹腔镜结直肠癌手术患者快速康复的影响[D].福州: 福建中医药大学,2015: 1-21.
[17] DALAL K S, RAJWADE D, SUCHAK R.“Nil per oral after midnight”: Is it necessary for clear fluids?[J].Indian J Anaesth, 2010,54(5): 445-447.
[18] 钟丽君,黄燕波,路潜.泌尿系肿瘤病人术前疾病不确定感与焦虑抑郁的相关性研究[J].全科护理,2017,15(12): 1426-1428.
[19] 刘蕊,田梅梅,尹小兵,等.基于快速康复外科理念的多学科协作模式缩短髋膝关节置换术前禁食时间的应用研究[J].同济大学学报(医学版),2017,38(3): 98-102,107.
[20] LÖBNER M, LUPPA M, MATSCHINGER H, et al.The course of depression and anxiety in patients undergoing disc surgery: a longitudinal observational study[J].J Psychosom Res, 2012,72(3): 185-194.