溃疡性结肠炎(ulcerative colitis, UC)是一种结、直肠的慢性非特异性炎症。普遍认为UC与多种因素有关,如生活方式、饮食、抗生素使用、遗传背景和免疫因素,其中一些因素可能影响肠道微生物群的组成[1-2]。UC患者均存在肠壁黏膜完整性受损,肠黏膜屏障通透性增加及肠道微生物在其发病中起了重要作用[3]。溃疡性结肠炎的治疗在于调整肠道菌群,修复损伤的肠黏膜,下调过度活化的免疫反应。美沙拉嗪是治疗UC的主要药物,在中、重度UC患者中,同时使用糖皮质激素诱导缓解,然而,相当多的患者出现激素抵抗或依赖[4]。尽管与传统疗法相比,生物制剂及免疫抑制剂能提高缓解率,但生物制剂价格昂贵,免疫抑制剂可导致严重不良事件,需要密切随访,很多患者不能耐受。近年来,人们对益生菌治疗UC的有效性给予了相当大的关注,益生菌联合传统药物治疗活动性UC患者被认为是安全有效的。酪酸梭菌作为益生菌已安全使用多年,本研究使用酪酸梭菌联合传统药物治疗轻、中度UC患者,观察联合用药对肠黏膜屏障功能的影响以及对临床疗效的作用。
1 资料与方法
1.1 研究对象
选择2017年1月—2018年12月同济大学附属第十人民医院门诊及病房收治的溃疡性结肠炎患者92例,诊断符合我国中华医学会消化病学分会2012年制定的炎症性肠病诊治专家共识意见中的标准[5]。纳入标准:年龄18~ 75岁;确诊为轻、中度活动期UC患者;无胃肠道梗阻症状及大出血症状;女性患者无妊娠计划及严格避孕。排除标准:1个月内使用抗生素或肠道益生菌制剂;有肠道手术史及肿瘤史;存在肝肾功能严重受损;哺乳期及妊娠期女性;对美沙拉嗪、酪酸梭菌及泼尼松过敏者。剔除标准:出现其他疾病需要使用其他药物的;不能完成随访者。研究获得所有患者同意,并通过医院伦理委员会同意(SHSY-IEC-3.0/16-55/01)。
1.2 用药方法
将92例UC患者根据门诊病例号大小顺序编号,随机分为观察组和对照组,各46例。两组患者均给予传统治疗:活动期UC患者口服美沙拉嗪片(德国福克制药股份有限公司,0.5g/片,注册证号H20150124)1.0g,4次/d;部分中度活动期UC患者同时每日口服泼尼松0.75mg/kg,1周后泼尼松每周减5mg,15mg/d后每2周减5mg直至结束。观察组在此基础上联合口服酪酸梭菌(日本米雅利桑制药株式会社,0.1g/片,注册证号S20140080)0.2g/次,3次/d。疗程均为12周。
1.3 观察内容
分别收集患者治疗前、治疗后6周、治疗后12周的血常规、肝肾功能、C反应蛋白、大便常规报告及肠屏障功能检测报告(血浆D-乳酸及血清内毒素指标);分别于治疗前、治疗后12周检查电子结肠镜,常规取肠黏膜活组织送病理检查。肠镜下评分有2位有经验内镜操作医师共同完成,病理评分由2位病理专业医师同时完成。
1.4 血浆D-乳酸浓度测定
清晨抽取患者治疗前后空腹外周静脉血3mL,肝素抗凝并离心(离心半径10cm,1000r/min,10min),-20℃储存待测。D-乳酸检测采用改良酶学分光光度法。
1.5 血清内毒素浓度测定
于清晨抽取患者治疗前后空腹外周静脉血3mL 离心(离心半径10cm,3000r/min,5min),分离血清,采用鲎试剂偶氮显色定量法检测血清内毒素浓度。
1.6 疗效判断标准
采用2012年及2018年炎症性肠病诊断与治疗的共识意见[5-6],改良Mayo评分评价疾病活动严重程度。临床疗效判断:缓解,指临床症状消失,结肠镜检查见黏膜大致正常;有效,指临床症状基本消失,结肠镜检查见轻度黏膜炎症或炎性息肉;无效,指临床症状未消失,结肠镜检查无改善[6]。总有效例数= 缓解例数+有效例数。UC内镜下评分采用血管纹理(0~2分)、出血(0~3分)、糜烂和溃疡(0~3分)4个变量总和的UCEIS评分标准[7],内镜病理评分使用隐窝(0~3分)、肠上皮细胞(0~3分)、嗜中性粒细胞(0~3分)、单核细胞(0~3分)4个变量总和来评价[8]。
1.7 不良反应
评价两组患者治疗前后出现恶心呕吐、腹泻、皮疹、头晕等不良反应。
1.8 统计学处理
使用SPSS 17.0软件进行统计学分析。计量资料以![]() 表示,组间比较用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
表示,组间比较用t检验,计数资料采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料比较
92例患者中共有82例患者完成试验,剔除10例患者(治疗过程中两组患者各有4例因加用其他药物剔除试验,另外再剔除对照组中有2例未如期复查肠镜患者)。观察组42名,年龄18~72岁;对照组40例,年龄18~70岁。其中初发型52例,慢性复发型30例;直肠型(E1)26例,左半结肠型(E2)39例,广泛结肠型(E3)17例。两组在疾病类型、活动度及治疗药物等一般资料比较差距无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者一般资料比较
Tab.1 Comparison of general information between the two groups ![]()

参数观察组(n=42)对照组(n=40)t/χ2P年龄/岁36.8±13.339.4±14.2t=0.8561>0.05性别 男2425 女1815χ2=0.2445>0.05临床类型 初发型2626 慢性复发型1614χ2=0.8460>0.05疾病严重程度 轻2726 中1514χ2=0.0046>0.05病变范围 E11412 E22019 E389χ2=0.1892>0.05治疗药物 美沙拉嗪3026 美沙拉嗪+ 泼尼松1214χ2=0.3910>0.05
2.2 两组患者治疗前后血浆D-乳酸浓度比较
治疗前观察组[(6.69±1.14)μg/mL]和对照组[(7.15±1.12)μg/mL]患者的D-乳酸水平比较,差异无统计学意义(P>0.05),两组患者治疗后D-乳酸水平均逐渐下降,治疗后6周观察组为(4.64±1.09)μg/mL,对照组为(4.38±2.31)μg/mL,两组D-乳酸水平均比治疗前有明显下降(P<0.01),但观察组和对照组之间差异无统计学意义(P>0.05)。经12周治疗后,两组患者D-乳酸水平持续降低,观察组[(3.98±0.54)μg/mL]和对照组[(4.22±0.47)μg/mL]组相比,差异有统计学意义(P<0.05),观察组D-乳酸水平较对照组更低,见表2。
表2 两组患者治疗前后血浆D-乳酸浓度比较
Tab.2 The difference of plasma D-lactate concentration in two groups before and after treatment (μg/mL)

组别n治疗前治疗后6周治疗后12周观察组426.69±1.144.64±1.09∗3.98±0.54∗#对照组407.15±1.124.38±2.31∗4.22±0.47∗
与对照组比较,#P<0.01;与治疗前比较,*P<0.05
2.3 两组患者治疗前后血清内毒素水平比较
治疗前,观察组和治疗组患者的血清内毒素差异无统计学意义[(0.241±0.35)vs(0.239±0.42)μg/mL,P>0.05]。治疗后6周,两组患者血清内毒素均有下降,其中观察组血清内毒素下降明显(P<0.05)。治疗后12周,与治疗前相比,两组患者血清内毒素均有明显变化(P<0.05),而且观察组与对照组差异有统计学意义[(0.016±0.15)vs(0.099±0.22)μg/mL,P<0.05)],见表3。
表3 两组患者治疗前后血清内毒素浓度比较
Tab.3 Serum endotoxin concentration in two groups before and after treatment (μg/mL)

组别n治疗前治疗后6周治疗后12周观察组420.241±0.350.100±0.15∗0.016±0.15∗#对照组400.239±0.420.194±0.260.099±0.22∗
与对照组比较,#P<0.05;与治疗前比较,*P<0.05
2.4 两组患者治疗前后活动指数评分比较
治疗前观察组及对照组Mayo评分分别为(7.08±2.41)、(6.92±2.08)分,两组差异无统计学意义(P>0.05)。经12周治疗后,观察组及对照组Mayo评分均明显下降[(2.45±1.94)、(3.67±2.15)分,P<0.01],但联合治疗的观察组比传统药物治疗组能更有效抑制疾病活动度(P<0.05),见表4。
表4 治疗前后两组患者评分的比较
Tab.4 Comparison of the scores of the two groups before and after treatment

组别nUCEIS评分病理评分Mayo评分治疗前治疗后治疗前治疗后治疗前治疗后观察组426.21±0.373.82±0.91∗#9.02±1.255.49±1.61∗#7.08±2.412.45±1.94∗#对照组406.07±0.484.21±0.81∗8.92±1.236.43±1.76∗6.92±2.083.67±2.15∗
与对照组比较,#P<0.05;与治疗前比较,*P<0.01
2.5 两组患者的内镜下病变严重度及病理评分比较
观察组和对照组治疗前的UCEIS评分分别为(6.21±0.37)、(6.07±0.48)分,两者比较差异无统计学意义(P>0.05),经治疗12周后,两组的UCEIS评分均显著下降[(3.82±0.91)、(4.21±0.81)分,P<0.01]。两组患者治疗前的病理评分分别为(9.02±1.25)、(8.92±1.2)分,两组相比差异无统计学意义(P>0.05),12周治疗后,两组病理评分均显著下降[(5.49±1.61)、(6.43±1.76)分,P<0.01],但观察组内镜评分及病理评分均比对照组降低的更明显(P<0.05),见表4。图1可见活动期及缓解期溃疡性结肠炎患者结肠镜下表现及评分。

图1 观察组溃疡性结肠炎患者治疗前后结肠镜下表现
Fig.1 Colonoscopic manifestations of the treatment group before and after treatment
治疗前UC患者活动期结肠镜下表现,UCEIS为5分;治疗后UC患者缓解期结肠镜下表现,UCEIS为0分
2.6 两组患者的临床疗效比较
经过12周治疗后,观察组总有效例数为39例,其中缓解例数18例、有效例数21例;而对照组的总有效例数为31例,其中缓解16例、有效15例,见表5。联合用药组的总有效例数明显高于传统用药组(χ2=3.868,P<0.05)。
表5 治疗后两组患者临床疗效比较
Tab.5 Comparison of clinical efficacy between the two groups

疗效观察组对照组χ2P总有效例数39(92.9%)31(77.5%) 缓解18(42.9%)16(40.0%) 有效21(50.0%)15(37.5%)无效例数3(7.1%)9(22.5%)3.8680.0492
2.7 两组患者治疗后发生不良反应的比较
两组患者治疗后,常见不良反应为:恶心呕吐、皮疹、头晕及白细胞下降,观察组及对照组不良反应发生率分别为9.5%及7.5%,两者比较差异无统计学意义(χ2=0.1075,P>0.05),见表6。
表6 治疗后两组患者发生不良反应比较
Tab.6 Comparison of adverse reactions between two groups after treatment

组别发生不良反应人数未发生不良反应人数观察组438对照组337
3 讨 论
研究表明,细菌组成的失衡会引起炎症前免疫反应,并在宿主体内诱发炎症性疾病[9-10]。微生物稳态失衡在炎症性肠病的发生、发展中起着重要的作用[11],共生菌与潜在致病性微生物之间发生菌群失调,如侵袭性的菌群增加和保护菌的减少[12-14]。研究表明,UC患者中乳酸杆菌、双歧杆菌等正常菌群数量下降[15],梭状芽孢杆菌簇Ⅳ和ⅩⅣa在炎症性肠病患者中的含量明显低于健康个体[16]。肠道菌群是肠黏膜生物屏障的重要组成部分,因此维持肠道微生态的平衡是治疗UC的重要手段,当益生菌数量显著降低时,可外源性补充益生菌,或者促进原有益生菌增殖。从而恢复肠黏膜生物屏障,改善肠黏膜膜通透性[17]。
本研究使用的酪酸梭菌(商品名:米雅),主要成分是酪酸梭菌MIYAIRI 588(CBM 588)菌株,最早用于临床治疗顽固性腹泻和抗生素相关性结肠炎的革兰阳性杆状专性厌氧菌。与艰难梭菌、产气梭菌和肉毒梭菌等致病性梭菌不同,CBM588是非致病性的,可以在不受消化液影响的情况下到达肠道中的目标位置,并在该处广泛生长、增殖并最终产生短链脂肪酸,如乙酸和丁酸等,通过降低肠腔pH值而起到抑制肠道内致病细菌生长的作用[18],同时,可增加有益菌的水平,尤其是双歧杆菌和乳酸杆菌[19],改善肠黏膜生物屏障。此外,CBM产生的短链脂肪酸,具有对肠黏膜上皮的增殖作用和抗炎作用[20],也可以改善肠黏膜的机械屏障。
治疗UC的传统药物美沙拉嗪属于氨基水杨酸药物,常用于治疗轻、中度UC患者,通过抑制前列腺素和炎症因子的产生[21],从而减轻黏膜炎症反应,但部分患者效果不佳,而糖皮质激素反复使用副反应大,且不能用于维持治疗。本研究在传统药物基础上联合酪酸梭菌治疗UC患者,观察了其临床疗效及对肠黏膜屏障的作用。研究中检测的血浆D-乳酸、血清内毒素均能在一定程度上评估肠道通透性及肠道黏膜屏障功能[22]。内毒素是革兰氏阴性细菌细胞壁上的脂多糖(1ipopolysaccharide,LPS)成分,在细菌裂解或黏附在其他细胞上时LPS被释放出来,肠黏膜屏障完整时,LPS仅微量吸收入人体循环[23-24]。当肠道菌群失调,致病菌增加,肠屏障受损,通透性增加时,革兰氏阴性致病菌及其产生的内毒素被吸收入血,使得血液中内毒素水平增高,因此活动期UC患者血液中内毒素水平可作为评价UC严重程度的一种炎性因子。血浆D-乳酸也是评价肠道完整性的一个指标,其主要由肠道多种细菌发酵代谢而来,正常上皮对其吸收极少,当肠功能受损时可透过肠黏膜屏障大量进人循环血,因此检测血浆中的D-乳酸水平也可反映肠屏障功能[25]。
本研究中加用酪酸梭菌的观察组经治疗后患者的肠黏膜通透性指标无论是血清内毒素水平还是血浆D-乳酸水平的改善情况均优于对照组患者,表明酪酸梭菌作为肠道益生菌能够保护肠黏膜,改善肠黏膜屏障,与国外报道的益生菌能够提高肠上皮屏障功能,降低肠壁通透性,减轻疾病的严重程度相符[26-27]。研究发现益生菌除了能促进肠黏膜上皮细胞分泌黏液,还能增强肠上皮细胞间的紧密连接。另外,接受酪酸梭菌联合传统药物治疗的UC观察组比单用传统药物的对照组能更有效改善患者临床活动指数及内镜和病理评分,同时,联合治疗也提高了UC患者的临床有效率,说明酪酸梭菌能增强传统药物对肠道炎症反应的抑制作用。而且,两组不良反应发生率差异无明显统计学意义,更说明酪酸梭菌治疗UC患者是安全、有效的,不良反应的发生与酪酸梭菌无明显因果关系。
总之,酪酸梭菌联合传统药物能有效抵抗致病菌对肠黏膜屏障的损伤,抑制肠道炎症,修复肠黏膜屏障功能,从而改善UC患者的临床症状,促进内镜下黏膜的愈合,为临床治疗提供新的策略。
[1] SHEEHAN D, MORAN C, SHANAHAN F.The microbiota in inflammatory bowel disease[J].J Gastroenterol, 2015,50(5): 495-507.
[2] GOLDSMITH J R, SARTOR R B.The role of diet on intestinal microbiota metabolism: downstream impacts on host immune function and health, and therapeutic implications[J].J Gastroenterol, 2014,49(5): 785-798.
[3] WEBER C R, TURNER J R.Inflammatory bowel disease: is it really just another break in the wall?[J].Gut, 2007,56(1): 6-8.
[4] 汪海潮,叶晨,王晓蕾.难治性中重度溃疡性结肠炎的生物制剂治疗研究进展[J].同济大学学报(医学版),2020,41(1): 136-140.
[5] 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].胃肠病学,2012,17(12): 763-781.
[6] 吴开春,梁洁,冉志华,等.炎症性肠病诊断与治疗的共识意见(2018年·北京)[J].中国实用内科杂志,2018,38(9): 796-812.
[7] TRAVIS S P, SCHNELL D, KRZESKI P, et al.Reliability and initial validation of the ulcerative colitis endoscopic index of severity[J].Gastroenterology, 2013, 145(5): 987-995.
[8] NIKOLAUS S, SCHREIBER S.Diagnostics of inflammatory bowel disease[J].Gastroenterology, 2007,133(5): 1670-1689.
[9] GARRETT W S, LORD G M, PUNIT S, et al.Communicable ulcerative colitis induced by T-bet deficiency in the innate immune system[J].Cell, 2007,131(1): 33-45.
[10] ELINAV E, STROWIG T, KAU A L, et al.NLRP6 inflammasome regulates colonic microbial ecology and risk for colitis[J].Cell, 2011,145(5): 745-757.
[11] SOKOL H, LEDUCQ V, ASCHARD H, et al.Fungal microbiota dysbiosis in IBD[J].Gut, 2017,66(6): 1039-1048.
[12] KOSTIC A D, XAVIER R J, GEVERS D.The microbiome in inflammatory bowel disease: current status and the future ahead[J].Gastroenterology, 2014,146(6): 1489-1499.
[13] BECKER C, NEURATH M F, WIRTZ S.The intestinal microbiota in inflammatory bowel disease[J].ILAR J, 2015,56(2): 192-204.
[14] FORBES J D, VAN DOMSELAAR G, BERNSTEIN C N.Microbiome survey of the inflamed and noninflamed gut at different compartments within the gastrointestinal tract of inflammatory bowel disease patients[J].Inflamm Bowel Dis, 2016,22(4): 817-825.
[15] LEVIN A, YAARI S, STOFF R, et al.Diagnosis of cytomegalovirus infection during exacerbation of ulcerative colitis[J].Digestion, 2017,96(3): 142-148.
[16] FRANK D N, ST AMAND A L, FELDMAN R A, et al.Molecular-phylogenetic characterization of microbial community imbalances in human inflammatory bowel diseases[J].Proc Natl Acad Sci USA, 2007,104(34): 13780-13785.
[17] 沈羽嘉,卞兆连,邵建国.炎症性肠病肠黏膜屏障功能受损机制与修复治疗的研究进展[J].山东医药,2019,59(02): 90-93.
[18] GONZ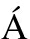 LEZ-PAJUELO M, ANDRADE J C, VASCONCELOS I.Production of 1, 3-propanediol by Clostridium butyricum VPI 3266 using a synthetic medium and raw glycerol[J].J Ind Microbiol Biotechnol, 2004,31(9): 442-446.
LEZ-PAJUELO M, ANDRADE J C, VASCONCELOS I.Production of 1, 3-propanediol by Clostridium butyricum VPI 3266 using a synthetic medium and raw glycerol[J].J Ind Microbiol Biotechnol, 2004,31(9): 442-446.
[19] TAKAHASHI M, CHANG D, DONG X, et al.The difference and the improvement effects of intestinal flora between irritable bowel syndrome patients and healthy volunteer using Clostridium butyricum MIYAIRI 588[J].J Jpn Soc Clin Studies Intest Microflora, 2001,3(1): 45-47.
[20] SEO M, INOUE I, TANAKA M, et al.Clostridium butyricum MIYAIRI 588 improves high-fat diet-induced non-alcoholic fatty liver disease in rats[J].Dig Dis Sci, 2013,58(12): 3534-3544.
[21] 施嫣红,汤茂春,虞卫华,等.美沙拉嗪治疗轻中度溃疡性结肠炎的临床疗效研究[J].同济大学学报(医学版),2015,36(6): 103-107.
[22] VANCAMELBEKE M, VERMEIRE S.The intestinal barrier: a fundamental role in health and disease[J].Expert Rev Gastroenterol Hepatol, 2017,11(9): 821-834.
[23] 丁道献,朱贤勇.双歧杆菌乳杆菌三联活菌片对肝硬化自发性腹膜炎患者肠黏膜屏障功能的保护作用[J].中国微生态学杂志,2014,26(5): 549-551.
[24] 邵启蕙,郭颂铭,董秋安.自拟“溃结2号方”治疗溃疡性结肠炎的临床观察[J].同济大学学报(医学版),2020,41(1): 112-116.
[25] SOBHIAN B, KRÖPFL A, HÖLZENBEIN T, et al.Increased circulating D-lactate levels predict risk of mortality after hemorrhage and surgical trauma in baboons[J].Shock, 2012,37(5): 473-477.
[26] VAN HEMERT S, VERWER J, SCHÜTZ B.Clinical studies evaluating effects of probiotics on parameters of intestinal barrier function[J].AiM, 2013,3(2): 212-221.
[27] FUCCIO L, GUIDO A.Probiotics supplementation for the prevention of gastrointestinal radiation-induced side effects: the time is now[J].Am J Gastroenterol, 2013,108(2): 277.