MRI是前列腺癌(prostate cancer, PCa)早期诊断、分期及随访等最有效的影像手段[1],欧洲泌尿放射协会发布的前列腺影像报告和数据系统(prostate imaging reporting and data system, PI-RADS)是目前公认的前列腺MRI检查与诊断指南。2015年,在PI-RADS第一版(PI-RADS v1)的基础上发布了第二版(PI-RADS v2)。PI-RADS v2与PI-RADS v1最重要的改进在于针对移行带、外周带分别引入了不同的主要与次要评分序列,动态对比增强(dynamic contrast enhancement, DCE)作为多参数磁共振成像(multiparametric MRI, Mp-MRI)必要序列之一,被降为外周带的次要评分序列[2]。因此,有文献开始质疑是否有必要把DCE作为常规前列腺MR扫描的必须序列[3-5],甚至提出了忽略DCE的双参数磁共振成像(biparametric MRI, Bp-MRI)的诊断及相应类似的评分标准[6-8]。另外,在前列腺特异性抗原(prostate-specific antigen, PSA)水平不同时,PCa发病率不同,且PSA水平与PCa风险级别明显相关[9-10],因此PI-RADS诊断PCa性能可能与PSA水平有关[11]。本研究拟针对不同PSA水平患者,探讨Bp-MRI与Mp-MRI对前列腺临床显著癌(clinically significant prostate cancer, csPCa)的诊断价值。
1 资料与方法
1.1 一般资料
回顾性连续收集同济大学附属同济医院2017年1月—2018年6月期间收治的前列腺病例临床及MRI资料。纳入标准:(1)所有病例均进行了完整的Mp-MRI检查,包括T1加权成像(T1WI)、T2加权成像(T2WI)、弥散加权成像(diffusion-weighted imaging, DWI)及相应表观弥散系数(apparent diffusion coefficient, ADC)图、DCE序列;(2)所有病例均经穿刺或根治病理证实,且前列腺穿刺活检均在MRI检查之后1个月以内进行,根治病例其根治术在MRI检查后3个月内进行;(3)患者在MRI检查之前无前列腺治疗史,如放射治疗,内分泌治疗等。排除标准:(1)MRI图像质量影响评分;(2)临床资料或MRI扫描序列不全。依据PSA水平将所有纳入研究病例分为低PSA组:PSA≤10ng/mL;高PSA组:PSA>10ng/mL。
1.2 MRI检查
所有病例均采用Siemens Verio 3.0T MR扫描,主要成像序列如下。(1)快速自旋回波序列(turbo spin echo, TSE)横断位T1WI;(2)横断位、矢状位高分辨T2WI,扫描参数:重复时间(repetition time, TR)=4290ms,回波时间(echo time, TE)=96ms,空间分辨率为0.7mm×0.6mm×3.0mm;(3)回波平面成像(echo planar imaging, EPI)序列横断位DWI及ADC图,扫描参数:TR=3000ms,TE=90ms,空间分辨率为1.6mm×1.2mm×3.0mm,b值包括50、800、1400s/mm2;(4)VIBE(volume interpolated body examination)序列横断位DCE,扫描参数:TR=4.8ms,TE=1.7ms,空间分辨率为0.8mm×0.6mm×2.0mm,时间分辨率为7.8s,持续约4.5min,增强扫描对比剂采用钆喷酸葡胺(gadolinium-diethylene-triamine pentaacetic acids, Gd-DTPA),剂量为0.1mmol/kg,流率为2.5mL/s。所有患者扫描前嘱其排便、适量留尿,定位时线圈中心位于耻骨联合处,用束带固定以减少呼吸运动产生的伪影,未使用肌松类药物。
1.3 图像及病理分析
所有病例先由1名不参与PI-RADS评分的放射科医师(具有前列腺MR诊断2年以上工作经验)与泌尿病理医师一起,依据病理结果对MR图像进行病灶标注。针对多病灶病例,标注病理评分最高的病灶。PI-RADS评分由4名具有前列腺MR诊断工作经验的高年资医师分两组、采用双盲法独立完成。一组分析去掉DCE序列的Bp-MRI图像,另一组分析含有DCE序列的Mp-MRI图像。评分标准依据在PI-RADS V2基础上修订的最新版PI-RADS v2.1,分析不一致者由第3名医师(具有前列腺MR诊断经验5年以上)判定最终评分。不包括DCE的双参数序列,针对外周带病变,参照文献[12]及“无足够DCE”的评分原则,采用T2WI评分标准区别DWI评分为3分的病例,如果T2WI评分≥4分,最终PI-RADS为4分。所有病例阅片分析后,记录最终的PI-RADS评分。
所有穿刺病理结果由影像科医师与泌尿病理医师复核,并对PI-RADS评分病变区域与病理结果分区一一对应,有根治病理的病例,以根治病理为准。csPCa定义为格林森评分(Gleason score, GS)≥7a(3+4)。
1.4 统计学处理
实验数据采用SPSS 19.0软件进行统计学分析处理。采用配对的χ2检验,以PI-RADS≥4为阳性阈值,比较Bp-MRI与Mp-MRI对csPCa的诊断性能,包括灵敏度、特异度以及准确度。采用κ检验,比较2名阅片者之间Bp-MRI阴性与阳性评分结果一致性,κ值小于0.20为缺乏一致性;κ值在0.21~0.40为一致性一般;κ值在0.41~0.60为一致性中等;κ值在0.61~0.80为一致性较好;κ值在0.81~1.00则认为具有高度一致性。所有统计学检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 病例资料
依据病例选择原则,共计298例前列腺病例纳入研究。以PSA 10ng/mL为阈值,低PSA组197例,占66.1%(197/298),平均PSA值为(6.7±2.5)ng/mL,其中csPCa 42例,占21.3%(42/197),位于外周带29例,位于移行带13例,5例仅穿刺活检证实,37例为根治病理证实。高PSA组101例,占33.9%(101/298),平均PSA值为(25.7±14.5)ng/mL,其中csPCa 60例,占59.4%(60/101),位于外周带38例,位于移行带22例,29例仅穿刺活检证实,31例为根治病理证实。
所有入组患者年龄为48~83岁,平均(67.5±20.3)岁,主要临床表现为体检发现PSA升高、排尿困难、尿频、尿急、尿痛、血尿等。
2.2 诊断效能
在197例低PSA组患者中,Mp-MRI评分,PI-RADS≤3分的病灶144例,PI-RADS≥4分的病灶53例,Mp-MRI诊断csPCa的灵敏度88.1%,特异度89.7%,诊断准确度89.3%。Bp-MRI评分,PI-RADS≤3分的病灶148例,PI-RADS≥4分的病灶49例,Bp-MRI诊断csPCa的灵敏度69.0%,特异度87.1%,诊断准确度83.2%。
在101例高PSA组患者中,Mp-MRI评分,PI-RADS≤3分的病灶45例,PI-RADS≥4分的病灶56例,Mp-MRI诊断csPCa的灵敏度88.3%,特异度92.7%,诊断准确度90.1%。Bp-MRI评分,PI-RADS≤3分的病灶46例,PI-RADS≥4分的病灶55例,Bp-MRI诊断csPCa的灵敏度83.3%,特异度87.8%,诊断准确度85.1%。典型病例Mp-MRI评分情况见图1。
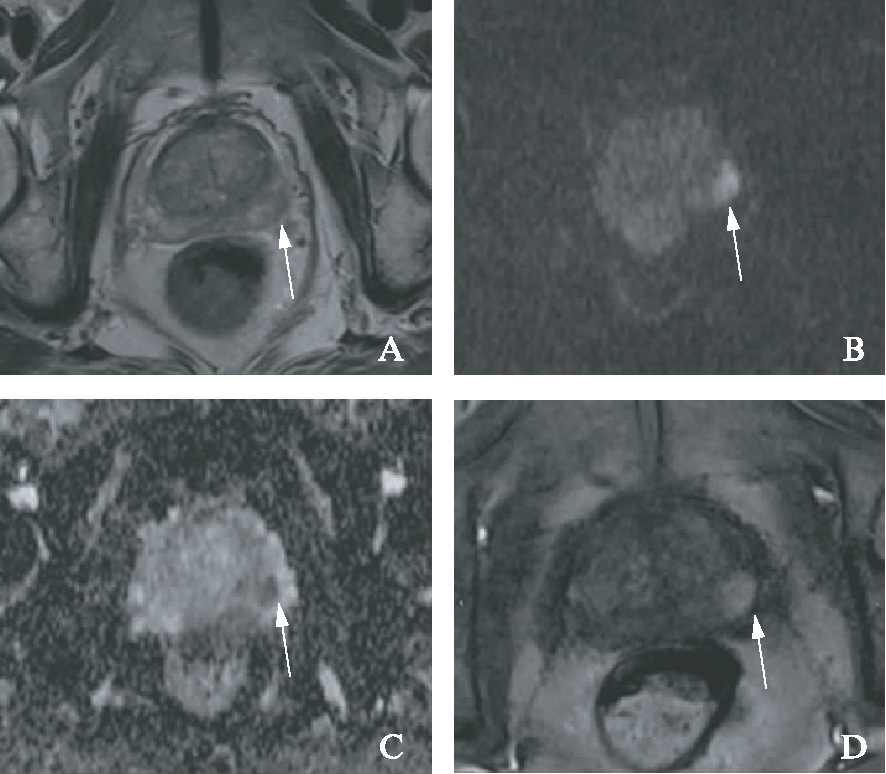
图1 高PSA组csPCa患者的Mp-MRI
Fig.1 Mp-MRI of csPCa in the high PSA group
患者,男,65岁,PSA 15ng/mL,根治病理证实左侧外周带csPCa,GS评分为7b(4+3)。一组2名医师对不含DCE序列的Bp-MRI(图A—C)评分,T2WI(A)显示左侧外周带见局灶性低信号病灶(箭头),边界不清,DWI(B)为高信号(箭头),相应ADC图(C)为低信号(箭头),2名阅片者DWI评分均为4分,最终PI-RADS评分为4分。另一组2名医师对含DCE序列的Mp-MRI(图A—D)评分,2名阅片者T2WI、DWI、ADC评分与前一组一致,DCE(D)显示相应区域早期强化(箭头),DCE阳性但不改变总评分,最终PI-RADS评分为4分
在低PSA组,Bp-MRI对csPCa诊断灵敏度低于Mp-MRI(χ2=4.53,P<0.05),Bp-MRI与Mp-MRI对csPCa诊断的假阴性病例中以中风险GS 7a或7b病灶为主。与Mp-MRI相比,Bp-MRI有额外8例假阴性,其中4例由于病灶体积较小,位置不典型而漏诊,4例为外周带DWI 3分病灶。在相应的Mp-MRI中,该8例由于DCE阳性,易于发现病灶,同时,外周带DWI 3分病灶PI-RADS评分上调为4分。Bp-MRI与Mp-MRI诊断csPCa的特异度及准确度比较差异均无统计学意义(P>0.05)。在高PSA组,Bp-MRI与Mp-MRI对csPCa的诊断灵敏度、特异度及准确度比较差异均无统计学意义(P>0.05),两者具有相似的诊断性能,见表1。
表1 Mp-MRI与Bp-MRI对不同PSA水平csPCa诊断性能比较
Tab.1 Comparison of Mp-MRI and Bp-MRI in the diagnosis of csPCa at different PSA levels
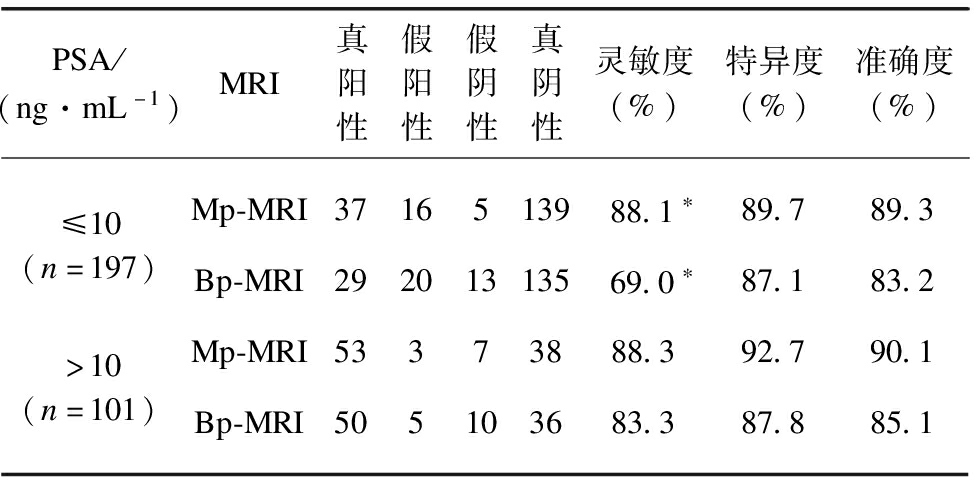
PSA/(ng·mL-1)MRI真阳性假阳性假阴性真阴性灵敏度(%)特异度(%)准确度(%)≤10(n=197)Mp-MRI3716513988.1∗89.789.3Bp-MRI29201313569.0∗87.183.2>10(n=101)Mp-MRI53373888.392.790.1Bp-MRI505103683.387.885.1
*P<0.05,Mp-MRI与Bp-MRI比较差异有统计学意义
2.3 阅片一致性分析
对两名医师Bp-MRI的PI-RADS评分结果进行一致性分析。以PI-RADS≥4为阳性阈值,阳性与阴性一致性比较κ值为0.817,具有高度一致性。
3 讨 论
随着PI-RADS v2的发布,DCE在PCa诊断中的作用降低。近两年来,随着Bp-MRI的研究报道增多,Bp-MRI在PCa诊断中的应用受到越来越多的关注[13]。前列腺DCE扫描对设备、技术有更高要求,忽略DCE不仅简化了流程扫描,缩短了扫描时间,降低了扫描费用,而且减少了造影剂导致系统性肾纤维化、肾衰以及脑内沉积的潜在风险。同时,随着前列腺PSA筛查的应用推广以及MR在国内中等规模医院的逐渐普及,前列腺MR检查需求越来越多,Bp-MRI在缩短扫描时间、减少检查费用方面的优势越来越突出。因此,探讨Bp-MRI在PCa诊断方面的应用价值有着重要的现实意义。
最近多篇Meta分析报道结果显示,Bp-MRI与Mp-MRI在检测PCa方面具有相似的诊断性能[14-16]。Kang等[14]报道Bp-MRI诊断PCa灵敏度为0.79,特异度为0.88,Mp-MRI灵敏度为0.79,特异度为0.89,且无论是以PI-RADS≥3,还是以PI-RADS≥4为阳性阈值,两者之间差异均无统计学意义。Woo等[15]报道Bp-MRI诊断灵敏度与特异度分别为0.74、0.90,Mp-MRI分别为0.76、0.89,两者对PCa或csPCa的诊断差异均无统计学意义。
PSA作为广泛应用于PCa筛查的肿瘤特异性标志物,虽然具有一定局限性,但PSA 10ng/mL常作为PCa风险评估的阈值,而且Bp-MRI对PCa诊断的性能可能与PSA水平有关。Rais-Bahrami等[17]以MR/超声融合引导下前列腺活检为标准,比较Bp-MRI与PSA及PSAD在PCa筛查中的价值,结果显示Bp-MRI检测PCa优于PSA和PSAD,AUC曲线下面积分别为0.80、0.66、0.74,同时,Bp-MRI结合PSA或PSAD可提高其检出率和诊断准确度。
然而,目前大部分有关Bp-MRI与Mp-MRI对比的研究报道均未结合PSA指标,以PSA 10ng/mL为阈值比较Bp-MRI与Mp-MRI对不同PSA水平csPCa的诊断差异未见报道。本研究以PSA 10ng/ml为阈值,将病例分为低PSA组和高PSA组,以PI-RADS≥4为阳性阈值,比较Bp-MRI与Mp-MRI对不同PSA水平csPCa的诊断性能,结果显示在高PSA组,两者诊断性能一致,而在低PSA组,虽然两者诊断特异度、准确度相似,但Bp-MRI对csPCa诊断灵敏度低于Mp-MRI(χ2=4.53,P<0.05),Bp-MRI可能会漏诊部分csPCa。将两组病例整合分析,结果显示两者灵敏度、特异度及准确度差异也无统计学意义(P>0.05),与文献报道一致。
Bp-MRI与Mp-MRI对csPCa的诊断性能可能与病灶位置、大小、GS评分以及DCE的意义有关。研究表明,PCa GS评分与ADC值存在相关性,GS评分越高,ADC值越低[18]。在高PSA组,GS≥8的高风险csPCa比例高于低PSA组,以PI-RADS≥4为阳性阈值,DWI及相应ADC图易于诊断,DCE作用不明显,因此Bp-MRI与Mp-MRI两者诊断性能相似。在低PSA组,Bp-MRI有额外8例假阴性,其主要原因是病灶相对较小,位置不典型以及外周带DWI 3分病灶的诊断问题,在相应的Mp-MRI中,该8例由于DCE阳性,对照T2WI易于发现病灶,同时,外周带DWI 3分病灶PI-RADS评分上调为4分,Mp-MRI表现为阳性,Mp-MRI诊断灵敏度高于Bp-MRI。
有关DCE在前列腺Mp-MRI中的意义一直存在争议。不过在最新的PI-RADS v2.1版中[19],仍建议将DCE作为Mp-MRI要求的序列之一,其重要的原因在于,在某些情况下,DCE仍有利于csPCa的检出。一些报道认为DCE有利于提高Mp-MRI前列腺癌诊断的灵敏度[20-21],尤其是针对体积较小的病灶,或者位于外周带偏前缘的病灶,与移行带分界不清,常规序列易于漏诊,另外,DCE也有利于外周带靠近中央带的病灶与正常中央带腺体的鉴别诊断[2]。
在PI-RADS v2.1版中,影响Bp-MRI诊断性能的另一个问题是外周带DWI 3分病灶的诊断。在高PSA组,DWI 3分病灶比例少,DCE作用有限,对Bp-MRI诊断性能影响不大。在低PSA组,本研究显示有4例(4/42)外周带DWI 3分csPCa,Bp-MRI呈假阴性,而Mp-MRI由于DCE阳性,PI-RADS评分上调为4分而呈真阳性,结果说明DCE有利于外周带DWI 3分PCa的诊断。Taghipour等[20]以前列腺根治术病理诊断结果为标准,回顾性分析了209例外周带csPCa的DCE-MRI评估情况,结果显示DWI 3分病灶有45例,约占21.5%,其中DCE阳性29例,真阳性21例,阴性16例,真阴性10例,DCE对于DWI 3分csPCa的诊断准确性为68.9%,DCE有利于DWI 3分csPCa的诊断。Greer等[21]以前列腺根治全切病理为标准,对比分析了420例外周带病灶,结果显示对于DWI 3分病灶,DCE阳性对PCa检出率为67.8%,对csPCa检出率为54.0%,DCE+DWI与单纯DWI相比,对外周带PCa检出率提高了16.0%。
文献报道显示Bp-MRI具有较好的阅片一致性。Kuhl等[22]以PI-RADS≥3为阳性,显示Bp-MRI阳性与阴性阅片一致性系数κ值为0.818,具有高度一致性,各PI-RADS评分之间阅片一致性系数κ值为0.60,具有中等一致性。本研究结果显示,以PI-RADS≥4为阳性阈值,2名阅片者之间Bp-MRI阳性与阴性评分具有高度一致性,κ值分别为0.817。
本研究的不足之处在于采用回顾性分析,与实际临床应用存在差异;部分病例为穿刺活检病理,与最终病理之间可能存在偏倚。另外,Bp-MRI在PCa诊断中的应用仍需不断完善。Bp-MRI扫描参数与评分尚未形成统一标准,而且Bp-MRI由于缺乏部分序列可能导致假阳性增加,尤其是以PI-RADS≥3作为阳性阈值时[23]。
总之,本研究以PSA 10ng/mL为阈值,比较Bp-MRI与Mp-MRI对低PSA组和高PSA组csPCa的诊断性能,结果显示在高PSA组,两者诊断性能一致,而在低PSA组,Bp-MRI对csPCa诊断灵敏度低于Mp-MRI,Bp-MRI存在漏诊部分csPCa的风险。
[1] 王为刚,张国凯,李军衡,等.3.0T磁共振图像计算机特征鉴别诊断前列腺良恶性病变的价值[J].同济大学学报(医学版),2019,40(2): 201-206,217.
[2] WEINREB J C, BARENTSZ J O, CHOYKE P L, et al.PI-RADS prostate imaging-reporting and data system: 2015, version 2[J].Eur Urol, 2016,69(1): 16-40.
[3] SCIALPI M, RONDONI V, AISA M C, et al.Is contrast enhancement needed for diagnostic prostate MRI?[J].Transl Androl Urol, 2017,6(3): 499-509.
[4] SCIALPI M, MARTORANA E, AISA M C, et al.Abbreviated biparametric prostate MR imaging: is it really an alternative to multiparametric MR imaging?[J].Radiology, 2018,286(1): 360-361.
[5] KAJI Y, INAMURA K.Diagnostic ability with abbreviated biparametric and full multiparametric prostate MR imaging: is the use of PI-RADS version 2 appropriate for comparison?[J].Radiology, 2018,286(2): 726-727.
[6] SCIALPI M, D’ANDREA A, MARTORANA E, et al.Biparametric MRI of the prostate[J].Turk J Urol, 2017,43(4): 401-409.
[7] SHERRER R L, GLASER Z A, GORDETSKY J B, et al.Comparison of biparametric MRI to full multiparametric MRI for detection of clinically significant prostate cancer[J].Prostate Cancer Prostatic Dis, 2019,22(2): 331-336.
[8] OBMANN V C, PAHWA S, TABAYAYONG W, et al.Diagnostic accuracy of a rapid biparametric MRI protocol for detection of histologically proven prostate cancer[J].Urology, 2018,122: 133-138.
[9] NG C F, CHIU P K, LAM N Y, et al.The Prostate Health Index in predicting initial prostate biopsy outcomes in Asian men with prostate-specific antigen levels of 4-10ng/mL[J].Int Urol Nephrol, 2014,46(4): 711-717.
[10] RADTKE J P, WIESENFARTH M, KESCH C, et al.Combined clinical parameters and multiparametric magnetic resonance imaging for advanced risk modeling of prostate cancer-patient-tailored risk stratification can reduce unnecessary biopsies[J].Eur Urol, 2017,72(6): 888-896.
[11] CHOI M H, LEE Y J, JUNG S E, et al.Prebiopsy biparametric MRI: differences of PI-RADS version 2 in patients with different PSA levels[J].Clin Radiol, 2018,73(9): 810-817.
[12] UENO Y, TAMADA T, TAKAHASHI S.Detection of clinically significant prostate cancer by using abbreviated biparametric prostate MR imaging[J].Radiology, 2018,286(3): 1093-1094.
[13] THESTRUP K C, LOGAGER V, BASLEV I, et al.Biparametric versus multiparametric MRI in the diagnosis of prostate cancer[J].Acta Radiol Open, 2016,5(8): 2058460116663046.
[14] KANG Z, MIN X D, WEINREB J, et al.Abbreviated biparametric versus standard multiparametric MRI for diagnosis of prostate cancer: a systematic review and meta-analysis[J].AJR Am J Roentgenol, 2019,212(2): 357-365.
[15] WOO S, SUH C H, KIM S Y, et al.Head-to-head comparison between biparametric and multiparametric MRI for the diagnosis of prostate cancer: a systematic review and meta-analysis[J].AJR Am J Roentgenol, 2018,211(5): W226-W241.
[16] NIU X K, CHEN X H, CHEN Z F, et al.Diagnostic performance of biparametric MRI for detection of prostate cancer: a systematic review and meta-analysis[J].AJR Am J Roentgenol, 2018,211(2): 369-378.
[17] RAIS-BAHRAMI S, SIDDIQUI M M, VOURGANTI S, et al.Diagnostic value of biparametric magnetic resonance imaging(MRI)as an adjunct to prostate-specific antigen(PSA)-based detection of prostate cancer in men without prior biopsies[J].BJU Int, 2015,115(3): 381-388.
[18] WOO S, KIM S Y, CHO J Y, et al.Preoperative evaluation of prostate cancer aggressiveness: using ADC and ADC ratio in determining gleason score[J].AJR Am J Roentgenol, 2016,207(1): 114-120.
[19] TURKBEY B, ROSENKRANTZ A B, HAIDER M A, et al.Prostate Imaging Reporting and Data System version 2.1: 2019 update of Prostate Imaging Reporting and Data System version 2[J].Eur Urol, 2019,76(3): 340-351.
[20] TAGHIPOUR M, ZIAEI A, ALESSANDRINO F, et al.Investigating the role of DCE-MRI, over T2 and DWI, in accurate PI-RADS v2 assessment of clinically significant peripheral zone prostate lesions as defined at radical prostatectomy[J].Abdom Radiol(NY), 2019,44(4): 1520-1527.
[21] GREER M D, SHIH J H, LAY N, et al.Validation of the dominant sequence paradigm and role of dynamic contrast-enhanced imaging in PI-RADS version 2[J].Radiology, 2017,285(3): 859-869.
[22] KUHL C K, BRUHN R, KR MER N, et al.Abbreviated biparametric prostate MR imaging in men with elevated prostate-specific antigen[J].Radiology, 2017,285(2): 493-505.
MER N, et al.Abbreviated biparametric prostate MR imaging in men with elevated prostate-specific antigen[J].Radiology, 2017,285(2): 493-505.
[23] STANZIONE A, IMBRIACO M, COCOZZA S, et al.Biparametric 3T magnetic resonance imaging for prostatic cancer detection in a biopsy-naïve patient population: a further improvement of PI-RADS v2?[J].Eur J Radiol, 2016,85(12): 2269-2274.