目前糖尿病患者干眼发病率为63%[1],且干眼的病情更为严重,治愈率更低。研究表明,糖尿病诱发干眼的机制包括泪膜不稳定[2]、泪液渗透压升高[3]、眼表炎症损害[4]、角膜神经感觉异常[5]和角结膜上皮细胞凋亡失衡等[6]。与正常人群相比,糖尿病患者角膜上皮基底细胞密度明显降低[7]。内质网应激(endoplasmic reciculm stress, ERS)是细胞对多种病理状况的一种自适应机制,ERS过强,凋亡通路将被激活诱导细胞死亡[8]。PERK、eIF2α和CHOP是ERS信号通路所属蛋白。其中PERK、eIF2α蛋白主要在ERS时参与未折叠蛋白反应(unfold protein response, UPR)以增强细胞抗应激能力,促进存活,CHOP在过度应激环境中,可促使内质网过氧化,进一步导致未折叠蛋白的累积,加重细胞损伤,从而诱导凋亡[9]。
高糖通过诱导大量活性氧产生激活ERS介导角膜表层组织损伤已在兔角膜上皮细胞(rabbit corneal epithelial cells, RCECs)中得到验证[10]。但葡萄糖浓度是否参与眼表细胞ERS的调控尚未有文献报道。研究发现高渗可通过激活氧化应激和ERS促进RCECs的凋亡[3]。葡萄糖浓度升高伴随着渗透压升高,泪糖浓度对RCECs的影响是否与渗透压的改变具有相关性需进一步的研究。本研究拟探讨葡萄糖浓度对RCECs生长的影响,以期对糖尿病性干眼的发生机制更深一步认识。
1 材料和方法
1.1 主要试剂和仪器
Dispase Ⅱ 中性蛋白酶和蛋白酶抑制剂购自瑞士Roche公司,0.05% EDTA-胰酶购自美国HyClone公司,角质上皮细胞培养基和青链霉素混合物购自美国ScienCell 公司,胎牛血清美国购自Gibco公司,葡萄糖和甘露醇粉末购自美国Sigma公司,PERK Antibody、phospho-PERK Antibody、phospho-eIF2α Antibody和CHOP Antibody购自美国Cell Signaling Technology公司,eIF2α Antibody购自美国Enzo Life Sciences公司,BCA试剂盒、β-actin Antibody、HRP标记IgG二抗和显影定影试剂盒购自上海碧云天生物科技有限公司,CO2恒温培养箱购自美国SHEL LAB公司,倒置相差显微镜系日本OLYMPUS公司产品,垂直转移电泳仪、转膜仪产自美国Bio-Rad公司。
1.2 兔角膜上皮细胞原代培养的建立及细胞分组
RCECs的原代培养参照参考文献[3]的方法进行并行免疫荧光鉴定。第1代RCECs接种于6孔板,密度为4×105个/孔,细胞贴壁后融合率达到80%左右时,改加入不含血清的培养液预处理过夜。取适量的葡萄糖和甘露醇粉末分别溶解于细胞培养液配制母液,抽滤除菌后备用,排除其他影响因素。各孔细胞随机分为3组:(1)对照组,仅含5.5mmol/L葡萄糖;(2)高渗组,含5.5mmol/L葡萄糖和27.5mmol/L甘露醇;(3)高糖组,仅含33mmol/L葡萄糖。浓度参照参考文献[11]。
1.3 Westren印迹法
细胞干预24h后吸除培养液,适量PBS漂洗3遍,加入120μL含有蛋白酶抑制剂的细胞裂解液,冰上裂解10min。将含裂解蛋白的所有液体吸出,转移至1.5mL EP管,迅速置于4℃离心机离心(离心半径20cm,14000r/min,10min),吸取上清液,转移至新的EP管。用BCA蛋白定量试剂盒测定各组样本蛋白浓度。剩余蛋白样品加入适量4×SDS-PAGE蛋白上样缓冲液混匀,迅速置于100℃水中煮10min。各组均取40μg变性总蛋白选择10%或12%的分离胶进行SDS-PAGE,电泳结束后进行转膜,将总蛋白转移至PVDF膜。用含5%脱脂奶粉或5% BSA的1×TBST封闭液封闭PVDF膜,室温孵育1h。弃封闭液,用TBST封闭液稀释的一抗孵育,4℃过夜(稀释比例PERK和eIF2α为1∶2000;p-eIF2α为1∶1000;p-PERK为1∶500;CHOP为1∶1000,β-actin为1:4000)。TBST洗膜3次,每次10min,孵HRP标记的对应来源的二抗,稀释比例1∶(4000~5000),室温1h。TBST 洗膜3次,每次10min,ECL显色试剂盒显色,于暗室胶片曝光,胶片取出后,依次置于显影液和定影液中快速漂洗,最后用清水冲净晾干。扫描仪扫描X射线胶片上的条带,用Image J对条带进行灰度值半定量分析,以目的蛋白与β-actin内参灰度比值表示目的蛋白相对表达量。
1.4 兔角膜上皮细胞形态学观察
按照1.2所介绍方法重新培养第1代RCECs并行饥饿过夜处理,选取孔板中生长旺盛且形成良好单层的细胞,置于倒置相差显微镜下观察并拍照记录。弃原培养液,再用PBS洗两次,清除脱落的细胞及杂质,各孔细胞随机加入等量的含不同浓度的葡萄糖和甘露醇的无血清培养液。葡萄糖浓度梯度依次为200、400、600和800mmol/L;甘露醇浓度梯度依次为200、400、600和800mmol/L;葡萄糖和甘露醇混合液总浓度均为800mmol/L,浓度之比分别为1∶3、1∶1和3∶1。以空白组作为对照组。每孔含3个复孔。放入培养箱中继续培养,于24h后在显微镜下观察细胞形态学变化。
1.5 上皮细胞显微镜下变化分级标准
通过计算倒置相差显微镜下异常形态RCECs百分比(异常形态RCECs面积/9.6cm2)进行损伤程度分级。培养后的上皮细胞生长正常为(-),细胞出现球形或呈聚拢状为(+),细胞呈弥漫性皱缩大量空泡并有灶性脱落<20%为(++),细胞皱裂、坏死脱落20%~50%为(+++),细胞灶性脱落50%~75%为(++++),细胞灶性脱落>75%为(+++++)。
1.6 统计学处理
所有计量数据均用![]() 表示,实验数据采用SPSS 22.0软件进行分析,采用GraphPad Prism 7.0进行图像数据分析,利用多重比较的单因素方差分析比较组间差异。P<0.05为差异有统计学意义。
表示,实验数据采用SPSS 22.0软件进行分析,采用GraphPad Prism 7.0进行图像数据分析,利用多重比较的单因素方差分析比较组间差异。P<0.05为差异有统计学意义。
2 结 果
2.1 各组兔角膜上皮细胞p-PERK、p-eIF2α和CHOP蛋白的表达
与对照组和高渗组相比,高糖组兔角膜上皮细胞p-PERK、p-eIF2α和CHOP表达水平升高(P<0.05);高渗组与对照组相比p-PERK、p-eIF2α和CHOP表达上调(P<0.05);各组中,PERK和eIF2α表达水平差异均无统计学意义(P>0.05),见图1。
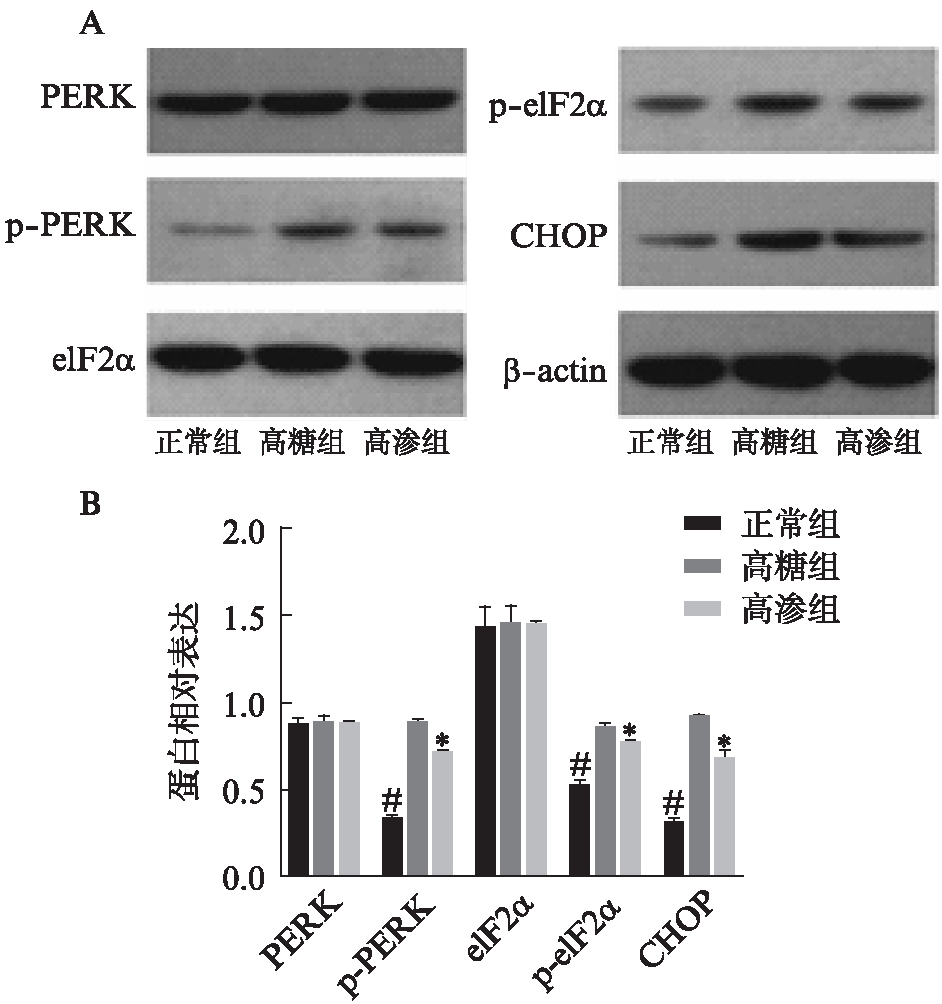
图1 兔角膜上皮细胞PERK,p-PERK、eIF2α、p-eIF2α和CHOP蛋白的表达
Fig.1 The expressions of PERK, p-PERK, eIF2α, p-eIF2α and CHOP protein in RCECs
高糖组与对照组、高渗组相比,*P<0.05;高渗组与对照组相比,#P<0.05
2.2 高糖与高渗状态下兔角膜上皮细胞形态变化的比较和分析
2.2.1 兔角膜上皮细胞形态变化与高糖水平的关系 随着葡萄糖浓度在200~800mmol/L范围内不断升高,100倍率下可见细胞脱落范围不断扩大,200和400倍率下可见细胞皱缩、体积缩小、细胞碎裂、胞间连接消失等损伤不断加重,细胞生长形态越来越差。200、400、600、800mmol/L葡萄糖浓度下细胞损伤分别为(+)、(+)、(+++)、(+++++),见图2。
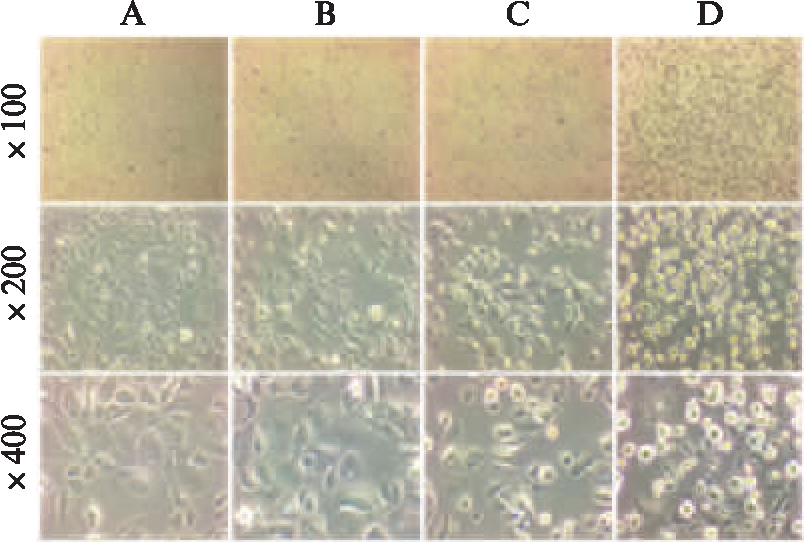
图2 不同高糖浓度处理的RCECs生长形态
Fig.2 The morphology of RCECs with different concentrations of glucose
A:200mmol/L葡萄糖;B:400mmol/L葡萄糖;C:600mmol/L葡萄糖;D:800mmol/L葡萄糖
2.2.2 兔角膜上皮细胞形态变化与渗透压浓度水平的关系 随着甘露醇浓度在200~800mmol/L范围内不断升高,100倍率下可见细胞脱落范围不断扩大,200和400倍率可见细胞皱缩、空泡化、体积缩小,细胞碎裂、胞间连接消失等情况不断加重,细胞生长形态越来越差。与图2相比,浓度为400mmol/L和600mmol/L 时,甘露醇均较葡萄糖致细胞生长形态差和脱落范围大。200、400、600、800mmol/L甘露醇浓度下细胞损伤分别为(+)、(++)、(++++)、(+++++),见图3。
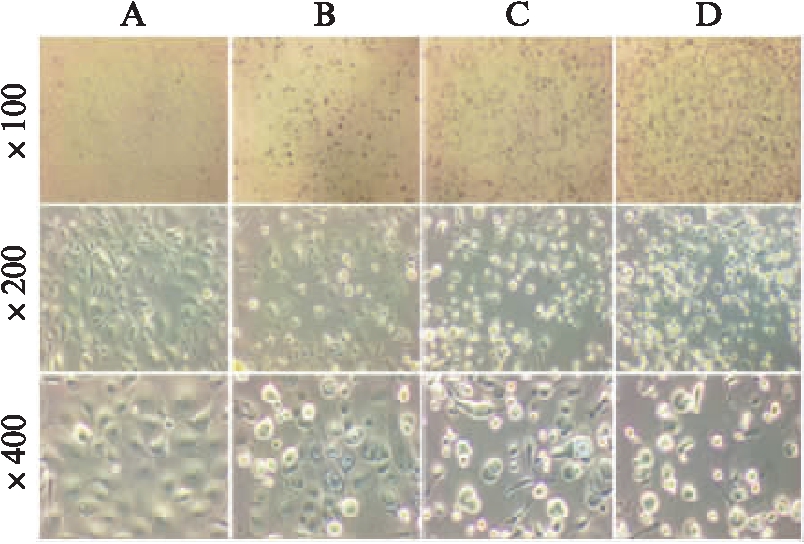
图3 不同渗透压浓度处理的RCECs生长形态
Fig.3 The morphology of RCECs with different concentrations of mannitol
A:200mmol/L甘露醇;B:400mmol/L甘露醇;C:600mmol/L 甘露醇;D:800mmol/L甘露醇
2.2.3 渗透压维持不变时,不同高糖浓度下兔角膜上皮细胞形态变化 随着葡萄糖浓度在200~600mmol/L范围内不断升高,且各组渗透压保持平衡,与空白对照组相比,100倍率下可见细胞脱落范围逐渐缩小,200和400倍率可见细胞皱缩、体积缩小,细胞碎裂、胞间连接消失等情况呈明显减轻趋势,细胞形态异形性减弱。200mmol/L葡萄糖+600mmol/L甘露醇细胞损伤为(++++);400mmol/L葡萄糖+400mmol/L甘露醇细胞损伤为(+++);600mmol/L葡萄糖+200mmol/L甘露醇细胞损伤为(++),见图4。
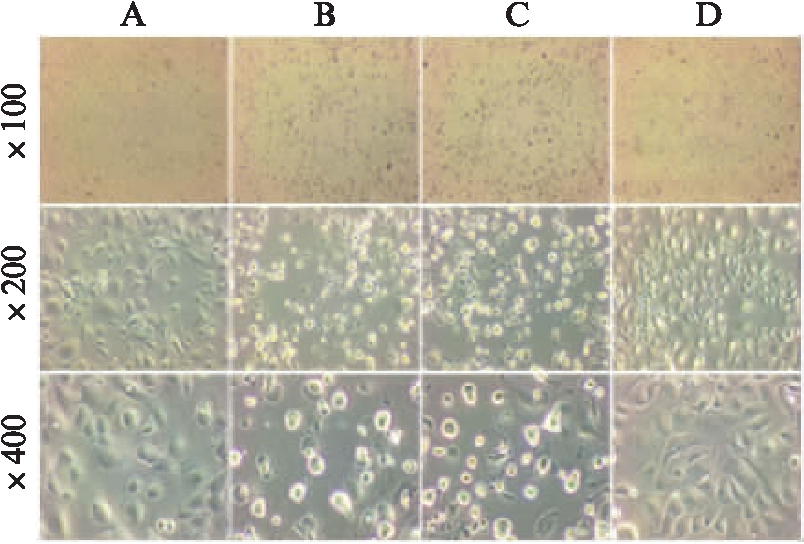
图4 同等渗透压不同高糖浓度处理的RCECs生长形态
Fig.4 The morphology of RCECs with different concentrations of glucose and same osmotic pressure
A:空白对照;B:200mmol/L葡萄糖+600mmol/L甘露醇;C:400mmol/L葡萄糖+400mmol/L甘露醇;D:600mmol/L葡萄糖+200mmol/L甘露醇
2.2.4 高糖及高渗对兔角膜上皮细胞的影响 为了更直观地表示出这些结果的差异及可能的相互关系,根据倒置相差显微镜下观察到RCECs生长形态随葡萄糖和甘露醇的浓度变化而改变的趋势,推测出其相关关系进行表示。
结论发现:(1)细胞损伤程度随葡萄糖浓度的升高而加重。葡萄糖较同浓度的甘露醇对细胞损伤更轻微,到达一定的浓度如800mmol/L时,两种处理下细胞均大片脱落死亡,高糖与高渗致细胞损伤程度相当,见图5A;(2)同等高渗透压条件下,细胞损伤程度随葡萄糖浓度升高而减轻,与图5A相符合,见图5B;(3)结合内质网应激蛋白高糖组较高渗组表达明显升高的结果进行分析,推测轻度高糖较轻度高渗对细胞的损伤程度相对较重,而重度高糖较重度高渗对细胞的损伤程度相对较轻过程较缓慢,直至超过一定的浓度时,两种作用均直接导致细胞死亡,见图5C(由于本实验浓度跨度范围大,图5与真实的曲线关系存在一定的偏差)。
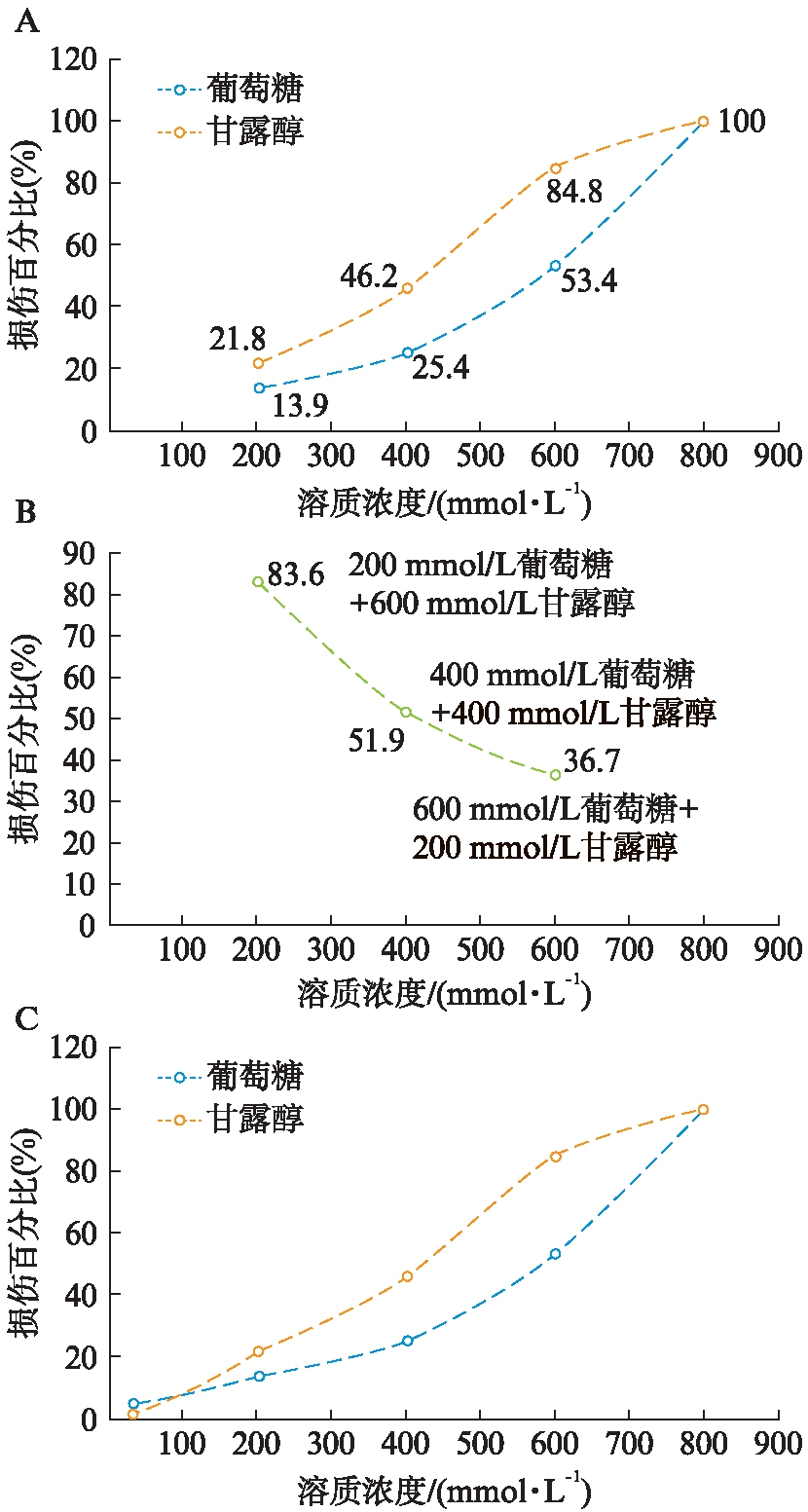
图5 倒置相差显微镜下RCECs损伤百分比与葡萄糖和甘露醇浓度的相关性推测及比较
Fig.5 The correlation between injury ratio of RCECs under phase contrast microscope and concentrations of glucose and mannitol
3 讨 论
泪膜稳定是维持眼表上皮正常结构和保持健康视觉功能的重要基础。现认为糖尿病性干眼是高泪糖引起泪膜损害伴角结膜上皮细胞损伤过多的结果[12],且病情与血糖控制情况和糖尿病病程相关[13]。泪液高糖可引起泪液渗透压的增加,且泪液渗透压随着糖尿病病程的增加而升高[14]。
内质网对内外环境的刺激极为敏感,当其发生功能紊乱时未折叠蛋白在腔内聚集的状态被称为ERS。应激早期,内质网通过启动UPR,如暂停蛋白质的合成、激活分子伴侣和折叠酶基因等的转录活性、诱导内质网相关性蛋白降解以促进细胞存活。若ERS过强,凋亡通路将被激活诱导细胞死亡[15]。前期实验通过高糖干预RCECs发现,高糖组(1mmol/L葡萄糖)p-PERK和CHOP蛋白表达水平较渗透压对照组(0.5mmol/L NaCl)相比明显上调[10]。本次实验显示,与正常组相比,高糖组和高渗组RCECs p-PERK、p-eIF2α和CHOP表达水平均升高,且高糖组较高渗组表达水平上调,与前期实验结果相符。可见,高糖组较高渗组RCECs遭受应激强,细胞损伤严重,高糖较高渗对细胞影响大。这与血液透析过程中预防性应用甘露醇(60~100mL/h)透析失衡综合征的发生率较高渗糖(40~60mL/h,50%葡萄糖)低[16]的现象相一致。因此,高泪糖对RCECs的损伤不限于渗透压的升高,还包括高糖本身的毒性作用。
葡萄糖属于有机物但又可电离,因此既有胶体渗透压又有晶体渗透压。甘露醇和葡萄糖分子式相近,在医药上是良好的利尿剂,不可电离,具有强渗透性[17]。为了更直观地观察高糖对角膜上皮的损伤作用,本次实验探究了葡萄糖浓度对RCECs生长的影响,甘露醇做对照。显微镜观察表明,在200~800mmol/L范围内,与空白组相比,葡萄糖浓度越高RCECs生长形态越差,如可见细胞皱缩、体积缩小、空泡化、胞间连接消失、细胞脱落与细胞碎裂等,细胞损伤趋向严重。因此,在此范围内,葡萄糖诱导的RCECs损伤与其浓度呈量-效关系,验证了干眼与糖尿病血糖控制情况的相关性[13]。本实验还发现,葡萄糖较同浓度的甘露醇处理过的细胞生长形态更好,细胞损伤范围小。当渗透压平衡时,RCECs损伤随葡萄糖浓度升高而减轻。因此,在此范围内,葡萄糖对RCECs的毒性效应弱于甘露醇。此时,高糖对RCECs的损伤中高渗所发挥的作用大于高糖本身。
此实验结果与上部分高糖组较高渗组内质网应激蛋白表达上调结果相悖。泪膜渗透压正常值是312mmol/L,高渗透压是指超过阈值316mmol/L,但个别患者的指标可高至360mmol/L[18]。可以推测,泪膜渗透压较高时,眼表微环境可迅速代偿以达到新的平衡,对细胞损伤轻微,而葡萄糖代谢紊乱累积的毒性代谢产物滞留致细胞损伤严重[19];超高渗情况下,渗透压对RCECs的刺激较急剧,葡萄糖既是能量储备,还可以被消耗从而降低渗透压,细胞损伤由轻到重有个累积过程,较高渗对细胞的影响缓慢。糖尿病患者人群血糖值范围波动较大,临床上糖尿病性酮症酸中毒或者是糖尿病高渗性昏迷的患者,血糖可以高达33~55mmol/L此时已危及生命。因此,糖尿病患者血糖水平多小于33mmol/L。糖尿病患者泪糖浓度约为血糖浓度1/6[20],因此,糖尿病患者高泪糖的渗透压可在泪膜代偿范围内,对细胞刺激小,但葡萄糖本身过量的糖化反应是造成角结膜上皮损伤的关键。在高泪糖慢性刺激细胞的过程中,伴随的渗透压升高对细胞的影响较小,而糖代谢紊乱所产生的毒性代谢产物不断累积和滞留激活一些病理性通路如ERS诱导细胞死亡,并导致角结膜上皮的损伤,这是一个长期累积且不可逆的过程。
综上,在临床上糖尿病患者体内的日积月累的糖化反应远超过伴随的渗透压升高所带来的影响,这些研究结果将有助于为治疗糖尿病性干眼提供新的理论依据和靶标。由于本实验为离体研究且细胞为兔源,在下一步的研究中将考虑采用人或鼠上皮以及自发糖尿病小鼠动物模型进一步研究证实。
[1] ALJAROUSHA M, BADARUDIN N E, CHE AZEMIN M Z.Comparison of dry eye parameters between diabetics and non-diabetics in district of kuantan, Pahang[J].Malays J Med Sci, 2016,23(3): 72-77.
[2] GOVINDARAJAN B, GIPSON I K.Membrane-tetheredmucins have multiple functions on the ocular surface[J].Exp Eye Res, 2010,90(6): 655-663.
[3] CHEN Y H, LI M, LI B, et al.Effect of reactive oxygen species generation in rabbit corneal epithelial cells on inflammatory and apoptotic signaling pathways in the presence of high osmotic pressure[J].PLoS One, 2013,8(8): e72900.
[4] 高彩凤,陈慧瑾,靳瑛,齐虹.Th17相关细胞因子在干眼患者眼表的表达及其相关性研究[J].中华实验眼科杂志,2014,32(07): 641-646.
[5] ZHANG X Y, ZHAO L, DENG S J, et al.Dry eye syndrome in patients with diabetes mellitus: prevalence, etiology, and clinical characteristics[J].J Ophthalmol, 2016,2016: 8201053.
[6] ZOUKHRI D, HODGES R R, BYON D, et al.Role of proinflammatory cytokines in the impaired lacrimation associated with autoimmune xerophthalmia[J].Invest Ophthalmol Vis Sci, 2002,43(5): 1429-1436.
[7] ZOU C L, WANG S Y, HUANG F, et al.Advancedglycation end products and ultrastructural changes in corneas of long-term streptozotocin-induced diabetic monkeys[J].Cornea, 2012,31(12): 1455-1459.
[8] CHISTIAKOV D A, SOBENIN I A, OREKHOV A N, et al.Role of endoplasmic reticulum stress in atherosclerosis and diabetic macrovascular complications[J].Biomed Res Int, 2014,2014: 1-14.
[9] DAI M X, ZHENG X H, YU J, et al.The impact of intermittent and repetitive cold stress exposure on endoplasmic reticulum stress and instability of atheroscleroticplaques[J].Cell Physiol Biochem, 2014,34(2): 393-404.
[10] LU J J, SHENG M J, YAO P P, et al.High concentration of glucose increases reactive oxygen species generation and apoptosis induced by endoplasmic reticulum stress pathway in rabbit corneal epithelial cells[J].J Ophthalmol, 2018,2018: 8234906.
[11] KANG M K, PARK S H, KIM Y H, et al.Chrysin ameliorates podocyte injury and slit diaphragm protein loss via inhibition of the PERK-eIF2α-ATF-CHOP pathway in diabetic mice[J].Acta Pharmacol Sin, 2017,38(8): 1129-1140.
[12] ANIAH AZMI N, BASTION M C.Short-term results of trial of topical insulin for treatment of dry eyes indiabetics[J].Eye Contact Lens, 2020,46(Suppl 1): S25-S32.
[13] PARAVICINI T M, TOUYZ R M.NADPH oxidases, reactive oxygen species, and hypertension: clinical implications and therapeuticpossibilities[J].Diabetes Care, 2008,31(Suppl 2): S170-S180.
[14] HUYNH K, BERNARDO B C, MCMULLEN J R, et al.Diabetic cardiomyopathy: mechanisms and new treatment strategies targeting antioxidant signaling pathways[J].Pharmacol Ther, 2014,142(3): 375-415.
[15] Francisco Cirera Segura, Myriam Ruiz Montes, Ver nica Rosales S
nica Rosales S nchez, et al.Estandarizaci
nchez, et al.Estandarizaci n de cuidados del síndrome metab
n de cuidados del síndrome metab lico en di
lico en di lisis peritoneal standardising care of metabolic syndrome in peritoneal dialysis[J].Enfermería Nefrol
lisis peritoneal standardising care of metabolic syndrome in peritoneal dialysis[J].Enfermería Nefrol gica, 2017,(3), 129-137.
gica, 2017,(3), 129-137.
[16] BACA J T, TAORMINA C R, FEINGOLD E, et al.Mass spectral determination of fasting tear glucose concentrations innondiabetic volunteers[J].Clin Chem, 2007,53(7): 1370-1372.
[17] DHILLON P, AMIR E, LO M, et al.A case-control study analyzing mannitol dosing for prevention of cisplatin-induced acute nephrotoxicity[J].J Oncol Pharm Pract, 2019,25(4): 875-883.
[18] SAWAZAKI R, ISHIHARA T, USUI S, et al.Diclofenac protects cultured human corneal epithelial cells against hyperosmolarity and ameliorates corneal surface damage in a rat model of dry eye[J].Invest Ophthalmol Vis Sci, 2014,55(4): 2547-2556.
[19] 李阳,陆晨晖,陆骊工,等.外源性FGF-2对高糖环境下内皮祖细胞功能的影响[J].同济大学学报(医学版),2018,39(1): 34-40.
[20] CHU M X, MIYAJIMA K, TAKAHASHI D, et al.Soft contact lens biosensor for in situ monitoring of tear glucose as non-invasive blood sugar assessment[J].Talanta, 2011,83(3): 960-965.
 erent concentrations of glucose and mannitol.The expressions of PKR like endoplasmic reticulum kinase(PERK), phosphorylated PKR like endoplasmic reticulum kinase(p-PERK), eukaryotic initiation factor 2α(eIF2α), phosphorylated eukaryotic initiation factor 2α(p-eIF2α)and transcription factor C/EBP homologous protein(CHOP)protein were determined by Western-bloting.The growth of RCECs cultivated in different glucose concentrations(200-800mmol/L)was observed with phase contrast microscope, and mannitol at corresponding concentrations was used as a osmotic pressure control.
erent concentrations of glucose and mannitol.The expressions of PKR like endoplasmic reticulum kinase(PERK), phosphorylated PKR like endoplasmic reticulum kinase(p-PERK), eukaryotic initiation factor 2α(eIF2α), phosphorylated eukaryotic initiation factor 2α(p-eIF2α)and transcription factor C/EBP homologous protein(CHOP)protein were determined by Western-bloting.The growth of RCECs cultivated in different glucose concentrations(200-800mmol/L)was observed with phase contrast microscope, and mannitol at corresponding concentrations was used as a osmotic pressure control.