氟斑牙是牙齿在发育矿化期机体摄入过量的氟化物而导致的成釉细胞损伤,釉基质矿化障碍而表现出牙齿发育异常,在临床上表现为牙齿失去正常的光泽,出现白垩色、着色、多孔样病变[1],影响牙齿的美观和功能,给患者的身心和生活质量带来影响。氟斑牙一旦发生,临床治疗主要是冷光美白、釉质微打磨、树脂贴面及全冠进行有创修复,而这些临床操作带来不同程度的牙齿损伤。多年来学者们一直在寻找方法减少氟斑牙的发生,以往研究表明,硒对过量氟化物导致的肝脏、肾脏、脑等氟中毒的损伤具有拮抗作用[2-4],其拮抗机制可能通过调整细胞凋亡与自噬来实现。为进一步研究硒对氟斑牙是否同样具有拮抗作用,本研究通过建立ICR小鼠氟斑牙模型,在饮用水中同时加入氟化钠和亚硒酸钠来观察硒对氟斑牙的拮抗效果,并通过免疫组化检测Beclin1在各组切牙成釉细胞中的表达差异,初步探讨自噬在硒拮抗氟斑牙的发生机制。
1 材料与方法
1.1 主要试剂和仪器
实验所用ICR小鼠购自上海斯莱克实验动物有限公司;H-E试剂盒(No: KGA 224)购自江苏凯基生物技术有限公司;兔多克隆抗体Beclin1(PB0014)、即用型SABC试剂盒(SA-1021)、DAB显色试剂盒(BM3847)购自武汉博士德生物工程有限公司。主要实验器材:组织处理仪(STP 120)购自美国Thermo Fisher公司,石蜡包埋机(LEICA EG 1150 H)、石蜡切片机(LEICA RM2235)、烤片机(LEICA HI 1220)购自德国Leica公司,立体显微镜(Stemi508)购自德国Carl Zeiss公司,数码显微镜(Eclipse 80i)购自日本Nikon公司,μCT-50购自瑞士Scanco Medical公司。
1.2 氟斑牙模型建立与分组
1.2.1 氟斑牙模型的建立与分级 选用上海史莱克实验动物有限公司提供的SPF级2月龄雄性ICR小鼠36只,体重22~25g。经适应性喂养1周后,在预实验及前期课题组实验的基础上,随机分为3组,每组12只,基础饲料喂养,自由饮水。对照组:实验室净水仪提供的去离子水(ddH2O);氟化钠组:200mg/L氟化钠配制去离子水溶液;硒组:200mg/L NaF+2mg/L Na2SeO3配制去离子水溶液。喂养8周,根据小鼠下颌切牙釉质的透明度、白垩色斑块、缺损等不同程度的变化,采用11级分级标准[5]记录氟斑牙的发生情况,将1~3级定为极轻度氟斑牙,4~5级定为轻度氟斑牙,6~8级定为中度氟斑牙,9~10级定为重度氟斑牙。
1.2.2 下颌切牙牙齿增长率 实验第1天和实验结束(8周),使用游标卡尺测量小鼠下颌切牙龈缘最低点至切缘最高点的垂直距离,分别记为T1和T2,计算下颌切牙增长率(%)[6]。
下颌切牙增长率![]()
1.3 micro-CT扫描
小鼠下颌骨分离后置于4%多聚甲醛固定 48h 后,进行micro-CT扫描分析。图像数据采用Mimics 13.0软件重建分析。影像学分析指标:以第一磨牙、第二磨牙牙尖平行为参照进行三维重建,计算其唇侧硬组织厚度(L/mm)及面积(BS/mm2)。
1.4 H-E染色方法
常规方法脱蜡至水,滴加苏木精染液染色 5min,水洗,返蓝10min,滴加伊红染液20s,水洗2~3s,冲洗掉多余染液后放入梯度乙醇中脱水,置于二甲苯中,封片,镜检拍照。
1.5 免疫组化染色方法
本实验采用SABC法进行Beclin1的免疫组化染色。具体操作:常规脱蜡至水;0.2% Triton X-100室温孵育10min裂解细胞膜;3%过氧化氢溶液室温孵育10min以灭活组织中的内源性过氧化物酶;将切片浸没于枸橼酸钠缓冲溶液中,微波炉热修复法进行抗原修复,常温彻底冷却,重复3次;5% BSA室温孵育30min;加入一抗兔多克隆抗体,4℃孵育过夜;室温生物素鼠抗兔IgG二抗孵育20min;滴加SABC(链霉亲和素标记的过氧化物酶)反应,室温20min;DAB显色,苏木精复染。中性树胶封片剂封片,镜检拍照[7]。阴性对照以山羊血清代替一抗。
1.6 统计学处理
使用SPSS 23.0软件,利用Student’s t检验对数据进行分析,使用ImageJ 1.52t对免疫组化结果进行灰度值的测定。P<0.05表示差异具有统计学意义。
2 结 果
2.1 不同组别小鼠切牙的形态学改变
对照组切牙发育良好,有光泽,透明度好,实验过程无明显变化(图1A)。氟化钠组小鼠随着实验时间的延长,牙面由棕黄色逐渐呈现淡黄色,4周时出现明显的着色不均,实验结束时,呈白垩色改变,牙面粗糙,呈现中度的氟斑牙症状(100%),下颌切牙较对照组短,且切端磨耗较重,未露髓(图1B)。硒组下颌切牙形态、色泽与正常组接近,氟斑牙分级介于正常与极轻度之间,其切端可见轻度磨耗(图1C)。实验结束时,小鼠氟斑牙分级和小鼠下颌切牙增长率见表1,硒组下颌切牙增长率与正常组相比,差异无统计学意义(P>0.05);氟化钠组与正常组、硒组与氟化钠组相比,差异有统计学意义(P<0.05)。
表1 3组小鼠下颌切牙氟斑牙形成的分级评分和增长率
Tab.1 The grade and the rate of length growth of mandibular incisors in three groups

组别n氟斑牙分级评分下颌切牙增长率(%)对照组12016.04±0.05氟化钠组128.33±0.10∗10.02±0.10∗硒组121.88±0.5#15.64±0.04#
与对照组相比,*P<0.05;硒组与氟化钠组相比,#P<0.05;硒组与对照组无统计学意义
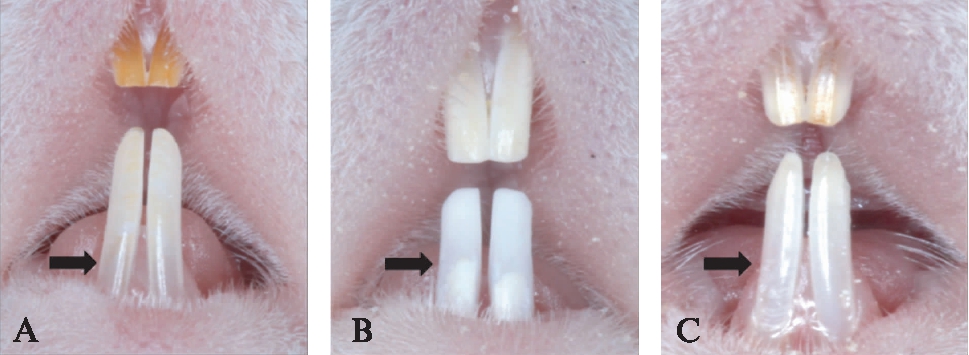
图1 小鼠下颌切牙不同组别的差异
Fig.1 The difference of the mouse mandibular incisors among the three groups
A: 对照组;B: 氟化钠组;C: 硒组;黑色箭头示小鼠牙齿色泽改变
2.2 micro-CT分析
2月龄小鼠喂养8周后取小鼠下颌骨,固定后进行micro-CT扫描分析,对照组小鼠切牙唇侧硬组织最厚(图2A、E),氟化钠组小鼠切牙牙唇侧硬组织正常组最薄(图2B、F),硒组介于其余两组之间(图2C、G)。3组间唇侧硬组织厚度和面积比较,差异有统计学意义(P<0.01),见图2D、H。
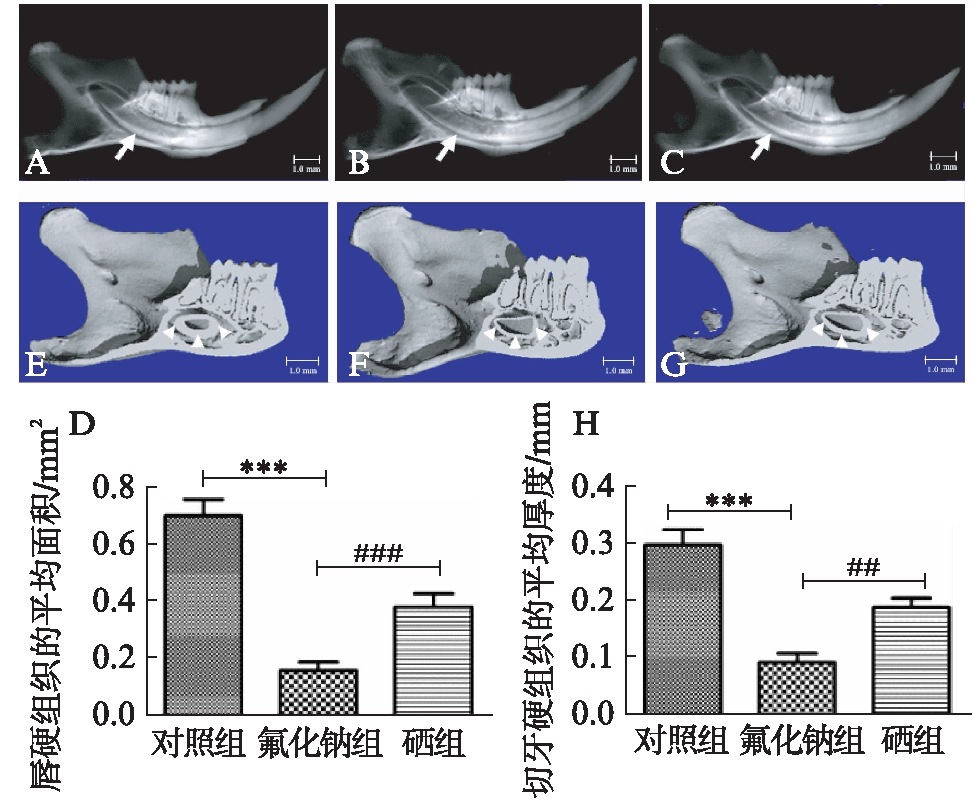
图2 micro-CT三维重建后3组小鼠切牙唇侧硬组织厚度以及面积的比较(标尺: 1.0mm)
Fig.2 Comparation of the thickness and area of the hard tissues on the labial side of the incisors by micro-CT 3D-Reconstruction among three groups(bar: 1.0mm)
A、E: 对照组;B、F: 氟化钠组;C、G: 硒组;D: 唇侧硬组织面积平均值;H: 唇侧硬组织厚度平均值;与对照组相比,氟化钠组***P<0.001;硒组与氟化钠组相比,###P<0.001、##P<0.01;硒组与对照组差异无统计学意义
2.3 成釉细胞在3组中排列方式的差异
正常组小鼠成釉细胞呈栅栏状排列,胞核位于基底部,极性明显(图3A);氟化钠组成釉细胞排列紊乱,见空泡性改变(图3B);硒组与正常组成釉细胞排列相似,胞核位于基底部,呈栅栏状排列(图3C)。而有趣的是3组成牙本质细胞的极化与排列基本一致,未见明显差异。
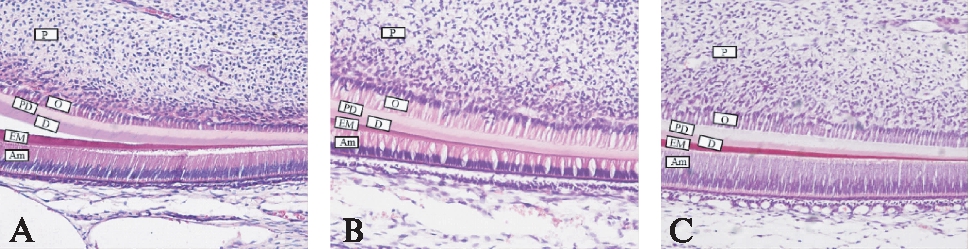
图3 3组小鼠切牙成釉细胞H-E染色(×100)
Fig.3 Changes in the arrangement of the ameloblast among the three groups(H-E staining ×100)
Am: 成釉细胞;EM: 釉质;D: 牙本质;PD: 前期牙本质;O: 成牙本质细胞;P: 牙髓;A:对照组;B: 氟化钠组;C: 硒组
2.4 Beclin1在3组小鼠切牙成釉细胞中的表达差异
Beclin1在3组小鼠切牙成釉细胞中的表达趋势基本一致,3组小鼠切牙成釉细胞从分泌期到成熟期Beclin1的阳性表达逐渐增强,但氟化钠组的表达最为明显,硒组的阳性表达趋势与对照组基本接近(图4A、B、C),其差异具有统计学意义(图4D);在分泌前期氟化钠组Beclin1在成釉细胞中的表达明显强于另外两组,且在星网状层中表达也很明显(图4E、F、G),且具有统计学意义(图4H);分泌期Beclin1在成釉细胞中正常组(图4I)和硒组(图4K)表达趋势基本一致,成釉细胞全层均有表达,但氟化钠组(图4J)在中间层细胞表达组较另外两组明显,其差异具有统计学意义(图4L)。成熟期中Beclin1在3组中成釉细胞全程均有表达,在氟化钠组,由于成釉细胞排列紊乱,部分区域呈空泡状,此处未检测到Beclin1的表达,但其余部分高于正常组,这种现象虽在硒组中也有发现,但相对较少,表达量低于氟化钠组(图4I、J、K),差异具有统计学意义(图4P)。

图4 Beclin1 3组小鼠切牙成釉细胞中表达
Fig.4 The expression of Beclin1 localization in ameloblast among three groups
Am: 成釉细胞;EM: 釉质;D: 牙本质;PD: 前期牙本质;O: 成牙本质细胞;P: 牙髓;A、E、I、M: 对照组,B、F、J、N: 氟化钠组,C、G、K、O: 硒组;A~C(×40),E~G、I~K、M~O(×200);D、H、L、P: 不同时期Beclin1表达的灰度分析;与对照组相比,***P<0.001、**P<0.01、*P<0.05;硒组与氟化钠组相比,##P<0.01、#P<0.05,正常组与硒处理组差异无统计学意义
3 讨 论
根据WHO标准,饮水中氟离子最高浓度为1.5~1.7mg/L,当长期摄入氟量过多时,则发生氟中毒[3]。硒作为机体必需的微量元素,参与机体多种酶的合成,可提高机体免疫力,调节机体代谢,具有清除自由基和高抗氧化活性的功效,被称为“天然解毒剂”[8],但摄入量过多则造成硒中毒。课题组通过文献回顾[2-4,6]及前期实验的基础上发现,200mg/L氟化钠可以成功构建饮水型小鼠氟斑牙模型。同时,在本次的预实验中,设置了2、4mg/L亚硒酸钠水溶液,结果发现低浓度硒可以达到很好的拮抗氟中毒效果[9]。本实验通过同时喂养小鼠氟离子与硒离子混合水溶液,结果发现,硒组小鼠切牙的生长变化与正常组无明显差异,而氟斑牙组在实验结束时均发生典型的氟斑牙症状,表现为小鼠切牙切断耗、变短,唇侧牙釉质呈白垩色改变。micro-CT结果显示,氟化钠组切牙唇侧硬组织厚度比对照组薄,硒拮抗组介于两者之间。H-E染色结果显示,氟化钠组成釉细胞排列紊乱,极性消失;而对照组与硒拮抗组成釉细胞呈栅栏状,排列整齐规则。以上结果表明,氟离子干扰牙釉质的形成,2mg/L亚硒酸钠可以减轻过量氟离子对小鼠切牙的危害,但是否为最适浓度,还需要实验证实,也是课题组下一步的实验方向。
自从氟斑牙被证明是由于机体摄入过多氟所致[10],各国学者对氟斑牙的发病机制展开广泛研究,并提出一些可能机制,包括对基质生物合成及分泌的影响、对基质蛋白及蛋白酶的直接作用、氧化应激反应影响[11-12]等。有文献提出,氟化钠可以通过自噬进而调节根尖牙乳头细胞成牙和成骨分化[13],同时,也有文献表明,硒对过量氟离子的抑制功能是通过调节细胞凋亡和自噬发挥作用[2-4]。由此,课题组大胆推测,硒对氟斑牙的拮抗效果也是通过协同或抑制作用发生的。自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质过程,是真核细胞特有的生命现象,自噬可在饥饿、缺氧、感染、老化和氧化应激等各种应激条件的刺激下被激活,是细胞对对内外环境压力变化的一种反应,是一种细胞程序性死亡方式(Ⅱ型程序性细胞死亡)[14]。Beclin1是细胞自噬的关键调控因子,是检测自噬发生的关键标志之一。大量实验研究表明,过量氟离子促进细胞自噬的发生。Yang等[15]提出,Beclin1可能在自噬与凋亡中有着至关重要的桥梁作用,参与了氟斑牙自噬过程中的调控;Lei等[16]发现氟化钠促进分泌期成釉细胞Beclin1的表达,且与氟剂量呈正相关,但该研究没有分析分泌前期和成熟期成釉细胞中Beclin1的表达。此外,也有实验发现适量硒对小鼠氟斑牙有一定拮抗作用[17],但对其机制并没有进行研究。本次实验结果表明,Beclin1在氟化钠组的表达无论在分泌前期、分泌期及成熟期的特异性表达明显高于正常组,而且也较硒组明显,说明自噬参与了氟斑牙的形成过程。硒组Beclin1的表达与正常组空间表达相似,这提示硒离子可能通过拮抗氟诱导的成釉细胞的自噬而达到拮抗的效果。
综上所述,适量浓度的硒离子对过量氟引起的小鼠氟斑牙确实存在一定的拮抗作用,自噬可能参与其中,但相关机制及硒离子拮抗氟的最适浓度还有待深入研究。
[1] BRONCKERS A L, LYARUU D M, DENBESTEN P K.The impact of fluoride onameloblasts and the mechanisms of enamel fluorosis[J].J Dent Res, 2009,88(10): 877-893.
[2] WANG Y X, XIAO X, ZHAN X A.Antagonistic effects of different selenium sources on growth inhibition, oxidative damage, and apoptosis induced by fluorine in broilers[J].Poult Sci, 2018,97(9): 3207-3217.
[3] GAO J P, WANG Y, XU G Q, et al.Selenium attenuates apoptosis and p-AMPK expressions in fluoride-induced NRK-52Ecells[J].Environ Sci Pollut Res Int, 2019,26(15): 15685-15697.
[4] ZHENG X R, SUN Y, KE LL, et al.Molecular mechanism of brain impairment caused by drinking-acquired fluorosis and selenium intervention[J].Environ Toxicol Pharmacol, 2016,43: 134-139.
[5] 侯铁舟,郭海燕,陶洪,等.小鼠氟牙症分级标准的建立[J].国际口腔医学杂志,2009,36(2): 140-143.
[6] 陶洪,郭海燕,侯铁舟,等.碘、钼、硒、镁、硼预防小鼠氟斑牙效果的评价[J].国际口腔医学杂志,2011,38(2): 145-149.
[7] 陈蔚婷,叶远舟,蔡昀,等.β-catenin在小鼠下颌第一磨牙发育过程中的表达[J].同济大学学报(医学版),2017,38(3): 19-24.
[8] KIELISZEK M, LIPINSKI B, ![]() S.Application of sodium selenite in the prevention and treatment ofcancers[J].Cells, 2017,6(4): E39.
S.Application of sodium selenite in the prevention and treatment ofcancers[J].Cells, 2017,6(4): E39.
[9] 刘璐,莫思怡,谢梦生,等.硒拮抗小鼠氟斑牙发生的实验研究[C]∥广州:第九次全国牙体牙髓病学学术会议,2014: 36-37.
[10] 樊明文,周学东.牙体牙髓病学[M].4版.北京: 人民卫生出版社,2012: 246-250.
[11] ZHANG Y, ZHANG K Q, MA L, et al.Fluoride induced endoplasmic Reticulum stress and calcium overload inameloblasts[J].Arch Oral Biol, 2016,69: 95-101.
[12] LI W S, JIANG B H, CAO X L, et al.Protective effect of lycopene on fluoride-inducedameloblasts apoptosis and dental fluorosis through oxidative stress-mediated Caspase pathways[J].Chem Biol Interact, 2017,261: 27-34.
[13] PAN Y, LI Z H, WANG Y Q, et al.Sodium fluoride regulates theosteo/odontogenic differentiation of stem cells from apical papilla by modulating autophagy[J].J Cell Physiol, 2019: 1-11.
[14] RAVANAN P, SRIKUMAR I F, TALWAR P.Autophagy: the spotlight for cellular stressresponses[J].Life Sci, 2017, 188: 53-67.
[15] YANG J W, WAN C Y, NIE S, et al.Localization of Beclin1 in mouse developing tooth germs: possible implication of the interrelation between autophagy andapoptosis[J].J Mol Histol, 2013,44(6): 619-627.
[16] LEI S, ZHANG Y, ZHANG K Q, et al.Effects of fluoride on the expression of Beclin1 and mTOR in ameloblasts[J].Cells Tissues Organs(Print), 2015,200(6): 405-412.
[17] 索冬卫,陈炅,张玉华,等.硒对过量氟化物致小鼠成釉细胞DNA损伤的拮抗作用[J].中国地方病防治杂志,2016,31(7): 811,826.